Method Article
절연 및 Chlamydomonas Centrioles의 단일 입자 재건을 위한 형광 이미징
요약
우리 정화 하 여 슈퍼 해상도 현미경 및 단일 입자 평균에 대 한 의무가 다른 방향에서 centrioles 많은 이미지 전략을 개발 했습니다.
초록
Centrioles 큰 고분자 어셈블리 세포 분열, 세포 운동 성, 또는 셀 신호 같은 기본적인 세포 생물학 과정의 적절 한 실행에 대 한 중요 한 있습니다. 녹색 조류 Chlamydomonas reinhardtii 중심소체 건축, 기능, 및 단백질 구성의 연구에서 통찰력 모델을 입증 했다. 이해 centriolar 건축으로 큰 발전에도 불구 하 고 현재 과제 중 하나는 더에서 그들의 역할을 이해 하기 위해서는 정확한 국산화는 중심소체의 구조 영역에서 centriolar 구성 요소를 결정 하는 중심소체 속입니다. 주요 제한은이 세포 기관이 회절 한계에 가까운 크기에 단백질 지 방화의 해석을 복잡 형광 현미경의 해상도에 놓여 있습니다. 이 문제를 해결 하기 위해 우리가 정화 및 슈퍼 해상도 현미경을 사용 하 여 다른 방향으로 C. reinhardtii centrioles의 많은 수를 이미지 하는 방법을 제공 하는. 이 기술을 형광 단일 입자 centrioles 취득의 많은 수 때문에 (Fluo-스파) 평균을 통해 데이터의 추가 처리를 허용 한다. Fluo-스파의 평균 생성 따라서 centriolar 하위 영역에 있는 다른 단백질의 지 방화를 촉진 하는 다른 방향에서 C. reinhardtii centrioles 스테인드. 중요 한 것은, 다른 종 또는 다른 큰 고분자 어셈블리에서 이미지 centrioles에이 메서드를 적용할 수 있습니다.
서문
중심소체는 진화론 보존된 세포 기관이 centrosome 동물 세포에서의 핵심에 놓여 있다 고 템플릿 속눈썹 또는 많은 진핵생물1,2flagella (라고도 centrioles이) 기초 본문으로 작동할 수 있다 이다. 이와 같이, centrioles가 근본적인 세포 생물학 프로세스 신호 세포를 스핀 들 어셈블리에서 배열 합니다. 따라서, 중심소체 어셈블리 또는 기능에 결함이 ciliopathies 및 암3를 포함 하 여 여러 가지 인간 병 리와 관련 되어 있다.
Centrioles는 무굴, 대칭, microtubule triplet 기반 원통형 구조는, 일반적으로, ~ 450 nm 긴 고 ~ 250 nm 넓은4,5,,67. 기존의 전자 현미경 및 다른 종에서 centrioles의 cryo 전자 단층 촬영 세 가지 별개의 영역으로 그들의 긴 축을 따라 centrioles 편광은 계시 했다: 인접 지역, 중앙 코어 및 원심 지역5 , 7 , 8 , 9 , 10 , 11. 중요 한 것은, 각각이 지역 특정 구조 특징을 나타냅니다. 첫째, 100 nm-긴 인접 지역의 루멘 머 저리 요소12microtubule 세 개에 연결 하는 수레 바퀴 구조를 포함 합니다. 둘째, 300-400 nm-긴 중부 지역 섬유 밀도 microtubules의 내부 얼굴에 따라 루멘 및 구조적 특징에 포함: Y 자 모양의 링커, C 관 꼬리 그리고 A 관9스텁. 마지막으로, 50-100 nm 원심 지역 중심소체5,13의 원심 부분을 둘러싸고 있는 하위 원심 및 원심 부속을 전시 한다.
지난 2 년간 중심소체14,,1516, 의 부분이 되 고 약 100 가지 단백질의 현재 추정에 지도 하는 centriolar 단백질의 증가 수의 발견에 의해 표시 된 17. 이러한 진보에도 불구 하 고는 중심소체 내이 단백질의 정확한 지 방화 구조 하위 영역에서 특히 애매 남아. 중요 한 것은, 정확 하 게 지역화는 중심소체의 구조 지역에 할당 그들의 기능에 대 한 더 나은 이해 결정적 이다. 이 점에서 C. reinhardtii centrioles 수단이 두 측면에서 첫 번째 delimitating 실린더9,,1819, 다음 허용 되는 따라 다른 구조상 특징에 의해 형광 현미경 검사 법을 사용 하 여 하위 구조 영역 단백질의 부분 집합의 지역화를 연결할 연구원. 예를 들어 Bld12p 및 Bld10p, 지역화 인접 지역에 수레 바퀴 구조에 특히 단백질20,21,,2223포함 됩니다. 지역화 하는 구조 단백질의 목록에는 또한 POB15 및 POC16, C. reinhardtii centrioles17의 내부 핵심 영역을 장식 하는 질량 분석에 의해 확인 된 두 개의 소설 단백질 포함 됩니다.
이 문서에서는 격리 하 고 후속 슈퍼 해상도 현미경 및 단일 입자 평균에 대 한 C. reinhardtii centrioles 이미지 개발 방법의 완전 한 설명 합니다. 이 위해 기술 한계 극복 될 필요가 있는 윤곽을 그리 다 중요 하다. 첫째, 중심소체 정화 절연9의 다양 한 단계 동안 자주 손실 되 고 수레 바퀴 구조와 전반적인 아키텍처를 달라질 수 있습니다. 둘째, 크기는 중심소체의 광학 현미경에서 회절 한계에 가까운 매우는입니다. 실제로, confocal 현미경 검사 법에서 얻을 수 있는 수평 해상도 약 200 nm24는 중심소체와 z에 해상도의 직경 비슷합니다-축에 대 한이 2-3 배 낮은, 이방성 볼륨에 선도. 셋째, 항 체 라벨 및 중심소체 오리엔테이션의이 특정 centriolar 하위 영역에 단백질을 지역화 하는 데 필요한 해석을 제한 수 있습니다. 마지막으로, centrioles 어려운 이미지의 많은 수를 확보 하 고 명확한 중심소체 방향을 찾을 수 셀당 두 복사본에 존재 한다. 이러한 기술적인 문제를 회피, 우리 격리 centrioles 다양 한 오리 엔 테이 션을 채택 하는의 큰 숫자에 적용 하는 슈퍼 해상도 현미경에 사용 하는 방법 개발 했다. 우리는 먼저 구조적으로 그대로 centrioles 및 procentrioles 포함 하는 수레 바퀴의 정화를 가능 하 게 하는 C. reinhardtii centrioles 정화 프로토콜을 설명 합니다. 다음, 우리는 centrioles 재래식으로 이미징 또는 슈퍼 해상도 형광 현미경에 대 한 coverslips에 집중 하는 단계별 프로토콜을 설명 합니다. 이 중요 한 단계 centrioles 여러 방향에서 몇 군데의 수를 증가 수 있습니다. 마지막으로, 우리는 단일 입자 평균 centrioles 다른 방향에서의 검출 하는 형광 현미경에 수집 된 데이터에 수행 하는 절차를 설명 합니다. 모두, 다양 한 종 또는 다른 큰 고분자 어셈블리에서 이미지 centrioles에이 메서드를 적용할 수 있습니다.
프로토콜
1. 미디어 준비 C. reinhardtii 문화와 중심소체 격리에 대 한
-
미디어 문화 C. reinhardtii 세포를의 준비
참고: 다음 단계는 탭 (인산 트리 아세테이트) 매체 x 1에 대 한 재고 솔루션의 준비를 설명합니다.- 1 M KH2포4 (136.09 g 1 L에 KH2포4 의)의 ~ 170 mL와 함께 250 mL의 1 M K2HPO4 (174.2 g K2HPO4 증류수 1 L에 구비)를 혼합 하 여 인산 염 버퍼 (pH 7)를 준비 합니다. PH 7을 도달 하는 혼합물을 조정 합니다.
- 트라이앵글 96.8 g, 인산 버퍼 (pH 7) 40 mL 및 아세트산, 40 mL를 혼합 하 여 솔루션 (40 x)를 준비 하 고 증류수 1 l 솔루션을 조정 합니다.
- 준비 솔루션 B (40 x) NH4Cl의 16 g, CaCl2, 2 세대 MgSO4의 4 g를 사용 하 여. 다른 구성 요소를 추가 하기 전에 별도로 CaCl2 증류수에 녹에 주의 해야 합니다. 증류수 1 l 솔루션을 조정 합니다.
- 다음과 같이 Hutner의 성분 버퍼25 를 준비 합니다.
- 버퍼의 1 l, 분해 물 표시 된 볼륨에 있는 각 화합물: EDTA disodium 소금 (250 ml에서 50 g), ZnSO4.7H2O (100 mL에 22 g), H3보3 (11.4 g 200 ml에서), MnCl2.4H2O (5.06 g 50 ml에서) CoCl2.6H2O (1.61 g 50 ml에서), CuSO4.5H2O (1.57 g 50 ml에서), (NH4) 6Mo7O24.4H2O (1.10 g 50 ml에서), 및 FeSO4.7H2O (4.99 g 50 ml에서).
참고: EDTA 끓는 물에 녹아 야 하 고 FeSO4 산화를 피하기 위해 마지막 준비 되어야 한다. - EDTA 제외 하 고 모든 솔루션을 함께 혼합 하 고 끓인 다. 다음, EDTA를 추가 하 고 솔루션 녹색 설정 해야 합니다. 모든 것을 녹이는 후 냉각 70 ° c 솔루션 이 온도에서 뜨거운 20% 코 솔루션 (20 g 100 ml에서)의 85 mL를 추가 합니다. 실내 온도 (RT)에 증류수 1 l 솔루션을 조정 합니다.
- 플라스 크에 목화 플러그를 추가 하 고 서 1 또는 2 주 동안 그것을 동요 하는 솔루션을 하자 하루 x 1. 솔루션 해야 처음 녹색 될 한 자주색, 떠나는 녹 갈색 침전; 솔루션은 분명 때까지 필터 종이 사용 하 여 침전을 제거 합니다. aliquots와-20 ° c.에 저장
- 버퍼의 1 l, 분해 물 표시 된 볼륨에 있는 각 화합물: EDTA disodium 소금 (250 ml에서 50 g), ZnSO4.7H2O (100 mL에 22 g), H3보3 (11.4 g 200 ml에서), MnCl2.4H2O (5.06 g 50 ml에서) CoCl2.6H2O (1.61 g 50 ml에서), CuSO4.5H2O (1.57 g 50 ml에서), (NH4) 6Mo7O24.4H2O (1.10 g 50 ml에서), 및 FeSO4.7H2O (4.99 g 50 ml에서).
- 다음 구성 요소를 혼합 하 여 C. reinhardtii 세포를 성장 탭 중간에 x 1을 준비: 솔루션 (40 x) 25 mL 및 솔루션 B의 25 mL (40 x) Hutner의 성분의 1 mL25, 버퍼와 증류수를 1 리터에 혼합물을 조정. 0.4 µ m 필터를 사용 하 여 혼합 소독.
-
중심소체 정화에 대 한 미디어 준비
- 500 mL 증류수와 조정의 최종 볼륨에서 10 mM HEPES (pH 7)에서 5% 자당을 사용 하 여 deflagellation 버퍼를 준비 합니다.
- 0.5 M 아세트산의 250 mL를 준비 합니다.
- H2O 파이프 분말을 첫 번째 추가 50 mL, 250 mL 1 M K-파이프 재고 솔루션 (pH 7.2)의 준비 다음 10 추가 솔루션까지 N 코 분명 되기 시작 합니다. PH 7.2 10 N과 1 N 코에 적정 하십시오 및 솔루션 H2o. 250 mL의 최종 볼륨을 조정
- 다음과 같이 5 자당 솔루션 (w/w)를 준비 합니다.
참고: 모든 자당 솔루션 후 주사기에 가용 화 0.4 µ m 필터를 사용 하 여 연결을 필터링 할 필요가 있다. Note 60% 및 70% 자당 해결책 solubilize 어렵다 하 고 가용 화를 촉진 하기 위하여 60 ° C에 미리 데워 물 욕조에 배치 되어야 합니다. 믹스는 자당 완전히 해산 될 때까지 매 10 분.- 준비 하려면 25% 자당, 자당의 25 g 무게 하 고 10 m m K-파이프 (pH 7.2)를 추가 하 여 100 g 무게를 조정 합니다.
- 준비 하려면 60% 자당, 자당의 60 g 무게 하 고 10 m K-파이프 (pH 7.2) 100 g 무게를 조정 합니다.
- 자당 기온 변화도 대 한 자당 솔루션을 준비 합니다. 자당의 40 g 무게 100 g 10 m K-파이프 (pH 7.2) 솔루션을 조정 하 여 40% 자당을 준비 합니다. 마찬가지로, 50% (w/w)와 70% (w/w) 자당을 준비 합니다.
- -20 ° c.에 솔루션 저장 녹고 후 제대로 자당 솔루션 resuspend를 주의 해야 합니다.
- 100 mL 혼합 1 mm HEPES (pH 7) 세포의 용 해 버퍼, 0.5 m m MgCl2및 1 %NP-40, 및 유지의 준비 4 ° c.에 그것 항상 실험 당일 신선한이 버퍼를 준비 합니다. 중심소체 고립의 날에 방지 효소 정제를 추가 합니다.
- 1 혼합물의 볼륨 HCl 가져와와 NaCl의 8 g, KCl의 2 세대, 나2HPO4, 1.44 g 그리고 증류수 H2o. 조정 pH 7.4 800 mL에 KH2포4 의 0.24 g을 혼합 하 여 인산 염 버퍼 식 염 수 (PBS) (pH 7.4) x 1을 준비 L 증 H2o.
2. C. reinhardtii Centrioles의 격리
참고: 그림 1을 참조 하십시오.
-
문화와 C. reinhardtii 세포의 확장
- 1 일 저녁에 문화 포함 된 1 10 mL 삼각 플라스 크에 단단한 격판덮개에서 cw15- 긴장 접종 탭 x. 23 ° c.에 2-3 일 동안 백색 형광등 (60 µE/m2s)에서 세포를 성장
- 3 일에 문화 10 희석 (100 mL)을 x 1 x에서 누르고 23 ° c.에 2-3 일에 대 한 조명 아래 셀 성장
- 6 일에 희석 문화 10 x 1 x에서 1 L 문화를 누릅니다. 문화 ~ 107 셀/mL26 (9-10 일) x 1의 대략적인 셀 밀도 나타내는 진한 녹색 색깔에 도달할 때까지 23 ° C에서 빛 아래에서 세포를 성장 한다.
-
C. reinhardtii centrioles의 정화
- Cw15- 셀 50 mL 원뿔 튜브에서 10 분 600 x g 에서 원심 펠 릿을 세척 세포 1 x 1 x PBS의 50 mL 및 100 ml를 피펫으로와 실내 온도 deflagellation 버퍼의 펠 릿 600 x g 10 분 Resuspend에서 그것을 회전.
- 천천히 4.5-4.7는 자력에의 최종 pH를 0.5 M 초 산의 방울을 추가 하 여 셀 전화 충격을 deflagellate 하 고 2 분 천천히 pH 7.0으로 복원 하려면 1 N 코 방울을 추가 대 한 셀을 품 어.
- 어떤 분리 flagella 제거를 10 분 600 x g 에서 셀 원심 제거는 상쾌한 고 얼음에 펠 릿을 저장 합니다. 씻어 펠 릿 2 x 1 x PBS 4 ° c.에 precooled의 50 mL 그런 다음 4 ° c.에서 10 분 600 x g 에서 펠 릿을 회전
- 1 x PBS의 30 mL에 펠 릿을 resuspend 하 고 천천히 (그림 1B)를 혼합 하지 않고 20 mL의 25% 자당 쿠션에 정지를 로드 합니다.
- 600 x g 상쾌한;에서 나머지 flagella를 제거 하려면 4 ° C에서 15 분 동안에 회전 셀 25% 자당 (그림 1C) 전파 됩니다. 신중 하 게는 흡 인기를 사용 하 여 상쾌한 발음만 맨 20 mL (빨간 화살표, 그림 1C) 유지.
- 감기 1 x PBS의 20 mL를 추가 하 여 나머지 20 mL 씻으십시오. 4 ° c.에서 10 분 600 x g 에서 샘플을 회전 감기 1 x PBS (4 ° C)에서 10 mL에 펠 릿을 resuspend. 다음 세포는 모든 셀을 한 번에 조회 수 있도록 아무 덩어리 인지 확인 합니다.
- 새로운 250 mL 병 resuspended 펠 릿을 전송 합니다. 100ml DNase의 5000 단위 세포를 보충 하는 세포의 용 해 버퍼를 추가 합니다. 그것은 전지와 아닌 다른 방법으로 주위에 세포의 용 해 버퍼를 추가 해야 합니다. 4 ° C에서 1 시간에 대 한 혼합물을 품 어와 모든 거품을 형성 하지 않고 병 매 15 분을 반전 하 여 신중 하 게 섞는다.
- 어떤 세포 파편 든 지 제거 하는 50 mL 원뿔 튜브에 4 ° C에서 10 분 600 x g 에서 lysed 세포 원심 세포 올바르게 수행, 셀 펠 릿 흰색 이어야 한다 (그림 1D). 피 펫과 상쾌한 수집 하 고 포함 하는 60% 자당 방석, 얼음에 30 mL 라운드-하단 튜브에 그것을 로드. 그런 다음 4 ° c.에 30 분 10000 x g 에서 튜브를 회전
참고: 여러 라운드 하단 튜브 (자료 테이블) 필요할 수 있습니다는 상쾌한의 볼륨에 따라. - 자당 쿠션 위에 1 mL의 표면에 뜨는 최대 발음 나머지 상쾌한의 1 mL와 자당 쿠션의 2 mL 사이 노란색 인터페이스 note 부드럽게 믹스는 자당과 나머지 상쾌한 컷 P1000 팁. 이 단계;에서 소용돌이 하지 마십시오 그렇지 않으면, procentrioles는이 단계에서 손실 될 수 있습니다. 모든 자당 쿠션 풀 하 고 얼음에 그들을 저장 합니다.
- 부드럽게 3 mL 50%와 40% 자당의 마지막으로, 3 mL (4 ° C에서) 70% 자당의 3 mL를 추가 하 여 얇은 벽 38.5 mL 폴 리 프로필 렌 튜브에 40%-70% 자당 기온 변화도 준비 합니다. 40%-70% 자당 기온 변화도;에 풀링된 인터페이스를 로드 이렇게 천천히 감기 자당은 아주 점성 때문에. 10 m m K-파이프 버퍼 (pH 7.2) 튜브 균형과 68,320 x g (예를 들어, SW32Ti 회전자) 4 ° c.에서 1 h 15 분에 그들을 원심합니다
- 다른 자당 레이어를 방해 하지 않고 0.8 m m 바늘으로 튜브의 하단에 구멍을 만들어 4 ° C에서 12 x 500 µ L 분수를 수집 합니다. 잘라 P200 피 펫 팁, 다음 면역 형광 검사에 사용 될 각 부분에서 추가 10 µ L aliquots를 준비 합니다. 스냅-동결 분수 액체 질소.
참고: 격리 centrioles는 centrioles의 전반적인 열 대권 외 보존 되도록 전자 현미경에 의해 분석할 수 있습니다.
3. Coverslips에 고립 된 Centrioles의 정량화: 원심 분리 및 면역 형광 검사
참고: 그림 2를 참조 하십시오.
-
튜브 및 coverslips 준비
- 분수 당 1 유리 라운드-하단 튜브 (15 mL)을 사용 하 여 centriolar 분수 (12 관 총에서) 분석.
- (이 어댑터 라고도 함) 사용자 지정 coverslip 지원 어댑터 라운드 하단 튜브에 넣어. 라운드-하단 튜브에 살 균 12 mm coverslip 장소.
참고: 여기 우리 12 mm coverslips, 사용 하지만 18 m m coverslips 30 ml 라운드-하단 튜브를 사용 하 여에 대 한 프로토콜을 적용할 수 있습니다. - 4 ° c.에 미리 냉각된 10 m m K-파이프 (pH 7.2)의 5 ml을 추가 coverslip 하지 부동은 어댑터에 아래로 유지 됩니다 있는지 확인 합니다. 얼음에 튜브를 놓습니다.
-
centrioles의 원심 분리
- 각 10 µ L 부분 찬 10 m m K-파이프 (pH 7.2) 100 µ L 희석. 자당 (그림 2A)의 완전 한 실종까지 잘 희석 resuspend 라운드-하단 튜브로 각 희석된 분수를 로드 합니다.
- 4 ° c.에서 10 분 (예를 들어, JS 13.1 진동 물통 회전자) 10000 x g 에서 튜브를 회전
- 손수 구부려 진된 장치 어댑터의 슬롯된 가장자리에 구멍에 삽입 하 여는 coverslip 복구 하 고 부드럽게 들어올립니다.
참고: 손수 푹된 장치는 수동으로 연결 하 고 수 제 스틱 (그림 2B 2D)에 성형 주사기 바늘으로 할 수 있다. - 라운드-하단 튜브의 상단에 도달, gloved 손가락으로 어댑터의 가장자리를 트랩 하 고는 coverslip 핀셋으로 제거 합니다. 기억 하는 coverslip의 측면을 포함는 centrioles 주의 해야 합니다. 면역 형광 검사에 대 한 coverslips 치료를 진행 합니다.
-
면역 형광 검사 얼룩이 지 고의 이미징 C. reinhardtii centrioles 절연
참고: 그림 2를 참조 하십시오.- 면역 형광 검사 다음과 같이 얼룩에 대 한 자료를 준비 합니다.
- 커버 유리 얼룩 랙 크리스탈 폴리스 티 렌 전송 실험실 상자 (높이 43 m m, 폭에서 50 m m 길이 60 m m)를 준비 합니다. 그것은 100% 메탄올으로를-20 ° c.에 그것을 저장합니다
- 습 한 챔버를 준비 합니다. 이 위해, 물 습도 조직 내부와 함께 배치 하 여 습 한 챔버 조립 광장 페 트리 접시 (그림 2E)의 가장자리. 밀봉 포장 하는 실험실의 추가 ( 재료의 표참조)는 항 체 믹스 면역 형광 검사 절차 (단계 3.3.2–3.3.3) 동안 배치 될 페 트리 접시의 한가운데에. 커버 뚜껑과 빛에서 그것을 보호 하기 위해 알루미늄 호 일 습 챔버.
- Immunostain로 절연된 centrioles 다음과 같습니다.
- 수정에서 coverslips는 centrioles와 직접 후-20 ° C 메탄올 (단계 3.3.1.1) 가득한 상자에 5 분 동안 그들을 배양 하 여 원심 분리 (3.2.4 단계).
- 족집게 및 장소 투명 실험실 상자에서 그들 ( 재료의 표참조) 1 x PBS의 50 mL 가득 실 온에서 5 분 동안 세척 coverslips를 제거 합니다.
- 1 차적인 항 체 혼합의 60 µ L 플라스틱 [1 차 항 체 1% 소 혈 청 알 부 민 (BSA)에 0.05% 희석 PBS에 트윈-20] 실험실 습 실에서 랩 씰링의 조각에. 조심 스럽게 직접 드롭 직면 centrioles 항 체 믹스 위에 coverslips를 하다. 1 차 항 체로 45 분에 대 한 coverslips를 품 어.
참고: 대표적인 결과 생성 하는 데 사용 된 1 차 항 체는 토끼 polyclonal Bld12 (1:300) 및 마우스 α-tubulin (DM1A) (1:300). - coverslips를 제거 하 고 3.3.2.2 단계에서 설명한 대로 1 x PBS에 5 분 동안 그들을 씻어. 1 %BSA 0.05%를 포함 하는 PBS에 2 차 항 체로 45 분에 대 한 coverslips를 품 어 트윈 20.
참고: 대표적인 결과 생성 하는 데 사용 된 2 차 항 체는 알 렉 사 488 (1:1, 000)를 결합 염소 안티 마우스와 알 렉 사 568 (1:1, 000)를 결합 하는 염소 항 토끼. - coverslips를 제거 하 고 3.3.2.2 단계에서 설명한 대로 1 x PBS에 5 분 동안 그들을 씻어.
- 슬라이드에 매체를 장착 하 고 신중 하 게 위에 (centrioles 장착 매체를 직면 하 고)는 coverslips을 배치의 3 µ L을 추가 하 여 유리 슬라이드에는 coverslips를 탑재 합니다. 매니큐어와 coverslip 가장자리를 밀봉 하십시오.
- 1.4 없음와 오일 목표 X 63에 confocal 현미경에 격리 centrioles deconvolution27 를 적용 하는 동안 이미지 ( 재료의 표참조).
참고: 여기, 다음 설정 사용 되었다: 알 렉 사 488와 알 렉 사 568 대 580-635 nm 500-545 nm.
- 면역 형광 검사 다음과 같이 얼룩에 대 한 자료를 준비 합니다.
4. 농도 Coverslips의 중심에 Centrioles의
주: 그림 3을 참조 하십시오.
-
재료 준비
- 얼음, (어댑터, 보조 파일 1로 제공 하는.stl 파일 라고) 하는 사용자 지정 coverslip 지원 어댑터, 사용자 정의 집중 (.stl 파일 보조 파일 2로 제공), 및 10 m m K-파이프 (pH 15 mL 유리 라운드-하단 튜브 준비 7.2) 4 ° c.에
- 폴 리-D-리 (PDL) 준비-coverslips 코팅. 10 H2o. 1 mg/mL PDL 재고 솔루션 배 희석 첫째, coverslips와 70 %EtOH, 에탄올, 제거 하자는 coverslips 건조 씻어. PDL과 coverslips 코트 하 고 실 온에서 30 분 동안 그들을 품 어. Coverslips 3 씻어 물으로 x 건조 그들을 보자.
참고: 코트 격리 centrioles의 수를 증가 하는 PDL와 coverslips는 coverslips에 첨부.
-
원심 분리
- 에 최근 무 균 12 mm coverslip, 집중 장치, PDL 유지의 하단 끝 코트 놓습니다. 상단에 직접 어댑터를 배치 하 여는 coverslip 모자. 라운드-하단 튜브를 반전 하 고 집중, coverslip, 그리고 어댑터 위에 그것을 배치.
- 부드럽게 라운드 하단 튜브의 맨 아래까지 핀셋으로 앙상블을 밀어 하 고 튜브를 반전. 집중의 상단에 올 때까지 라운드 하단 튜브를 10mm K-파이프 버퍼 (pH 7.2)를 추가 합니다. 거기 남아 있지는 집중의 중앙 실린더에 있는 모든 거품 다는 것을 확인 하십시오.
- 부드럽게 농축된 중심소체 분수를 포함 한 약 수를 10 m m K-파이프 버퍼 (pH 7.2)의 100 µ L을 추가 하 고 볼륨을 철저 하 게 혼합.
- 집중 노즐의 빈 센터에서 10 m m K-파이프 버퍼 (pH 7.2)의 100 µ L를 제거 하 고 내용을 빈 센터에 남아 돌보는 집중의 빈 센터 10 m m K-파이프 버퍼 (pH 7.2)에서 풍부한 centriolar 분수의 100 µ L를 추가.
- 4 ° c.에 미리 냉각된 원심 분리기에서 (예를 들어, JS 13.1 진동 물통 회전자) 10 분 10000 x g 에서 원심
- 핀셋으로 집중 장치를 제거 합니다.
- 손수 구부려 진된 장치 어댑터의 슬롯된 가장자리에 구멍에 삽입 하 여는 coverslip 복구 하 고 부드럽게 들어올립니다. 라운드-하단 튜브의 상단에 도달, gloved 손가락으로 어댑터의 가장자리를 트랩 하 고는 coverslip 핀셋으로 제거 합니다. 기억 하는 coverslip의 측면을 포함 centrioles 주의 해야 합니다. 면역 형광 검사에 대 한 coverslips 치료를 진행 합니다.
참고: 손수 푹된 장치는 수동으로 연결 하 고 수 제 스틱 (그림 2B-D)에 성형 주사기 바늘으로 할 수 있다. - 고정 및 단계 3.3.2–3.3.4에서 다 집중된 centrioles의 면역 형광 염색을 수행 합니다.
5입니다. 단일 입자 평균
참고: 그림 4를 참조.
- 단일 입자 평균에 대 한 이미징
- 일반 안티-페이딩 장착 매체를 사용 하 여 슬라이드에는 coverslip를 탑재 합니다. 구조화 조명 현미경 (2D SIM) 이미징 CFI Apochromat TIRF 목표를 사용 하 여 수행 (100 X, 나 1.49, WD 0.12 m m)와 다시 조명 안에 CCD 카메라.
참고: 3 MHz 읽을 카메라에 100 ms 획득 시간 설정 했다. 2.5 X 렌즈 사용 되었다 SIM 이미징.
참고: 여기에 제시 된 데이터 집합 3 차원 시뮬레이션 현미경에 인수 되었다 ( 재료의 표참조). - 이미지 총 중심소체를 구성 하는 이미지의 큰 스택 인수 centrioles 신호 각각 Z-스택 위의의 중심소체 신호 아래와 위쪽 및 아래쪽 위치를 설정 하 여. 스택 프로젝트 및 단일 입자 평균 5.2와 5.3 단계에 따라 수행을 계속 진행 합니다.
- 일반 안티-페이딩 장착 매체를 사용 하 여 슬라이드에는 coverslip를 탑재 합니다. 구조화 조명 현미경 (2D SIM) 이미징 CFI Apochromat TIRF 목표를 사용 하 여 수행 (100 X, 나 1.49, WD 0.12 m m)와 다시 조명 안에 CCD 카메라.
- 스택의 투영
- ImageJ 이미지 스택을 엽니다. 클릭 '→ 스택 이미지 → Z 프로젝트'. 프로젝션 유형을 설정으로최대 강도'.
- 클릭 하 여 이미지를 반전 '편집 → 반전'. 생성 되는 프로젝션 저장 (.tif 형식).
- 단일 입자 정렬 Scipion
- 빨간색을 눌러 Scipion에서 새 프로젝트를 만들기 '프로젝트 만들기' 버튼 페이지의 상단에. 왼쪽된 패널에서 두 번 클릭 '수입 → 수입 현미경'.
- 채우기는 '파일 디렉터리' 와 '패턴 ' 데이터 디렉터리 및 이름 필드. 기본 매개 변수를 유지 합니다. '실행'클릭 합니다.
- '입자 → 수확 → xmipp3-수동 (1 단계) 따기'에 두 번. '입력 현미경' 필드 가까이 돋보기 아이콘을 클릭 하 고 단계 5.3.1에서에서 가져온된 현미경을 선택. '실행'클릭 합니다.
- 새로 열린된 창에서 그들을 클릭 하 여 다른 현미경에서 입자를 선택 합니다. 모든 현미경 사진으로 완료 되 면 빨간색 버튼 '+ 좌표'클릭 합니다.
- '입자 → 추출 → xmipp3-추출 입자'에 두 번. '입력 좌표' 필드 가까이 돋보기 아이콘을 클릭 하 고 단계 5.3.4에서에서 고른된 좌표를 선택. 입자 크기에 따라 '입자 크기 (픽셀)' 상자를 채우십시오. '전처리' 탭에서 먼지 제거 설정: 없음 (그것은 아티팩트를 생성할 수 있다); 대비 반전: 없음 (검은 입자, 흰색 배경); 단계 내리고: 없음 (CTF 교정에 연결); 정상화: 예.
- 다음, '실행'을 클릭 하십시오. 작업이 완료 되 면 클릭 하 고 작업 (테두리 두꺼운 될)의 상자를 선택 하 여 추출 된 입자를 확인 '분석 결과 (메인 메뉴의 왼쪽 아래).
- '2D → → xmipp3 정렬-cl2d와 일치'에 두 번. '입력 입자' 필드 가까이 돋보기 아이콘을 클릭 하 고 단계 5.3.5에서에서 추출 된 입자를 선택. 참조 이미지를 사용 하지 마십시오. '실행'클릭 합니다.
- 두 번 클릭 ' 2D → → 더 많은 → xmipp3-정렬 정렬 적용 2d'. '입력 입자' 필드 가까이 돋보기 아이콘을 클릭 하 고 단계 5.3.7에서에서 정렬 된 입자를 선택.
- 5.3.6 단계에서 '실행' 을 클릭 합니다. 작업 상자의 선택 후 '분석 결과' 를 클릭 하 여 결과 확인할 수 있습니다.
- '입자 → 마스크 → xmipp3-2d 마스크 적용'에 두 번.
- '입력 입자' 필드 가까이 돋보기 아이콘을 클릭 하 고 단계 5.3.9에서에서 정렬 된 입자를 선택. '마스크 소스' 는 '기하학'으로 설정 됩니다. 다음 마스크 형식으로 마스크의 매개 변수 설정: 원형; 반경 (픽셀): 클릭 한 입자 (중심소체) 주위에 아무것도 없이 찾고는 '마술 지팡이 ' ; 완벽 한 값을 찾을 수 있도록 창이 열립니다 왼쪽에 아이콘 이동 센터: 없음 (해당 되는 경우 입자는 중심으로 완벽 하 게) 또는 예 (해당 되는 경우에 입자 이동 된다); X-센터 오프셋: 입자 위치;에 따라 Y-센터 오프셋: 입자 위치에 따라. '실행'클릭 합니다.
- ' 분석 결과 ' 버튼을 사용 하 여 마스크 올바르게 적용 됩니다 확인. 아니라면, '2d 마스크 적용' 작업을 마우스 오른쪽 단추로 클릭 하 고 '편집'을 선택 합니다. 그것은 다시 '실행' 으로 버튼 마스크 (크기 또는 교대) 및 실행 매개 변수를 수정 합니다.
- '2D → 분류 → xmipp3-cl2d'두 번 클릭.
- '입력 입자' 필드 가까이 돋보기 아이콘을 클릭 하 고 단계 5.3.11에서에서 마스크 입자를 선택. 클래스의 수는 클래스 당 약 50 입자를 얻기 위해 해야 합니다. '실행'클릭 합니다.
- ' 분석 결과 ' 버튼을 클릭 하 여 결과 확인 합니다. 열린된 창에서 바로 "무엇을 표시" 옆에 있는 '눈' 아이콘을 클릭 합니다.
- 새 창 '블록' 메뉴에서 'Classes2D' 를 선택 하 여 생성 된 클래스의 검사를 허용 합니다. 같은 메뉴에서 'Class00N_Particles' 를 선택 하 여 각 클래스의 콘텐츠를 확인 합니다. 단지 나쁜 입자를 포함 하는 어떤 것 들을 식별 하기 위해 각 클래스를 검사 합니다. 'Classes2D' 보기로 다시 이동 하 고 각각을 클릭 하 여 좋은 입자와 클래스를 선택 합니다. 'Ctrl' 키를 선택 하는 동안 누른 상태를 유지 하 여 여러 클래스를 선택 가능 하다.
- 좋은 입자와 함께 모든 클래스를 선택 하면 '+ 입자' 이 입자와 하위 집합을 만들려면 클릭 합니다.
- 같은 창에서 입자의 다른 방향을 나타내는 클래스의 몇 가지 세트를 선택 합니다. '+ 평균'에 클릭 하 여 새 하위 집합을 만듭니다.
- 평균에 대 한 각 방향/선택, 다음과 같이 할.
- '2D → → xmipp3 정렬-cl2d와 일치'에 두 번.
- '입력 입자' 필드 가까이 돋보기 아이콘을 클릭 하 고 단계 5.3.17에서에서 좋은 입자를 선택. '예'를 '참조 이미지 사용' 을 설정 합니다. '참조 이미지' 필드 가까이 돋보기 아이콘을 클릭 하십시오 고 단계의 5.3.18 '하위 집합 만들기' 작업에 흰색 화살표 왼쪽에 클릭을 참조로 그것을 사용 하 여 이미지를 선택. 별도 창에서 어떤 개체를 확인 하는 개체를 두 번 누릅니다. '실행'클릭 합니다.
- 두 번 클릭 ' 2D → → 더 많은 → xmipp3-정렬 정렬 적용 2d'. '입력 입자' 필드 가까이 돋보기 아이콘을 클릭 하 고 단계 5.3.19.2에서에서 정렬 된 입자를 선택.
- '실행'클릭 합니다.
- 맞춤의 결과 확인 ('분석 결과 '); 정렬 된 입자와 입자 평균 표시 됩니다.
- 경우 평균 좋은 이며 입자는 모두 같은 방식으로 지향, 저장을 클릭 하 여 평균 ' → 고급 ImageJ' ImageJ로 이미지를 저장 하 고.
- 평균 향상 시킬 수 있습니다, 모든 잘 지향적인된 이미지를 선택 하 고 '+ 입자' 버튼으로 새로운 하위 집합을 만듭니다. 하위 집합 (모든 나쁜 입자 제거) 청소 될 때까지 단계 5.3.19.1–5.3.19.4를 되풀이. 때마다 정렬이 수행 (단계 5.3.19.2), 참조 (반복, 평균 품질 증가를 반복)에서 최근 생성 된 평균에 설정 됩니다.
결과
C. reinhardtii 중심소체 격리:
Centrioles, cw15- C. reinhardtii 세포 했다 빛 아래에서 몇 일 동안 액체 문화에서 자란 고 씻 겨 PBS 가진 1 x 10 분 Pelleted 세포에 대 한 600 x g 에서 원심 분리에 의해 연속적으로 수송과에서 resuspended 하 고는 버퍼 전에 2 분(그림 1)4.5-4.7의 최종 pH 0.5 M 초 산을 사용 하 여 pH 쇼크를 수행 하 여 deflagellation deflagellation 1 N 코의 pH 7.0 복원 사용 되었다. 셀 시체에서 분리 flagella를 분리, deflagellated 세포는 flagella의 일괄 제거 하 centrifuged 처음 했다. 펠 릿 다음 PBS 가진 2 x 세차 고 천천히 25% 자당 쿠션 (그림 1B)에 그것을 로드 하기 전에 30 ml PBS의 resuspended. 튜브는 분리 flagella의 대부분을 제거 하 4 ° C에서 15 분 동안 600 x g 에서 회전 된다. 원심, 후 셀 시체 자당 쿠션 (그림 1C)에 확산 되었고 제거 되는 ( 그림 1C에서 빨간색 화살표)까지 상쾌한의 약 30 mL. 씻어 셀의 결과 20 mL 차가운 PBS의 20 mL에 resuspended 그리고 10 분 600 x g 에서 centrifuged 했다. 다음으로 상쾌한 했다 무시 하 고 셀 10 mL PBS에에서 resuspended 완전히 했다. 셀 250 mL 병에 전송 하 고 세포의 용 해 버퍼 resuspended 셀에 한 번에 추가 되었습니다. DNase는 세포에 추가 되었고 1 h 4 ° c.에 대 한 인 큐베이 팅 세포 파편을 제거 하는 원심 분리 단계 후 (참조 그림 1D화이트 펠 릿)는 상쾌한 수집 되었고 2 mL 60% 자당 쿠션 4 ° c.에 30 분 10000 x g 에서 원심 분리 이전에 신중 하 게 로드 유의 세포의 100 ml, 15 mL의 8 관 세포의 용 해 버퍼 튜브 당 자당의 2 mL에 로드의 12.5 mL에 해당 하는이 단계를 수행 하는 데 사용 했다. 원심, 후는 상쾌한의 대부분 제거 된 쿠션 위에 최대 1 mL. 나머지 상쾌한의 1 mL 다음 2 mL 쿠션으로 수집 하 고 혼합 되었고 24 mL의 최종 볼륨을 얻기 위해 풀링. 수영장에는 40 로드 다음 %-50%, 70% 자당 그라데이션 및 68,320 x g 1 h 15 분에 4 ° c.에 냈 지 마지막으로 격리 된 centrioles 바늘을 사용 하 여 원심 분리 관의 아래 부분에 구멍을 만들어 수집 했다 고 방울 12 x 500 µ L 분수에서 수집 된. 다른 자당의 높은 밀도 인해 드롭에서 형성 된 아주 느리게 시작 (70% 자당) 그리고 더 빠르게 (40% 자당).
격리 된 Centrioles의 면역 형광 검사
격리 절차의 품질을 평가 하기 위해 각 수집 된 그라데이션 분수의 10 µ L 다음에 coverslip coverslip 지원 어댑터 (그림 2A-2D)를 사용 하 여 centrifuged 했다. 중요 한 것은,는 coverslip를 안전 하 게 제거 하려면 사용자 지정 구부려 진된 장치 설계 되었다 (그림 2B). 다음으로 coverslips 면역 형광에 의해 분석 되었다. CrSAS-6(Bld12p)에 대 한 항 체는 수레 바퀴 구조와 α-tubulin centriolar 벽을 강조 하기 위해 (DMA1)의 존재를 나타내는 데이 연구에 사용 되었다. CrSAS-6와 α-tubulin 시야 당에 대 한 긍정적인 했다 centrioles의 수를 계산 하 고 분수 당 centrioles의 총 수를 계산 하는 다음, 그것은 어떤 분수 절연된 centrioles ( 에 대 한 풍부한 했다 확인할 수 그림 2 층-2 H). 흥미롭게도, 6 분수 했다 농축 centrioles (그림 2F , 2g, 분수 #1-6)에 대 한 분수 # 3에 대 한 피크와 마지막 분수 아니었다, 정화 되었음을 나타내는 동안. Note이 특정 실험에서 총 centrioles의 95 %CrSAS-6 그리고 α-tubulin 분수 # 3에에서 대 한 긍정적인가 했다. 이 가장 고립 된 centrioles 그들의 재주 넘기 유지 나타냅니다. 없는 농축 centrioles의 첫 번째 부분에서 관찰 되는 경우 격리 프로시저 작동 하지 않았다 고 반복 해야 합니다. 참고 일부 flagellar 조각 centrioles 없는 분수에서 주로 관찰 될 수 있다.
다음, centrioles µ L 당의 총 수를 계산 하려면 시야 당 중심소체의 수는 비율으로 그림 2H에 의해 증식 한다. 결과 수 해야 다음에 면역 형광 centrioles µ L 당 수를 사용 하는 분수의 볼륨으로 나눌 수 있습니다. 이 특정 격리 절차에서 가장 풍부한 분수 (92 x 92 µ m2의 필드의 보기)와 0.00846 m m2 의 면적에 약 37 centrioles 포함. 튜브 부분의 표면 반경 176 m m2의 총 표면에 7.5 m m 이었다. 해당 비율 이었다 다음 176/0.00846 = 20,803.8, 그래서 10 µ L에서 769,740 centrioles (37 x 20, 803.8)의 총. 따라서, 1 µ L에 centrioles 수 76,974 했다.
Coverslips에 고립 된 Centrioles의 농도:
Centrioles 필드의 수를 늘리면 더 입자 평균 절차에 대 한 사용할 수 있는 비슷한 방향 검출의 기회를 증가 뿐만 아니라 명확한 중심소체 방향 탐지의 가능성이 높아집니다. 집중된 분수에서 centrioles는 여전히는 coverslip에 스파스, 우리 원심 액세서리를 coverslip (그림 3A) 집중 장치 라는 중간 centrioles 집중 개발 했다. 3 차원 인쇄에 대 한 정확한 조치.stl 파일이이 원고와 함께 제공 되는 참고.
첫째, 12 m m의 한 coverslip 집중 장치 (그림 3B)에 탑재 했다. 라운드-하단 튜브 거꾸로 되었고 조립된 어댑터 및 집중 배치와 어댑터는 coverslip 위에 배치 되었다. 라운드-하단 튜브는 다음 부드럽게 반전, 샘플 (프로토콜 단계 4.2)의 로드 되므로. centrioles 했다 다음 4 ° c.에서 10 분 동안 10000 x g 에서 centrifuged 그 후,는 centrioles 면역 형광 검사를 받게 되었고 CrSAS-6/Bld12p 및 α-tubulin (그림 3C-3E) 스테인드. 중요 한 것은, 집중 장치, 없이 약 30 centrioles 보였다 시야그림 3(C), 당 때 집중 장치 사용된 (그림 3D-3 층) 183 centrioles 시야 당 보인 반면. 참고는 centrioles는 coverslip 한가운데 직경에서 4 mm의 디스크에만 적용 합니다. 이 결과 농도 단계 작동 하 고 coverslips, 따라서 그들의 탐지를 완화 하 고 이미지의 정의 된 영역에서 centrioles의 6-fold 농축 수를 보여 줍니다.
형광 단일 입자 평균 절연 C. reinhardtii Centrioles:
약 120의 해상도 도달할 수 있는 SIM 현미경을 사용 하 여 여기, nm, monoglutamylated tubulin (GT335, 그림 4), centriolar microtubules에 tubulin 수정에 대 한 스테인드 centrioles 군데24했다. C. reinhardtii centrioles는 약 500 nm, 쌍에서 항상 길고 자주 발견과 관련, 새로 복제 probasal 시체 (라고 하 procentrioles이 하) 및 microtubule 관련 섬유19전기. 따라서,이 최종 조립 큰 약 1 µ m 이었다. 이러한 이유로, 그리고 전체에서 centrioles 이미지 순서, Z-스택 격리 centrioles에 취득 하는 것이 좋습니다.
여기, 인수, 후 최종 이미지 ImageJ28 (이미지/스택/Z 프로젝트/최대 강도 프로젝션, 그림 4B)를 사용 하 여 최대 강도 투영을 수행 하 여 생성 되었습니다. 이러한 이미지에서 cryo 전자 현미경 검사 법 소프트웨어를 사용 하 여 단일 입자 분석 centrioles 유사한 방향으로의 클래스를 만들기 위해 수행 하 고 수행한 다음 평균. 이렇게 하려면, 이미지 컬러는 처음 더 나은 시각화 개체 (그림 4C) 위하여 반전 됩니다. Centrioles 가운데 자유롭게 사용할 수 있는 Scipion 소프트웨어29 을 통합 하는 Xmipp3 등 여러 전자 현미경 소프트웨어 프로그램을 사용 하 여 각 입자에는 상자에 수동으로 선택 했다 (그림 4D). 상자의 크기는 사용자에 의해 정의 되어야 하는 참고. 여기, 50 x 50 픽셀 31.84의 픽셀 크기의 상자 nm 사용 되었다. 다음으로, 모든 입자 했다 (그림 4E)을 추출 하 고 Xmipp3를 사용 하 여 정렬 (그림 4F). 다음, 12 픽셀 반경에 원형 마스크 centriolar-쌍 (그림 4G)에서 각 중심소체 분리에 적용 되었습니다. 입자 다음, 여러 평균을 생성 하는 Xmipp3를 사용 하 여 분류 되었다. 단지 동종 클래스 평균 유지 했다, 클래스 평균에서 갈리는 입자 수동으로 제외 된 의미. 이 단계는 선택한 한 완벽에 가까운 평균을 생성 하기 위해 반복 되었다. 평균 두 클래스 생성 된 5 개의 반복 후: 63 개체 (그림 4H)에서 상위 뷰와 측면 monoglutamylated centrioles의 (그림 4나) 98 입자에서 볼. 개체의 크기는 monoglutamylation 신호에 따라 강도 플롯 프로필의 봉우리 사이의 거리를 측정 하 여 결정 했다.
중요 한 것은,의 사이드 뷰 클래스 평균 길이가 260 nm 직경 250 nm, 지역화 중심소체17의 핵심 내 길이 286 ± 33 nm의 영역을 표시 했다 측정된 monoglutamylated tubulin 신호에 비해.
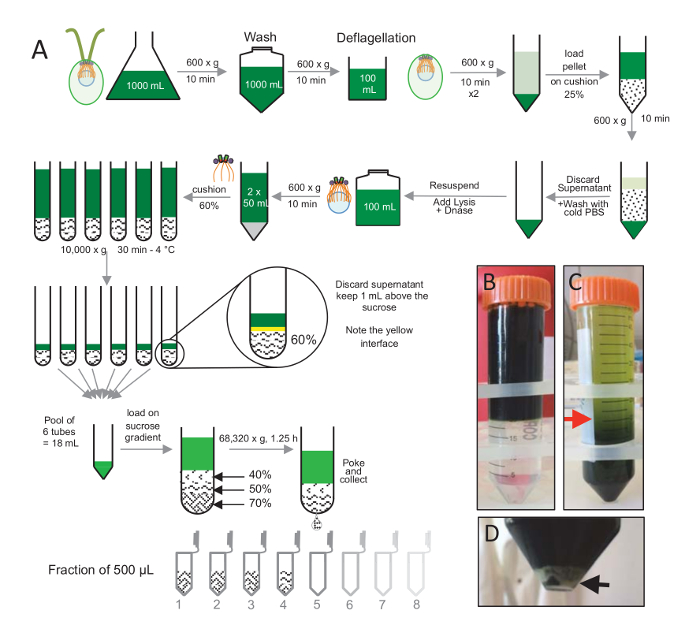
그림 1 : 정화 C. reinhardtii centrioles. (A) 이것은 C. reinhardtii centrioles의 격리로 이어지는 각 단계에 대 한 도식 표현 이다. 그것은 25% 자당 기온 변화도에 원심 분리 후 전에 프로토콜 (B)와 (C)의 대표적인 단계를 포함합니다. 패널 C 에 빨간색 화살표는 원심 분리 후 계속 최소 볼륨을 나타냅니다. (D)이이 패널 원심 분리 후 lysed 세포의 흰색 펠 릿을 보여줍니다. 검은색 화살표는 펠 릿을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
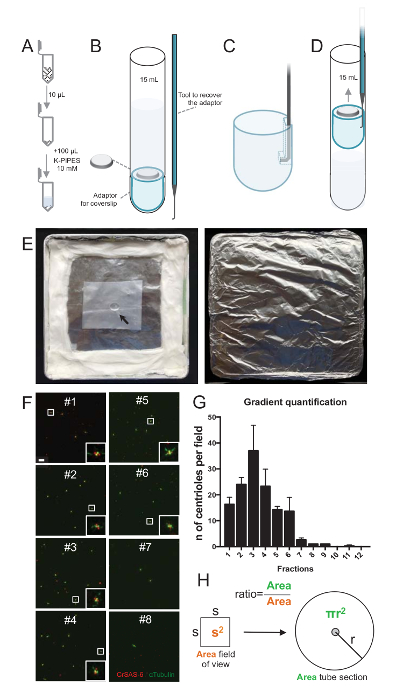
그림 2 : 원심 분리 설정에 면역 형광 검사를 수행 하기 위해 절연 centrioles. 각 수집 된 분수의 (A) 10 µ L를 먼저 희석 하 여 100 µ L 10 m m K-파이프 (pH 7.2)에서. (B) 15 mL 라운드-하단 튜브, 12 m m coverslip coverslip, 대 한 어댑터를 포함 하는 원심 분리 장치 및 원심 분리 후에 coverslip 복구 주문 품 구부려 진된 장치 도식 표현입니다. 패널 C 와 D 는 coverslip 원심 분리 후 복구 하는 방법을 설명 하는 그림을 표시 합니다. (C) 장소는 어댑터의 슬롯된 가장자리에 있는 구멍에 구부려 진된 도구와 (D) 부드럽게 당겨. (E) 이러한 면역 형광 이미징 수행 하는 데 필요한 습기 챔버의 사진입니다. 화살표는 12mm coverslip을 나타냅니다. (F) 이들은 63 X (2 줌) 그라데이션 분수 #1-8, 정화 절차 동안 수집된의 대표적인 confocal 이미지와 CrSAS-6 (레드)와 α-tubulin (녹색)에 대 한 스테인드. 인세트 낮은 확대 보기에서 흰색 상자로 표시 된 영역에 해당 합니다. 눈금 막대 = 10 µ m. (G) CrSAS-6 및 각 분수에 시야 당 α-tubulin centrioles 긍정적인의 수를 나타내는 그래프입니다. 분수 #1-6에서 농축 note Centrioles 필드 각 분수에서의 평균 수: #1 16.3 ± 4.7 #2 = 24.0 ± 4.6, #3 = 37.0 ± 17.0, #4 = 23.3 ± 11.4, #5 = 14.3 ± 2.1, #6 = 13.7 ± 9.3, #7 = 2.7 ± 1.2, #8 = 1.0 ± 0.0, #9 = 1.0 ± 0.0, #10 = 0.0 ± 0.0, # 11를 = 0.3 ± 0.6, #12 = = 0.0 ± 0.0. 각 부분에 대 한 3 임의의 필드 몇 군데 있었다. 가장 풍부한 분수 #3 세, 우리 발견은 centrioles의 95%는 CrSAS-6 및 α-tubulin 긍정적인 참고 (n = 205 centrioles). (H) A centrioles는 현미경의 측정된 영역에 존재의 수의 비율 centrioles 튜브의 영역에 존재의 총 수를 계산 하는 데 사용 됩니다. 중심소체 수 µ L 당 10 µ L 원래 centrifuged 분수에서 계산할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
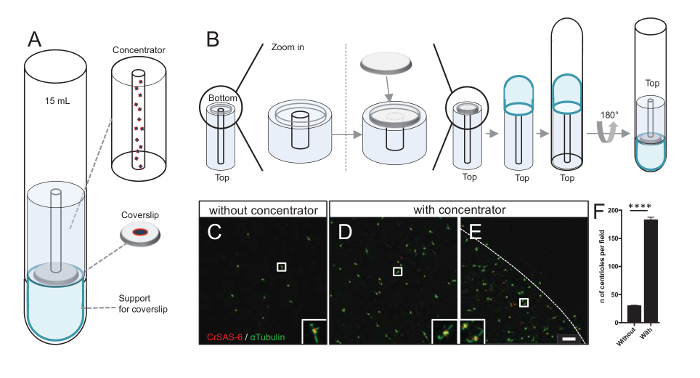
그림 3 : 절연된 centrioles 집중 장치를 사용 하 여 centrifuged는. (A)이이 패널 centrioles 면역 형광 검사, 등 15 mL 라운드-하단 튜브, 집중 장치, 12 mm coverslip 지원 어댑터 장치 이전 coverslips에 집중 하는 데 필요한 원심 분리 장치를 보여 줍니다. (B)이이 패널 원심 분리 장치를 조립 하는 단계를 보여 줍니다. 패널 C-E CrSAS-6 (레드)와 α-tubulin (그린) (C) 없이 또는 (D-E)에 대 한 집중 장치 물 centrioles의 공초점 이미지를 표시 합니다. 인세트 낮은 확대 보기에서 흰색 상자로 표시 된 영역에 해당 합니다. 눈금 막대는 10 µ m. 노트 centrioles 풍성 하 게 (점선 나타냅니다 집중 영역의 테두리) coverslip 중간 (F)이이 그래프 보기의 필드와 집중 장치 없이 당 centrioles의 수를 나타냅니다. 5 무작위 분야의 보기는 분석 했다. Centrioles의 평균 수는, 집중, 집중, 29.8 ± 2.9, 없이 182.6 ± 11.5, P < 0.0001. 통계적 의미는 짝이 없는 t에 의해 평가 되었다-테스트. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
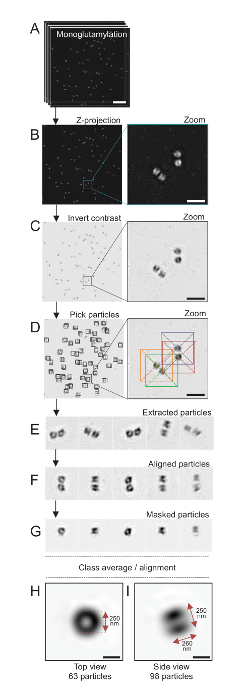
그림 4 : 단일 입자에 고립 된 평균 C. reinhardtii centrioles. (A)이이 패널 centrioles GT335로 얼룩진 고 SIM 현미경을 사용 하 여 인수의 스택 이미지를 보여주는 Z. (B) 이러한 패널 스택된 이미지의 최대 강도 Z 투영 표시. 눈금 막대 = 1 µ m. (C)이 패널 표시 대표 이미지는 거꾸로 대조. 삽입 더 나은 centrioles 시각화를 줌에 나타냅니다. (D)이 패널 표시 입자 따기. 삽입 된 입자 했다 선택 하는 방법을 나타냅니다. (E) 이들은 5 추출의 예 입자. (F)이이 패널 정렬 후 입자를 보여줍니다. (G)이이 패널 마스크를 적용 한 후 입자를 보여줍니다. 패널 H 와 나 두 클래스 평균을 표시: (H)는 상단 보기 (63 입자)와 (나) 측면 보기 (98 입자). 이중 화살표는 GT335 신호 크기를 나타냅니다. 눈금 막대 = 250 nm. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
보조 파일 1. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
보조 파일 2. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
토론
생물학에서 과제 중 하나는 건축 문맥에 있는 단백질의 정확한 지 방화를 해독 것입니다. 중심소체는 이러한 방법을 적용 하는 이상적인 구조 그것의 길이 따라 재미 있는 ultrastructural 기능을 공개 하는 cryo 전자 단층 촬영을 사용 하 여 그것의 건축 공부 하고있다. 그러나,으로 광학 현미경의 해상도 제한 가까이, 그것은 정확 하 게 사용 하 여 기존의 현미경30중심소체의 구조 하위 영역에 면역 형광 검사 하 여 단백질을 지역화 어렵다.
광학 현미경의 해상도 제공, 대략 200의 측면 최대 해상도 빛의 회절에 의해 제한 된다 광학 현미경24nm. 그러나,이 제한 되었습니다 지난 20 년의 중요 한 돌파구 중 하나에 의해 우회할 광학 현미경: 최고 해결책 방법의 발명. 이러한 접근은 다른 해상도에서 회절 한계를 넘어 이미지 수: 120 SIM에 대 한, 약 50 nm에 자극된 방출 소모 (호텔 위치), 및 20-40 nm 단일 분자 지 방화 현미경 검사 법 (SMLM)24. 이러한 새로운 발전과 함께 슈퍼 해상도 현미경의,는 중심소체의 구조 하위 영역 달성 가능 하다. 그러나, 실제로, 그것은 아직 정확 하 게 성숙한 centrioles 셀 당 2만 부에 존재 하 고 무작위 방향, 해석 하 게 하는 주요 이유로 구조적 요소에 단백질의 지역화가 결정 하기 어려운 지역화 어려운입니다. 이러한 이유로, 프로토콜 설정 했다 연구자 centrioles, 비-모호한 방향 관찰 기회 증가 수가 많은 슈퍼 해상도로 이미지를 수 있도록. 중요 한 것은,이 방법은 절연된 centrioles의 사용에 의존, 우리 제공 하는 그대로 C. reinhardtii 를 정화 하는 방법을 centrioles 성숙한 centrioles 및 procentrioles를 포함 하는.
마지막으로,이 프로토콜 군데 수 중심소체 방향 범위 때문에 단일 입자 분석 적용할 수 있는 전자 현미경 소프트웨어를 사용 하 여. Centrioles 특정 방향에서의 평균 클래스의 생성 결과. 중요 한 것은, 이러한 결과 2 차원 이미지 다음는 중심소체 따라 특정 단백질의 지 방화를 평가 하기 위해 사용할 수 있습니다. 실제로,이 방법은 듀얼 컬러 슈퍼 고해상도 이미지에 적용할 수 있습니다 그리고 다른 색상 동안 중심소체 해골 (예를 들어, tubulin), 특정 centriolar 단백질에 표시 될 수 있습니다 공개를 한 색상을 사용할 수 있습니다. 한 가지 색 또는 두 가지 색상으로 얻은 평균을 빼서 중심소체 (근 위, 중앙, 또는 말 초)에 따라 단백질을 등록 하기 쉽게 된다. 참고 두 개의 채널 정확 하 게 어떤 잘못 된 해석을 방지 하기 위해 정렬 되어야 한다. 또한, 최고 전망의 평균 단백질 centriolar 루멘, microtubule 벽을 따라 나는 중심소체 외부 내부 localizes 경우 해독 도움이 됩니다.
이 메서드는 다른 유형의 라벨 때문에 그렇지 않으면 지역화 어려울 수 있는 특정 단백질의 지역화를 확인 장점이 있습니다. 참고는 다른 방법으로는 centrioles 내 단백질을 지도 하는에서 기술 되었다 상호 3 차원 시뮬레이션/SMLM, 예를 들어,는 centrioles의 특정 방향 주위 원환을 형성 하는 마커의 타원형 프로 파일을 확인 하 여 평가 중심소체 시뮬레이션 영상에 의해입니다. 이 매개 변수를 사용 하 여 4-5 nm30의 정밀도 가진 단백질을 지역화 가능 하다. Note는 또한 설명 하는 방법을 여기에서는 격리 centrioles 그대로 procentrioles, 중심소체 아키텍처는 가장 가능성이 크게 보존 하는 서명으로. 그러나, 몇몇 건축 기능은 중심소체 직경으로 인간의 centrosome5의 절연 증폭 divalent 양이온의 농도 변화 등 정화 하는 동안 방해를 배제 수 없습니다 합니다.
여기에 제시 된 프로토콜의 중요 한 단계 중 하나는 충분히 집중된 격리 centrioles Fluo-스파 의무가 다른 방향에서 얻을 것입니다. 이렇게 하려면 먼저 확인 순도 중심소체 격리 절차의 효율성. 절연된 centrioles의 낮은 농도 적절 한 이미지와 이미지 처리 되지 것입니다. 이 위해 우리 centrioles 시야 당 수를 풍부 하 게 하는 방법을 제공 하는. 사용 분수에서 centrioles의 수에 따라 집중 장치에 로드 볼륨 조정 되어야 한다, 250 µ L의 최대 볼륨.
중요 한 것은,이 방법은 cw15 C. reinhardtii 세포-세포 벽에 대 한 개발 되었습니다. 이 긴장에서 세포 벽의 취약성은 적절 한 세포 세포의 용 해 및, 따라서, 그 내용의 해방에 대 한 수 있습니다. 이 프로토콜은 야생-타입 C. reinhardtii 에 대 한 효율적인 세포, 세포 벽 방지 적절 한 세포의 용 해로. 쥡니다 또는 autolysin, 세포 벽31을 저하 시킬 수 있는 효소와 세포의 사전 인큐베이션 등 대체 전략 여기 격리 프로토콜을 적용 하기 전에 셀 벽을 변경 하는 장소에 넣어야 할 것입니다.
이 설치는 기존의 confocal 현미경에서 높은 처리량 전용 슈퍼 해상도 현미경에 이르기까지, 현미경의 종류와 함께 사용할 수 있습니다. SMLM 하 고, 특별 한 버퍼는 필요 적절 한 영상 그리고, 따라서, 12mm coverslip는 coverslip 위에 버퍼에 대 한 적응 챔버를 사용 한다. 다음 이미지는 거꾸로 현미경으로 수행 됩니다. 현미경 설정 12 mm coverslip 허용 하지 않으면, 여기에 제시 된 프로토콜에 18 m m coverslips 30 mL 라운드-하단 튜브 및 수정 된 어댑터와 집중 장치를 사용 하 여 적용할 수 있습니다. 그것은 또한 고정 하는 방법으로 주 SMLM에 있는 마지막 개조의 품질은 얼룩의 사용, 기본 항 체의 질에 따라 달라 집니다 중요 하다.
요약 하자면, Fluo-스파 다른 방향에서 centrioles의 평균을 생성 하는 따라서 돕는 정밀 centriolar 단백질을 지역화 하 여 수많은 centrioles 따라 이미지에 적용할 수 있는 메서드를 제공 하는 우리. 중요 한 것은,이 방법을 적용할 수 있습니다 일반적으로 다른 종에서 격리 centrioles, 다른 세포 또는 큰 고분자 어셈블리. 마지막으로, 샘플 준비 방법 여기에 제시, 결합 형광 SMLM 데이터32의 단일 입자 분석 최근 알고리즘 개발, 고분자의 큰 분자 제작에서 개선 더 열 수 있습니다. 어셈블리입니다.
공개
저자는 공개 없다.
감사의 말
우리 콜 Polytechnique 연방 공과대 학교 드 로잔 (EPFL), 로잔, 스위스, SIM 이미지는 centrioles의 인수 했다에서 피에르 Gönczy BioImaging & 광학 플랫폼 (BIOP) 감사 합니다. 니콜라이 Klena 및 Davide Gambarotto는 유럽 연구 회의 (ERC) 시작 그랜트 (StG) 715289 (악센트) 및 Maeva 르 Guennec, 폴 Guichard, 스위스 국립 과학 재단 (SNSF) PP00P3_157517에 의해 버 지 니 하멜에 의해 지원 됩니다. 수잔 논문집 제네바의 대학에 의해 지원 됩니다.
자료
| Name | Company | Catalog Number | Comments |
| Mouse monoclonal anti-apha tubulin (clone DM1A) | Abcam | ab7291 | dilution 1:300 |
| DNaseI | Roche | 10104159001 | |
| 12 mm coverslips | Roth | YX03.1 | |
| 18 mm coverslips | Roth | LH23.1 | |
| K2HPO4 | Fluka | 60355 | |
| KH2PO4 | Fluka | 60230 | |
| Tris base | Biosolve Chimie SARL | 0020092391BS | |
| acetic acid | Carlo Erba Reagents | 524520 | |
| NH4Cl | Sigma | A-4514 | |
| CaCl2 | Sigma | C-7902 | |
| MgSO4 | Sigma | 63140-500G-F | |
| steritop filter | Millipore | SCGPT05RE | |
| sucrose | Sigma | S7903-1KG | |
| HEPES | AppliChem PanReac | A3724,0250 | |
| PIPES | Sigma | P6757-500G | |
| MgCl2 | ACROS ORGANICS | 197530010 | |
| NP-40 | AppliChem PanReac | A1694,0250 | |
| Round-bottom (Kimble) tubes 15 mL | Fisherscientific | 09-500-34 | |
| Round-bottom (Kimble) tubes 30 mL | Fisherscientific | 09-500-37 | |
| cover glass staining rack | Thomas scientific | 8542E40 | |
| crystal polystyrene transmission lab box | FISHERS | 11712944 | |
| Methanol | VWR | 20864.32 | |
| BSA | Roche | 10735086001 | |
| Triton X100 | Roth | 3051.3 | |
| goat anti-mouse coupled to Alexa 488 | invitrogen | A11029 | dilution 1:1,000 |
| goat anti-rabbit coupled to Alexa 568 | invitrogen | A11036 | dilution 1:1,000 |
| mounting medium | abcam | ab188804 | |
| Tube, thinwall polypropylene | Beckman Coulter | 326823 | |
| Poly-D-Lysine 1 mg/mL | SIGMA | A-003-E | |
| Mouse monoclonal anti-Polyglutamylation modification mAb (GT335) | Adipogen | AG-20B-0020 | dilution 1:1,000 |
| glycerol mounting medium with DAPI and DABCO | Abcam | ab188804 | |
| 50 mL conical tubes | Falcon | 14-432-22 | |
| Eppendorf 5810R centrifuge | Eppendorf | 5811000622 | |
| Beckman JS-13.1 swinging bucket rotor | Beckman Coulter | 346963 | |
| Beckman SW 32Ti rotor | Beckman Coulter | 369694 | |
| parafilm | Bemis | 13-374-10 | |
| Leica TCS SP8 with Hyvolution mode | Leica | ||
| OSRAM L18W/954 LUMILUX | Luxe Daylight/ OSRAM | ||
| Whatman filter paper | Sigma | WHA1001325 | |
| CrSAS-6/Bld12 antibody | dilution 1:300 (Hamel el al., 2014) | ||
| Scipion | http://scipion.i2pc.es/ | ||
| EM CCD camera (Andor iXON DU897) | Andor |
참고문헌
- Bornens, M. The centrosome in cells and organisms. Science. 335 (6067), 422-426 (2012).
- Nigg, E. A., Holland, A. J. Once and only once: mechanisms of centriole duplication and their deregulation in disease. Nature Reviews Molecular Cell Biology. 19 (5), 297-312 (2018).
- Nigg, E. A., Raff, J. W. Centrioles, centrosomes, and cilia in health and disease. Cell. 139 (4), 663-678 (2009).
- Gönczy, P. Towards a molecular architecture of centriole assembly. Nature Reviews Molecular Cell Biology. 13 (7), 425-435 (2012).
- Paintrand, M., Moudjou, M., Delacroix, H., Bornens, M. Centrosome organization and centriole architecture: their sensitivity to divalent cations. Journal of Structural Biology. 108 (2), 107-128 (1992).
- Winey, M., O'Toole, E. Centriole structure. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1650), (2014).
- Dippell, R. V. The development of basal bodies in paramecium. Proceedings of the National Academy of Sciences of the United States of America. 61 (2), 461 (1968).
- Allen, R. D. The morphogenesis of basal bodies and accessory structures of the cortex of the ciliated protozoan Tetrahymena pyriformis. The Journal of Cell Biology. 40 (3), 716-733 (1969).
- Li, S., Fernandez, J. -. J., Marshall, W. F., Agard, D. A. Three-dimensional structure of basal body triplet revealed by electron cryo-tomography. The EMBO Journal. 31 (3), 552-562 (2012).
- Guichard, P., Chrétien, D., Marco, S., Tassin, A. -. M. Procentriole assembly revealed by cryo-electron tomography. The EMBO Journal. 29 (9), 1565-1572 (2010).
- Guichard, P., et al. Native architecture of the centriole proximal region reveals features underlying its 9-fold radial symmetry. Current Biology. 23 (17), 1620-1628 (2013).
- Hirono, M. Cartwheel assembly. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1650), (2014).
- Bornens, M., Paintrand, M., Berges, J., Marty, M. C., Karsenti, E. Structural and chemical characterization of isolated centrosomes. Cell Motility and the Cytoskeleton. 8 (3), 238-249 (1987).
- Keller, L. C., Romijn, E. P., Zamora, I., Yates, J. R., Marshall, W. F. Proteomic analysis of isolated chlamydomonas centrioles reveals orthologs of ciliary-disease genes. Current Biology. 15 (12), 1090-1098 (2005).
- Kilburn, C. L., et al. New Tetrahymena basal body protein components identify basal body domain structure. The Journal of Cell Biology. 178 (6), 905-912 (2007).
- Bauer, M., Cubizolles, F., Schmidt, A., Nigg, E. A Quantitative analysis of human centrosome architecture by targeted proteomics and fluorescence imaging. The EMBO Journal. 35 (19), 1-15 (2016).
- Hamel, V., et al. Identification of Chlamydomonas Central Core Centriolar Proteins Reveals a Role for Human WDR90 in Ciliogenesis. Current Biology. 27 (16), 2486-2498 (2017).
- Cavalier-Smith, T. basal body and flagellar development during the vegetative cell cycle and the sexual cycle of Chlamydomonas reinhardii. Journal of Cell Science. 16 (3), 529 (1974).
- Geimer, S., Melkonian, M. The ultrastructure of the Chlamydomonas reinhardtii basal apparatus: identification of an early marker of radial asymmetry inherent in the basal body. Journal of Cell Science. 117, 2663-2674 (2004).
- Nakazawa, Y., Hiraki, M., Kamiya, R., Hirono, M. SAS-6 is a cartwheel protein that establishes the 9-fold symmetry of the centriole. Current Biology. 17 (24), 2169-2174 (2007).
- Hamel, V., et al. Correlative multicolor 3D SIM and STORM microscopy. Biomedical Optics Express. 5 (10), 3326 (2014).
- Guichard, P., et al. Cell-free reconstitution reveals centriole cartwheel assembly mechanisms. Nature Communications. 8, 14813 (2017).
- Hiraki, M., Nakazawa, Y., Kamiya, R., Hirono, M. Bld10p constitutes the cartwheel-spoke tip and stabilizes the 9-fold symmetry of the centriole. Current Biology. 17 (20), 1778-1783 (2007).
- Sahl, S. J., Hell, S. W., Jakobs, S. Fluorescence nanoscopy in cell biology. Nature Reviews Molecular Cell Biology. 18 (11), 685-701 (2017).
- Hutner, S. H., Provasoli, L., Schatz, A., Haskins, C. P. Some Approaches to the Study of the Role of Metals in the Metabolism of Microorganisms. Proceedings of the American Philosophical Society. 94 (2), 152-170 (1950).
- Keller, L. C., Marshall, W. F. Isolation and proteomic analysis of chlamydomonas centrioles. Methods in Molecular Biology. 432 (1), 289-300 (2008).
- Borlinghaus, R. T., Kappel, C. HyVolution-the smart path to confocal super-resolution. Nature Methods. 13 (3), (2016).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- de la Rosa-Trevín, J. M., et al. Scipion: A software framework toward integration, reproducibility and validation in 3D electron microscopy. Journal of Structural Biology. 195 (1), 93-99 (2016).
- Gartenmann, L., et al. A combined 3D-SIM/SMLM approach allows centriole proteins to be localized with a precision of ∼4-5 nm. Current Biology. 27 (19), 1054-1055 (2017).
- Jaenicke, L., Kuhne, W., Spessert, R., Wahle, U., Waffenschmidt, S. Cell-wall lytic enzymes (autolysins) of Chlamydomonas reinhardtii are (hydroxy)proline-specific proteases. European Journal of Biochemistry. 170 (1-2), 485-491 (1987).
- Salas, D., et al. Angular reconstitution-based 3D reconstructions of nanomolecular structures from superresolution light-microscopy images. Proceedings of the National Academy of Sciences of the United States of America. 114 (35), 9273-9278 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유