Method Article
Изоляция и флуоресценции изображений для одной частицы реконструкция Хламидомонада Centrioles
В этой статье
Резюме
Мы разработали стратегию для очищения и большое количество centrioles в различных ориентациях поддаются суперразрешением микроскопии и одного частица усреднения изображений.
Аннотация
Centrioles являются большие макромолекулярных сборки, важное значение для надлежащего выполнения основных клеток биологических процессов, таких как деление клеток, клеток подвижности или сигнализации ячейки. Зеленые водоросли Хламидомонада показало оказался глубокий модели в исследовании Центриоль архитектуры, функции и состав белков. Несмотря на большие успехи в направлении понимания centriolar архитектуры один из текущих задач является для определения точной локализации centriolar компонентов в рамках структурных регионах Центриоль для того, чтобы лучше понять их роль в Центриоль биогенеза. Одним из основных ограничений заключается в резолюции микроскопии флуоресцирования, которая усложняет толкование локализации протеина в этой органелле с размерами недалеко от дифракционного предела. Чтобы решить этот вопрос, мы предоставляем способ очищения и изображения большое количество C. показало centrioles с различными ориентациями и использованием микроскопии суперразрешением. Эта техника позволяет дальнейшую обработку данных через флуоресцентные сингл частица усреднения (Fluo-спа) ввиду большого числа centrioles приобрел. FLUO-спа генерирует средние окрашенных centrioles C. показало в различных ориентациях, способствуя тем самым локализация различных белков в centriolar регионах. Важно отметить, что этот метод может применяться для centrioles изображения от других видов или других крупных макромолекулярных сборок.
Введение
Центриоль является эволюционно сохранены органелл, который лежит в основе центросом в животных клетках и может выступать в качестве органа базальную (именуемый centrioles далее) реснички шаблон или жгутиков многих эукариот1,2. Таким образом centrioles имеют решающее значение для основных клеток биологические процессы, начиная от шпинделя Ассамблеи в ячейку сигнализации. Таким образом дефекты Центриоль Ассамблеи или функции были связаны с несколько человеческих патологий, в том числе рака и ciliopathies3.
Centrioles девятикратного, симметрично, микротрубочки, триплет-на основе цилиндрических структур, которые являются, как правило, ~ 450 нм длиной и ~ 250 Нм широкий4,5,6,7. Обычных электронной микроскопии и крио электронная томография centrioles от разных видов показали, что centrioles являются поляризованный вдоль их оси с трех различных регионов: проксимальный региона, центральное ядро и дистальной регион5 , 7 , 8 , 9 , 10 , 11. Важно отметить, что каждый из этих регионов отображает структурных особенностей. Во-первых в просвет проксимальных регионе 100 Нм Лонг содержит структуру колесом, подключенных к микротрубочек триплет через элемент булавочную головку12. Во-вторых, 300 – 400 Нм Лонг центрального региона содержит волокнистых плотности в просвет и структурные особенности вдоль внутренней стороны микротрубочек: Y-образный компоновщик, C-трубочку хвост и A-трубочку заглушки9. Наконец 50 – 100 Нм при дистальной части региона экспонатов югу дистальных и дистальной придатки, которые окружают дистальной частью Центриоль5,13.
За последние два десятилетия были отмечены открытия все большего числа centriolar белков, ведущих к текущей оценке около 100 различных белков, будучи частью Центриоль14,,1516, 17. Несмотря на эти достижения, точной локализации этих белков в пределах Центриоль остается недостижимым, особенно в рамках структурных субрегионов. Важно отметить, что назначение точной локализации структурных областей Центриоль имеет решающее значение для лучшего понимания их функции. В этой связи C. показало centrioles сыграли важную роль в обоих аспектах, первый делимитации различные структурные особенности вдоль цилиндра9,18,19, который затем позволяет Исследователи соотнести локализации подмножество белков с помощью флуоресцентной микроскопии к югу структурные области. Это включает в себя, например, белки, Bld12p и Bld10p, которые в частности локализовать в регионе проксимального отдела и в структуре колесом20,21,,22-23. Список каркаса локализованные белков также включает в себя POB15 и POC16, два Роман белков, выявленных по масс-спектрометрии, которые украшают внутреннее ядро центрального региона C. reinhardtii centrioles17.
Этот документ содержит полное описание метода, разработанного для изоляции и изображения C. показало centrioles для последующих суперразрешением микроскопии и сингл частиц в среднем. Для достижения этой цели, важно разграничить технические ограничения, которые необходимо преодолеть. Во-первых Центриоль очистки может повлиять на общую архитектуру, с колесом структуры, часто теряются на различных этапах изоляции9. Во-вторых размеры Центриоль очень близки дифракционный предел в оптической микроскопии. Действительно, латеральное разрешение, которое может быть получено в конфокальной микроскопии — около 200 nm24, похож на диаметр Центриоль и резолюции в z-оси идет о 2-3 x ниже, ведет к анизотропной тома. В-третьих неоднородность антитела маркировки и Центриоль ориентации может ограничить толкование необходимо локализовать белка в конкретных centriolar субрегионе. Наконец centrioles существует только две копии в клетку, что делает его трудно приобрести большое количество изображений и найти однозначный Центриоль ориентацию. Чтобы обойти эти технические вопросы, мы разработали метод, который основывается на применении суперразрешением микроскопия на большое число изолированных centrioles, которые принимают различные ориентации. Сначала мы опишем протокол для очистки C. показало centrioles, который позволяет очистки структурно нетронутыми centrioles и procentrioles, содержащие колесом. Затем мы опишем пошаговое протокол сосредоточиться centrioles на coverslips для образов обычными или суперразрешением флуоресцентной микроскопии. Этот важный шаг позволяет для увеличения числа centrioles, отображаемого в нескольких направлениях. Наконец мы будем описывать процедуры для выполнения одно частиц в среднем на данных, полученных на люминесцентные Микроскопы, что облегчает обнаружение centrioles в разных направлениях. Вообще этот метод может применяться для centrioles изображений из различных видов или других крупных макромолекулярных сборок.
протокол
1. средства массовой информации подготовка C. показало культуры и изоляции Центриоль
-
Подготовка средств массовой информации для культуры клеток C. показало
Примечание: Ниже шаги описывают подготовку акций решения для 1 х TAP (фосфат трис ацетат) среднего.- Подготовка фосфатного буфера (рН 7), путем смешивания 250 мл 1 M K2HPO4 (174.2 g K2HPO4 дополнить дистиллированной водой до 1 Л) с ~ 170 мл 1м х2PO4 (136.09 g KH2PO4 в 1 Л). Отрегулируйте смесь для достижения рН 7.
- Подготовить раствор (40 x), смешивая 96,8 g трис, 40 мл фосфатного буфера (рН 7) и 40 мл уксусной кислоты и настроить решение для 1 Л дистиллированной водой.
- Подготовить решение B (40 x) с помощью 16 g NH4Cl, 2 g CaCl2и 4 g MgSO4. Будьте осторожны, чтобы растворить CaCl2 в дистиллированной воде отдельно перед его добавлением к другим компонентам. Настройте решение 1 Л дистиллированной водой.
- Готовят Хатнер в прослеживающие элементы буфера25 следующим образом.
- На 1 Л буфера, распустить каждое соединение в указанный объем воды: ЭДТА динатриевая соль (50 г 250 мл), ZnSO4.7H2O 22 g в 100 мл, H3Бо3 (11,4 г на 200 мл), НКД2.4H2O (5.06 g 50 мл) , CoCl2.6H2O (1,61 g 50 мл), CuSO4.5H2O (1.57 g 50 мл), (NH4) 6Mo7O24.4H2O (1.10 g 50 мл) и FeSO4.7H2O (4.99 g 50 мл).
Примечание: ЭДТА, должны быть распущены в кипящей воде, и FeSO4 должен быть готов последний избежать окисления. - Смешайте все решения, за исключением ЭДТА и довести до кипения. Затем добавить ЭДТА, и решение должен стать зеленым. После растворения все, прохладном решение 70 ° C. На этой температуре добавьте 85 мл горячего раствора KOH 20% (20 г в 100 мл). Настройте решение 1 Л дистиллированной водой при комнатной температуре (RT).
- Добавить плагин хлопка в колбу и дайте постоять 1-2 недели, покачивая его решение 1 раза в день. Решение должно первоначально быть зелеными и затем становятся пурпурными, оставляя осадок ржавчины коричневый; удаление осадка с помощью фильтровальной бумаги, до тех пор, пока раствор не станет прозрачным. Заморозить аликвоты и хранить при температуре от-20 ° C.
- На 1 Л буфера, распустить каждое соединение в указанный объем воды: ЭДТА динатриевая соль (50 г 250 мл), ZnSO4.7H2O 22 g в 100 мл, H3Бо3 (11,4 г на 200 мл), НКД2.4H2O (5.06 g 50 мл) , CoCl2.6H2O (1,61 g 50 мл), CuSO4.5H2O (1.57 g 50 мл), (NH4) 6Mo7O24.4H2O (1.10 g 50 мл) и FeSO4.7H2O (4.99 g 50 мл).
- Подготовка 1 х TAP средний рост клеток C. показало , смешивая следующие компоненты: 25 мл раствора (40 x) и 25 мл раствора B (40 x) с 1 мл Хатнер прослеживающих элементов буфера25и отрегулировать смеси на 1 Л дистиллированной водой. Стерилизуйте смесь, с помощью фильтра 0,4 мкм.
-
Подготовка средств массовой информации для очистки Центриоль
- Подготовьте deflagellation буфера, используя 5% сахарозы в 10 мм HEPES (рН 7) на окончательный объем 500 мл скорректирована с дистиллированной водой.
- Подготовка 250 мл уксусной кислоты 0,5 М.
- Подготовка 250 мл 1 M K-трубы Стоковый раствор (pH 7.2), первый добавить 50 мл H2O растворить порошок трубы, а затем Добавление 10 N Кох до решения начинает становиться ясно. Титруйте до pH 7.2 с 10 N и 1 N Кох и настроить решение для окончательный объем 250 мл с H2O.
- Подготовьте 5 решения сахарозы (w/w) следующим образом.
Примечание: Все сахарозы решения должны быть отфильтрованы после солюбилизация, с помощью фильтра 0,4 мкм подключен в шприц. Обратите внимание, что 60% и 70% сахарозы решения трудны для того солюбилизировать последнего и должны быть помещены в ванну с водой, предварительно нагревают при 60 ° C для облегчения солюбилизация. Mix каждые 10 мин до тех пор, пока полностью не растворится сахарозы.- Для подготовки 25%-ая сахароза, вес 25 г сахарозы и отрегулировать вес до 100 g, добавив 10 мм K-трубы (pH 7.2).
- Подготовка 60% сахарозы, весят 60 г сахарозы и отрегулировать вес до 100 g с 10 мм K-трубы (pH 7.2).
- Подготовьте сахарозы решения для градиента сахарозы. Подготовьте 40%-ая сахароза, весом 40 г сахарозы и регулируя решение 100 g с 10 мм K-трубы (pH 7.2). Аналогичным образом подготовьте 50% (w/w) и 70% (w/w) сахарозы.
- Хранить решения при-20 ° C. Будьте внимательны к Ресуспензируйте сахарозы решения должным образом после оттаивания.
- Подготовка 100 мл буфера lysis путем смешивания 1 мм HEPES (рН 7), MgCl 0,5 мм2и 1% NP-40, и держать его на 4 ° C. Всегда готовить этот буфер свежий день эксперимента. Добавьте анти протеазы таблеток в день Центриоль изоляции.
- Подготовить 1 x фосфатный буфер (PBS) (рН 7,4), смешивая 8 г NaCl, 2 г KCl, 1,44 г Na2HPO4и 0,24 г х2PO4 800 мл дистиллированной H2O. Регулировка рН 7,4 с HCl. Принесите объем смеси до 1 L с дистиллированной H2O.
2. изоляция C. reinhardtii Centrioles
Примечание: Смотрите Рисунок 1.
-
Культура и расширение C. reinhardtii клеток
- Вечером в день 1, прививать cw15 - штамм от твердых пластины в культуру колбу Эрленмейера, содержащие 10 мл 1 x ТКП. Вырастить клетки под белые флуоресцентные лампы (60 µE/м2с) для 2-3 дней при 23 ° C.
- На третий день, разбавить культуры 10 x (до 100 мл) в 1 x КОСНИТЕСЬ и расти клетки под свет на 2-3 дней при 23 ° C.
- На 6 день, разбавить культуры 10 x 1 x нажмите получить 1 Л культуры. Вырасти клетки под свет при 23 ° C, до тех пор, пока культура достигает темно-зеленого цвета, указывающее приблизительный клеток плотность ~ 1 x 10-7 кл/мл26 (день 9 – 10).
-
Очистка centrioles C. показало
- Центрифуги cw15 - клетки на 600 x g 10 мин в 50 мл конические трубы. Помыть лепешка из клетки 1 x 50 мл ПБС и спина его на 600 x g 10 мин Ресуспензируйте Пелле в 100 мл-комнатной deflagellation буфера с пипеткой.
- Deflagellate клетки с рН шок, медленно добавляя капли уксусной кислоты 0,5 М до окончательного pH 4,5-4,7 на магнитной мешалкой и инкубировать и клетки для 2 мин медленно добавить капель 1 N Кох для восстановления pH 7.0.
- Центрифуга клетки на 600 x g 10 мин для удаления любой отдельный жгутиков. Удалить супернатант и хранить таблетки на льду. Помыть лепешка 2 x с 50 мл ПБС охладить при 4 ° C. Затем спина гранул на 600 x g 10 мин при 4 ° C.
- Ресуспензируйте гранулы в 30 мл ПБС и медленно загрузки подвеска на подушке 20 мл 25%-сахароза без смешивания (рис. 1Б).
- Спина на 600 x g 15 мин при температуре 4 ° C для удаления оставшихся жгутиков в надосадке; клетки расположены в 25%-ая сахароза (рис. 1C). Держите только самый нижний 20 мл (красная стрелка, рис. 1C), тщательно аспирационных супернатанта, используя отсос.
- Вымойте оставшиеся 20 мл, добавив 20 мл холодного ПБС. Спиновые образца на 600 x g 10 мин при 4 ° C. Ресуспензируйте гранулы в 10 мл холодного ПБС (при 4 ° C). Убедитесь, что есть нет сгустки, так что следующие lysis хитов все клетки сразу.
- Ресуспензированы гранулы передать новый флакон 250 мл. Добавьте 100 мл буфера lysis, дополнена 5000 единиц DNase клеток. Важно добавить буфера lysis клетки и не другой путь вокруг. Инкубировать смеси за 1 час при температуре 4 ° C и тщательно смешать его, переворачивать бутылку каждые 15 мин без формирования любые пузыри.
- Центрифуга лизированных клетках на 600 x g 10 мин при 4 ° C в 50 мл Конические трубки для удаления любой ячейки мусор. Если lysis была выполнена правильно, Пелле клетки должны быть белого цвета (рис. 1D). Собирать супернатант с пипеткой и загрузить его на трубу раунд снизу 30 мл, содержащие 60% сахарозы подушке, на льду. Затем спина трубки на 10000 x г за 30 мин при 4 ° C.
Примечание: Несколько тур нижней трубы (Таблица материалов) могут быть необходимы, в зависимости от объема супернатант. - Аспирационная супернатанта до 1 мл выше сахарозы подушки. Обратите внимание, желтый интерфейс между 1 мл оставшихся супернатант и 2 мл сахарозы подушки. Осторожно смешайте с вырезать кончик P1000 сахарозы и оставшиеся супернатант. Сделать не вихря на данном этапе; в противном случае procentrioles на данном этапе могут быть потеряны. Объединить все сахарозы подушки и хранить их на льду.
- Подготовьте градиент 40% - 70% сахарозы в тонкостенных 38,5 мл полипропиленовые трубы, осторожно добавив 3 мл 70%-ая сахароза (при 4 ° C), следуют 3 мл 50% и наконец, 3 мл 40% сахарозы. Загрузить объединенные интерфейсы на 40% - 70% сахарозы градиента; делаете это медленно, потому что холодный сахароза очень вязкой. Баланс трубки с 10 мм K-трубы буфере (рН 7,2) и центрифуги их на 68,320 x g (например, с SW32Ti ротором) за 1 ч 15 мин при 4 ° C.
- Соберите 12 x 500 мкл фракций на 4 ° C, сделав отверстие в нижней части трубки с иглой 0,8 мм не нарушая слои различных сахарозы. С сократить кончиком пипетки P200 Подготовьте дополнительные 10 мкл аликвоты от каждой фракции, которая будет использоваться для следующих иммунофлюоресценции. Фракций оснастки замораживание в жидком азоте.
Примечание: Изолированные centrioles могут быть проанализированы по электронной микроскопии для сохранения общего Ультраструктура centrioles.
3. Количественная оценка изолированных Centrioles на Coverslips: центрифугирования и иммунофлуоресценции
Примечание: Смотрите Рисунок 2.
-
Подготовка трубы и coverslips
- Используйте 1 раунд дно стеклянной трубки (15 мл) за дроби для анализа centriolar фракции (12 труб в общей сложности).
- Поместите пользовательские coverslip поддержка адаптер (далее называемый адаптер) в раунд снизу трубку. Место coverslip стерильный 12 мм в трубу раунд снизу.
Примечание: Здесь мы использовали coverslips 12 мм, но протокол может быть адаптирована для 18 мм coverslips с помощью 30 мл раунд нижней трубы. - Добавьте 5 мл, предварительно охлажденный 10 мм K-трубы (рН 7,2) при 4 ° C. Убедитесь, что coverslip не является плавающей и остается вниз на адаптер. Место труб на льду.
-
Центрифугирование centrioles
- Разбавляют каждую 10 мкл долю с 100 мкл холодной 10 мм K-трубы (pH 7.2). Ресуспензируйте разрежения хорошо до полного исчезновения сахарозы (рисA). Загрузите каждый разреженных фракция в раунд снизу трубку.
- Спиновые трубки на 10000 x g 10 мин (например, с ротором размахивая ведро JS-13.1) при 4 ° C.
- Восстановить coverslip, вставив ручной подключили устройство в отверстие в прорези края адаптера и осторожно приподнимите его.
Примечание: Ручной подключили устройство могут быть сделаны с иглой шприца вручную зацепили и формованных на домашнее палку (цифры 2B-2D). - После достижения верхней части трубки раунд дно, ловушка края адаптера с пальца в перчатке и удалить coverslip с помощью пинцета. Будьте внимательны и помните, какая сторона coverslip содержит centrioles. Перейти к лечения coverslips иммунофлюоресценции.
-
Иммунофлюоресценции окраски и обработки изображений из изолированных C. reinhardtii centrioles
Примечание: Смотрите Рисунок 2.- Подготовьте материалы для пятнать следующим иммунофлюоресценции.
- Подготовьте шкаф Стекло покровное окрашивание в коробке лаборатории полистирола передачи кристалл (60 мм в длину на 50 мм в ширину, Высота 43 мм). Заполните его с 100% метанола и хранить его при-20 ° C.
- Подготовьте влажной камере. Для этого, собрать влажной камере, поместив увлажняется водой ткани наряду с внутренней края квадрата Петри (2 рисунокE). Добавить кусочек лаборатории, герметизация обертывание (см. Таблицу материалы) до середины Петри блюдо, на котором будут размещены антитела смеси во время процедуры иммунофлюоресценции (шаги 3.3.2–3.3.3). Обложка, крышку и влажной камере с алюминиевой фольгой, чтобы защитить его от света.
- Имунноконтраст изолированные centrioles как следует.
- Исправить coverslips с centrioles непосредственно после центрифугирования (шаг 3.2.4) по инкубации их на 5 минут в поле заполнены с-20 ° C метанола (шаг 3.3.1.1).
- Удалите coverslips с помощью пинцета и место их в коробку лабораторные прозрачные (см. Таблицу материалы) заполнены с 50 мл ПБС и мыть их в течение 5 мин при комнатной температуре.
- Пипетка 60 мкл основное антитело смеси [первичных антител, разводят в 1% бычьим сывороточным альбумином (БСА) и 0,05% Tween-20 в PBS] на части, лаборатории, герметизация забинтовать влажной камере. Тщательно заложить coverslips поверх смесь антител с centrioles, прямо напротив падение. Инкубируйте coverslips 45 мин с первичных антител.
Примечание: Первичного антитела, которые были использованы для создания представительных результатов являются кролика polyclonal Bld12 (1: 300) и мышь α-тубулина (DM1A) (1: 300). - Удаление coverslips и мыть их в течение 5 мин в однократном ПБС, как описано в шаге 3.3.2.2. Инкубировать coverslips 45 мин с вторичные антитела в PBS, содержащей 1% BSA и 0,05% Tween-20.
Примечание: Вторичные антитела, которые были использованы для создания представительных результатов являются коза анти мыши в сочетании с Alexa 488 (1:1, 000) и коз анти кролика, в сочетании с Alexa 568 (1:1, 000). - Удаление coverslips и мыть их в течение 5 мин в однократном ПБС, как описано в шаге 3.3.2.2.
- Установите coverslips на стеклянное скольжение, добавив 3 мкл монтажа средних на слайде и тщательно размещение coverslips на вершине (centrioles сталкивается средний монтажа). Уплотнить coverslip с ногтей.
- Изображение изолированных centrioles на конфокального микроскопа: 63 X нефти цель с н.а. 1.4 при применении деконволюция27 (см. Таблицу материалы).
Примечание: Здесь, использовались следующие параметры: 500 – 545 Нм для Alexa 488 и 580 – 635 нм для Alexa 568.
- Подготовьте материалы для пятнать следующим иммунофлюоресценции.
4. концентрация Centrioles на центр Coverslips
Примечание: Смотрите Рисунок 3.
-
Подготовка материала
- Подготовка 15 мл стеклянной трубки круглым дном на льду, пользовательские coverslip поддержка адаптер (так называемый адаптер далее, файл .stl предоставляется как дополнительный файл 1), пользовательские концентратор (файл .stl как дополнительный файл 2) и 10 мм K-трубы (пэ-аша 7.2) при 4 ° C.
- Подготовить поли D-Лизин (PDL)-с покрытием coverslips. Разбавленной 10 x 1 мг/мл PDL Стоковый раствор с H2O. Во-первых мыть coverslips с 70% EtOH, удалить этанола и пусть coverslips сухой. Пальто coverslips с PDL и Инкубируйте 30 мин при комнатной температуре. Мыть coverslips 3 x с водой и дайте им высохнуть.
Примечание: Пальто coverslips с PDL увеличить число изолированных centrioles прикреплены к coverslips.
-
Центрифугирование
- Место стерильным 12 мм coverslip на встраиваемые, снизу конец концентратор, сохраняя PDL пальто лицевой стороной вниз. Крышка coverslip, поставив адаптер непосредственно на вершине. Инвертировать раунд дно трубки и поместите его на концентратор, coverslip и адаптер.
- Аккуратно нажмите ансамбль с помощью пинцета, пока достигнет нижней части трубки раунд снизу и инвертировать трубки. Добавьте 10 мм K-трубы буфере (рН 7,2) в раунд снизу трубку до тех пор, пока он доходит до верхней части концентратор. Убедитесь, что не оставаться любые пузыри в центрального цилиндра концентратора.
- Аккуратно добавить 100 мкл буфера 10 мм K-трубы (рН 7,2) один Алиготе, содержащие обогащенного Центриоль дроби и тщательно перемешайте тома.
- Удаление 100 мкл буфера K-трубы 10 мм (рН 7,2) из центра полые концентратор и 100 мкл обогащенный centriolar фракции в 10 мм K-трубы буфере (рН 7,2) в Полый центр концентратор, заботясь, что содержание по-прежнему в центре полого.
- Центрифуга на 10000 x g 10 мин (например, с ротором размахивая ведро JS-13.1) в центрифугу предварительно охлажденным при 4 ° C.
- С помощью пинцета удалите концентратор.
- Восстановить coverslip, вставив ручной подключили устройство в отверстие в прорези края адаптера и осторожно приподнимите его. После достижения верхней части трубки раунд дно, ловушка края адаптера с пальца в перчатке и удалить coverslip с помощью пинцета. Будьте внимательны и помните, какая сторона coverslip содержат centrioles. Перейти к лечения coverslips иммунофлюоресценции.
Примечание: Ручной подключили устройство могут быть сделаны с иглой шприца вручную зацепили и формованных на домашнее палку (Цифры 2B-D). - Выполнение фиксации и иммунофлюоресценции окрашивание концентрированных centrioles как это сделано в шаге 3.3.2–3.3.4.
5. single частиц в среднем
Примечание: Смотрите Рисунок 4.
- Изображений для усреднения сингл частицы
- Установите coverslip на слайде с помощью регулярных анти выцветанию монтажа средних. Выполнять структурированного освещения микроскопии (2D SIM) изображений с помощью CFI Апохромат TIRF цель (100 X, NA 1,49, WD 0,12 мм) и задней подсветкой EM CCD камеры.
Примечание: Приобретение время было равным 100 мс на камеру читать из 3 МГц. 2,5 X объектив был использован для SIM воображения.
Примечание: Набор данных, представленные здесь была приобретена на 3-D SIM микроскопа (см. Таблицу материалы). - Изображение centrioles, приобретая большой стек изображений, включая общее Центриоль сигнала, установив вверх верхней и нижней позиции Z-стека выше и ниже Центриоль сигнал, соответственно. Перейти к проекту стека и выполнять сингл частиц в среднем согласно шаги 5.2 и 5.3.
- Установите coverslip на слайде с помощью регулярных анти выцветанию монтажа средних. Выполнять структурированного освещения микроскопии (2D SIM) изображений с помощью CFI Апохромат TIRF цель (100 X, NA 1,49, WD 0,12 мм) и задней подсветкой EM CCD камеры.
- Проекция стека
- Откройте стек изображений с ImageJ. Затем нажмите на '→ стеки изображений → Z проекта'. Задать тип проекции какМакс интенсивности'.
- Инвертировать изображение, нажав на 'Правка → инвертировать'. Сохранить проекцию, которая создается (в формате .tif).
- Одноместный частица выравнивание с Scipion
- Создайте новый проект в Scipion, нажав красный 'Создание проекта' кнопку в верхней части страницы. На левой панели, дважды щелкните на 'Импорт → импорт микроскопии'.
- Заполните 'Каталог файлов' и 'шаблон ' поля согласно каталога данных и имена. Сохраните параметры по умолчанию. Нажмите на «Выполнить».
- Дважды щелкните на «Частицы → подбор → xmipp3 - ручной сбор (шаг 1)». Нажмите на значок увеличительного стекла рядом поле «Ввода микроскопии» и выберите импортированные микроскопии шаг 5.3.1. Нажмите на «Выполнить».
- В открывшемся окне выберите частиц из различных микроскопии, нажав на них. Когда закончите с каждый Микрофотография, нажмите на красную кнопку «+ координирует».
- Дважды щелкните на «Частицы → экстракт → xmipp3 - экстракт частиц». Нажмите на значок увеличительного стекла рядом поле «Ввода координат» и выберите взял координаты из шага 5.3.4. Заполните «Поле Размер частиц (px)» по размерам частиц. В закладке «Preprocess» задать удаление пыли: нет (она может создавать артефакты); Инвертировать контраст: нет (черные частицы, белый фон); Листать фазы: No (связано с CTF коррекции); Нормализовать: Да.
- Затем нажмите кнопку «Выполнить». Когда работа сделана, проверьте извлечения частиц, выбрав поле задания (границы становятся толще) и нажмите на кнопку «анализировать результаты (слева внизу главного меню).
- Дважды щелкните на «2D → выравнивание → xmipp3 - привести в соответствие с cl2d». Нажмите на значок увеличительного стекла рядом поле «Ввода частицы» и выберите извлеченный частиц из шага 5.3.5. Не следует использовать эталонный образ. Нажмите на «Выполнить».
- Дважды щелкните на ' 2D → выравнивание → более → xmipp3 - применить выравнивание 2d'. Нажмите на значок увеличительного стекла рядом поле «Ввода частицы» и выберите соответствие частиц из шага 5.3.7.
- Нажмите на «Выполнить» как шаг 5.3.6. Результаты можно проверить, нажав на «Анализ результатов» после выбора окна заданий.
- Дважды щелкните на «Частицы → маска → xmipp3 - применить 2d маску».
- Нажмите на значок увеличительного стекла рядом поле «Ввода частицы» и выберите соответствие частиц из шага 5.3.9. «Маска исходного» имеет значение «Геометрии». Затем, установите параметры маски как тип маски: циркулярный; Радиус (px): ищет одна частица (Центриоль) без ничего вокруг него, нажмите на 'волшебной палочкой ' значок на левой стороне, которая открывает окно, чтобы помочь найти идеальное значение; Shift-центр: Нет (если частица прекрасно центрируется) или Да (если частицы смещается); Смещение X-центр: согласно позиции частицы; Смещение Y-центр: согласно позиции частицы. Нажмите на «Выполнить».
- Используйте кнопку «анализировать результаты» для проверки, если маска применяется правильно. Если нет, щелкните правой кнопкой мыши на работу «Применить маску 2d» и выберите «Изменить». Измените параметры маски (размер и/или смены) и запустить его снова с «Выполнить» кнопку.
- Дважды щелкните на «2D → классифицировать → xmipp3 - cl2d».
- Нажмите на значок увеличительного стекла рядом поле «Ввода частицы» и выберите масках частиц из шага 5.3.11. Количество классов следует получить около 50 частиц в классе. Нажмите на «Выполнить».
- Проверьте результаты, нажав на кнопку «анализировать результаты» . В открывшемся окне нажмите на значок «глаз» рядом с «Что показать».
- Новое окно позволяет осмотр созданных классов, выбрав «Classes2D» в меню «Блок» . Проверьте содержание каждого класса в том же меню, выбрав «Class00N_Particles» . Осмотрите каждый класс, чтобы определить, какие из них содержат только плохие частиц. Вернитесь в представление «Classes2D» и выберите классы с хорошим частиц, нажав на каждом. Можно выбрать несколько классов, удерживая клавишу «Ctrl» во время выбора.
- Когда все классы с хорошей частицы были выбраны, нажмите на «+ частицы» для создания подмножества с этими частицами.
- В том же окне выберите несколько наборы классов, которые представляют различные ориентации частиц. Создайте новый набор, нажав на «+ средние».
- Для каждой ориентации/средний выбран выполните следующее.
- Дважды щелкните на «2D → выравнивание → xmipp3 - привести в соответствие с cl2d».
- Нажмите на значок увеличительного стекла рядом поле «Ввода частицы» и выбрать хорошее частиц из шага 5.3.17. Набор «Использование эталонного образа» для «Да». Нажмите на значок увеличительного стекла рядом поле «Исходный образ» и нажмите на белой стрелкой слева, чтобы «Создать подмножество» работа с шагом 5.3.18 и выберите изображение, чтобы использовать его как ссылку. Дважды щелкните объект, чтобы открыть его в отдельном окне и проверить это объект. Нажмите на «Выполнить».
- Дважды щелкните на ' 2D → выравнивание → более → xmipp3 - применить выравнивание 2d'. Нажмите на значок увеличительного стекла рядом поле «Ввода частицы» и выберите соответствие частиц из шага 5.3.19.2.
- Нажмите на «Выполнить».
- Проверить результат выравнивание ('Анализировать результаты); Он покажет соответствие частиц и среднее значение этих частиц.
- Если средний хороший и частицы ориентированы таким же образом, сохранить средний, нажав на ' Advanced → ImageJ' и сохранить изображение с ImageJ.
- Если среднее может быть улучшена, выберите все изображения, четко ориентированных и создайте новый набор с кнопкой «+ частицы» . Повторяем шаги 5.3.19.1–5.3.19.4 до тех пор, пока подмножество очищается (все плохие частицы удаляются). Каждый раз, когда выравнивание выполнено (шаг 5.3.19.2), устанавливается ссылка на последний сгенерированный средний (от итерации итерации, увеличивает среднее качество).
Результаты
C. reinhardtii Центриоль изоляции:
Чтобы изолировать centrioles, cw15- C. показало клетки были выросли в жидком культуре на несколько дней под светом и впоследствии гранулированных центрифугированием при 600 x g за 10 мин гранулированная клетки были смыты 1 x с PBS и ресуспензированы в deflagellation буфера перед deflagellation, выполняя рН шок, с использованием уксусной кислоты 0,5 М до окончательного pH 4,5-4,7 за 2 мин(рис. 1). Дополнение N 1 Кох был использован для восстановления pH 7.0. Чтобы отделить отдельностоящий жгутиков от клеток тела, deflagellated клетки были впервые центрифугировали удалить основную часть жгутиков. Пелле была затем промывают 2 x с PBS и высокомобильна в 30 мл PBS до погрузки медленно на 25%-сахароза подушке (рис. 1Б). Трубка была вращаться на 600 x g 15 мин при 4 ° C, чтобы удалить большую часть отдельностоящий жгутиков. После центрифугирования, клеток органов были распространены в подушке сахарозы (рис. 1C) и восстановлены путем удаления примерно 30 мл супернатант (до красной стрелкой на рис. 1C). Результате 20 мл отмытых клеток были затем высокомобильна в 20 мл холодного PBS и центрифугируют в 600 x g за 10 мин. Далее супернатанта была отвергнута, и клетки были полностью высокомобильна в 10 мл ФСБ. Клетки были переданы бутылка 250 мл и буфера lysis был добавлен к ресуспензированы клеткам одновременно. DNase была добавлена lysis и инкубировали в течение 1 ч при 4 ° C. После центрифугирования шаг для удаления мусора клеток (см. белые гранулы на рис. 1D), супернатанта собрана и тщательно погружены на 2 мл 60% сахарозы подушку перед центрифугированием на 10000 x г за 30 мин при 4 ° C. Обратите внимание, что на 100 мл лизис, 8 трубы 15 мл были использованы для выполнения этого шага, соответствующий 12,5 мл буфера lysis, загружены на 2 мл сахарозы в трубку. После центрифугирования, большая часть супернатант была удалена до 1 мл над подушкой. 1 мл оставшихся супернатант затем собранные с подушкой 2 мл и затем смешанные и объединить для получения окончательного объема 24 мл. Бассейн был затем загружены на 40%, 50%, 70%-сахароза градиента и закрученная на 68,320 x g 1 час и 15 минут при 4 ° C. Наконец изолированные centrioles были собраны, сделав отверстие в нижней части трубки центрифугирования, с помощью иглы и капли были собраны в 12 x 500 мкл дробей. Благодаря высокой плотности различных сахарозы, падение сформировали очень медленно в начале (70% сахарозы), а затем более быстро (40% сахарозы).
Иммунофлюоресценции изолированных Centrioles
Чтобы оценить качество процедуры изоляции, 10 мкл каждого собранного градиента фракции был затем центрифугировали на coverslip с помощью coverslip поддержка адаптера (рис. 2A-2D). Важно, чтобы безопасно удалить coverslip, был разработан пользовательский подключили устройство (рис. 2B). Далее coverslips были проанализированы иммунофлюоресценции. Антитела против CrSAS-6(Bld12p) были использованы в данном исследовании для указания наличия колесом структуры и α-тубулина (DMA1), чтобы выделить centriolar стены. Подсчитывать количество centrioles, которые были положительными для CrSAS-6 и α-тубулина в поле зрения и затем вычисляя общее количество centrioles на фракции, было невозможно определить, какой фракции были обогащенные для изолированных centrioles ( Рисунок 2F-2 Ч). Интересно, что 6 фракций обогатились для centrioles (Рисунок 2F и 2 G, фракций #1 – 6), с пиком часть #3, в то время как последний фракций не были, указав, что очистка работал. Обратите внимание, что в этой конкретной эксперимент, 95% всего centrioles были положительными для CrSAS-6 и α-тубулина в фракции #3. Это означает, что наиболее изолированных centrioles сохранить их колесом. Если никакого обогащения centrioles наблюдается в первой фракции, процедура изоляции не работать и должен быть повторен. Обратите внимание, что некоторые flagellar штук может наблюдаться главным образом в долях лишена centrioles.
Далее рассчитать общее количество centrioles за мкл, количество Центриоль в поле зрения следует быть умножена на коэффициент, представленные на рисунке 2H. Затем полученное число следует разделить на объем фракция используется для иммунофлюоресценции для получения количества centrioles за мкл. В этой процедуре конкретной изоляции наиболее обогащенного фракция содержится около 37 centrioles в области 0.00846 мм2 (с поля зрения 92 x 92 мкм2). Поверхность трубчатой секции была 7,5 мм в радиусе, с общей площадью 176 мм2. Соответствующий коэффициент был затем 176/0.00846 = 20,803.8, так что в общей сложности 769,740 centrioles (37 x 20, 803.8) в 10 мкл. Таким образом количество centrioles в 1 мкл был 76,974.
Концентрация изолированных Centrioles на Coverslips:
Увеличение числа centrioles в поле увеличивает вероятность обнаружения однозначно Центриоль ориентации, а также увеличивая вероятность обнаружения аналогичные ориентиры, которые могут быть использованы для дальнейших процедур усреднения частиц. Как centrioles от концентрации фракций по-прежнему скудны на coverslip, мы разработали центрифугирования аксессуар сосредоточиться centrioles в центре coverslip (рисA) именем концентратор. Обратите внимание, что файл .stl с помощью конкретных мер для 3-D печати предоставляется с этой рукописи.
Во-первых одна coverslip 12 мм был установлен на концентратор (рис. 3B). Адаптер был помещен на вершине coverslip и раунд нижняя труба была перевернутый и помещен над собрал адаптер и концентратор. Раунд нижняя труба была затем аккуратно перевернутый, таким образом позволяя загрузке образца (шаг 4.2протокол ). Centrioles были затем центрифугировали при 10000 x g 10 мин при 4 ° C. После этого centrioles были подвергнуты иммунофлюоресценции и витражи для CrSAS-6/Bld12p и α-тубулина (рис. 3 c-3E). Главное без концентратора, около 30 centrioles были замечены в поле зрения (рис. 3C), тогда как 183 centrioles были замечены в поле зрения, когда концентратор используется (рис. 3D-3F). Обратите внимание, что centrioles охватывает только диск 4 мм в диаметре в середине coverslip. Этот результат демонстрирует, что концентрация шаг работает и позволяет кратные обогащения centrioles в определенную область coverslips, таким образом ослабление их обнаружения и обработки изображений.
Флуоресцентный сингл частица усреднения изолированных C. reinhardtii Centrioles:
Здесь, с помощью микроскопии SIM, которая может достигать с разрешением около 120 Нм, centrioles, витражи для monoglutamylated тубулин (GT335, рис. 4), модификация тубулина в centriolar микротрубочки, были образа24. C. reinhardtii centrioles являются около 500 нм длиной, всегда в паре и часто нашли с связанные, недавно дублирует probasal органов (упоминаемый как procentrioles ниже) и поперечно-полосатой связанные микротрубочек волокна19. Таким образом эта окончательная сборка была около 1 мкм большой. По этой причине и для того, чтобы изображение centrioles во всей их полноте мы рекомендуем приобретать Z-укладывают на изолированные centrioles.
Здесь после приобретения, окончательный образ был создан, выполняя проекция максимальной интенсивности с использованием ImageJ28 (изображение/стеки/Z проекта/Макс интенсивности проекции, Рисунок 4B). От таких изображений анализ одного частиц с помощью программного обеспечения крио электронная микроскопия была выполнена классов centrioles с аналогичными ориентации, а затем в среднем была выполнена. Чтобы сделать это, цвет изображения был сначала перевернуть для лучше визуализировать объекты (рис. 4C). Centrioles были собраны вручную в коробке по центру над каждой частицы, используя свободно доступных Scipion программного обеспечения29 , которая объединяет несколько программ программного обеспечения электронной микроскопии, таких как Xmipp3 (рис. 4D). Обратите внимание, что размер окна должен быть определен пользователем. Здесь, коробки 50 x 50 пикселей для пикселя размером 31.84 Нм были использованы. Далее все частицы были извлечены (Рисунок 4E) и соответствие с помощью Xmipp3 (рис. 4F). Далее круговой маска 12 пикселов в радиусе был применен к изоляции каждого Центриоль от centriolar пары (Рисунок 4G). Затем были классифицированы частицы, используя Xmipp3, для создания нескольких средние. Только держали однородных класса средние, означает, что частицы, которые расходятся от класса средние вручную были исключены. Этот шаг был повторен для того, чтобы генерировать в среднем почти идеальный для каждой выбранной ориентации. После пяти итераций, были созданы два класса средних: вид сверху из 63 объектов (рис. 4H) и боковой вид из 98 частиц (рис. 4я) monoglutamylated centrioles. Размеры объекта были определены путем измерять расстояние между пиками интенсивности участок профиля вдоль monoglutamylation сигнал.
Важно отметить, что средний класс сбоку составляет 260 Нм с диаметром 250 Нм, сопоставимые с измеренной monoglutamylated тубулин сигнал, который был показан для локализации для региона 286 Нм ± 33 в длину в пределах ядро Центриоль17.
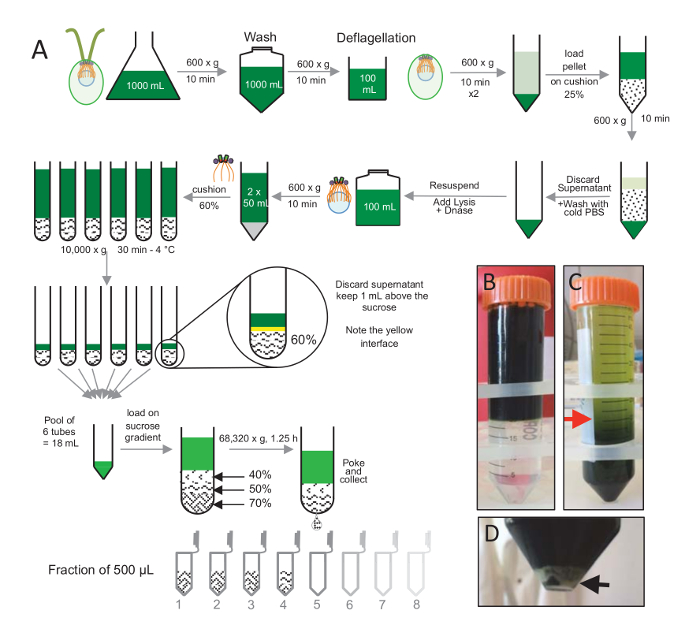
Рисунок 1 : Очистка C. reinhardtii centrioles. (A) это схематическое представление каждого шага, ведущего к изоляции C. reinhardtii centrioles. Она включает в себя представителем шаги (C) и (B) протокола до после центрифугирования на 25%-сахароза градиента. Красная стрелка в группе C указывает минимальный объем держать после центрифугирования. (D) Эта группа показывает белые гранулы лизированных клетках после центрифугирования. Черная стрелка указывает гранулы. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
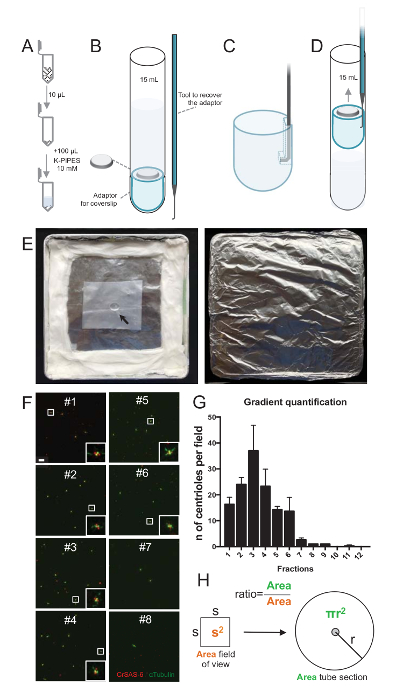
Рисунок 2 : Центрифугирования настройки для выполнения иммунофлюоресценции на изолированные centrioles. (A) 10 мкл каждого собираемой фракции сначала разводят в 100 мкл 10 мм K-трубы (pH 7.2). (B) это схематическое представление устройств центрифугирования, охватывающей 15 мл круглым дном, coverslip 12 мм, переходник для coverslip, и по индивидуальному заказу подключили устройство для восстановления coverslip после центрифугирования. Панели, C и D показывают рисунки, объясняя, как восстановить coverslip после центрифугирования. Осторожно потяните место подключили инструмент в отверстие в прорези края адаптер (C) и (D). (E) это фотографии Влажный палаты, необходимых для выполнения иммунофлюоресценции изображений. Стрелка показывает coverslip 12 мм. (F) эти представитель конфокальный изображения на 63 X (масштаб 2) градиента фракций #1-8, собранные во время процедуры очистки и витражи для CrSAS-6 (красный) и α-тубулина (зеленый). Вставок соответствуют региона указали на белом поле в нижнем увеличение просмотров. Шкалы бар = 10 мкм. (G) это граф, представляющих количество положительных centrioles для CrSAS-6 и α-тубулина в поле зрения в каждой фракции. Обратите внимание, обогащения фракций #1-6. Среднее количество centrioles в каждом поле в каждой фракции: #1 = ± 16.3 4.7, #2 = 24.0 ± 4.6, #3 = 37,0 ± 17.0, #4 = 23.3 ± 11.4, #5 = 14,3 ± 2,1, #6 = 13,7 ± 9.3, #7 = 2,7 ± 1,2, #8 = 1,0 ± 0.0, #9 = 1,0 ± 0.0, #10 = ± 0.0 0.0, #11 = 0,3 ± 0,6, #12 = 0.0 ± 0.0. Для каждой фракции были образы 3 случайных полей. Обратите внимание, что при подсчете наиболее обогащенного фракция #3, мы обнаружили, что 95% centrioles являются позитивными для CrSAS-6 и α-тубулина (n = 205 centrioles). (H) A соотношение числа centrioles в районе измеренной микроскопии используется для вычисления общего числа centrioles в районе трубки. Центриоль номер за мкл может быть рассчитана из 10 мкл первоначально центрифугировали фракций. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
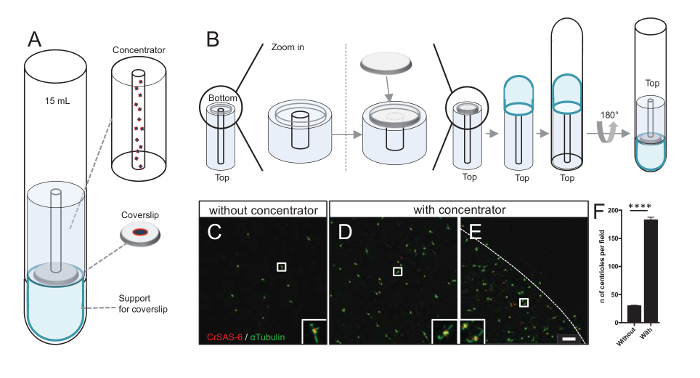
Рисунок 3 : Изолированные centrioles центрифугировали использования концентраторов. (A) Эта группа показывает центрифугирования устройства необходимо сосредоточиться centrioles на coverslips до иммунофлюоресценции, включая 15 мл круглым дном, концентратор, coverslip 12 мм и поддержка адаптер аппарата. (B) Эта группа показывает шаги, чтобы собрать центрифугированием устройство. Панелей C-E Показать конфокальный образы centrioles, витражи для CrSAS-6 (красный) и α-тубулина (зеленый) (C) без или (D-E) с концентратор. Вставок соответствуют региона указали на белом поле в нижнем увеличение просмотров. Линейки шкалы — 10 мкм. Обратите внимание, что centrioles обогащаются в середине coverslip (пунктирная линия представляет границы области концентрированный). (F) этот граф представляет число centrioles в поле зрения без и с концентратор. Были проанализированы пять случайных полей зрения. Среднее количество centrioles является, без концентратора, 29,8 ± 2.9 и с концентратор, 182.6 ± 11,5, P < 0,0001. Статистическая значимость был оценен непарных t-теста. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
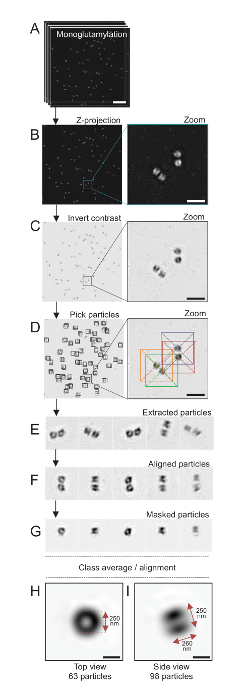
Рисунок 4 : Single частиц в среднем на изолированные C. reinhardtii centrioles. (A) Эта группа показывает Z стека образы centrioles окрашивали GT335 и приобрели с помощью микроскопа SIM. (B) эти панели показывают максимальную интенсивность Z проекция сложены изображения. Шкалы бар = 1 мкм. (C) эти панели показывают представитель изображение с Перевернутый контраст. Врезные представляет зум-визуализировать лучше centrioles. (D) эти частицы шоу панели выбора. Врезные указывает, как частицы были собраны. (E) это примеры 5 извлечения частиц. (F) Эта группа показывает частицы после выравнивания. (G) Эта группа показывает частицы после применения маски. Панелей H и я показать две средние класса: (H) сверху вид (63 частицы) и (я) сбоку (98 частицы). Двойные стрелки указывают размеры GT335 сигнала. Шкалы бар = 250 Нм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Дополнительный файл 1. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Одна из проблем в области биологии является расшифровать точной локализации белков в контексте архитектуры. Центриоль является идеальной структурой применять эти методы, как его архитектура была изучена с помощью томографии крио электрон, раскрывая интересные ультраструктурные особенности вдоль его длины. Однако из-за его размеры близко к пределу резолюции в оптической микроскопии, трудно точно локализовать белок, иммунофлюоресценции для структурной субрегиона Центриоль, с использованием обычных Микроскопы30.
В резолюции в оптической микроскопии ограничены дифракцией света, который дает, грубо говоря, боковые максимальное разрешение 200 Нм в оптической микроскопии24. Однако, этот предел был одним из основных достижений за последние 20 лет проходили в оптической микроскопии: изобретение суперразрешением методов. Эти подходы можно изображения за пределами дифракции в разных разрешениях: 120 Нм для SIM, около 50 Нм для истощения простимулированное излучение (интереса) и 20-40 Нм для локализации одной молекулы микроскопии (SMLM)24. С этими новыми событиями суперразрешением микроскопии структурные субрегионах Центриоль достижимы. Однако на практике, это все еще трудно точно определить локализация протеина структурного элемента для основная причина что пожилые centrioles существуют только 2 копий на ячейки и имеют случайные ориентации, который делает толкование Локализация трудно. По этой причине протокол был создан, позволяет исследователям изображения супер резолюции большое количество centrioles, увеличивая шанс наблюдать не двусмысленным ориентации. Важно то, как этот метод полагается на использование изолированных centrioles, мы предоставляем способ очистить нетронутыми C. reinhardtii centrioles, которые содержат Зрелые centrioles и procentrioles.
Наконец ввиду ряда Центриоль ориентиры, которые могут быть образы с настоящим Протоколом, анализ сингл частиц может применяться в том с помощью электронной микроскопии программного обеспечения. Это приводит к формированию среднего класса centrioles в определенной ориентации. Важно отметить, что эти полученные изображения 2-D затем может использоваться для оценки локализации определенного белка вдоль Центриоль. Действительно этот метод может быть применен к двойной цвет супер-разрешение изображения, и один цвет может использоваться для раскрыть Центриоль скелета (например, тубулин), а другой цвет можно отнести к конкретным centriolar белка. Вычитая средние значения, полученные с одного или двух цветов, она становится легче зарегистрировать белок вдоль Центриоль (проксимальной, Центральный или дистальной части). Обратите внимание, что два канала должны быть точно согласованы для предотвращения каких-либо заблуждение интерпретаций. Кроме того средние Топ просмотров поможет расшифровать Если белок локализует внутри centriolar люмен, вдоль стены микротрубочек, или за пределами Центриоль.
Этот метод имеет преимущество для определения локализации специфических белков, которые могут быть трудно локализовать иначе из-за разнородных маркировки. Обратите внимание, что другие методы для сопоставления белков внутри centrioles были описаны в коррелятивных 3-D SIM/SMLM с, например, оценки конкретных направлений centrioles, определяя эллиптической профиль маркера, образуя Тор вокруг Центриоль у Вообразимый SIM. С помощью этого параметра, возможна локализация протеина с точностью до 4-5 Нм30. Обратите внимание, что метод, описанный здесь использует изолированное centrioles с нетронутыми procentrioles, знак того, что архитектура Центриоль скорее во многом сохраняется. Однако мы не можем исключать которые некоторые архитектурные особенности нарушается во время очистки, такие как диаметр Центриоль различной концентрации катионов двухвалентной как усиленный с изоляцией человека Центросома5.
Одним из важнейших шагов протокола, представленные здесь является получение достаточно концентрированной изолированных centrioles в различных ориентациях поддаются Fluo-спа. Чтобы сделать это, сначала обеспечить чистоту и эффективность процедуры изоляции Центриоль. Низкая концентрация изолированных centrioles будет препятствовать правильной визуализации и дальнейшей обработки изображений. Для этой цели мы предоставляем способ обогатить число centrioles в поле зрения. В зависимости от количества centrioles в фракции используется следует скорректировать объем загруженной в концентратор, объемом 250 мкл.
Важно отметить, что этот метод был разработан для клеточной стенки минус cw15-C. reinhardtii клетки. В этот штамм хрупкость клеточной стенки позволяет для надлежащего лизис клеток и, таким образом, освобождение его содержание. Этот протокол не является эффективным для одичал тип C. reinhardtii клетки, как клеточной стенки предотвращает надлежащего lysis. Альтернативные стратегии, такие как sonication или предварительной инкубации клеток с autolysin, фермента, который может ухудшить клеточной стенки31, придется положить в место для изменения клеточной стенки до применения Протокол изоляции, представленные здесь.
Эта настройка может использоваться с различными типами Микроскопы, начиная от обычных конфокальные микроскопы для высокой пропускной способности посвятил суперразрешением микроскопы. Обратите внимание, что при выполнении SMLM, Специальный буфер не требуется для правильной обработки изображений, и, таким образом, следует использовать камеру, адаптированные для coverslip 12 мм с буфером поверх coverslip. Последующие изображения будет выполняться с Перевернутый микроскопы. Если Микроскоп настройки не позволяют coverslip 12 мм, протокол, представленные здесь может применяться к 18 мм coverslips с помощью 30 мл трубки раунд дно и изменение адаптер и концентратор. Важно также, обратите внимание, что качество окончательной реконструкции в SMLM будет зависеть качество окрашивания и первичного антитела, используемые, а также метод фиксации.
Таким образом мы обеспечиваем метод, который может быть применен к изображению, а затем многочисленные centrioles Fluo-спа, который будет генерировать средние centrioles в различных ориентациях, тем самым помогая локализовать centriolar белка с точностью. Важно отметить, что этот метод может применяться в более общем изолированных centrioles от других видов, другие органеллы или для больших сборок высокомолекулярных соединений. Наконец подход подготовки образцов представлены здесь, в сочетании с последние разработки алгоритмов для анализа сингл частиц флуоресцентный SMLM данных32, может открыть дальнейшие улучшения в молекулярных картографии большой высокомолекулярных соединений сборки.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарим Пьер Gönczy и BioImaging и оптики платформы (BIOP) École политехнической школе Лозанны (ФПШЛ), Лозанна, Швейцария, где были приобретены SIM изображения centrioles. Николай клёна и Давиде Gambarotto, поддерживаются начиная грант Совета европейских исследований (ERC) (ПТГ) 715289 (ACCENT) и Maeva Le Guennec, Пол Гишар и Virginie Hamel, швейцарского национального фонда науки (SNSF) PP00P3_157517. Susanne Borgers поддерживается Женевского университета.
Материалы
| Name | Company | Catalog Number | Comments |
| Mouse monoclonal anti-apha tubulin (clone DM1A) | Abcam | ab7291 | dilution 1:300 |
| DNaseI | Roche | 10104159001 | |
| 12 mm coverslips | Roth | YX03.1 | |
| 18 mm coverslips | Roth | LH23.1 | |
| K2HPO4 | Fluka | 60355 | |
| KH2PO4 | Fluka | 60230 | |
| Tris base | Biosolve Chimie SARL | 0020092391BS | |
| acetic acid | Carlo Erba Reagents | 524520 | |
| NH4Cl | Sigma | A-4514 | |
| CaCl2 | Sigma | C-7902 | |
| MgSO4 | Sigma | 63140-500G-F | |
| steritop filter | Millipore | SCGPT05RE | |
| sucrose | Sigma | S7903-1KG | |
| HEPES | AppliChem PanReac | A3724,0250 | |
| PIPES | Sigma | P6757-500G | |
| MgCl2 | ACROS ORGANICS | 197530010 | |
| NP-40 | AppliChem PanReac | A1694,0250 | |
| Round-bottom (Kimble) tubes 15 mL | Fisherscientific | 09-500-34 | |
| Round-bottom (Kimble) tubes 30 mL | Fisherscientific | 09-500-37 | |
| cover glass staining rack | Thomas scientific | 8542E40 | |
| crystal polystyrene transmission lab box | FISHERS | 11712944 | |
| Methanol | VWR | 20864.32 | |
| BSA | Roche | 10735086001 | |
| Triton X100 | Roth | 3051.3 | |
| goat anti-mouse coupled to Alexa 488 | invitrogen | A11029 | dilution 1:1,000 |
| goat anti-rabbit coupled to Alexa 568 | invitrogen | A11036 | dilution 1:1,000 |
| mounting medium | abcam | ab188804 | |
| Tube, thinwall polypropylene | Beckman Coulter | 326823 | |
| Poly-D-Lysine 1 mg/mL | SIGMA | A-003-E | |
| Mouse monoclonal anti-Polyglutamylation modification mAb (GT335) | Adipogen | AG-20B-0020 | dilution 1:1,000 |
| glycerol mounting medium with DAPI and DABCO | Abcam | ab188804 | |
| 50 mL conical tubes | Falcon | 14-432-22 | |
| Eppendorf 5810R centrifuge | Eppendorf | 5811000622 | |
| Beckman JS-13.1 swinging bucket rotor | Beckman Coulter | 346963 | |
| Beckman SW 32Ti rotor | Beckman Coulter | 369694 | |
| parafilm | Bemis | 13-374-10 | |
| Leica TCS SP8 with Hyvolution mode | Leica | ||
| OSRAM L18W/954 LUMILUX | Luxe Daylight/ OSRAM | ||
| Whatman filter paper | Sigma | WHA1001325 | |
| CrSAS-6/Bld12 antibody | dilution 1:300 (Hamel el al., 2014) | ||
| Scipion | http://scipion.i2pc.es/ | ||
| EM CCD camera (Andor iXON DU897) | Andor |
Ссылки
- Bornens, M. The centrosome in cells and organisms. Science. 335 (6067), 422-426 (2012).
- Nigg, E. A., Holland, A. J. Once and only once: mechanisms of centriole duplication and their deregulation in disease. Nature Reviews Molecular Cell Biology. 19 (5), 297-312 (2018).
- Nigg, E. A., Raff, J. W. Centrioles, centrosomes, and cilia in health and disease. Cell. 139 (4), 663-678 (2009).
- Gönczy, P. Towards a molecular architecture of centriole assembly. Nature Reviews Molecular Cell Biology. 13 (7), 425-435 (2012).
- Paintrand, M., Moudjou, M., Delacroix, H., Bornens, M. Centrosome organization and centriole architecture: their sensitivity to divalent cations. Journal of Structural Biology. 108 (2), 107-128 (1992).
- Winey, M., O'Toole, E. Centriole structure. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1650), (2014).
- Dippell, R. V. The development of basal bodies in paramecium. Proceedings of the National Academy of Sciences of the United States of America. 61 (2), 461 (1968).
- Allen, R. D. The morphogenesis of basal bodies and accessory structures of the cortex of the ciliated protozoan Tetrahymena pyriformis. The Journal of Cell Biology. 40 (3), 716-733 (1969).
- Li, S., Fernandez, J. -. J., Marshall, W. F., Agard, D. A. Three-dimensional structure of basal body triplet revealed by electron cryo-tomography. The EMBO Journal. 31 (3), 552-562 (2012).
- Guichard, P., Chrétien, D., Marco, S., Tassin, A. -. M. Procentriole assembly revealed by cryo-electron tomography. The EMBO Journal. 29 (9), 1565-1572 (2010).
- Guichard, P., et al. Native architecture of the centriole proximal region reveals features underlying its 9-fold radial symmetry. Current Biology. 23 (17), 1620-1628 (2013).
- Hirono, M. Cartwheel assembly. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1650), (2014).
- Bornens, M., Paintrand, M., Berges, J., Marty, M. C., Karsenti, E. Structural and chemical characterization of isolated centrosomes. Cell Motility and the Cytoskeleton. 8 (3), 238-249 (1987).
- Keller, L. C., Romijn, E. P., Zamora, I., Yates, J. R., Marshall, W. F. Proteomic analysis of isolated chlamydomonas centrioles reveals orthologs of ciliary-disease genes. Current Biology. 15 (12), 1090-1098 (2005).
- Kilburn, C. L., et al. New Tetrahymena basal body protein components identify basal body domain structure. The Journal of Cell Biology. 178 (6), 905-912 (2007).
- Bauer, M., Cubizolles, F., Schmidt, A., Nigg, E. A Quantitative analysis of human centrosome architecture by targeted proteomics and fluorescence imaging. The EMBO Journal. 35 (19), 1-15 (2016).
- Hamel, V., et al. Identification of Chlamydomonas Central Core Centriolar Proteins Reveals a Role for Human WDR90 in Ciliogenesis. Current Biology. 27 (16), 2486-2498 (2017).
- Cavalier-Smith, T. basal body and flagellar development during the vegetative cell cycle and the sexual cycle of Chlamydomonas reinhardii. Journal of Cell Science. 16 (3), 529 (1974).
- Geimer, S., Melkonian, M. The ultrastructure of the Chlamydomonas reinhardtii basal apparatus: identification of an early marker of radial asymmetry inherent in the basal body. Journal of Cell Science. 117, 2663-2674 (2004).
- Nakazawa, Y., Hiraki, M., Kamiya, R., Hirono, M. SAS-6 is a cartwheel protein that establishes the 9-fold symmetry of the centriole. Current Biology. 17 (24), 2169-2174 (2007).
- Hamel, V., et al. Correlative multicolor 3D SIM and STORM microscopy. Biomedical Optics Express. 5 (10), 3326 (2014).
- Guichard, P., et al. Cell-free reconstitution reveals centriole cartwheel assembly mechanisms. Nature Communications. 8, 14813 (2017).
- Hiraki, M., Nakazawa, Y., Kamiya, R., Hirono, M. Bld10p constitutes the cartwheel-spoke tip and stabilizes the 9-fold symmetry of the centriole. Current Biology. 17 (20), 1778-1783 (2007).
- Sahl, S. J., Hell, S. W., Jakobs, S. Fluorescence nanoscopy in cell biology. Nature Reviews Molecular Cell Biology. 18 (11), 685-701 (2017).
- Hutner, S. H., Provasoli, L., Schatz, A., Haskins, C. P. Some Approaches to the Study of the Role of Metals in the Metabolism of Microorganisms. Proceedings of the American Philosophical Society. 94 (2), 152-170 (1950).
- Keller, L. C., Marshall, W. F. Isolation and proteomic analysis of chlamydomonas centrioles. Methods in Molecular Biology. 432 (1), 289-300 (2008).
- Borlinghaus, R. T., Kappel, C. HyVolution-the smart path to confocal super-resolution. Nature Methods. 13 (3), (2016).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- de la Rosa-Trevín, J. M., et al. Scipion: A software framework toward integration, reproducibility and validation in 3D electron microscopy. Journal of Structural Biology. 195 (1), 93-99 (2016).
- Gartenmann, L., et al. A combined 3D-SIM/SMLM approach allows centriole proteins to be localized with a precision of ∼4-5 nm. Current Biology. 27 (19), 1054-1055 (2017).
- Jaenicke, L., Kuhne, W., Spessert, R., Wahle, U., Waffenschmidt, S. Cell-wall lytic enzymes (autolysins) of Chlamydomonas reinhardtii are (hydroxy)proline-specific proteases. European Journal of Biochemistry. 170 (1-2), 485-491 (1987).
- Salas, D., et al. Angular reconstitution-based 3D reconstructions of nanomolecular structures from superresolution light-microscopy images. Proceedings of the National Academy of Sciences of the United States of America. 114 (35), 9273-9278 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены