A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
קבלת סרטן גזע כדורים מגינקולוגית סרטן השד גידולים
* These authors contributed equally
In This Article
Summary
מטרת מתודולוגיה זו היא לזהות את תאי גזע הסרטן (csc) בקווי התאים של סרטן ודגימות הגידול האנושי הראשוני עם הפרוטוקול ליצירת כדור, בצורה איתנה, באמצעות בחני פונקציונלי ואפיון פנוטימית עם זרימה cy, try ומערבי מחוק.
Abstract
תאי גזע סרטניים (CSC) הם אוכלוסיה קטנה עם התחדשות עצמית ופלסטיות אשר אחראים tumorigenesis, עמידות לטיפול ומחלות חוזרות ונשנות. אוכלוסיה זו יכולה להיות מזוהה על ידי סמנים פני השטח, פעילות אנזימטית ופרופיל פונקציונלי. גישות אלה לכשעצמו מוגבלות, בשל הפלסטיות הטרוגניות ו-CSC. כאן, אנו לעדכן את פרוטוקול יוצרי הספירה כדי להשיג כדורים CSC מסרטן השד גינקולוגית, הערכת תכונות פונקציונלי, סמנים CSC וביטוי חלבון. התחומים מתקבלים עם שימוש בתאי יחיד בצפיפות נמוכה בתרבות ההשעיה, באמצעות מדיום חצי מוצק מתילצלולוזה כדי למנוע הגירה ואגרגטים. פרוטוקול זה רווחי ניתן להשתמש בקווי תאים סרטניים, אלא גם בגידולים ראשוניים. התרבות הטריממדי הלא חסיד ההשעיה חשב לחקות את מיקרוסביבה הגידול, במיוחד CSC-נישה, הוא שיושלם עם גורם גדילה באפידרמיס וגורם גדילה בסיסי הפיצוץ כדי להבטיח איתות CSC. במטרה לזהות חזקה של CSC, אנו מציעים גישה משלימה, שילוב פונקציונלי הערכה פנוטימית. יכולת להרכיב כדור, אזור התחדשות עצמית והקרנת כדור ליצור תכונות פונקציונליות CSC. בנוסף, האפיון כולל את הערכת הזרימה של הסמנים, המיוצגים על ידי CD44+/Cd24-ו- CD133, ואבן החשופה המערבית, בהתחשב ב-aldh. הפרוטוקול המוצג היה גם אופטימיזציה עבור דגימות הגידול הראשוני, בעקבות הליך העיכול לדוגמה, שימושי עבור מחקר טרנסלtional.
Introduction
אוכלוסיות סרטן הן הטרוגנית, עם תאים המציגים מורפולוגיות שונות, התפשטות וקיבולת הפלישה, בשל ביטוי גנים דיפרנציאלי. בין תאים אלה, אוכלוסיית המיעוט קיים בשם תאים גזע הסרטן (CSC)1, אשר יש את היכולת של התחדשות עצמית, לכידה של טרוגניות של נישה הגידול העיקרי והפקת מושלתי בצורה מאוד מבדילים שאינם מגיבים כראוי להומטיק שולטת2. מאפייני CSC ניתן לתרגם ישירות בפרקטיקה הקלינית, בהתחשב הקשר עם אירועים, כגון התנגדות או עמידות כימותרפיה3. הזיהוי של CSC יכול להוביל לפיתוח של טיפולים ייעודיים העשויים לכלול חסימה של סמנים פני השטח, קידום של בידול CSC, חסימת של רכיבים מסלול איתות CSC, השמדת נישה, ו אפיגנטי מנגנונים4.
בידוד של csc כבר בוצע קווי תאים בדגימות של גידולים ראשוניים5,6,7,8. הפרופיל הפונקציונלי המתואר עבור CSC כולל קיבולת הקלקגנטית, האוכלוסייה הצדדית והיווצרות מוורוספירה9. CD44גבוהה/cd24הנמוכה פנוטיפים הקשורים בעקביות עם השד csc, אשר הוכיחה להיות tuמוריגניים ב vivo והיה כבר קשור האפיתל למעבר mesenchymal5,10. פעילות ALDH גבוהה היתה גם קשורה עם שכניות ואפיתל למעבר mesenchymal (האמבולנס) בכמה סוגים של גידולים מוצק11. Aldh ביטוי נקשר עם עמידות כימותרפיה ו csc פנוטיפ בחוץ מבחנה12,13,14,15,16. מספר סמנים אחרים קושרו למאפייני csc בסוגים שונים של גידולים, כגון CD133, CD49f, ITGA6, CD1663,4 ואחרים, כמתואר בטבלה 1.
הספירות מורכבות ממודל תלת-מימדי לחקר והתרחבות של CSC. במודל זה, התא השעיות מקווי התא ומדגימות הדם או הגידול מעובדות במדיום שיושלם עם גורמי גדילה, כלומר גורם גידול באפידרמיס (EGF) ו בסיסי הצמיחה פיברוהפיצוץ גורם (bFGF), ללא סרום של שור עוברי ו בתנאים שאינם חסיד17. עיכוב של הדבקה תא תוצאות מוות על ידי אנואיקיס של תאים הבדיל18. הספירות נגזרות מצמיחת המשובטים של תא מבודד. למטרה זו, התאים מופצים בצפיפות נמוכה כדי למנוע פיוז ' ן תא וצבירה19. אסטרטגיה נוספת כוללת את השימוש בוצק מתילתאית20.
הפרוטוקול יוצר הספירה זכה לפופולריות בבידוד csc והתרחבות, עקב הזמן והעלות והסיבות הטכניות, הרווחיות והאנטי-21,22. למרות שמורות מסוימות במידה של היווצרות הספירה משקפת CSC, יש נטייה של תאי גזע לצמוח בתנאים שאינם חסיד עם פנוטיפ אופייני, אשר דומה המיקרו הסביבה הטבעית21. אף אחת השיטות הזמינות עבור בידוד של CSC מפני גידולים מוצקים יש יעילות מלאה, הדגשת החשיבות של פיתוח סמנים ספציפיים יותר או שילובים של מתודולוגיות סמנים.
בפרוטוקול זה, אנו מפרטים את הבידוד של CSC עם פרוטוקול יוצרי הספירה, עם העיקרון של צמיחה תא יחיד בתנאים שאינם חסיד ויכולת לייצר פנוטיפ הבדיל. ייצוג סכמטי של הליך זה מיוצג באיור 1. אנו מתארים גם את האפיון עם סמנים פני השטח וביטוי ALDH עבור CSC, הן עבור השד תאים סרטניים גינקולוגית קווים ודגימות של גידולים ראשוניים.
Protocol
פרוטוקול זה בוצע להיענות להנחיות המוסריות של בית החולים קוימברה והמרכז הלאומי (CHUC) בבנק הגידולים, ואושר על ידי ועדת האתיקה של CHUC לבריאות ועל ידי הוועדה הלאומית להגנת הנתונים הפורטוגזית.
1. פרוטוקול היווצרות כדור ואוכלוסיות מתוונות מתרבויות תאים מתמשך
הערה: בצע את כל ההליכים תחת תנאים סטריליים נוקשים.
- הכנת מבחנות או צלחות על ידי ציפוי של משטח גדילה עם פולי (2-הידרוקסיל-מתיונין-מתיאקריז)
- להכין פתרון 15 מ"ג/mL על ידי ערבוב פולי HEMA באתנול מוחלט ב 65 ° c. התרבות תא הפרווה מבחנות או צלחות עם 50 μL/cm2.
- המשך להתייבש ב37 ° c בתנור ייבוש. אם יש צורך, עוטפים את הצלחות ומאחסנים בטמפרטורת החדר.
- הכנת מדיית הספירה (SCM)
- הכינו פתרון 2% של מתילצלולוזה במים באולטרטהורים וחטא בחיטוי. מתילתאית נוטה להיות קל יותר לפתרון על-ידי קירור; לפיכך, פזר את האבקה במים ב-80 ° c ומערבבים עד לקירור23.
- הכינו פתרון מרוכז בשתי שעות של SCM (פתרון מניות). פתרון העבודה SCM מכיל DMEM-F12, שיושלם עם 100 מ"מ ריקבון, 1% אינסולין, העברת, סלניום ו 1% אנטיביוטי-antimycotic פתרון (10,000 U/mL, 10 מ"ג/mL סטרפטומיצין ו 25 μg/mL אמפוריטיצין B).
- כדי להכין את SCM, לערבב כרכים שווים של פתרון מלאי SCM עם 2% הפתרון של מתילצלולוזה.
- להשלים את המדיום מיד לפני השימוש על-ידי הוספת 10 ng/mL מקדם גידול באפידרמיס (EFG) ו 10 ng/mL בסיסי גידול פיברוהפיצוץ גורם (bFGF).
- אם קווי תא יותר בררן נמצאים בשימוש, להשלים את המדיום עם 0.4% סרום ביוסמין, אשר עשוי להיות יתרון.
- התחל עם בקבוקון של MCF7 או סרטן השד HCC1806 או ECC-1 או RL95-2 התאים סרטן רירית הרחם (או שורה אחרת של תאים של סרטן הבחירה) עם 80% כדי 90% המפגש.
- התעלם ממדיית התרבות התאית, שטוף עם תמיסת מלוחים באגירה מפוספז (PBS) ונתק את התאים עם טריפסין-EDTA (1 עד 2 מ ל בבקבוקון של 75 ס מ2 של תרבית תאים).
- הוסף מדיה לתרבות התא (2 עד 4 מ ל עבור 75 ס מ2 התרבות התא בקבוקון) ו צנטריפוגה ב 200 x g עבור 5 דקות כדי למחוק אנזימים.
- להשעות את הגלולה בתוך נפח ידוע של מדיה תרבות התא ו פיפטה למעלה ולמטה כדי להבטיח השעיה תא יחיד. למטרה זו, ניתן להשתמש במסננת תא 40 יקרומטר.
- לספור את התאים בתוך ה, ולחשב את ריכוז התא של ההשעיה התא. נצל צעד זה כדי להבטיח התבוננות של השעיית תא בודד. ספירת תאים זהירים חיוני כדי לכמת במדויק את ההשפעות של טיפולים.
- להשעות את הכמות הנחושה של השעיית התא ב SCM בינונית להשלים והעברה למנות פולי HEMA מצופה. כערך התייחסות לצפיפות הזריעה, שקול 500 ל2000 תאים/cm2.
הערה: אופטימיזציה של צפיפות ושעת התרבות עבור כל קו התא מומלץ מאוד24. - דגירה ב 37 ° צ' ו 5% CO2 עבור 2 ימים ללא הפרעה לוחיות.
- הקמת מחדש את ריכוז גורמי הצמיחה על ידי הוספת 10 ng/mL EFG ו 10 ng/mL bFGF לתקשורת התרבות התא. . חזור על השלב הזה כל יומיים
- דגירה ב 37 ° צ' ו 5% CO2 עד 5 ימים לאחר ציפוי (זה יכול להשתנות בין 3 עד 12 ימים על פי קו התא) כדי להשיג כדורים, אשר מציגים את המבנה של מושבות התא בצורת כדור ההשעיה.
- השתמש או לאסוף את הספירות, על ידי ליטוף, עבור הניסויים.
- כדי להשיג אוכלוסיות חסיד נגזרות, למקם את הספירות לתוך תנאי תרבות סטנדרטיים, ההתאמה של קו התא המשמש. 1 עד 2 ימים לאחר מכן, ניתן לראות מונאולייר של תאים הגדלים סביב כדורים חסיד, אשר מציג מורפולוגיה דומה לקו התא של המקור.
2. כדור היוצרים פרוטוקול מדגימות הגידול האנושי
הערה: השימוש בדגימות אנושיות לצורכי מחקר חייב לעמוד בחקיקה של כל מדינה, ולהיות מאושר על ידי ועדת האתיקה של המוסדות המעורבים.
- הכינו את מדיית ההובלה המכילה את DMEM/F12, שיושלם עם 10% סרום של שור עוברי (FBS) ו 2% אנטיביוטי-antimycotic פתרון (10,000 U/mL פניצילין, 10 מ"ג/mL סטרפטומיצין ו 25 μg/mL אמפוריטיצין B).
- הכינו את מדיית העיכול המכילה DMEM/F12, שיושלם עם 10% FBS, 1% אנטיביוטי פתרון antimycotic, 1 מ"ג/mL סוג IV הרביעי ו-100 μg/mL DNAse I.
- להכין את האנזים הפעלה מדיה המכיל DMEM/F12, שיושלם עם 10% FBS ו 1% אנטיביוטי-antimycotic פתרון (10,000 U/mL פניצילין, 10 מ"ג/mL סטרפטומיצין ו 25 μg/mL אמפוריטיצין B).
- הכן את ה-SCM כמתואר בסעיף 1.2.
- השג את המדגם במהלך המחקר המקקרוסקופי של החלק הפעיל בהקדם האפשרי לאחר הסרה כירורגית.
- מניחים את הדגימות במדיית התחבורה ומעבירים אותם למעבדה לצורך עיבוד. עיבוד לדוגמה צריך להתחיל בתוך 1 h האוסף הבא כדי לשפר את שיעור ההצלחה של השגרה. החלת זהירות באיסוף מדגם. . טפל בדגימות בזהירות למנוע את השימוש באזורים נמק או מצרוב.
- תחת לשכת הזרימה הסטרילית, העבירו את המדגם למנה וחתכו אותם לחתיכות קטנות יותר (בסביבות 1 מ"מ3) עם אזמל.
- מודטת הרקמה האנושית בצינור עם מדיית העיכול ב שייקר מסתובבת עד 180 דקות, ב 37 ° c. זהה את הצינורית הזאת כצינור A.
- החליפו את פתרון האנזים כל 15 דקות.
- לאסוף את מדיית העיכול (מבלי להסיר שברי רקמה) ולהעביר אותו דרך מסננת תא 40 יקרומטר לצינור חדש חצי מלא עם מדיה הפעלה אנזים. שמרו על צינורית זו בטמפרטורת החדר והזדהו כצינור B.
- הוספת מדיית העיכול החדשה לצינור A ולהחזיר אותו שייקר מסתובבת ב 37 ° c.
- בכל אחד מהאוספים, בדוק את הכדאיות של התאים בשיטת ההדרה הכחולה.
- חזור על הליך זה עבור 180 דקות או עד שספירת התאים תהיה נמוכה באופן משמעותי.
- מודטת את שברי הרקמה בצינור A בתמיסה העיכול השנייה המכילה חלקים שווים של המאאז ו טריפסין-EDTA, ערבוב של 10 דקות ב 37 ° c.
- להוסיף את האנזים ההפעלה מדיה לצינור A ולסנן את התוכן באמצעות מסננת תא 40 יקרומטר לתוך Tube B.
- צנטריפוגה את ההשעיה התא ב Tube B ב 200 x g עבור 10 דקות.
- השהה את הגלולה ב-SCM ובדוק את ריכוז התא באמצעות הומוציטוטומטר.
- השהה את הכמות הנחושה של השעיית התאים ב SCM והעבר למנות פולי-HEMA מצופות (ראה שלב 1.1) עם צפיפות הזריעה של 4000 תאים/cm2.
- דגירה ב 37 ° צ' ו 5% CO2 עבור 2 ימים ללא הפרעה לוחיות.
- הקמת מחדש את ריכוז גורמי הצמיחה על ידי הוספת 10 ng/mL EFG ו 10 ng/mL bFGF לתקשורת התרבות התא.
הערה: עליך לעשות זאת כל יומיים. - דגירה ב 37 ° צ' ו 5% CO2 עד 5 ימים לאחר ציפוי (זה יכול להשתנות עד 12 ימים) כדי להשיג כדורים, אשר מציגים את המבנה של מושבות התא בצורת כדור ההשעיה.
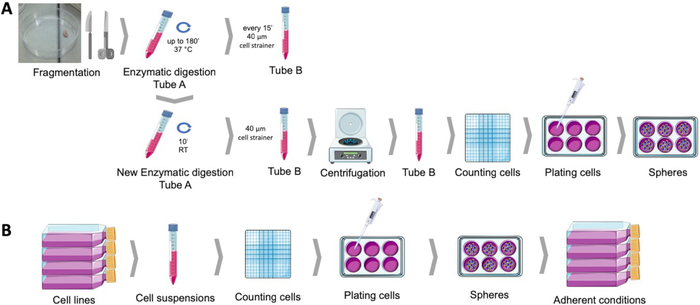
איור 1: השגת תאים גזע סרטן מדגימות הגידול רירית הרחם האנושי (A), השד גינקולוגית התאים הסרטניים (ב). דגימות הגידול של האדם הם מפוצלים, מתעכל אנזימטי ומצופה כדור culturing בינונית לתוך מנות פולי HEMA מצופה. קווי התאים הסרטניים מנותקים, השעיות בתאים נספרים, ותאים בודדים מופצים בצפיפות נמוכה ללוחות מצופים פולי-HEMA בתנאים מתאימים. הספירות שהושגו, כאשר הן ממוקמות תחת תנאי תרבות מחסיד, יוצרות אוכלוסיות חסיד נגזרות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
3. הספירה ליוצרים קיבולת, התחדשות עצמית ואזור הקרנת כדור
הערה: יכולת יצירת הספירה היא היכולת של אוכלוסיית תאי הגידול לייצר כדורים. התחדשות עצמית היא היכולת של תאי כדור לייצר מושבות החדש של תאים כדוריים בהשעיה. אזור הקרנת הספירה מייצג את האזור הנכבש על ידי הספירה ולכן הבעה בגודלם ומספר חטיבות התאים שעברו בפרק זמן מסוים.
- קביעת יכולת יצירת הספירה
- לאחר השלמת פרוטוקול להרכיב את הספירה, לאסוף את הספירות שפופרת צנטריפוגה וצנטריפוגה ב 125 x g עבור 5 דקות.
- התעלם מ-SCM והשהה בעדינות את הגלולה בנפח ידוע של מדיה חדשה. במטרה למקד את התחומים כדי להקל על הספירה, השהה את הספירות בנפח מדיה קטן. להיזהר לא להפריע את הספירות.
- השתמש הומוציטוטומטר כדי לספור את הספירות עם יותר מ-40 יקרומטר בקוטר. לחילופין, ניתן לספור כדורים ישירות על הלוח באמצעות מיקרוסקופ המצויד בגרטיכאל25 או באמצעות מערכת אוטומטית26,27.
- חשב את יחס האחוזים של הספירות שהתקבלו לעומת מספר התאים המצופים בתחילה.
- קביעת התחדשות עצמית
- לאחר השלמת פרוטוקול להרכיב את הספירה, לאסוף את הספירות שפופרת צנטריפוגה וצנטריפוגה ב 125 x g עבור 5 דקות.
- השמט את המדיה של הספרה והשהה בעדינות את הגלולה בטריפסין-אדטה.
- דגירה עד 5 דקות ב 37 ° c.
- הוסף מדיה הפעלה אנזימים ופיפטה למעלה ולמטה כדי להבטיח השעיית תא בודד.
- באמצעות הומוציטומטר ובשיטת ההדרה הכחולה, ספור את התאים הפעילים בהשעיה.
- הפעל את פרוטוקול יצירת הספירה כמתואר בסעיף 1.
- לאחר 8 ימים, להשתמש הומוציטוטומטר כדי לספור את הספירות עם יותר מ-40 יקרומטר קוטר.
- חשב את יחס האחוזים של הספירות שהתקבלו לעומת מספר התאים המצופים בתחילה.
- קביעת אזור הקרנת הספירה
- כדי להעריך את האזור שנכבש על ידי הספירות, להשיג תמונות של לפחות 10 שדות אקראיים לכל תנאי, במיקרוסקופ הפוך מצויד מודול רכישת תמונה. מומלץ להגדלה של 100X עד 400X.
- ניתוח תמונות באמצעות תוכנת דימות, כגון תוכנת ImageJ28, על-ידי ציור תחומי עניין המתאימים לתחומים ולמדידת האזור שלו בפיקסלים.
- חשב אזור הקרנת כדור כאזור ממוצע של פיקסלים שנמדדו.
4. סרטן גזע תא מסמן הערכה עם מערכת הזרמת זרימה
הערה: CD44+/Cd24-/שנמוך פנוטיפ היה קשור בעקביות עם השד ותאי גזע גינקולוגית סרטן. הפרוצדורה המתוארת עשויה לשמש להערכת סמני פני שטח תא אלה ואחרים.
- לאחר השלמת פרוטוקול להרכיב את הספירה, לאסוף את הספירות שפופרת צנטריפוגה וצנטריפוגה ב 125 x g עבור 5 דקות.
- להיפטר SCM ולהשעות בעדינות את הגלולה בטריפסין-EDTA.
- דגירה עד 5 דקות ב 37 ° c.
- הוסף מדיה הפעלה אנזימים ופיפטה למעלה ולמטה כדי להבטיח השעיית תא בודד.
- צנטריפוגה ב 125 x g עבור 5 דקות, למחוק את הסופרנטנט ולהשעות בעדינות את התאים ב-PBS.
- לאפשר לתאים לנוח בהשעיה עבור 30 דקות כדי להבטיח שחזור של הממברנה ממברנה.
- באמצעות הומוציטומטר ובשיטת ההדרה הכחולה, ספור את התאים בהשעיה.
- כוונן את נפח ההשעיה של התא ל 106 תאים/500 μl.
- דגירה עם נוגדנים חד שבטיים לפי הוראות של הספקים (ריכוז, זמן, טמפרטורה, אור/כהה) ובהתחשב הניסוי להגדיר מיוצג בטבלה 2 או סמנים שניתנו בטבלה 1.
- מיד לאחר הצביעת, לבצע את ניתוח הזרימה cy, באמצעות cytometric זרימה עם מודולים המתאים לזיהוי.
- לתקנן את ההתקנה cytometer בעקבות פרוטוקולים שנקבעו על ידי EuroFlow Consortium29.
- הגדר שערים ראשיים על בסיס החלק הקדמי והחוצה ללא הריסות ותאים מתים. ניתן לשפר זאת על-ידי התוויות הנמצאות במקביל עם המבקר ב-V ו-לאחר התאים השליליים.
- הגדר שערים פלואורסצנטית על בסיס דגימות בלתי מוכתמות ופיצוי על חפיפה ספקטרלית באמצעות פקדים ויטראז ' יחיד.
5. סרטן גזע תא מסמן הערכה עם אבן חשופה מערבית
הערה: בנוסף לפעילות ALDH1, הביטוי הגבוה של סמן זה היה משויך בעקביות עם השד ו גינקולוגית בתאי גזע הסרטן13,14. הפרוצדורה המתוארת עשויה לשמש להערכת סמני תא אלה ואחרים.
- לאחר השלמת פרוטוקול להרכיב את הספירה, לאסוף את הספירות שפופרת צנטריפוגה וצנטריפוגה ב 125 x g עבור 5 דקות.
- הכנת כל התאים הסלולריים
- הניחו את שפופרות הצנטריפוגה על הקרח והשמט את הסופרנטאנט מבלי לשבש את הגלולה.
- לשטוף את הגלולה עם 1 מ ל של ה-PBS קר להיפטר על ידי צנטריפוגה.
- להשעות את הגלולה בנפח קטן (200-500 μL) של מאגר הליזה ריפה30 (הנאל 150 MM, טריס-HCl 1.50 mM pH 7.4, טריטון-X100 1% vol./vol, נתרן deoxycholic חומצה 0.5% wt./vol., נתרן dodecyl סולפט 0.5% wt./vol.) שיושלם עם מיני מלאה ו dithioitol 1 מ"מ.
- שמירה על הדגימות קר (על הקרח), לשלוח אותם מערבולת ו sonication עם משרעת 30%.
- צנטריפוגה את הדגימות עבור 15 דקות ב 14,000 x g בצנטריפוגה בקירור להגדיר 4 ° c.
- העבר את הסופרנטטים לחדש, מזוהה כראוי מיקרוצינורות.
- לקבוע את ריכוזי החלבון באמצעות bca או ברדפורד בחני31.
- במקרה הצורך, יש לאחסן את הדגימות ב-80 ° c עד לניתוח כתמי אבן מערבי נוסף.
- ביצוע מדגם דנטורציה, אלקטרופורזה, העברת אלקטרון וזיהוי חלבונים בהתאם לפרוטוקולים סטנדרטיים של בלוק מערבי, כמתואר32,33,34.
תוצאות
הפרוטוקול ליצירת הספירה מאפשר מושבות כדוריות להיות מושגת בהשעיה מתוך העיכול כמה קווי רירית הרחם וסרטן השד (איור 2א) או לאחר בדיקות אנזימטיות עדין של רקמה מדגימות הגידול האנושי (איור 2E). בשני המקרים, מספר ימים לאחר הציפוי, מושבות מונבטיים כ?...
Discussion
פרוטוקול זה מפרט גישה להשגת כדורים מתאי סרטן ודגימות אנושיות ראשיות. כדורים מועשר בתתי-אוכלוסיה עם מאפיינים כמו תאי גזע36. העשרה זו ב CSC תלויה הכדאיות בסביבה מעגן ללא התאים בזמן הבדיל מסתמך על הדבקה37מצע. כמו ציפוי ראשוני של תאים סרטניים בסביבה הקפדה נמוכה הכופה הה?...
Disclosures
. למחברים אין מה לגלות
Acknowledgements
מחקר זה מומן על ידי האגודה הפורטוגזית של גניקולוגיה באמצעות פרס 2016 מחקר על ידי CIMAGO. CNC. IBILI נתמך באמצעות הקרן עבור מדע וטכנולוגיה, פורטוגל (UID//או/04539/2013), ובמימון שיתוף על ידי פדר-להתחרות (POCI-01-0145-פדר-007440). בית החולים של קוימברה ומרכז האוניברסיטה (CHUC) בבנק הגידול, אושרה על ידי ועדת האתיקה של CHUC לבריאות ועל ידי הוועדה הלאומית להגנת נתונים פורטוגזית, היה המקור של דגימות רירית הרחם של חולים ואחריו בשירות גניקולוגיה של המוסד. איור 1 הופק בעזרת Servier אמנות רפואית, זמין מ www.servier.com.
Materials
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Merck Millipore | 100983 | |
| Accutase | Gibco | A1110501 | StemPro Accutas Cell Dissociation Reagent |
| ALDH antibody | Santa Cruz Biotechnology | SC166362 | |
| Annexin V FITC | BD Biosciences | 556547 | |
| Antibiotic antimycotic solution | Sigma | A5955 | |
| BCA assay | Thermo Scientific | 23225 | Pierce BCA Protein Assay Kit |
| Bovine serum albumin | Sigma | A9418 | |
| CD133 antibody | Miteny Biotec | 293C3-APC | Allophycocyanin (APC) |
| CD24 antibody | BD Biosciences | 658331 | Allophycocyanin-H7 (APC-H7) |
| CD44 antibody | Biolegend | 103020 | Pacific Blue (PB) |
| Cell strainer | BD Falcon | 352340 | 40 µM |
| Collagenase, type IV | Gibco | 17104-019 | |
| cOmplete Mini | Roche | 118 361 700 0 | |
| Dithiothreitol | Sigma | 43815 | |
| DMEM-F12 | Sigma | D8900 | |
| DNAse I | Roche | 11284932001 | |
| ECC-1 | ATCC | CRL-2923 | Human endometrium adenocarcinoma cell line |
| Epidermal growth factor | Sigma | E9644 | |
| Fibroblast growth factor basic | Sigma | F0291 | |
| Haemocytometer | VWR | HERE1080339 | |
| HCC1806 | ATCC | CRL-2335 | Human mammary squamous cell carcinoma cell line |
| Insulin, transferrin, selenium Solution | Gibco | 41400045 | |
| MCF7 | ATCC | HTB-22 | Human mammary adenocarcinoma cell line |
| Methylcellulose | AlfaAesar | 45490 | |
| NaCl | JMGS | 37040005002212 | |
| Poly(2-hydroxyethyl-methacrylate | Sigma | P3932 | |
| Putrescine | Sigma | P7505 | |
| RL95-2 | ATCC | CRL-1671 | Human endometrium carcinoma cell line |
| Sodium deoxycholic acid | JMS | EINECS 206-132-7 | |
| Sodium dodecyl sulfate | Sigma | 436143 | |
| Tris | JMGS | 20360000BP152112 | |
| Triton-X 100 | Merck | 108603 | |
| Trypan blue | Sigma | T8154 | |
| Trypsin-EDTA | Sigma | T4049 | |
| ß-actin antibody | Sigma | A5316 |
References
- Hardin, H., Zhang, R., Helein, H., Buehler, D., Guo, Z., Lloyd, R. V. The evolving concept of cancer stem-like cells in thyroid cancer and other solid tumors. Laboratory Investigation. 97 (10), 1142 (2017).
- Plaks, V., Kong, N., Werb, Z. The Cancer Stem Cell Niche: How Essential Is the Niche in Regulating Stemness of Tumor Cells?. Cell Stem Cell. 16 (3), 225-238 (2015).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells in solid tumours accumulating evidence and unresolved questions. Nature reviews. Cancer. 8, 755-768 (2008).
- Allegra, A., et al. The Cancer Stem Cell Hypothesis: A Guide to Potential Molecular Targets. Cancer Investigation. 32 (9), 470-495 (2014).
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proceedings of the National Academy of Sciences. 100 (7), 3983-3988 (2003).
- Friel, A. M., et al. Functional analyses of the cancer stem cell-like properties of human endometrial tumor initiating cells. Cell Cycle. 7 (2), 242-249 (2008).
- Zhang, S., et al. Identification and Characterization of Ovarian Cancer-Initiating Cells from Primary Human Tumors. Cancer Research. 68 (11), 4311-4320 (2008).
- Bapat, S. A., Mali, A. M., Koppikar, C. B., Kurrey, N. K. Stem and progenitor-like cells contribute to the aggressive behavior of human epithelial ovarian cancer. Cancer research. 65 (8), 3025-3029 (2005).
- Carvalho, M. J., Laranjo, M., Abrantes, A. M., Torgal, I., Botelho, M. F., Oliveira, C. F. Clinical translation for endometrial cancer stem cells hypothesis. Cancer and Metastasis Reviews. 34 (3), 401-416 (2015).
- Morel, A. P., Lièvre, M., Thomas, C., Hinkal, G., Ansieau, S., Puisieux, A. Generation of Breast Cancer Stem Cells through Epithelial-Mesenchymal Transition. PLoS ONE. 3 (8), e2888 (2008).
- Tirino, V., et al. Cancer stem cells in solid tumors: an overview and new approaches for their isolation and characterization. The FASEB Journal. 27 (1), 13 (2013).
- Ajani, J. A., et al. ALDH-1 expression levels predict response or resistance to preoperative chemoradiation in resectable esophageal cancer patients. Molecular Oncology. 8 (1), 142-149 (2014).
- Carvalho, M. J., et al. Endometrial Cancer Spheres Show Cancer Stem Cells Phenotype and Preference for Oxidative Metabolism. Pathology and Oncology Research. , (2018).
- Laranjo, M., et al. Mammospheres of hormonal receptor positive breast cancer diverge to triple-negative phenotype. The Breast. 38, 22-29 (2018).
- Cui, M., et al. Non-Coding RNA Pvt1 Promotes Cancer Stem Cell–Like Traits in Nasopharyngeal Cancer via Inhibiting miR-1207. Pathology & Oncology Research. , (2018).
- Deng, S., et al. Distinct expression levels and patterns of stem cell marker, aldehyde dehydrogenase isoform 1 ALDH1), in human epithelial cancers. PloS one. 5 (4), e10277 (2010).
- Weiswald, L. B., Guinebretière, J. M., Richon, S., Bellet, D., Saubaméa, B., Dangles-Marie, V. In situ protein expression in tumour spheres: development of an immunostaining protocol for confocal microscopy. BMC Cancer. 10 (1), 106 (2010).
- Weiswald, L. B., Bellet, D., Dangles-Marie, V. Spherical Cancer Models in Tumor Biology. Neoplasia. 17 (1), 1-15 (2015).
- Picon-Ruiz, M., et al. Low adherent cancer cell subpopulations are enriched in tumorigenic and metastatic epithelial-to-mesenchymal transition-induced cancer stem-like cells. Scientific Reports. 6 (1), 1-13 (2016).
- Dontu, G., et al. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells. Genes & development. 17 (10), 1253-1270 (2003).
- Ballout, F., et al. Sphere-Formation Assay: Three-Dimensional in vitro Culturing of Prostate Cancer Stem/Progenitor Sphere-Forming Cells. Frontiers in Oncology. 8 (August), 1-14 (2018).
- Ishiguro, T., Ohata, H., Sato, A., Yamawaki, K., Enomoto, T., Okamoto, K. Tumor-derived spheroids: Relevance to cancer stem cells and clinical applications. Cancer Science. 108 (3), 283-289 (2017).
- Noseda, M., Nasatto, P., Silveira, J., Pignon, F., Rinaudo, M., Duarte, M. Methylcellulose, a Cellulose Derivative with Original Physical Properties and Extended Applications. Polymers. 7 (5), 777-803 (2015).
- Shaw, F. L., et al. A detailed mammosphere assay protocol for the quantification of breast stem cell activity. Journal of Mammary Gland Biology and Neoplasia. 17 (2), 111-117 (2012).
- Zhou, M., et al. LncRNA-Hh Strengthen Cancer Stem Cells Generation in Twist-Positive Breast Cancer via Activation of Hedgehog Signaling Pathway. Stem cells (Dayton, Ohio). 34 (1), 55-66 (2016).
- Ha, J. R., et al. Integration of Distinct ShcA Signaling Complexes Promotes Breast Tumor Growth and Tyrosine Kinase Inhibitor Resistance. Molecular cancer research MCR. 16 (5), 894-908 (2018).
- Jurmeister, S., et al. Identification of potential therapeutic targets in prostate cancer through a cross-species approach. EMBO molecular medicine. 10 (3), (2018).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature methods. 9 (7), 671-675 (2012).
- Kalina, T., et al. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols. Leukemia. 26 (9), 1986-2010 (2012).
- Peach, M., Marsh, N., Miskiewicz, E. I., MacPhee, D. J. . Solubilization of Proteins: The Importance of Lysis Buffer Choice. , 49-60 (2015).
- Olson, B. J. S. C. Assays for Determination of Protein Concentration. Current Protocols in Pharmacology. , A.3A.1-A.3A.32 (2016).
- Eslami, A., Lujan, J. Western Blotting: Sample Preparation to Detection. Journal of Visualized Experiments. (44), 1-2 (2010).
- Silva, J. M., McMahon, M. The Fastest Western in Town: A Contemporary Twist on the Classic Western Blot Analysis. Journal of Visualized Experiments. 84 (84), 1-8 (2014).
- Oldknow, K. J., et al. A Guide to Modern Quantitative Fluorescent Western Blotting with Troubleshooting Strategies. Journal of Visualized Experiments. 8 (93), 1-10 (2014).
- Serambeque, B. . Células estaminais do cancro do endométrio - a chave para o tratamento personalizado? [Stem Cells of Endometrial Cancer: The Key to Personalized Treatment?]. , (2018).
- Lee, C. H., Yu, C. C., Wang, B. Y., Chang, W. W. Tumorsphere as an effective in vitro platform for screening anti-cancer stem cell drugs. Oncotarget. 7 (2), (2015).
- De Luca, A., et al. Mitochondrial biogenesis is required for the anchorage-independent survival and propagation of stem-like cancer cells. Oncotarget. 6 (17), (2015).
- Masuda, A., et al. An improved method for isolation of epithelial and stromal cells from the human endometrium. Journal of Reproduction and Development. 62 (2), 213-218 (2016).
- Del Rio-Tsonis, K., et al. Facile isolation and the characterization of human retinal stem cells. Proceedings of the National Academy of Sciences. 101 (44), 15772-15777 (2004).
- Wang, L., Guo, H., Lin, C., Yang, L., Wang, X. I. Enrichment and characterization of cancer stem-like cells from a cervical cancer cell line. Molecular Medicine Reports. 9 (6), 2117-2123 (2014).
- Chen, Y. C., et al. High-throughput single-cell derived sphere formation for cancer stem-like cell identification and analysis. Scientific Reports. 6 (April), 1-12 (2016).
- Kim, J., Jung, J., Lee, S. J., Lee, J. S., Park, M. J. Cancer stem-like cells persist in established cell lines through autocrine activation of EGFR signaling. Oncology Letters. 3 (3), 607-612 (2012).
- Hwang-Verslues, W. W., et al. Multiple Lineages of Human Breast Cancer Stem/Progenitor Cells Identified by Profiling with Stem Cell Markers. PloS one. 4 (12), e8377 (2009).
- Feng, Y., et al. Metformin reverses stem cell-like HepG2 sphere formation and resistance to sorafenib by attenuating epithelial-mesenchymal transformation. Molecular Medicine Reports. 18 (4), 3866-3872 (2018).
- Wang, H., Paczulla, A., Lengerke, C. Evaluation of Stem Cell Properties in Human Ovarian Carcinoma Cells Using Multi and Single Cell-based Spheres Assays. Journal of Visualized Experiments. (95), 1-11 (2015).
- Stebbing, J., Lombardo, Y., Coombes, C. R., de Giorgio, A., Castellano, L. Mammosphere Formation Assay from Human Breast Cancer Tissues and Cell Lines. Journal of Visualized Experiments. (97), 1-5 (2015).
- Zhao, H., et al. Sphere-forming assay vs. organoid culture: Determining long-term stemness and the chemoresistant capacity of primary colorectal cancer cells. International Journal of Oncology. 54 (3), 893-904 (2019).
- Bagheri, V., et al. Isolation and identification of chemotherapy-enriched sphere-forming cells from a patient with gastric cancer. Journal of Cellular Physiology. 233 (10), 7036-7046 (2018).
- Kaowinn, S., Kaewpiboon, C., Koh, S., Kramer, O., Chung, Y. STAT1-HDAC4 signaling induces epithelial-mesenchymal transition and sphere formation of cancer cells overexpressing the oncogene, CUG2. Oncology Reports. , 2619-2627 (2018).
- Lonardo, E., Cioffi, M., Sancho, P., Crusz, S., Heeschen, C. Studying Pancreatic Cancer Stem Cell Characteristics for Developing New Treatment Strategies. Journal of Visualized Experiments. (100), 1-9 (2015).
- Lu, H., et al. Targeting cancer stem cell signature gene SMOC-2 Overcomes chemoresistance and inhibits cell proliferation of endometrial carcinoma. EBioMedicine. 40, 276-289 (2019).
- Bu, P., Chen, K. Y., Lipkin, S. M., Shen, X. Asymmetric division: a marker for cancer stem cells. Oncotarget. 4 (7), (2013).
- Islam, F., Qiao, B., Smith, R. A., Gopalan, V., Lam, A. K. Y. Cancer stem cell: fundamental experimental pathological concepts and updates. Experimental and molecular pathology. 98 (2), 184-191 (2015).
- Liu, W., et al. Comparative characterization of stem cell marker expression, metabolic activity and resistance to doxorubicin in adherent and spheroid cells derived from the canine prostate adenocarcinoma cell line CT1258. Anticancer research. 35 (4), 1917-1927 (2015).
- Broadley, K. W. R., et al. Side Population is Not Necessary or Sufficient for a Cancer Stem Cell Phenotype in Glioblastoma Multiforme. STEM CELLS. 29 (3), 452-461 (2011).
- Cojoc, M., Mäbert, K., Muders, M. H., Dubrovska, A. A role for cancer stem cells in therapy resistance: Cellular and molecular mechanisms. Seminars in Cancer Biology. 31, 16-27 (2015).
- Batlle, E., Clevers, H. Cancer stem cells revisited. Nature Medicine. 23 (10), 1124-1134 (2017).
- Zhang, X. L., Jia, Q., Lv, L., Deng, T., Gao, J. Tumorspheres Derived from HCC Cells are Enriched with Cancer Stem Cell-like Cells and Present High Chemoresistance Dependent on the Akt Pathway. Anti-cancer agents in medicinal chemistry. 15 (6), 755-763 (2015).
- Fukamachi, H., et al. CD49fhigh Cells Retain Sphere-Forming and Tumor-Initiating Activities in Human Gastric Tumors. PLoS ONE. 8 (8), e72438 (2013).
- Gao, M. Q., Choi, Y. P., Kang, S., Youn, J. H., Cho, N. H. CD24+ cells from hierarchically organized ovarian cancer are enriched in cancer stem cells. Oncogene. 29 (18), 2672-2680 (2010).
- Cariati, M., et al. Alpha-6 integrin is necessary for the tumourigenicity of a stem cell-like subpopulation within the MCF7 breast cancer cell line. International Journal of Cancer. 122 (2), 298-304 (2008).
- López, J., Valdez-Morales, F. J., Benítez-Bribiesca, L., Cerbón, M., Carrancá, A. Normal and cancer stem cells of the human female reproductive system. Reproductive Biology and Endocrinology. 11 (1), 53 (2013).
- Alvero, A. B., et al. Molecular phenotyping of human ovarian cancer stem cells unravels the mechanisms for repair and chemoresistance. Cell Cycle. 8 (1), 158-166 (2009).
- Charafe-Jauffret, E., Ginestier, C., Birnbaum, D. Breast cancer stem cells: tools and models to rely on. BMC Cancer. 9 (1), 202 (2009).
- Leccia, F., et al. ABCG2, a novel antigen to sort luminal progenitors of BRCA1- breast cancer cells. Molecular Cancer. 13 (1), 213 (2014).
- Croker, A. K., Allan, A. L. Inhibition of aldehyde dehydrogenase (ALDH) activity reduces chemotherapy and radiation resistance of stem-like ALDHhiCD44+ human breast cancer cells. Breast Cancer Research and Treatment. 133 (1), 75-87 (2012).
- Sun, M., et al. Enhanced efficacy of chemotherapy for breast cancer stem cells by simultaneous suppression of multidrug resistance and antiapoptotic cellular defense. Acta Biomaterialia. 28, 171-182 (2015).
- Shao, J., Fan, W., Ma, B., Wu, Y. Breast cancer stem cells expressing different stem cell markers exhibit distinct biological characteristics. Molecular Medicine Reports. 14 (6), 4991-4998 (2016).
- Croker, A. K., et al. High aldehyde dehydrogenase and expression of cancer stem cell markers selects for breast cancer cells with enhanced malignant and metastatic ability. Journal of Cellular and Molecular Medicine. 13 (8b), 2236-2252 (2009).
- Cheung, S. K. C., et al. Stage-specific embryonic antigen-3 (SSEA-3) and β3GalT5 are cancer specific and significant markers for breast cancer stem cells. Proceedings of the National Academy of Sciences. 113 (4), 960-965 (2016).
- Meyer, M. J., Fleming, J. M., Lin, A. F., Hussnain, S. A., Ginsburg, E., Vonderhaar, B. K. CD44 pos CD49f hi CD133/2 hi Defines Xenograft-Initiating Cells in Estrogen Receptor–Negative Breast Cancer. Cancer Research. 70 (11), 4624-4633 (2010).
- Ahn, S. M., Goode, R. J. A., Simpson, R. J. Stem cell markers: Insights from membrane proteomics?. PROTEOMICS. 8 (23-24), 4946-4957 (2008).
- Chefetz, I., et al. TLR2 enhances ovarian cancer stem cell self-renewal and promotes tumor repair and recurrence. Cell Cycle. 12 (3), 511-521 (2013).
- Alvero, A. B., et al. Stem-Like Ovarian Cancer Cells Can Serve as Tumor Vascular Progenitors. Stem Cells. 27 (10), 2405-2413 (2009).
- Yin, G., et al. Constitutive proteasomal degradation of TWIST-1 in epithelial–ovarian cancer stem cells impacts differentiation and metastatic potential. Oncogene. 32 (1), 39-49 (2013).
- Wei, X., et al. Mullerian inhibiting substance preferentially inhibits stem/progenitors in human ovarian cancer cell lines compared with chemotherapeutics. Proceedings of the National Academy of Sciences. 107 (44), 18874-18879 (2010).
- Meirelles, K., et al. Human ovarian cancer stem/progenitor cells are stimulated by doxorubicin but inhibited by Mullerian inhibiting substance. Proceedings of the National Academy of Sciences. 109 (7), 2358-2363 (2012).
- Shi, M. F., et al. Identification of cancer stem cell-like cells from human epithelial ovarian carcinoma cell line. Cellular and Molecular Life Sciences. 67 (22), 3915-3925 (2010).
- Meng, E., et al. CD44+/CD24− ovarian cancer cells demonstrate cancer stem cell properties and correlate to survival. Clinical & Experimental Metastasis. 29 (8), 939-948 (2012).
- Witt, A. E., et al. Identification of a cancer stem cell-specific function for the histone deacetylases, HDAC1 and HDAC7, in breast and ovarian. Oncogene. 36 (12), 1707-1720 (2017).
- Wu, H., Zhang, J., Shi, H. Expression of cancer stem markers could be influenced by silencing of p16 gene in HeLa cervical carcinoma cells. European journal of gynaecological oncology. 37 (2), 221-225 (2016).
- Huang, R., Rofstad, E. K. Cancer stem cells (CSCs), cervical CSCs and targeted therapies. Oncotarget. 8 (21), 35351-35367 (2017).
- Zhang, X., et al. Imatinib sensitizes endometrial cancer cells to cisplatin by targeting CD117-positive growth-competent cells. Cancer Letters. 345 (1), 106-114 (2014).
- Luo, L., et al. Ovarian cancer cells with the CD117 phenotype are highly tumorigenic and are related to chemotherapy outcome. Experimental and Molecular Pathology. 91 (2), 596-602 (2011).
- Zhao, P., Lu, Y., Jiang, X., Li, X. Clinicopathological significance and prognostic value of CD133 expression in triple-negative breast carcinoma. Cancer Science. 102 (5), 1107-1111 (2011).
- Ferrandina, G., et al. Expression of CD133-1 and CD133-2 in ovarian cancer. International Journal of Gynecologic Cancer. 18 (3), 506-514 (2008).
- Rutella, S., et al. Cells with characteristics of cancer stem/progenitor cells express the CD133 antigen in human endometrial tumors. Clinical cancer research an official journal of the American Association for Cancer Research. 15 (13), 4299-4311 (2009).
- Friel, A. M., et al. Epigenetic regulation of CD133 and tumorigenicity of CD133 positive and negative endometrial cancer cells. Reproductive Biology and Endocrinology. 8 (1), 147 (2010).
- Nakamura, M., et al. Prognostic impact of CD133 expression as a tumor-initiating cell marker in endometrial cancer. Human Pathology. 41 (11), 1516-1529 (2010).
- Saha, S. K., et al. KRT19 directly interacts with β-catenin/RAC1 complex to regulate NUMB-dependent NOTCH signaling pathway and breast cancer properties. Oncogene. 36 (3), 332-349 (2017).
- LV, X., Wang, Y., Song, Y., Pang, X., Li, H. Association between ALDH1+/CD133+ stem-like cells and tumor angiogenesis in invasive ductal breast carcinoma. Oncology Letters. 11 (3), 1750-1756 (2016).
- Ruscito, I., et al. Exploring the clonal evolution of CD133/aldehyde-dehydrogenase-1 (ALDH1)-positive cancer stem-like cells from primary to recurrent high-grade serous ovarian cancer (HGSOC). A study of the Ovarian Cancer Therapy–Innovative Models Prolong Survival (OCTIPS). European Journal of Cancer. 79, 214-225 (2017).
- Sun, Y., et al. Isolation of Stem-Like Cancer Cells in Primary Endometrial Cancer Using Cell Surface Markers CD133 and CXCR4. Translational Oncology. 10 (6), 976-987 (2017).
- Rahadiani, N., et al. Expression of aldehyde dehydrogenase 1 (ALDH1) in endometrioid adenocarcinoma and its clinical implications. Cancer Science. 102 (4), 903-908 (2011).
- Mamat, S., et al. Transcriptional Regulation of Aldehyde Dehydrogenase 1A1 Gene by Alternative Spliced Forms of Nuclear Factor Y in Tumorigenic Population of Endometrial Adenocarcinoma. Genes & Cancer. 2 (10), 979-984 (2011).
- Mukherjee, S. A., et al. Non-migratory tumorigenic intrinsic cancer stem cells ensure breast cancer metastasis by generation of CXCR4+ migrating cancer stem cells. Oncogene. 35 (37), 4937-4948 (2016).
- Lim, E., et al. Aberrant luminal progenitors as the candidate target population for basal tumor development in BRCA1 mutation carriers. Nature Medicine. 15 (8), 907-913 (2009).
- Liang, Y. J., et al. Interaction of glycosphingolipids GD3 and GD2 with growth factor receptors maintains breast cancer stem cell phenotype. Oncotarget. 8 (29), 47454-47473 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved