Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Получение Рак стволовых клеток Сферы от гинекологических и опухолей рака молочной железы
* Эти авторы внесли равный вклад
В этой статье
Резюме
Цель этой методологии заключается в выявлении раковых стволовых клеток (CSC) в раковых клеточных линиях и первичных образцах опухолей человека с помощью протокола формирования сферы, в надежной манере, используя функциональные анализы и фенотипическую характеристику с цитометрией потока и западной Пятно.
Аннотация
Раковые стволовые клетки (CSC) представляют собой небольшую популяцию с самообновлениеи и пластичности, которые отвечают за опухолевое, устойчивость к лечению и рецидивирующие заболевания. Эта популяция может быть идентифицирована по поверхностным маркерам, ферментативной активности и функциональному профилю. Эти подходы как таковые ограничены из-за фенотипической неоднородности и пластичности CSC. Здесь мы обновляем протокол формирования сферы для получения сфер CSC от рака молочной железы и гинекологических, оценивая функциональные свойства, маркеры CSC и экспрессию белка. Сферы получаются с одноклеточным посевом при низкой плотности в культуре подвески, используя полутвердую среду метилцеллюлозы, чтобы избежать миграции и агрегатов. Этот выгодный протокол может быть использован в линиях раковых клеток, но и в первичных опухолей. Трехмерная культура неприсоединения подвески, которая, как считается, имитирует микроокружение опухоли, особенно CSC-niche, дополнена эпидермальным фактором роста и основным фактором роста фибробластов для обеспечения сигнализации CSC. Стремясь к надежной идентификации CSC, мы предлагаем дополнительный подход, сочетающий функциональную и фенотипическую оценку. Сфераобразная способность, самообновление и область проекции сферы устанавливают функциональные свойства CSC. Кроме того, характеристика включает в себя цитометрию потока оценки маркеров, представленных CD44и/CD24- и CD133, и западный пятно, учитывая ALDH. Представленный протокол был также оптимизирован для первичных образцов опухоли, после процедуры пищеварения образца, полезной для трансляционных исследований.
Введение
Популяции рака неоднородны, с клетками, представляющими различные морфологии, пролиферации и вторжения потенциала, из-за дифференциальной экспрессии генов. Среди этих клеток, меньшинство населения существует названный рак стволовых клеток (CSC)1, которые имеют возможность для самообновления, повторяя неоднородность первичной ниши опухоли и производство аберрантично дифференциации прародителей, которые не реагируют адекватно гомеостатической контроля2. Свойства CSC могут быть непосредственно переведены в клинической практике, учитывая связь с событиями, такими как опухолевость или устойчивость к химиотерапии3. Идентификация CSC может привести к разработке целевых методов лечения, которые могут включать блокировку поверхностных маркеров, продвижение дифференциации CSC, блокирование компонентов сигнальных путей CSC, разрушение ниши и эпигенетические механизмы4.
Изоляция CSC была выполнена в линиях клеток и в образцах первичных опухолей5,6,7,8. Функциональный профиль, описанный для CSC, включает клоногенную емкость, боковое население и образование опухоли9. CD44высокий/CD24низкий фенотип был последовательно связан с груди CSC, которая оказалась опухолевой in vivo и уже был связан с эпителией к мезенхимального перехода5,10. Высокая активность ALDH также была связана со стеблей и эпителией к мезенхимальному переходу (EMT) в нескольких типах твердых опухолей11. ВЫРАЖЕНИЕ ALDH было связано с устойчивостью к химиотерапии и к phenotype CSC in vitro12,13,14,15,16. Несколько других маркеров были связаны с свойствами CSC в различных типах опухолей, таких как CD133, CD49f, ITGA6, CD1663,4 и другие, как описано в таблице 1.
Опухоли состоят из трехмерной модели для изучения и расширения CSC. В этой модели, клеточные суспензии от клеточных линий и из крови или опухоли образцов культивируются в среде дополняется факторами роста, а именно эпидермальный фактор роста (EGF) и основной фактор роста фибробластов (bFGF), без сыворотки крупного рогатого скота плода и в неприсоединения условиях17. Ингибирование клеточной адгезии приводит к смерти от ануикиса дифференцированных клеток18. Сферы являются производными от клонального роста изолированной клетки. Для этого клетки распределяются при низкой плотности, чтобы избежать слияния клеток и агрегации19. Другая стратегия включает в себя использование полутвердых метилцеллюлозы20.
Протокол формирования сферы приобрел популярность в изоляции и расширении CSC, благодаря времени и стоимости и техническим, прибыльным и воспроизводимым причинам21,22. Несмотря на некоторые резервы, по степени формирования сферы которых отражает ЦСК, существует склонность стволовых клеток к росту в неприсоединения с характерным фенотипом, который напоминает родную микросреду21. Ни один из методов, доступных для изоляции CSC от твердых опухолей, не имеет полной эффективности, подчеркивая важность разработки более конкретных маркеров или комбинаций методологий и маркеров.
В этом протоколе мы подробно описываем изоляцию CSC с протоколом формирования сферы, с принципом одноклеточного роста в условиях неприсоединения и способностью производить дифференцированный фенотип. Схематическое представление этой процедуры представлено на рисунке 1. Мы также описываем характеристику с поверхностными маркерами и выражением ALDH для CSC, как для линий опухолевых клеток молочной и гинекологических, так и образцов первичных опухолей.
протокол
Этот протокол был выполнен в соответствии с этическими принципами коимбры больницы и Университетского центра (CHUC) Опухолевый банк, и был одобрен комитетом по этике CHUC для здоровья и Португальской национальной комиссии по защите данных.
1. Протокол формирования сферы и выведенные Популяции придерживающихся от непрерывных культур клетки
ПРИМЕЧАНИЕ: Выполните все процедуры в строгих стерильных условиях.
- Приготовление неприсоединения подвесной культуры фляг или пластин путем покрытия поверхности роста поли (2-гидроксиэтил-метакрилат (поли-ХЕМА)
- Приготовьте раствор 15 мг/мл, помешивая поли-HEMA в абсолютном этаноле при 65 градусах Цельсия. Шерох клетки культуры колбы или тарелки с 50 л /см2.
- Оставьте высохнуть при температуре 37 градусов по Цельсию в сушильной духовке. При необходимости оберните тарелки и храните при комнатной температуре.
- Подготовка сферного культивирования носителей (СКМ)
- Приготовьте 2% раствор метилцеллюлозы в ультрачистой воде и стерилизуйте в автоклаве. Метилцеллюлоза, как правило, легче растворять путем охлаждения; поэтому рассеять порошок в воде при 80 градусах по Цельсию и перемешать до охлаждения23.
- Подготовьте двухразовое концентрированное решение SCM (акционерное решение). Рабочий раствор СКМ содержит DMEM-F12, дополненный 100 мМ гетрекцина, 1% инсулина, трансферрин, селен и 1% антимикотический раствор (10 000 U/mL пенициллин, 10 мг/мл streptomycin и 25 мкг/мл амфотерицин B).
- Для подготовки СКМ смешайте равные объемы стакового раствора SCM с 2% раствором метилцеллюлозы.
- Завершите среду непосредственно перед использованием, добавив 10 нг/мл эпидермального фактора роста (EFG) и 10 нг/мл основного фактора роста фибробластов (bFGF).
- Если используются более привитые клеточные линии, дополнить среду 0,4% бычьего сыворотки альбумина, что может быть преимуществом.
- Начните с колбы MCF7 или HCC1806 рака молочной железы или ECC-1 или RL95-2 эндометрия раковых клеток (или других раковых клеток линии выбора) с 80% до 90% слияния.
- Откажитесь от средств культуры клеток, промойте фосфатбуферным сольниковым раствором (PBS) и отсоедините клетки с помощью трипсина-ЭДТА (от 1 до 2 мл для колбы2-х клеточных культур).
- Добавьте средства культуры клеток (от 2 до 4 мл для колбы2-сантиметровой культуры клеток) и центрифугу при 200 х г в течение 5 мин, чтобы отказаться от ферментов.
- Приостановить гранулы в известном объеме клеточной культуры средств массовой информации и пипетки вверх и вниз, чтобы обеспечить одну подвеску ячейки. Для этой цели можно использовать ситечко для 40 мкм.
- Подсчитайте клетки в гемоцитометре и вычислите концентрацию клеточной суспензии. Воспользуйтесь этим шагом, чтобы обеспечить наблюдение за одноклеточной подвеской. Тщательный подсчет клеток имеет важное значение для точной количественной оценки последствий лечения.
- Приостановить определенное количество клеточной подвески в SCM полной среде и передачи на поли-HEMA покрытием блюд. В качестве эталонного значения плотности посева, рассмотреть 500 до 2000 клеток / см2.
ПРИМЕЧАНИЕ: Оптимизация плотности посева и времени культуры для каждой клеточной линии настоятельно рекомендуется24. - Инкубировать при 37 градусах Цельсия и 5% CO2 в течение 2 дней, не нарушая пластин.
- Восстановить концентрацию факторов роста, добавив 10 нг/мл EFG и 10 нг/мл bFGF к средствам культуры клеток. Повторяйте этот шаг каждые два дня.
- Инкубировать при 37 градусах Цельсия и 5% CO2 до 5 дней после покрытия (это может варьироваться от 3 до 12 дней в зависимости от клеточной линии) для получения сфер, которые представляют морфологию подвесной шарообразных клеточных колоний.
- Используйте или собирайте сферы, путем пипетки, для экспериментов.
- Для того чтобы получить выведенные популяции адепонтов, устанавливают сферы в стандартные условия культуры, соответственно используемой линии клетки. Через 1-2 дня можно наблюдать монослой клеток, растущих вокруг адептов, который представляет морфологию, похожую на клеточную линию происхождения.
2. Протокол формирования сферы из образцов опухолей человека
ПРИМЕЧАНИЕ: Использование образцов человека в исследовательских целях должно соответствовать законодательству каждой страны и утверждаться Комитетом по этике соответствующих учреждений.
- Подготовьте транспортные носители, содержащие DMEM/F12, дополненные 10% сывороткой крупного рогатого скота плода (FBS) и 2% антимикотический раствор (10 000 U/mL пенициллин, 10 мг/мл стрептомицин и 25 мкг/мл амфотерицин B).
- Подготовьте пищеварение, содержащее DMEM/F12, дополненное 10% FBS, 1% антибиотико-антимикоттным раствором, 1 мг/мл IV коллагеназы типа IV и 100 мкг/мл DNAse I.
- Подготовьте ферментинактивационный носитель, содержащий DMEM/F12, дополненный 10% FBS и 1% антимикотический раствор (10 000 U/mL пенициллина, 10 мг/мЛ стрептомицина и 25 мкг/мл амфотерицин B).
- Подготовьте СКМ, как описано в разделе 1.2.
- Получить образец во время макроскопического исследования оперативной части как можно скорее после хирургического удаления.
- Поместите образцы в транспортные носители и перенесите их в лабораторию для обработки. Обработка образцов должна начинаться в пределах 1 ч после сбора, чтобы улучшить показатель успешности процедуры. Примените осторожность в сборе образцов. Тщательно обработайте образцы. Избегайте использования некротических или прижметизированных зон.
- Под стерильную камеру потока перенесите образец на тарелку и нарежьте на мелкие кусочки (около 1 мм3)скальпелем.
- Инкубировать ткани человека в трубке с пищеварением средств в вращающейся шейкер е до 180 мин, при 37 градусов по Цельсию. Определите эту трубку как Труба А.
- Замените ферментный раствор каждые 15 минут.
- Соберите пищеварения средств (без удаления фрагментов ткани) и передать его через 40 мкм ячейки ситечко в новую трубку наполовину заполнены ферментом инактивации средств массовой информации. Поддерживайте эту трубку при комнатной температуре и идентифицируйте ее как труба B.
- Добавьте новые носители пищеварения в трубку А и верните его в вращающийся шейкер при 37 градусах Цельсия.
- В каждой коллекции проверяйте жизнеспособность ячейки с помощью метода исключения trypan blue.
- Повторите эту процедуру в течение 180 минут или до тех пор, пока количество клеток значительно ниже.
- Инкубировать фрагменты тканей в трубе А во втором растворе пищеварения, содержащем равные части акутаза и трипсин-ЭДТА, помешивая в течение 10 мин при 37 градусах Цельсия.
- Добавьте ферментинактивации носителя в трубку А и фильтруйте содержимое через 40 мкм клеточный ситечко в трубку B.
- Центрифуга подвески ячейки в трубе B на 200 х г в течение 10 мин.
- Приостановить гранулы в SCM и проверить концентрацию клеток с помощью гемоситометра.
- Приостановить определенное количество клеточной суспензии в СКМ и перенести на поли-HEMA покрытой посуды (см. шаг 1.1) с плотностью посева 4000 клеток /см2.
- Инкубировать при 37 градусах Цельсия и 5% CO2 в течение 2 дней, не нарушая пластин.
- Восстановить концентрацию факторов роста, добавив 10 нг/мл EFG и 10 нг/мл bFGF к средствам культуры клеток.
ПРИМЕЧАНИЕ: Вы должны делать это каждые два дня. - Инкубировать при 37 градусах Цельсия и 5% CO2 до 5 дней после покрытия (это может варьироваться до 12 дней) для получения сфер, которые представляют морфологию подвесной шарообразных клеточных колоний.
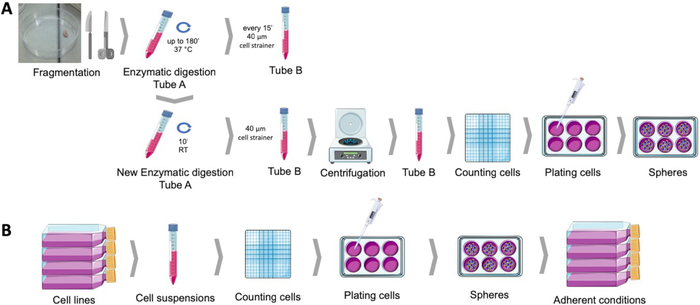
Рисунок 1: Получение раковых стволовых клеток из образцов опухолей эндометрия человека (A) и линий раковых клеток молочной железы и гинекологических (B). Образцы опухолей человека фрагментированы, ферментативно усваиваются и покрываются в сфере культивирования среды в поли-HEMA покрытием блюд. Линии раковых клеток отсоединяются, подсчитываются суспензии клеток, а одиночные клетки распределяются при низкой плотности в поли-HEMA покрытием пластин при соответствующих условиях. Полученные сферы, помещенные в условия хрущенной культуры, производят производные популяции приверженцев. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
3. Сфера-образующая емкость, самообновление и область проекции сферы
ПРИМЕЧАНИЕ: Сфера-образующая способность является способность популяции опухолевых клеток производить сферы. Самообновление – это способность сферных клеток производить новые колонии сферических клеток в суспензии. Область проекции сферы является репрезентативной области, занимаемой сферой, и поэтому выразительна их размер и количество делений клеток, претерпеваемых в определенный период времени.
- Определение сферы формирования потенциала
- После завершения протокола формирования сферы соберите сферы в центрифужную трубку и центрифугу при 125 х г в течение 5 мин.
- Откажитесь от SCM и осторожно приостановить гранулы в известном объеме свежих носителей. С целью концентрации сфер для облегчения подсчета, приостановить сферы в небольшом объеме средств массовой информации. Будьте осторожны, чтобы не беспокоить сферы.
- Используйте гемоцитометр для подсчета сфер диаметром более 40 мкм. Кроме того, сферы можно пересчитать непосредственно на пластине с помощью микроскопа, оснащенного graticule25 или с помощью автоматизированной системы26,27.
- Рассчитайте процентное соотношение сфер, полученных по сравнению с числом ячеек, первоначально покрытых.
- Определение самообновления
- После завершения протокола формирования сферы соберите сферы в центрифужную трубку и центрифугу при 125 х г в течение 5 мин.
- Откажитесь от сферы культивирования носителей и осторожно приостановить гранулы в трипсин-EDTA.
- Инкубировать до 5 мин при 37 градусах Цельсия.
- Добавить фермент инактивации средств и пипетки вверх и вниз, чтобы обеспечить одну суспензию клеток.
- Используя гемоцитометр и метод исключения trypan blue, подсчитайте жизнеспособные клетки в подвеске.
- Инициировать протокол формирования сферы, как описано в разделе 1.
- После 8 дней, используйте гемоцитометр для подсчета сфер с более чем 40 мкм в диаметре.
- Рассчитайте процентное соотношение сфер, полученных по сравнению с числом ячеек, первоначально покрытых.
- Определение области проекции сферы
- Чтобы оценить площадь, занимаемую сферами, получить изображения по крайней мере 10 случайных полей на состояние, в перевернутом микроскопе, оборудованном модулем приобретения изображения. Рекомендуется увеличение от 100X до 400X.
- Анализ изображений с помощью программного обеспечения изображений, таких как программное обеспечение ImageJ28, путем рисования областей, представляющих интерес, соответствующих сферам и измерения его области в пикселях.
- Рассчитайте область проекции сферы по мере измерения средней площади пикселей.
4. Оценка маркера стволовых клеток рака с помощью цитометрии потока
ПРИМЕЧАНИЕ: CD44/CD24-/низкий фенотип был последовательно связан с раковыми клетками молочной железы и гинекологического рака. Описанная процедура может быть использована для оценки этого и других маркеров поверхности клеток.
- После завершения протокола формирования сферы соберите сферы в центрифужную трубку и центрифугу при 125 х г в течение 5 мин.
- Откажитесь от SCM и осторожно приостановить гранулы в трипсин-EDTA.
- Инкубировать до 5 мин при 37 градусах Цельсия.
- Добавить фермент инактивации средств и пипетки вверх и вниз, чтобы обеспечить одну суспензию клеток.
- Центрифуга при 125 х г в течение 5 мин, отбросить супернатант и осторожно приостановить клетки в PBS.
- Разрешить клеткам отдохнуть в подвеске в течение 30 минут, чтобы обеспечить восстановление мембранной конформации.
- Используя гемоцитометр и метод исключения trypan blue, подсчитайте клетки в подвеске.
- Отрегулируйте объем суспензии ячейки до 106 ячеек/500 Л.
- Инкубировать моноклональными антителами в соответствии с инструкциями поставщиков (концентрация, время, температура и свет/темнота) и с учетом набора экспериментов, представленных в таблице 2 или маркеров, приведенных в таблице 1.
- Сразу же после окрашивания выполняйте цитометрический анализ потока с помощью цитометра потока с соответствующими модулями обнаружения.
- Стандартизуизировать установку цитометра, следуя протоколам, установленным консорциумом EuroFlow29.
- Настройка первичных ворот на основе переднего и бокового рассеяния, исключающего мусор и мертвые клетки. Это может быть улучшено путем сопутствующей маркировки с приложением V и gating отрицательных клеток.
- Установите флуоресценцию ворота на основе неокрашенных образцов и компенсации за спектральное перекрытие с помощью одного окрашенных элементов управления.
5. Оценка маркера стволовых клеток рака с западным пятном
ПРИМЕЧАНИЕ: В дополнение к деятельности ALDH1, высокое выражение этого маркера было последовательно связано с молочной железы и гинекологических раковых стволовых клеток13,14. Описанная процедура может быть использована для оценки этого и других маркеров клеток.
- После завершения протокола формирования сферы соберите сферы в центрифужную трубку и центрифугу при 125 х г в течение 5 мин.
- Подготовка целую клеточную лисаты
- Поместите центрифуги труб на лед и отбросить супернатант, не нарушая гранулы.
- Вымойте гранулы с 1 мл холодного PBS и отбросить центрифугированием.
- Приостановить гранулы в небольшом объеме (200-500 л) буфера лиза RIPA30 (NaCl 150 mM, Tris-HCl 1.50 mM pH 7.4, Triton-X100 1% vol./vol., натриевая дезоксихоловая кислота 0.5% wt./vol., натрий dodecyl sulfate 0.5% wt./vol.) дополнено cOmplete Mini и дитиотрейтол 1 мм.
- Поддерживая образцы холодными (на льду), подайте их в вихрь и звукование с 30% амплитудой.
- Центрифуги образцы в течение 15 мин при 14000 х г в охлажденной центрифуге установлен до 4 градусов по Цельсию.
- Перенесите супернационты в новые, правильно идентифицированные микротрубки.
- Определить концентрации белка с помощью BCA или Брэдфорд анализы31.
- При необходимости храните образцы при -80 градусов по Цельсию до дальнейшего анализа западного поблу.
- Выполните диверсионную денатурацию, электрофорез, передачу электронов и обнаружение белка в соответствии со стандартными западными протоколами промотирования, как описано32,33,34.
Результаты
Протокол формирования сферы позволяет получить сферические колонии в подвеске от нескольких линий эндометрия и рака молочной железы(рисунок 2A) или после нежного ферментативного переваривания тканей из образцов опухолей человека(рисунок 2
Обсуждение
Этот протокол детализирует подход для того чтобы получить tumorspheres от линий клетки рака и главным образом людских образцов. Опухоли обогащаются в субпопуляции со стволовыми клетками, как свойства36. Это обогащение в CSC зависит от жизнеспособности в среде, свободной от крепле?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было профинансировано Португальским обществом гинекологии в рамках Исследовательской премии 2016 года и CIMAGO. Чпу. IBILI поддерживается через Фонд науки и техники, Португалия (UID/NEU/04539/2013), и совместно финансируется FEDER-COMPETE (POCI-01-0145-FEDER-007440). Больница Коимбра и Университетский центр (ЧУК) Опухолевый банк, утвержденный Комитетом по этике ЧУК по здравоохранению и Португальской национальной комиссией по защите данных, был источником экскутриции пациентов, за которыми следовали в гинекологической службе учреждения. Рисунок 1 был произведен с использованием Сервье медицинского искусства, доступные из www.servier.com.
Материалы
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Merck Millipore | 100983 | |
| Accutase | Gibco | A1110501 | StemPro Accutas Cell Dissociation Reagent |
| ALDH antibody | Santa Cruz Biotechnology | SC166362 | |
| Annexin V FITC | BD Biosciences | 556547 | |
| Antibiotic antimycotic solution | Sigma | A5955 | |
| BCA assay | Thermo Scientific | 23225 | Pierce BCA Protein Assay Kit |
| Bovine serum albumin | Sigma | A9418 | |
| CD133 antibody | Miteny Biotec | 293C3-APC | Allophycocyanin (APC) |
| CD24 antibody | BD Biosciences | 658331 | Allophycocyanin-H7 (APC-H7) |
| CD44 antibody | Biolegend | 103020 | Pacific Blue (PB) |
| Cell strainer | BD Falcon | 352340 | 40 µM |
| Collagenase, type IV | Gibco | 17104-019 | |
| cOmplete Mini | Roche | 118 361 700 0 | |
| Dithiothreitol | Sigma | 43815 | |
| DMEM-F12 | Sigma | D8900 | |
| DNAse I | Roche | 11284932001 | |
| ECC-1 | ATCC | CRL-2923 | Human endometrium adenocarcinoma cell line |
| Epidermal growth factor | Sigma | E9644 | |
| Fibroblast growth factor basic | Sigma | F0291 | |
| Haemocytometer | VWR | HERE1080339 | |
| HCC1806 | ATCC | CRL-2335 | Human mammary squamous cell carcinoma cell line |
| Insulin, transferrin, selenium Solution | Gibco | 41400045 | |
| MCF7 | ATCC | HTB-22 | Human mammary adenocarcinoma cell line |
| Methylcellulose | AlfaAesar | 45490 | |
| NaCl | JMGS | 37040005002212 | |
| Poly(2-hydroxyethyl-methacrylate | Sigma | P3932 | |
| Putrescine | Sigma | P7505 | |
| RL95-2 | ATCC | CRL-1671 | Human endometrium carcinoma cell line |
| Sodium deoxycholic acid | JMS | EINECS 206-132-7 | |
| Sodium dodecyl sulfate | Sigma | 436143 | |
| Tris | JMGS | 20360000BP152112 | |
| Triton-X 100 | Merck | 108603 | |
| Trypan blue | Sigma | T8154 | |
| Trypsin-EDTA | Sigma | T4049 | |
| ß-actin antibody | Sigma | A5316 |
Ссылки
- Hardin, H., Zhang, R., Helein, H., Buehler, D., Guo, Z., Lloyd, R. V. The evolving concept of cancer stem-like cells in thyroid cancer and other solid tumors. Laboratory Investigation. 97 (10), 1142 (2017).
- Plaks, V., Kong, N., Werb, Z. The Cancer Stem Cell Niche: How Essential Is the Niche in Regulating Stemness of Tumor Cells?. Cell Stem Cell. 16 (3), 225-238 (2015).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells in solid tumours accumulating evidence and unresolved questions. Nature reviews. Cancer. 8, 755-768 (2008).
- Allegra, A., et al. The Cancer Stem Cell Hypothesis: A Guide to Potential Molecular Targets. Cancer Investigation. 32 (9), 470-495 (2014).
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proceedings of the National Academy of Sciences. 100 (7), 3983-3988 (2003).
- Friel, A. M., et al. Functional analyses of the cancer stem cell-like properties of human endometrial tumor initiating cells. Cell Cycle. 7 (2), 242-249 (2008).
- Zhang, S., et al. Identification and Characterization of Ovarian Cancer-Initiating Cells from Primary Human Tumors. Cancer Research. 68 (11), 4311-4320 (2008).
- Bapat, S. A., Mali, A. M., Koppikar, C. B., Kurrey, N. K. Stem and progenitor-like cells contribute to the aggressive behavior of human epithelial ovarian cancer. Cancer research. 65 (8), 3025-3029 (2005).
- Carvalho, M. J., Laranjo, M., Abrantes, A. M., Torgal, I., Botelho, M. F., Oliveira, C. F. Clinical translation for endometrial cancer stem cells hypothesis. Cancer and Metastasis Reviews. 34 (3), 401-416 (2015).
- Morel, A. P., Lièvre, M., Thomas, C., Hinkal, G., Ansieau, S., Puisieux, A. Generation of Breast Cancer Stem Cells through Epithelial-Mesenchymal Transition. PLoS ONE. 3 (8), e2888 (2008).
- Tirino, V., et al. Cancer stem cells in solid tumors: an overview and new approaches for their isolation and characterization. The FASEB Journal. 27 (1), 13 (2013).
- Ajani, J. A., et al. ALDH-1 expression levels predict response or resistance to preoperative chemoradiation in resectable esophageal cancer patients. Molecular Oncology. 8 (1), 142-149 (2014).
- Carvalho, M. J., et al. Endometrial Cancer Spheres Show Cancer Stem Cells Phenotype and Preference for Oxidative Metabolism. Pathology and Oncology Research. , (2018).
- Laranjo, M., et al. Mammospheres of hormonal receptor positive breast cancer diverge to triple-negative phenotype. The Breast. 38, 22-29 (2018).
- Cui, M., et al. Non-Coding RNA Pvt1 Promotes Cancer Stem Cell–Like Traits in Nasopharyngeal Cancer via Inhibiting miR-1207. Pathology & Oncology Research. , (2018).
- Deng, S., et al. Distinct expression levels and patterns of stem cell marker, aldehyde dehydrogenase isoform 1 ALDH1), in human epithelial cancers. PloS one. 5 (4), e10277 (2010).
- Weiswald, L. B., Guinebretière, J. M., Richon, S., Bellet, D., Saubaméa, B., Dangles-Marie, V. In situ protein expression in tumour spheres: development of an immunostaining protocol for confocal microscopy. BMC Cancer. 10 (1), 106 (2010).
- Weiswald, L. B., Bellet, D., Dangles-Marie, V. Spherical Cancer Models in Tumor Biology. Neoplasia. 17 (1), 1-15 (2015).
- Picon-Ruiz, M., et al. Low adherent cancer cell subpopulations are enriched in tumorigenic and metastatic epithelial-to-mesenchymal transition-induced cancer stem-like cells. Scientific Reports. 6 (1), 1-13 (2016).
- Dontu, G., et al. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells. Genes & development. 17 (10), 1253-1270 (2003).
- Ballout, F., et al. Sphere-Formation Assay: Three-Dimensional in vitro Culturing of Prostate Cancer Stem/Progenitor Sphere-Forming Cells. Frontiers in Oncology. 8 (August), 1-14 (2018).
- Ishiguro, T., Ohata, H., Sato, A., Yamawaki, K., Enomoto, T., Okamoto, K. Tumor-derived spheroids: Relevance to cancer stem cells and clinical applications. Cancer Science. 108 (3), 283-289 (2017).
- Noseda, M., Nasatto, P., Silveira, J., Pignon, F., Rinaudo, M., Duarte, M. Methylcellulose, a Cellulose Derivative with Original Physical Properties and Extended Applications. Polymers. 7 (5), 777-803 (2015).
- Shaw, F. L., et al. A detailed mammosphere assay protocol for the quantification of breast stem cell activity. Journal of Mammary Gland Biology and Neoplasia. 17 (2), 111-117 (2012).
- Zhou, M., et al. LncRNA-Hh Strengthen Cancer Stem Cells Generation in Twist-Positive Breast Cancer via Activation of Hedgehog Signaling Pathway. Stem cells (Dayton, Ohio). 34 (1), 55-66 (2016).
- Ha, J. R., et al. Integration of Distinct ShcA Signaling Complexes Promotes Breast Tumor Growth and Tyrosine Kinase Inhibitor Resistance. Molecular cancer research MCR. 16 (5), 894-908 (2018).
- Jurmeister, S., et al. Identification of potential therapeutic targets in prostate cancer through a cross-species approach. EMBO molecular medicine. 10 (3), (2018).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature methods. 9 (7), 671-675 (2012).
- Kalina, T., et al. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols. Leukemia. 26 (9), 1986-2010 (2012).
- Peach, M., Marsh, N., Miskiewicz, E. I., MacPhee, D. J. . Solubilization of Proteins: The Importance of Lysis Buffer Choice. , 49-60 (2015).
- Olson, B. J. S. C. Assays for Determination of Protein Concentration. Current Protocols in Pharmacology. , A.3A.1-A.3A.32 (2016).
- Eslami, A., Lujan, J. Western Blotting: Sample Preparation to Detection. Journal of Visualized Experiments. (44), 1-2 (2010).
- Silva, J. M., McMahon, M. The Fastest Western in Town: A Contemporary Twist on the Classic Western Blot Analysis. Journal of Visualized Experiments. 84 (84), 1-8 (2014).
- Oldknow, K. J., et al. A Guide to Modern Quantitative Fluorescent Western Blotting with Troubleshooting Strategies. Journal of Visualized Experiments. 8 (93), 1-10 (2014).
- Serambeque, B. . Células estaminais do cancro do endométrio - a chave para o tratamento personalizado? [Stem Cells of Endometrial Cancer: The Key to Personalized Treatment?]. , (2018).
- Lee, C. H., Yu, C. C., Wang, B. Y., Chang, W. W. Tumorsphere as an effective in vitro platform for screening anti-cancer stem cell drugs. Oncotarget. 7 (2), (2015).
- De Luca, A., et al. Mitochondrial biogenesis is required for the anchorage-independent survival and propagation of stem-like cancer cells. Oncotarget. 6 (17), (2015).
- Masuda, A., et al. An improved method for isolation of epithelial and stromal cells from the human endometrium. Journal of Reproduction and Development. 62 (2), 213-218 (2016).
- Del Rio-Tsonis, K., et al. Facile isolation and the characterization of human retinal stem cells. Proceedings of the National Academy of Sciences. 101 (44), 15772-15777 (2004).
- Wang, L., Guo, H., Lin, C., Yang, L., Wang, X. I. Enrichment and characterization of cancer stem-like cells from a cervical cancer cell line. Molecular Medicine Reports. 9 (6), 2117-2123 (2014).
- Chen, Y. C., et al. High-throughput single-cell derived sphere formation for cancer stem-like cell identification and analysis. Scientific Reports. 6 (April), 1-12 (2016).
- Kim, J., Jung, J., Lee, S. J., Lee, J. S., Park, M. J. Cancer stem-like cells persist in established cell lines through autocrine activation of EGFR signaling. Oncology Letters. 3 (3), 607-612 (2012).
- Hwang-Verslues, W. W., et al. Multiple Lineages of Human Breast Cancer Stem/Progenitor Cells Identified by Profiling with Stem Cell Markers. PloS one. 4 (12), e8377 (2009).
- Feng, Y., et al. Metformin reverses stem cell-like HepG2 sphere formation and resistance to sorafenib by attenuating epithelial-mesenchymal transformation. Molecular Medicine Reports. 18 (4), 3866-3872 (2018).
- Wang, H., Paczulla, A., Lengerke, C. Evaluation of Stem Cell Properties in Human Ovarian Carcinoma Cells Using Multi and Single Cell-based Spheres Assays. Journal of Visualized Experiments. (95), 1-11 (2015).
- Stebbing, J., Lombardo, Y., Coombes, C. R., de Giorgio, A., Castellano, L. Mammosphere Formation Assay from Human Breast Cancer Tissues and Cell Lines. Journal of Visualized Experiments. (97), 1-5 (2015).
- Zhao, H., et al. Sphere-forming assay vs. organoid culture: Determining long-term stemness and the chemoresistant capacity of primary colorectal cancer cells. International Journal of Oncology. 54 (3), 893-904 (2019).
- Bagheri, V., et al. Isolation and identification of chemotherapy-enriched sphere-forming cells from a patient with gastric cancer. Journal of Cellular Physiology. 233 (10), 7036-7046 (2018).
- Kaowinn, S., Kaewpiboon, C., Koh, S., Kramer, O., Chung, Y. STAT1-HDAC4 signaling induces epithelial-mesenchymal transition and sphere formation of cancer cells overexpressing the oncogene, CUG2. Oncology Reports. , 2619-2627 (2018).
- Lonardo, E., Cioffi, M., Sancho, P., Crusz, S., Heeschen, C. Studying Pancreatic Cancer Stem Cell Characteristics for Developing New Treatment Strategies. Journal of Visualized Experiments. (100), 1-9 (2015).
- Lu, H., et al. Targeting cancer stem cell signature gene SMOC-2 Overcomes chemoresistance and inhibits cell proliferation of endometrial carcinoma. EBioMedicine. 40, 276-289 (2019).
- Bu, P., Chen, K. Y., Lipkin, S. M., Shen, X. Asymmetric division: a marker for cancer stem cells. Oncotarget. 4 (7), (2013).
- Islam, F., Qiao, B., Smith, R. A., Gopalan, V., Lam, A. K. Y. Cancer stem cell: fundamental experimental pathological concepts and updates. Experimental and molecular pathology. 98 (2), 184-191 (2015).
- Liu, W., et al. Comparative characterization of stem cell marker expression, metabolic activity and resistance to doxorubicin in adherent and spheroid cells derived from the canine prostate adenocarcinoma cell line CT1258. Anticancer research. 35 (4), 1917-1927 (2015).
- Broadley, K. W. R., et al. Side Population is Not Necessary or Sufficient for a Cancer Stem Cell Phenotype in Glioblastoma Multiforme. STEM CELLS. 29 (3), 452-461 (2011).
- Cojoc, M., Mäbert, K., Muders, M. H., Dubrovska, A. A role for cancer stem cells in therapy resistance: Cellular and molecular mechanisms. Seminars in Cancer Biology. 31, 16-27 (2015).
- Batlle, E., Clevers, H. Cancer stem cells revisited. Nature Medicine. 23 (10), 1124-1134 (2017).
- Zhang, X. L., Jia, Q., Lv, L., Deng, T., Gao, J. Tumorspheres Derived from HCC Cells are Enriched with Cancer Stem Cell-like Cells and Present High Chemoresistance Dependent on the Akt Pathway. Anti-cancer agents in medicinal chemistry. 15 (6), 755-763 (2015).
- Fukamachi, H., et al. CD49fhigh Cells Retain Sphere-Forming and Tumor-Initiating Activities in Human Gastric Tumors. PLoS ONE. 8 (8), e72438 (2013).
- Gao, M. Q., Choi, Y. P., Kang, S., Youn, J. H., Cho, N. H. CD24+ cells from hierarchically organized ovarian cancer are enriched in cancer stem cells. Oncogene. 29 (18), 2672-2680 (2010).
- Cariati, M., et al. Alpha-6 integrin is necessary for the tumourigenicity of a stem cell-like subpopulation within the MCF7 breast cancer cell line. International Journal of Cancer. 122 (2), 298-304 (2008).
- López, J., Valdez-Morales, F. J., Benítez-Bribiesca, L., Cerbón, M., Carrancá, A. Normal and cancer stem cells of the human female reproductive system. Reproductive Biology and Endocrinology. 11 (1), 53 (2013).
- Alvero, A. B., et al. Molecular phenotyping of human ovarian cancer stem cells unravels the mechanisms for repair and chemoresistance. Cell Cycle. 8 (1), 158-166 (2009).
- Charafe-Jauffret, E., Ginestier, C., Birnbaum, D. Breast cancer stem cells: tools and models to rely on. BMC Cancer. 9 (1), 202 (2009).
- Leccia, F., et al. ABCG2, a novel antigen to sort luminal progenitors of BRCA1- breast cancer cells. Molecular Cancer. 13 (1), 213 (2014).
- Croker, A. K., Allan, A. L. Inhibition of aldehyde dehydrogenase (ALDH) activity reduces chemotherapy and radiation resistance of stem-like ALDHhiCD44+ human breast cancer cells. Breast Cancer Research and Treatment. 133 (1), 75-87 (2012).
- Sun, M., et al. Enhanced efficacy of chemotherapy for breast cancer stem cells by simultaneous suppression of multidrug resistance and antiapoptotic cellular defense. Acta Biomaterialia. 28, 171-182 (2015).
- Shao, J., Fan, W., Ma, B., Wu, Y. Breast cancer stem cells expressing different stem cell markers exhibit distinct biological characteristics. Molecular Medicine Reports. 14 (6), 4991-4998 (2016).
- Croker, A. K., et al. High aldehyde dehydrogenase and expression of cancer stem cell markers selects for breast cancer cells with enhanced malignant and metastatic ability. Journal of Cellular and Molecular Medicine. 13 (8b), 2236-2252 (2009).
- Cheung, S. K. C., et al. Stage-specific embryonic antigen-3 (SSEA-3) and β3GalT5 are cancer specific and significant markers for breast cancer stem cells. Proceedings of the National Academy of Sciences. 113 (4), 960-965 (2016).
- Meyer, M. J., Fleming, J. M., Lin, A. F., Hussnain, S. A., Ginsburg, E., Vonderhaar, B. K. CD44 pos CD49f hi CD133/2 hi Defines Xenograft-Initiating Cells in Estrogen Receptor–Negative Breast Cancer. Cancer Research. 70 (11), 4624-4633 (2010).
- Ahn, S. M., Goode, R. J. A., Simpson, R. J. Stem cell markers: Insights from membrane proteomics?. PROTEOMICS. 8 (23-24), 4946-4957 (2008).
- Chefetz, I., et al. TLR2 enhances ovarian cancer stem cell self-renewal and promotes tumor repair and recurrence. Cell Cycle. 12 (3), 511-521 (2013).
- Alvero, A. B., et al. Stem-Like Ovarian Cancer Cells Can Serve as Tumor Vascular Progenitors. Stem Cells. 27 (10), 2405-2413 (2009).
- Yin, G., et al. Constitutive proteasomal degradation of TWIST-1 in epithelial–ovarian cancer stem cells impacts differentiation and metastatic potential. Oncogene. 32 (1), 39-49 (2013).
- Wei, X., et al. Mullerian inhibiting substance preferentially inhibits stem/progenitors in human ovarian cancer cell lines compared with chemotherapeutics. Proceedings of the National Academy of Sciences. 107 (44), 18874-18879 (2010).
- Meirelles, K., et al. Human ovarian cancer stem/progenitor cells are stimulated by doxorubicin but inhibited by Mullerian inhibiting substance. Proceedings of the National Academy of Sciences. 109 (7), 2358-2363 (2012).
- Shi, M. F., et al. Identification of cancer stem cell-like cells from human epithelial ovarian carcinoma cell line. Cellular and Molecular Life Sciences. 67 (22), 3915-3925 (2010).
- Meng, E., et al. CD44+/CD24− ovarian cancer cells demonstrate cancer stem cell properties and correlate to survival. Clinical & Experimental Metastasis. 29 (8), 939-948 (2012).
- Witt, A. E., et al. Identification of a cancer stem cell-specific function for the histone deacetylases, HDAC1 and HDAC7, in breast and ovarian. Oncogene. 36 (12), 1707-1720 (2017).
- Wu, H., Zhang, J., Shi, H. Expression of cancer stem markers could be influenced by silencing of p16 gene in HeLa cervical carcinoma cells. European journal of gynaecological oncology. 37 (2), 221-225 (2016).
- Huang, R., Rofstad, E. K. Cancer stem cells (CSCs), cervical CSCs and targeted therapies. Oncotarget. 8 (21), 35351-35367 (2017).
- Zhang, X., et al. Imatinib sensitizes endometrial cancer cells to cisplatin by targeting CD117-positive growth-competent cells. Cancer Letters. 345 (1), 106-114 (2014).
- Luo, L., et al. Ovarian cancer cells with the CD117 phenotype are highly tumorigenic and are related to chemotherapy outcome. Experimental and Molecular Pathology. 91 (2), 596-602 (2011).
- Zhao, P., Lu, Y., Jiang, X., Li, X. Clinicopathological significance and prognostic value of CD133 expression in triple-negative breast carcinoma. Cancer Science. 102 (5), 1107-1111 (2011).
- Ferrandina, G., et al. Expression of CD133-1 and CD133-2 in ovarian cancer. International Journal of Gynecologic Cancer. 18 (3), 506-514 (2008).
- Rutella, S., et al. Cells with characteristics of cancer stem/progenitor cells express the CD133 antigen in human endometrial tumors. Clinical cancer research an official journal of the American Association for Cancer Research. 15 (13), 4299-4311 (2009).
- Friel, A. M., et al. Epigenetic regulation of CD133 and tumorigenicity of CD133 positive and negative endometrial cancer cells. Reproductive Biology and Endocrinology. 8 (1), 147 (2010).
- Nakamura, M., et al. Prognostic impact of CD133 expression as a tumor-initiating cell marker in endometrial cancer. Human Pathology. 41 (11), 1516-1529 (2010).
- Saha, S. K., et al. KRT19 directly interacts with β-catenin/RAC1 complex to regulate NUMB-dependent NOTCH signaling pathway and breast cancer properties. Oncogene. 36 (3), 332-349 (2017).
- LV, X., Wang, Y., Song, Y., Pang, X., Li, H. Association between ALDH1+/CD133+ stem-like cells and tumor angiogenesis in invasive ductal breast carcinoma. Oncology Letters. 11 (3), 1750-1756 (2016).
- Ruscito, I., et al. Exploring the clonal evolution of CD133/aldehyde-dehydrogenase-1 (ALDH1)-positive cancer stem-like cells from primary to recurrent high-grade serous ovarian cancer (HGSOC). A study of the Ovarian Cancer Therapy–Innovative Models Prolong Survival (OCTIPS). European Journal of Cancer. 79, 214-225 (2017).
- Sun, Y., et al. Isolation of Stem-Like Cancer Cells in Primary Endometrial Cancer Using Cell Surface Markers CD133 and CXCR4. Translational Oncology. 10 (6), 976-987 (2017).
- Rahadiani, N., et al. Expression of aldehyde dehydrogenase 1 (ALDH1) in endometrioid adenocarcinoma and its clinical implications. Cancer Science. 102 (4), 903-908 (2011).
- Mamat, S., et al. Transcriptional Regulation of Aldehyde Dehydrogenase 1A1 Gene by Alternative Spliced Forms of Nuclear Factor Y in Tumorigenic Population of Endometrial Adenocarcinoma. Genes & Cancer. 2 (10), 979-984 (2011).
- Mukherjee, S. A., et al. Non-migratory tumorigenic intrinsic cancer stem cells ensure breast cancer metastasis by generation of CXCR4+ migrating cancer stem cells. Oncogene. 35 (37), 4937-4948 (2016).
- Lim, E., et al. Aberrant luminal progenitors as the candidate target population for basal tumor development in BRCA1 mutation carriers. Nature Medicine. 15 (8), 907-913 (2009).
- Liang, Y. J., et al. Interaction of glycosphingolipids GD3 and GD2 with growth factor receptors maintains breast cancer stem cell phenotype. Oncotarget. 8 (29), 47454-47473 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены