Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Obtenir des sphères de cellules souches cancéreuses à partir de tumeurs gynécologiques et du cancer du sein
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L’objectif de cette méthodologie est d’identifier les cellules souches cancéreuses (CSC) dans les lignées de cellules cancéreuses et les échantillons primaires de tumeurs humaines avec le protocole de formation de sphère, d’une manière robuste, en utilisant des essais fonctionnels et la caractérisation phénotypique avec cytométrie du flux et de l’Ouest Tache.
Résumé
Les cellules souches cancéreuses (CSC) sont une petite population avec l’auto-renouvellement et la plasticité qui sont responsables de la tumorigénèse, la résistance au traitement et la maladie récurrente. Cette population peut être identifiée par des marqueurs de surface, une activité enzymatique et un profil fonctionnel. Ces approches en soi sont limitées, en raison de l’hétérogénéité phénotypique et de la plasticité du SCC. Ici, nous mettons à jour le protocole de formation de sphère pour obtenir des sphères de CSC des cancers du sein et gynécologiques, évaluant des propriétés fonctionnelles, des marqueurs de CSC et l’expression de protéine. Les sphères sont obtenues avec l’ensemencement unicellulaire à faible densité dans la culture de suspension, en utilisant un milieu semi-solide de méthylcellulose pour éviter la migration et les agrégats. Ce protocole rentable peut être utilisé dans les lignées cellulaires cancéreuses, mais aussi dans les tumeurs primaires. La culture tridimensionnelle de suspension non-adhérente pensée pour imiter le microenvironnement de tumeur, particulièrement le CSC-niche, est complétée avec le facteur épidermique de croissance et le facteur de croissance de base de fibroblaste pour assurer la signalisation de CSC. Visant une identification robuste du SCC, nous proposons une approche complémentaire, combinant l’évaluation fonctionnelle et phénotypique. La capacité de formation de sphère, l’auto-renouvellement et la zone de projection de sphère établissent des propriétés fonctionnelles de CSC. En outre, la caractérisation comprend l’évaluation de la cytométrie du débit des marqueurs, représentés par CD44/CD24- et CD133, et Western blot, compte tenu de l’ALDH. Le protocole présenté a également été optimisé pour les échantillons primaires de tumeur, suivant une procédure de digestion d’échantillon, utile pour la recherche translationnelle.
Introduction
Les populations cancéreuses sont hétérogènes, avec des cellules présentant différentes morphologies, la prolifération et la capacité d’invasion, en raison de l’expression différentielle des gènes. Parmi ces cellules, une population minoritaire existe des cellules souches cancéreuses (CSC)1, qui ont la capacité d’auto-renouvellement, récapitulant l’hétérogénéité de la niche tumorale primaire et produisant des progéniteurs aberrants différenciants qui ne répondent pas adéquatement aux contrôles homéostatiques2. Les propriétés de CSC peuvent être directement traduites dans la pratique clinique, étant donné l’association avec des événements, tels que la tumorigénicité ou la résistance à la chimiothérapie3. L’identification du SCC peut mener à la mise au point de thérapies ciblées qui peuvent inclure le blocage des marqueurs de surface, la promotion de la différenciation du SCC, le blocage des composantes de la voie de signalisation du SCC, la destruction des niches et les mécanismes épigénétiques4.
L’isolement du SCC a été effectué dans les lignées de cellules et dans des échantillons de tumeurs primaires5,6,7,8. Le profil fonctionnel décrit pour le SCC comprend la capacité clonogène, la population latérale et la formation de tumorosphère9. Le phénotypefaible cD44élevé/CD24 a été uniformément associé au CSC de sein, qui s’est avéré être tumorigenic in vivo et a été déjà associé à la transition épithéliale à la transition mésenchymale5,10. L’activité élevée d’ALDH a été également associée à la tige et à la transition épithéliale à la transition mésenchymale (EMT) dans plusieurs types de tumeurs pleines11. L’expression d’ALDH a été associée à la résistance à la chimiothérapie et au phénotype de CSC in vitro12,13,14,15,16. Plusieurs autres marqueurs ont été liés aux propriétés du SCC dans différents types de tumeurs, comme CD133, CD49f, ITGA6, CD1663,4 et d’autres, comme décrit dans le tableau 1.
Les tumorspheres se composent d’un modèle tridimensionnel pour l’étude et l’expansion de CSC. Dans ce modèle, les suspensions cellulaires des lignées cellulaires et des échantillons de sang ou de tumeur sont cultivées dans un milieu complété par des facteurs de croissance, à savoir le facteur de croissance épidermique (EGF) et le facteur de croissance de base du fibroblaste (bFGF), sans sérum bovin fœtal et dans des conditions non adhérentes17. L’inhibition de l’adhérence cellulaire entraîne la mort par anoikis de cellules différenciées18. Les sphères sont dérivées de la croissance clonale d’une cellule isolée. À cette fin, les cellules sont distribuées à faible densité pour éviter la fusion cellulaire et l’agrégation19. Une autre stratégie comprend l’utilisation de la méthylcellulose semi-solide20.
Le protocole de formation de sphère a gagné la popularité dans l’isolement et l’expansion de CSC, en raison du temps et du coût et des raisons techniques, profitables, et reproductibles21,22. Malgré certaines réserves sur l’étendue de la formation de sphère soumet le SCC, il y a une propension des cellules souches à se développer dans des conditions non adhérentes avec le phénotype caractéristique, qui ressemble au microenvironnement indigène21. Aucune des méthodes disponibles pour l’isolement du SCC des tumeurs pleines n’a l’efficacité complète, soulignant l’importance de développer des marqueurs plus spécifiques ou des combinaisons des méthodologies et des marqueurs.
Dans ce protocole, nous détaillons l’isolement du SCC avec le protocole de formation de sphère, avec le principe de la croissance unicellulaire dans des conditions non adhérentes et la capacité de produire un phénotype différencié. Une représentation schématique de cette procédure est représentée à la figure 1. Nous décrivons également la caractérisation avec des marqueurs de surface et l’expression d’ALDH pour CSC, pour des lignes de cellules de tumeur de sein et gynécologiques et des échantillons des tumeurs primaires.
Protocole
Ce protocole a été exécuté conformément aux directives éthiques de la Banque de tumeurs de l’Hôpital et du Centre Universitaire de Coimbra (CHUC), et a été approuvé par le Comité d’éthique de la santé du CHUC et par la Commission nationale portugaise de protection des données.
1. Protocole de formation de sphères et populations adhérentes dérivées des cultures cellulaires continues
REMARQUE : Effectuez toutes les procédures dans des conditions stériles strictes.
- Préparation de flacons ou de plaques de culture de suspension non adhérents en enrobant la surface de croissance de poly(2-hydroxyethyl-méthacrylate (poly-HEMA)
- Préparer une solution de 15 mg/ml en remuant le poly-HEMA dans de l’éthanol absolu à 65 oC. Enrober les flacons ou les plaques de culture cellulaire avec 50 l/cm2.
- Laisser sécher à 37 oC dans un four à sécher. Si nécessaire, envelopper les assiettes et les conserver à température ambiante.
- Préparation des supports de culture de sphère (SCM)
- Préparer une solution de 2% de méthylcellulose dans de l’eau ultrapure et stériliser dans l’autoclave. La méthylcellulose a tendance à être plus facile à solubilité par refroidissement; donc disperser la poudre dans l’eau à 80 oC et remuer jusqu’à ce qu’elle soit refroidie23.
- Préparer une solution deux fois concentrée de SCM (solution stock). La solution de travail SCM contient du DMEM-F12, complété par 100 mM de putréscine, 1 % d’insuline, de transferrine, de sélénium et 1 % de solution antibiotique-antimycotique (10 000 u/mL de pénicilline, 10 mg/mL de streptomycine et 25 'g/mL d’amphotericine B).
- Pour préparer le SCM, mélanger des volumes égaux de la solution de stock SCM avec la solution de 2% de méthylcellulose.
- Terminer le milieu immédiatement avant l’utilisation en ajoutant 10 ng/mL facteur de croissance épidermique (EFG) et 10 ng/mL facteur de croissance de base de fibroblaste (bFGF).
- Si des lignées cellulaires plus exigeantes sont utilisées, complétez le milieu avec 0,4 % d’albumine bovine, ce qui pourrait être un avantage.
- Commencez par un flacon de MCF7 ou HCC1806 cancer du sein ou ECC-1 ou RL95-2 cellules cancéreuses endométriales (ou autre lignée de cellules cancéreuses de choix) avec 80% à 90% de confluence.
- Jeter le support de culture cellulaire, laver avec une solution saline tamponnée en phosphate (PBS) et détacher les cellules avec de la trypsine-EDTA (1 à 2 ml pour un flacon de culture cellulaire de 75 cm2).
- Ajouter le support de culture cellulaire (2 à 4 ml pour un flacon de culture cellulaire de 75 cm2) et la centrifugeuse à 200 x g pendant 5 min pour jeter les enzymes.
- Suspendre la pastille dans un volume connu de support de culture cellulaire et pipette de haut en bas pour assurer une suspension de cellule unique. À cette fin, une passoire cellulaire de 40 m peut être utilisée.
- Comptez les cellules dans l’hémocytomètre et calculez la concentration cellulaire de la suspension cellulaire. Profitez de cette étape pour assurer l’observation d’une suspension à cellule unique. Un comptage minutieux des cellules est essentiel pour quantifier avec précision les effets des traitements.
- Suspendre la quantité déterminée de suspension cellulaire dans le milieu complet SCM et le transférer dans des plats enduits poly-HEMA. Comme valeur de référence pour la densité d’ensemencement, considérez 500 à 2000 cellules/cm2.
REMARQUE : L’optimisation de la densité d’ensemencement et du temps de culture pour chaque lignée cellulaire est fortement recommandée24. - Incuber à 37 oC et 5 % de CO2 pendant 2 jours sans déranger les plaques.
- Rétablir la concentration des facteurs de croissance en ajoutant 10 ng/mL EFG et 10 ng/mL bFGF au média de culture cellulaire. Répétez cette étape tous les deux jours.
- Incuber à 37 oC et 5 % de CO2 jusqu’à 5 jours après le placage (ce qui peut varier de 3 à 12 jours selon la lignée cellulaire) pour obtenir des sphères, qui présentent la morphologie des colonies cellulaires en forme de boule de suspension.
- Utiliser ou collecter les sphères, par pipetting, pour les expériences.
- Pour obtenir des populations adhérentes dérivées, placer les sphères dans des conditions de culture standard, respectivement de la ligne cellulaire utilisée. 1 à 2 jours plus tard, il est possible d’observer une monocouche de cellules poussant autour des sphères adhérentes, ce qui présente une morphologie similaire à la lignée cellulaire d’origine.
2. Protocole de formation de sphère à partir d’échantillons de tumeurs humaines
REMARQUE : L’utilisation d’échantillons humains à des fins de recherche doit être conforme à la législation de chaque pays et être approuvée par le Comité d’éthique des institutions concernées.
- Préparer le support de transport contenant du DMEM/F12, complété par 10 % de sérum bovin fœtal (FBS) et 2 % de solution antibiotique-antimycotique (10 000 pénicilline U/mL, 10 mg/mL de streptomycine et 25 'g/mL amphotericin B).
- Préparer le support de digestion contenant DMEM/F12, complété par 10% FBS, 1% solution antimycotique antibiotique, 1 mg/mL de type IV collagène et 100 'g/mL DNAse I.
- Préparer le support d’inactivation d’enzymecontenant contenant d’autres d’un DMEM/F12, complété par 10 % de FBS et 1 % de solution antibiotique-antimycotique (10 000 u/mL de pénicilline, 10 mg/mL de streptomycine et 25 'g/mL d’amphotericine B).
- Préparer le MCS tel que décrit à la section 1.2.
- Obtenir l’échantillon au cours de l’étude macroscopique de la pièce opératoire dès que possible après l’ablation chirurgicale.
- Placez les échantillons dans les supports de transport et transférez-les au laboratoire pour le traitement. Le traitement de l’échantillon devrait commencer dans les 1 h suivant la collecte afin d’améliorer le taux de réussite de la procédure. Appliquez la prudence dans la collecte d’échantillons. Manipulez soigneusement les échantillons. Évitez l’utilisation de zones nécrotiques ou cautérisées.
- Sous la chambre d’écoulement stérile, transférer l’échantillon dans un plat et le couper en petits morceaux (environ 1 mm3) avec un scalpel.
- Incuber le tissu humain dans un tube avec un support de digestion dans un shaker rotatif jusqu’à 180 min, à 37 oC. Identifiez ce tube comme tube A.
- Remplacer la solution enzymatique toutes les 15 min.
- Recueillir le support de digestion (sans enlever les fragments de tissu) et le transférer à travers une passoire cellulaire de 40 m à un nouveau tube à moitié rempli de médias d’inactivation d’enzymes. Maintenez ce tube à température ambiante et identifiez-le comme tube B.
- Ajouter un nouveau support de digestion au tube A et le remettre dans le shaker rotatif à 37 oC.
- À chaque collecte, vérifiez la viabilité des cellules à l’aide de la méthode d’exclusion bleu trypan.
- Répétez cette procédure pendant 180 min ou jusqu’à ce que le nombre de cellules soit significativement inférieur.
- Incuber les fragments de tissu dans le tube A dans une deuxième solution de digestion contenant des parties égales de l’accutase et de la trypsine-EDTA, en remuant pendant 10 min à 37 oC.
- Ajouter le milieu d’inactivation d’enzyme s’asseoir dans le tube A et filtrer le contenu à travers une passoire cellulaire de 40 m dans le tube B.
- Centrifugelant la suspension cellulaire dans le tube B à 200 x g pendant 10 min.
- Suspendre la pastille dans SCM et vérifier la concentration cellulaire à l’aide d’un hémocytomètre.
- Suspendre la quantité déterminée de suspension cellulaire en SCM et transférer dans des plats enduits poly-HEMA (voir l’étape 1.1) avec une densité d’ensemencement de 4000 cellules/cm2.
- Incuber à 37 oC et 5 % de CO2 pendant 2 jours sans déranger les plaques.
- Rétablir la concentration des facteurs de croissance en ajoutant 10 ng/mL EFG et 10 ng/mL bFGF au média de culture cellulaire.
REMARQUE: Vous devez le faire tous les deux jours. - Incuber à 37 oC et 5 % de CO2 jusqu’à 5 jours après le placage (ce qui peut varier jusqu’à 12 jours) pour obtenir des sphères qui présentent la morphologie des colonies cellulaires en forme de boule de suspension.
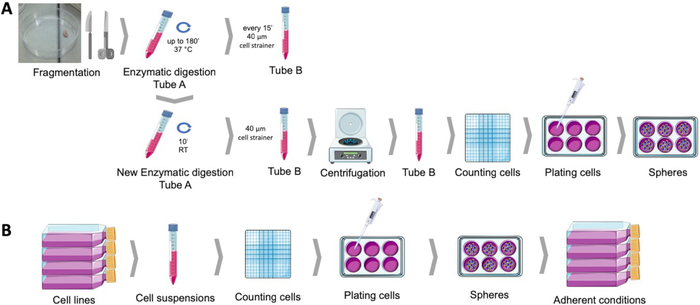
Figure 1 : Obtenir des cellules souches cancéreuses à partir d’échantillons de tumeurs endométriales humaines (A) et de lignées de cellules cancéreuses du sein et gynécologiques (B). Les échantillons humains de tumeur sont fragmentés, enzymatiquement digérés et plaqués dans le milieu de culture de sphère dans les plats enduits poly-HEMA. Les lignées de cellules cancéreuses sont détachées, les suspensions cellulaires sont comptées et les cellules individuelles sont distribuées à faible densité dans des plaques enduites de poly-HEMA dans des conditions appropriées. Les sphères obtenues, lorsqu’elles sont placées dans des conditions de culture adhérentes, produisent des populations adhérentes dérivées. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
3. Capacité de formation de sphère, auto-renouvellement, et zone de projection de sphère
REMARQUE : La capacité de formation de sphère est la capacité d’une population de cellules tumorales à produire des sphères. L’auto-renouvellement est la capacité des cellules de sphère à produire de nouvelles colonies de cellules sphériques en suspension. La zone de projection de sphère est représentative de la zone occupée par la sphère et donc expressive de leur taille et du nombre de divisions cellulaires subies dans une certaine période de temps.
- Détermination de la capacité de formation de sphères
- Après l’achèvement du protocole de formation de sphère, recueillir les sphères dans un tube de centrifugeuse et une centrifugeuse à 125 x g pendant 5 min.
- Jetez le SCM et suspendez délicatement la pastille dans un volume connu de supports frais. Dans le but de concentrer les sphères pour faciliter le comptage, suspendre les sphères dans un petit volume de médias. Veillez à ne pas déranger les sphères.
- Utilisez un hémocytomètre pour compter les sphères de plus de 40 m de diamètre. Alternativement, les sphères peuvent être comptées directement sur la plaque à l’aide d’un microscope équipé d’un graticule25 ou à l’aide d’un système automatisé26,27.
- Calculer le rapport de pourcentage des sphères obtenues par rapport au nombre de cellules initialement plaquées.
- Déterminer l’auto-renouvellement
- Après l’achèvement du protocole de formation de sphère, recueillir les sphères dans un tube de centrifugeuse et une centrifugeuse à 125 x g pendant 5 min.
- Jetez la sphère de culture des médias et suspendez doucement la pastille dans trypsin-EDTA.
- Incuber jusqu’à 5 min à 37 oC.
- Ajouter le support d’inactivation enzymatique et la pipette de haut en bas pour assurer une suspension à cellule unique.
- À l’aide d’un hémocytomètre et de la méthode d’exclusion bleue trypan, compter les cellules viables dans la suspension.
- Initier le protocole de formation de sphère tel que décrit à la section 1.
- Après 8 jours, utilisez un hémocytomètre pour compter les sphères de plus de 40 m de diamètre.
- Calculer le rapport de pourcentage des sphères obtenues par rapport au nombre de cellules initialement plaquées.
- Détermination de la zone de projection de sphère
- Pour évaluer la zone occupée par les sphères, obtenir des images d’au moins 10 champs aléatoires par condition, dans un microscope inversé équipé d’un module d’acquisition d’images. Un grossissement de 100X à 400X est recommandé.
- Analyser les images à l’aide d’un logiciel d’imagerie, tel que le logiciel ImageJ28, en dessinant des zones d’intérêt correspondant aux sphères et en mesurant sa zone en pixels.
- Calculer la zone de projection de sphère comme la zone moyenne des pixels mesurées.
4. Évaluation des marqueurs de cellules souches cancéreuses avec Cytométrie de flux
REMARQUE : CD44etCD24-/faible phénotype était constamment associé aux cellules souches du cancer du sein et gynécologiques. La procédure décrite peut être utilisée pour évaluer ceci et d’autres marqueurs de surface de cellules.
- Après l’achèvement du protocole de formation de sphère, recueillir les sphères dans un tube de centrifugeuse et une centrifugeuse à 125 x g pendant 5 min.
- Jetez le SCM et suspendez délicatement la pastille dans trypsin-EDTA.
- Incuber jusqu’à 5 min à 37 oC.
- Ajouter le support d’inactivation enzymatique et la pipette de haut en bas pour assurer une suspension à cellule unique.
- Centrifugeuse à 125 x g pendant 5 min, jetez le supernatant et suspendez délicatement les cellules en PBS.
- Laisser reposer les cellules en suspension pendant 30 min pour assurer la récupération de la conformation de la membrane.
- À l’aide d’un hémocytomètre et de la méthode d’exclusion bleue trypan, compter les cellules dans la suspension.
- Ajuster le volume de suspension cellulaire à 106 cellules/500 l.
- Incuber avec les anticorps monoclonaux selon les instructions des fournisseurs (concentration, temps, température et lumière/obscurité) et considérer l’ensemble d’expériences représenté dans le tableau 2 ou les marqueurs donnés dans le tableau 1.
- Immédiatement après la coloration, effectuez l’analyse cytométrique de flux à l’aide d’un cytomètre de débit avec des modules de détection appropriés.
- Standardisez la configuration des cytomètres, suivant les protocoles établis par l’EuroFlow Consortium29.
- Installez des portes primaires en fonction de la diffusion vers l’avant et latérale à l’exclusion des débris et des cellules mortes. Ceci peut être amélioré par l’étiquetage concomitant avec l’annexin ecinvou v et les cellules négatives de gating.
- Définir des barrières de fluorescence en fonction des échantillons non tachés et la compensation d’un chevauchement spectral à l’aide de commandes tachées uniques.
5. Évaluation des marqueurs de cellules souches cancéreuses avec Western Blot
REMARQUE : En plus de l’activité d’ALDH1, l’expression élevée de ce marqueur a été uniformément associée aux cellules souches de cancer de sein etgynécologique13,14. La procédure décrite peut être utilisée pour évaluer ceci et d’autres marqueurs cellulaires.
- Après l’achèvement du protocole de formation de sphère, recueillir les sphères dans un tube de centrifugeuse et une centrifugeuse à 125 x g pendant 5 min.
- Préparation de l’ensemble de la cellule lysates
- Placer les tubes de centrifugeuse sur la glace et jeter le supernatant sans perturber la pastille.
- Laver la pastille avec 1 ml de PBS froid et jeter par centrifugation.
- Suspendre la pastille dans un petit volume (200-500 l) de tampon de lyse RIPA30 (NaCl 150 mM, Tris-HCl 1.50 mM pH 7.4, Triton-X100 1% vol./vol., sodium deoxyclic acid 0.5% wt./vol., sodium dodecyl sulfate 0.5% wt./vol.) complété avec cOmplete Mini et dithiothreitol 1 mM.
- Maintenir les échantillons froids (sur la glace), les soumettre au vortex et à la sonication avec une amplitude de 30%.
- Centrifuger les échantillons pendant 15 min à 14 000 x g dans une centrifugeuse réfrigérée fixée à 4 oC.
- Transférez les supernatants vers de nouveaux microtubes bien identifiés.
- Déterminer les concentrations protéiques à l’aide des tests BCA ou Bradford31.
- Si nécessaire, entreposer les échantillons à -80 oC jusqu’à ce qu’une analyse plus poussée de la tache occidentale soit effectuée.
- Effectuer la dénaturation de l’échantillon, l’électrophorèse, le transfert d’électrons et la détection des protéines selon les protocoles occidentaux standard de blotting, comme décrit32,33,34.
Résultats
Le protocole de formation de sphère permet d’obtenir des colonies sphériques en suspension à partir de plusieurs lignées cellulaires de l’endomètre et du cancer du sein (figure 2A) ou après une digestion enzymatique douce des tissus provenant d’échantillons de tumeurs humaines (Figure 2E). Dans les deux cas, quelques jours après le placage, des colonies sphériques monoclonales en suspension sont obtenues. Les sph?...
Discussion
Ce protocole détaille une approche pour obtenir des tumorspheres des lignées de cellules cancéreuses et des échantillons humains primaires. Les tumorsphères sont enrichies dans une sous-population avec des propriétés de cellules souches36. Cet enrichissement au SCC dépend de la viabilité dans un environnement sans ancrage alors que les cellules différenciées dépendent de l’adhérence à un substrat37. Comme le placage primaire des cellules tumorales dans un en...
Déclarations de divulgation
Les auteurs n’ont rien à révéler.
Remerciements
Cette étude a été financée par la Société portugaise de gynécologie par le Prix de recherche 2016 et par CIMAGO. Cnc. L’IBILI est soutenue par la Fondation pour la science et la technologie, Portugal (UID/NEU/04539/2013), et cofinancée par FEDER-COMPETE (POCI-01-01-0145-FEDER-007440). La Banque de tumeurs de l’Hôpital et du Centre Universitaire de Coimbra (CHUC), agréée par le Comité d’éthique de la santé du CHUC et par la Commission nationale portugaise de protection des données, a été la source d’échantillons d’endomètre de patients suivis au Service de gynécologie de l’établissement. Figure 1 a été produite à l’aide de Servier Medical Art, disponible à partir de www.servier.com.
matériels
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Merck Millipore | 100983 | |
| Accutase | Gibco | A1110501 | StemPro Accutas Cell Dissociation Reagent |
| ALDH antibody | Santa Cruz Biotechnology | SC166362 | |
| Annexin V FITC | BD Biosciences | 556547 | |
| Antibiotic antimycotic solution | Sigma | A5955 | |
| BCA assay | Thermo Scientific | 23225 | Pierce BCA Protein Assay Kit |
| Bovine serum albumin | Sigma | A9418 | |
| CD133 antibody | Miteny Biotec | 293C3-APC | Allophycocyanin (APC) |
| CD24 antibody | BD Biosciences | 658331 | Allophycocyanin-H7 (APC-H7) |
| CD44 antibody | Biolegend | 103020 | Pacific Blue (PB) |
| Cell strainer | BD Falcon | 352340 | 40 µM |
| Collagenase, type IV | Gibco | 17104-019 | |
| cOmplete Mini | Roche | 118 361 700 0 | |
| Dithiothreitol | Sigma | 43815 | |
| DMEM-F12 | Sigma | D8900 | |
| DNAse I | Roche | 11284932001 | |
| ECC-1 | ATCC | CRL-2923 | Human endometrium adenocarcinoma cell line |
| Epidermal growth factor | Sigma | E9644 | |
| Fibroblast growth factor basic | Sigma | F0291 | |
| Haemocytometer | VWR | HERE1080339 | |
| HCC1806 | ATCC | CRL-2335 | Human mammary squamous cell carcinoma cell line |
| Insulin, transferrin, selenium Solution | Gibco | 41400045 | |
| MCF7 | ATCC | HTB-22 | Human mammary adenocarcinoma cell line |
| Methylcellulose | AlfaAesar | 45490 | |
| NaCl | JMGS | 37040005002212 | |
| Poly(2-hydroxyethyl-methacrylate | Sigma | P3932 | |
| Putrescine | Sigma | P7505 | |
| RL95-2 | ATCC | CRL-1671 | Human endometrium carcinoma cell line |
| Sodium deoxycholic acid | JMS | EINECS 206-132-7 | |
| Sodium dodecyl sulfate | Sigma | 436143 | |
| Tris | JMGS | 20360000BP152112 | |
| Triton-X 100 | Merck | 108603 | |
| Trypan blue | Sigma | T8154 | |
| Trypsin-EDTA | Sigma | T4049 | |
| ß-actin antibody | Sigma | A5316 |
Références
- Hardin, H., Zhang, R., Helein, H., Buehler, D., Guo, Z., Lloyd, R. V. The evolving concept of cancer stem-like cells in thyroid cancer and other solid tumors. Laboratory Investigation. 97 (10), 1142 (2017).
- Plaks, V., Kong, N., Werb, Z. The Cancer Stem Cell Niche: How Essential Is the Niche in Regulating Stemness of Tumor Cells?. Cell Stem Cell. 16 (3), 225-238 (2015).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells in solid tumours accumulating evidence and unresolved questions. Nature reviews. Cancer. 8, 755-768 (2008).
- Allegra, A., et al. The Cancer Stem Cell Hypothesis: A Guide to Potential Molecular Targets. Cancer Investigation. 32 (9), 470-495 (2014).
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proceedings of the National Academy of Sciences. 100 (7), 3983-3988 (2003).
- Friel, A. M., et al. Functional analyses of the cancer stem cell-like properties of human endometrial tumor initiating cells. Cell Cycle. 7 (2), 242-249 (2008).
- Zhang, S., et al. Identification and Characterization of Ovarian Cancer-Initiating Cells from Primary Human Tumors. Cancer Research. 68 (11), 4311-4320 (2008).
- Bapat, S. A., Mali, A. M., Koppikar, C. B., Kurrey, N. K. Stem and progenitor-like cells contribute to the aggressive behavior of human epithelial ovarian cancer. Cancer research. 65 (8), 3025-3029 (2005).
- Carvalho, M. J., Laranjo, M., Abrantes, A. M., Torgal, I., Botelho, M. F., Oliveira, C. F. Clinical translation for endometrial cancer stem cells hypothesis. Cancer and Metastasis Reviews. 34 (3), 401-416 (2015).
- Morel, A. P., Lièvre, M., Thomas, C., Hinkal, G., Ansieau, S., Puisieux, A. Generation of Breast Cancer Stem Cells through Epithelial-Mesenchymal Transition. PLoS ONE. 3 (8), e2888 (2008).
- Tirino, V., et al. Cancer stem cells in solid tumors: an overview and new approaches for their isolation and characterization. The FASEB Journal. 27 (1), 13 (2013).
- Ajani, J. A., et al. ALDH-1 expression levels predict response or resistance to preoperative chemoradiation in resectable esophageal cancer patients. Molecular Oncology. 8 (1), 142-149 (2014).
- Carvalho, M. J., et al. Endometrial Cancer Spheres Show Cancer Stem Cells Phenotype and Preference for Oxidative Metabolism. Pathology and Oncology Research. , (2018).
- Laranjo, M., et al. Mammospheres of hormonal receptor positive breast cancer diverge to triple-negative phenotype. The Breast. 38, 22-29 (2018).
- Cui, M., et al. Non-Coding RNA Pvt1 Promotes Cancer Stem Cell–Like Traits in Nasopharyngeal Cancer via Inhibiting miR-1207. Pathology & Oncology Research. , (2018).
- Deng, S., et al. Distinct expression levels and patterns of stem cell marker, aldehyde dehydrogenase isoform 1 ALDH1), in human epithelial cancers. PloS one. 5 (4), e10277 (2010).
- Weiswald, L. B., Guinebretière, J. M., Richon, S., Bellet, D., Saubaméa, B., Dangles-Marie, V. In situ protein expression in tumour spheres: development of an immunostaining protocol for confocal microscopy. BMC Cancer. 10 (1), 106 (2010).
- Weiswald, L. B., Bellet, D., Dangles-Marie, V. Spherical Cancer Models in Tumor Biology. Neoplasia. 17 (1), 1-15 (2015).
- Picon-Ruiz, M., et al. Low adherent cancer cell subpopulations are enriched in tumorigenic and metastatic epithelial-to-mesenchymal transition-induced cancer stem-like cells. Scientific Reports. 6 (1), 1-13 (2016).
- Dontu, G., et al. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells. Genes & development. 17 (10), 1253-1270 (2003).
- Ballout, F., et al. Sphere-Formation Assay: Three-Dimensional in vitro Culturing of Prostate Cancer Stem/Progenitor Sphere-Forming Cells. Frontiers in Oncology. 8 (August), 1-14 (2018).
- Ishiguro, T., Ohata, H., Sato, A., Yamawaki, K., Enomoto, T., Okamoto, K. Tumor-derived spheroids: Relevance to cancer stem cells and clinical applications. Cancer Science. 108 (3), 283-289 (2017).
- Noseda, M., Nasatto, P., Silveira, J., Pignon, F., Rinaudo, M., Duarte, M. Methylcellulose, a Cellulose Derivative with Original Physical Properties and Extended Applications. Polymers. 7 (5), 777-803 (2015).
- Shaw, F. L., et al. A detailed mammosphere assay protocol for the quantification of breast stem cell activity. Journal of Mammary Gland Biology and Neoplasia. 17 (2), 111-117 (2012).
- Zhou, M., et al. LncRNA-Hh Strengthen Cancer Stem Cells Generation in Twist-Positive Breast Cancer via Activation of Hedgehog Signaling Pathway. Stem cells (Dayton, Ohio). 34 (1), 55-66 (2016).
- Ha, J. R., et al. Integration of Distinct ShcA Signaling Complexes Promotes Breast Tumor Growth and Tyrosine Kinase Inhibitor Resistance. Molecular cancer research MCR. 16 (5), 894-908 (2018).
- Jurmeister, S., et al. Identification of potential therapeutic targets in prostate cancer through a cross-species approach. EMBO molecular medicine. 10 (3), (2018).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature methods. 9 (7), 671-675 (2012).
- Kalina, T., et al. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols. Leukemia. 26 (9), 1986-2010 (2012).
- Peach, M., Marsh, N., Miskiewicz, E. I., MacPhee, D. J. . Solubilization of Proteins: The Importance of Lysis Buffer Choice. , 49-60 (2015).
- Olson, B. J. S. C. Assays for Determination of Protein Concentration. Current Protocols in Pharmacology. , A.3A.1-A.3A.32 (2016).
- Eslami, A., Lujan, J. Western Blotting: Sample Preparation to Detection. Journal of Visualized Experiments. (44), 1-2 (2010).
- Silva, J. M., McMahon, M. The Fastest Western in Town: A Contemporary Twist on the Classic Western Blot Analysis. Journal of Visualized Experiments. 84 (84), 1-8 (2014).
- Oldknow, K. J., et al. A Guide to Modern Quantitative Fluorescent Western Blotting with Troubleshooting Strategies. Journal of Visualized Experiments. 8 (93), 1-10 (2014).
- Serambeque, B. . Células estaminais do cancro do endométrio - a chave para o tratamento personalizado? [Stem Cells of Endometrial Cancer: The Key to Personalized Treatment?]. , (2018).
- Lee, C. H., Yu, C. C., Wang, B. Y., Chang, W. W. Tumorsphere as an effective in vitro platform for screening anti-cancer stem cell drugs. Oncotarget. 7 (2), (2015).
- De Luca, A., et al. Mitochondrial biogenesis is required for the anchorage-independent survival and propagation of stem-like cancer cells. Oncotarget. 6 (17), (2015).
- Masuda, A., et al. An improved method for isolation of epithelial and stromal cells from the human endometrium. Journal of Reproduction and Development. 62 (2), 213-218 (2016).
- Del Rio-Tsonis, K., et al. Facile isolation and the characterization of human retinal stem cells. Proceedings of the National Academy of Sciences. 101 (44), 15772-15777 (2004).
- Wang, L., Guo, H., Lin, C., Yang, L., Wang, X. I. Enrichment and characterization of cancer stem-like cells from a cervical cancer cell line. Molecular Medicine Reports. 9 (6), 2117-2123 (2014).
- Chen, Y. C., et al. High-throughput single-cell derived sphere formation for cancer stem-like cell identification and analysis. Scientific Reports. 6 (April), 1-12 (2016).
- Kim, J., Jung, J., Lee, S. J., Lee, J. S., Park, M. J. Cancer stem-like cells persist in established cell lines through autocrine activation of EGFR signaling. Oncology Letters. 3 (3), 607-612 (2012).
- Hwang-Verslues, W. W., et al. Multiple Lineages of Human Breast Cancer Stem/Progenitor Cells Identified by Profiling with Stem Cell Markers. PloS one. 4 (12), e8377 (2009).
- Feng, Y., et al. Metformin reverses stem cell-like HepG2 sphere formation and resistance to sorafenib by attenuating epithelial-mesenchymal transformation. Molecular Medicine Reports. 18 (4), 3866-3872 (2018).
- Wang, H., Paczulla, A., Lengerke, C. Evaluation of Stem Cell Properties in Human Ovarian Carcinoma Cells Using Multi and Single Cell-based Spheres Assays. Journal of Visualized Experiments. (95), 1-11 (2015).
- Stebbing, J., Lombardo, Y., Coombes, C. R., de Giorgio, A., Castellano, L. Mammosphere Formation Assay from Human Breast Cancer Tissues and Cell Lines. Journal of Visualized Experiments. (97), 1-5 (2015).
- Zhao, H., et al. Sphere-forming assay vs. organoid culture: Determining long-term stemness and the chemoresistant capacity of primary colorectal cancer cells. International Journal of Oncology. 54 (3), 893-904 (2019).
- Bagheri, V., et al. Isolation and identification of chemotherapy-enriched sphere-forming cells from a patient with gastric cancer. Journal of Cellular Physiology. 233 (10), 7036-7046 (2018).
- Kaowinn, S., Kaewpiboon, C., Koh, S., Kramer, O., Chung, Y. STAT1-HDAC4 signaling induces epithelial-mesenchymal transition and sphere formation of cancer cells overexpressing the oncogene, CUG2. Oncology Reports. , 2619-2627 (2018).
- Lonardo, E., Cioffi, M., Sancho, P., Crusz, S., Heeschen, C. Studying Pancreatic Cancer Stem Cell Characteristics for Developing New Treatment Strategies. Journal of Visualized Experiments. (100), 1-9 (2015).
- Lu, H., et al. Targeting cancer stem cell signature gene SMOC-2 Overcomes chemoresistance and inhibits cell proliferation of endometrial carcinoma. EBioMedicine. 40, 276-289 (2019).
- Bu, P., Chen, K. Y., Lipkin, S. M., Shen, X. Asymmetric division: a marker for cancer stem cells. Oncotarget. 4 (7), (2013).
- Islam, F., Qiao, B., Smith, R. A., Gopalan, V., Lam, A. K. Y. Cancer stem cell: fundamental experimental pathological concepts and updates. Experimental and molecular pathology. 98 (2), 184-191 (2015).
- Liu, W., et al. Comparative characterization of stem cell marker expression, metabolic activity and resistance to doxorubicin in adherent and spheroid cells derived from the canine prostate adenocarcinoma cell line CT1258. Anticancer research. 35 (4), 1917-1927 (2015).
- Broadley, K. W. R., et al. Side Population is Not Necessary or Sufficient for a Cancer Stem Cell Phenotype in Glioblastoma Multiforme. STEM CELLS. 29 (3), 452-461 (2011).
- Cojoc, M., Mäbert, K., Muders, M. H., Dubrovska, A. A role for cancer stem cells in therapy resistance: Cellular and molecular mechanisms. Seminars in Cancer Biology. 31, 16-27 (2015).
- Batlle, E., Clevers, H. Cancer stem cells revisited. Nature Medicine. 23 (10), 1124-1134 (2017).
- Zhang, X. L., Jia, Q., Lv, L., Deng, T., Gao, J. Tumorspheres Derived from HCC Cells are Enriched with Cancer Stem Cell-like Cells and Present High Chemoresistance Dependent on the Akt Pathway. Anti-cancer agents in medicinal chemistry. 15 (6), 755-763 (2015).
- Fukamachi, H., et al. CD49fhigh Cells Retain Sphere-Forming and Tumor-Initiating Activities in Human Gastric Tumors. PLoS ONE. 8 (8), e72438 (2013).
- Gao, M. Q., Choi, Y. P., Kang, S., Youn, J. H., Cho, N. H. CD24+ cells from hierarchically organized ovarian cancer are enriched in cancer stem cells. Oncogene. 29 (18), 2672-2680 (2010).
- Cariati, M., et al. Alpha-6 integrin is necessary for the tumourigenicity of a stem cell-like subpopulation within the MCF7 breast cancer cell line. International Journal of Cancer. 122 (2), 298-304 (2008).
- López, J., Valdez-Morales, F. J., Benítez-Bribiesca, L., Cerbón, M., Carrancá, A. Normal and cancer stem cells of the human female reproductive system. Reproductive Biology and Endocrinology. 11 (1), 53 (2013).
- Alvero, A. B., et al. Molecular phenotyping of human ovarian cancer stem cells unravels the mechanisms for repair and chemoresistance. Cell Cycle. 8 (1), 158-166 (2009).
- Charafe-Jauffret, E., Ginestier, C., Birnbaum, D. Breast cancer stem cells: tools and models to rely on. BMC Cancer. 9 (1), 202 (2009).
- Leccia, F., et al. ABCG2, a novel antigen to sort luminal progenitors of BRCA1- breast cancer cells. Molecular Cancer. 13 (1), 213 (2014).
- Croker, A. K., Allan, A. L. Inhibition of aldehyde dehydrogenase (ALDH) activity reduces chemotherapy and radiation resistance of stem-like ALDHhiCD44+ human breast cancer cells. Breast Cancer Research and Treatment. 133 (1), 75-87 (2012).
- Sun, M., et al. Enhanced efficacy of chemotherapy for breast cancer stem cells by simultaneous suppression of multidrug resistance and antiapoptotic cellular defense. Acta Biomaterialia. 28, 171-182 (2015).
- Shao, J., Fan, W., Ma, B., Wu, Y. Breast cancer stem cells expressing different stem cell markers exhibit distinct biological characteristics. Molecular Medicine Reports. 14 (6), 4991-4998 (2016).
- Croker, A. K., et al. High aldehyde dehydrogenase and expression of cancer stem cell markers selects for breast cancer cells with enhanced malignant and metastatic ability. Journal of Cellular and Molecular Medicine. 13 (8b), 2236-2252 (2009).
- Cheung, S. K. C., et al. Stage-specific embryonic antigen-3 (SSEA-3) and β3GalT5 are cancer specific and significant markers for breast cancer stem cells. Proceedings of the National Academy of Sciences. 113 (4), 960-965 (2016).
- Meyer, M. J., Fleming, J. M., Lin, A. F., Hussnain, S. A., Ginsburg, E., Vonderhaar, B. K. CD44 pos CD49f hi CD133/2 hi Defines Xenograft-Initiating Cells in Estrogen Receptor–Negative Breast Cancer. Cancer Research. 70 (11), 4624-4633 (2010).
- Ahn, S. M., Goode, R. J. A., Simpson, R. J. Stem cell markers: Insights from membrane proteomics?. PROTEOMICS. 8 (23-24), 4946-4957 (2008).
- Chefetz, I., et al. TLR2 enhances ovarian cancer stem cell self-renewal and promotes tumor repair and recurrence. Cell Cycle. 12 (3), 511-521 (2013).
- Alvero, A. B., et al. Stem-Like Ovarian Cancer Cells Can Serve as Tumor Vascular Progenitors. Stem Cells. 27 (10), 2405-2413 (2009).
- Yin, G., et al. Constitutive proteasomal degradation of TWIST-1 in epithelial–ovarian cancer stem cells impacts differentiation and metastatic potential. Oncogene. 32 (1), 39-49 (2013).
- Wei, X., et al. Mullerian inhibiting substance preferentially inhibits stem/progenitors in human ovarian cancer cell lines compared with chemotherapeutics. Proceedings of the National Academy of Sciences. 107 (44), 18874-18879 (2010).
- Meirelles, K., et al. Human ovarian cancer stem/progenitor cells are stimulated by doxorubicin but inhibited by Mullerian inhibiting substance. Proceedings of the National Academy of Sciences. 109 (7), 2358-2363 (2012).
- Shi, M. F., et al. Identification of cancer stem cell-like cells from human epithelial ovarian carcinoma cell line. Cellular and Molecular Life Sciences. 67 (22), 3915-3925 (2010).
- Meng, E., et al. CD44+/CD24− ovarian cancer cells demonstrate cancer stem cell properties and correlate to survival. Clinical & Experimental Metastasis. 29 (8), 939-948 (2012).
- Witt, A. E., et al. Identification of a cancer stem cell-specific function for the histone deacetylases, HDAC1 and HDAC7, in breast and ovarian. Oncogene. 36 (12), 1707-1720 (2017).
- Wu, H., Zhang, J., Shi, H. Expression of cancer stem markers could be influenced by silencing of p16 gene in HeLa cervical carcinoma cells. European journal of gynaecological oncology. 37 (2), 221-225 (2016).
- Huang, R., Rofstad, E. K. Cancer stem cells (CSCs), cervical CSCs and targeted therapies. Oncotarget. 8 (21), 35351-35367 (2017).
- Zhang, X., et al. Imatinib sensitizes endometrial cancer cells to cisplatin by targeting CD117-positive growth-competent cells. Cancer Letters. 345 (1), 106-114 (2014).
- Luo, L., et al. Ovarian cancer cells with the CD117 phenotype are highly tumorigenic and are related to chemotherapy outcome. Experimental and Molecular Pathology. 91 (2), 596-602 (2011).
- Zhao, P., Lu, Y., Jiang, X., Li, X. Clinicopathological significance and prognostic value of CD133 expression in triple-negative breast carcinoma. Cancer Science. 102 (5), 1107-1111 (2011).
- Ferrandina, G., et al. Expression of CD133-1 and CD133-2 in ovarian cancer. International Journal of Gynecologic Cancer. 18 (3), 506-514 (2008).
- Rutella, S., et al. Cells with characteristics of cancer stem/progenitor cells express the CD133 antigen in human endometrial tumors. Clinical cancer research an official journal of the American Association for Cancer Research. 15 (13), 4299-4311 (2009).
- Friel, A. M., et al. Epigenetic regulation of CD133 and tumorigenicity of CD133 positive and negative endometrial cancer cells. Reproductive Biology and Endocrinology. 8 (1), 147 (2010).
- Nakamura, M., et al. Prognostic impact of CD133 expression as a tumor-initiating cell marker in endometrial cancer. Human Pathology. 41 (11), 1516-1529 (2010).
- Saha, S. K., et al. KRT19 directly interacts with β-catenin/RAC1 complex to regulate NUMB-dependent NOTCH signaling pathway and breast cancer properties. Oncogene. 36 (3), 332-349 (2017).
- LV, X., Wang, Y., Song, Y., Pang, X., Li, H. Association between ALDH1+/CD133+ stem-like cells and tumor angiogenesis in invasive ductal breast carcinoma. Oncology Letters. 11 (3), 1750-1756 (2016).
- Ruscito, I., et al. Exploring the clonal evolution of CD133/aldehyde-dehydrogenase-1 (ALDH1)-positive cancer stem-like cells from primary to recurrent high-grade serous ovarian cancer (HGSOC). A study of the Ovarian Cancer Therapy–Innovative Models Prolong Survival (OCTIPS). European Journal of Cancer. 79, 214-225 (2017).
- Sun, Y., et al. Isolation of Stem-Like Cancer Cells in Primary Endometrial Cancer Using Cell Surface Markers CD133 and CXCR4. Translational Oncology. 10 (6), 976-987 (2017).
- Rahadiani, N., et al. Expression of aldehyde dehydrogenase 1 (ALDH1) in endometrioid adenocarcinoma and its clinical implications. Cancer Science. 102 (4), 903-908 (2011).
- Mamat, S., et al. Transcriptional Regulation of Aldehyde Dehydrogenase 1A1 Gene by Alternative Spliced Forms of Nuclear Factor Y in Tumorigenic Population of Endometrial Adenocarcinoma. Genes & Cancer. 2 (10), 979-984 (2011).
- Mukherjee, S. A., et al. Non-migratory tumorigenic intrinsic cancer stem cells ensure breast cancer metastasis by generation of CXCR4+ migrating cancer stem cells. Oncogene. 35 (37), 4937-4948 (2016).
- Lim, E., et al. Aberrant luminal progenitors as the candidate target population for basal tumor development in BRCA1 mutation carriers. Nature Medicine. 15 (8), 907-913 (2009).
- Liang, Y. J., et al. Interaction of glycosphingolipids GD3 and GD2 with growth factor receptors maintains breast cancer stem cell phenotype. Oncotarget. 8 (29), 47454-47473 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon