Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Beschaffung von Krebsstammzellkugeln aus gynäkologischen und Brustkrebstumoren
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Ziel dieser Methodik ist es, Krebsstammzellen (CSC) in Krebszelllinien und primären menschlichen Tumorproben mit dem kugelbildenden Protokoll auf robuste Weise zu identifizieren, wobei funktionelle Assays und phänotypische Charakterisierung mit Durchflusszytometrie und western Fleck.
Zusammenfassung
Krebsstammzellen (CSC) sind eine kleine Population mit Selbsterneuerung und Plastizität, die für Tumorgenese, Resistenz gegen Behandlung und wiederkehrende Krankheiten verantwortlich sind. Diese Grundgesamtheit kann durch Oberflächenmarker, enzymatische Aktivität und ein funktionelles Profil identifiziert werden. Diese Ansätze an sich sind aufgrund der phänotiver Heterogenität und CSC-Plastizität begrenzt. Hier aktualisieren wir das kugelbildende Protokoll, um CSC-Kugeln aus Brust- und gynäkologischen Krebsarten zu erhalten und funktionelle Eigenschaften, CSC-Marker und Proteinexpression zu bewerten. Die Kugeln werden mit einzelliger Aussaat bei geringer Dichte in Suspensionskultur unter Verwendung eines halbfesten Methylcellulosemediums gewonnen, um Migration und Aggregate zu vermeiden. Dieses profitable Protokoll kann in Krebszelllinien, aber auch in Primärtumoren verwendet werden. Die dreidimensionale nicht-haftende Suspensionskultur, die die Tumormikroumgebung, insbesondere die CSC-Nische, imitiert, wird durch einen epidermalen Wachstumsfaktor und einen grundlegenden Fibroblasten-Wachstumsfaktor ergänzt, um die CSC-Signalisierung zu gewährleisten. Mit dem Ziel einer robusten Identifizierung von CSC schlagen wir einen komplementären Ansatz vor, der funktionale und phänotypische Evaluierung kombiniert. Kugelbildende Kapazität, Selbsterneuerung und Kugelprojektionsfläche etablieren CSC-Funktionseigenschaften. Darüber hinaus umfasst die Charakterisierung die Flow-Zytometrie-Auswertung der Marker, dargestellt durch CD44+/CD24- und CD133 und Western Blot, unter Berücksichtigung von ALDH. Das vorgestellte Protokoll wurde auch für primäre Tumorproben optimiert, nach einem Probenverdauungsverfahren, das für die translationale Forschung nützlich ist.
Einleitung
Krebspopulationen sind heterogen, wobei Zellen aufgrund der differenziellen Genexpression unterschiedliche Morphologien, Proliferations- und Invasionsfähigkeit darstellen. Unter diesen Zellen existiert eine Minderheitspopulation namens Krebsstammzellen (CSC)1, die die Fähigkeit zur Selbsterneuerung haben, die Heterogenität der primären Tumornische rekapitulieren und abnorm differenzierende Vorläufer produzieren, die nicht angemessen auf homöostatische Kontrollen reagieren2. CSC-Eigenschaften können direkt in der klinischen Praxis übersetzt werden, da die Assoziation mit Ereignissen, wie Tumorigenität oder Resistenz gegen Chemotherapie3. Die Identifizierung von CSC kann zur Entwicklung gezielter Therapien führen, die die Blockade von Oberflächenmarkern, die Förderung der CSC-Differenzierung, die Blockierung von CSC-Signalwegkomponenten, Nischenzerstörung und epigenetische Mechanismen umfassen können4.
Die Isolierung von CSC wurde in Zelllinien und in Proben von Primärtumoren5,6,7,8durchgeführt. Das für CSC beschriebene funktionelle Profil umfasst clonogene Kapazität, Seitenpopulation und Tumorkugelbildung9. Der CD44high/CD24low phänotyp wurde konsequent mit Brust-CSC assoziiert, das sich in vivo als tumoriogen erwiesen hat und bereits mit epitheliadem zu mesenchymalem Übergang5,10assoziiert wurde. Hohe ALDH-Aktivität wurde auch mit Stammheit und epitheliale mesenchymale Minase (EMT) bei verschiedenen Arten von soliden Tumoren11assoziiert. Die ALDH-Expression wurde mit einer Resistenz gegen Chemotherapie und CSC-Phänotyp in vitro12,13,14,15,16assoziiert. Mehrere andere Marker wurden mit CSC-Eigenschaften in verschiedenen Tumorarten verknüpft, wie CD133, CD49f, ITGA6, CD1663,4 und andere, wie in Tabelle 1beschrieben.
Die Tumorsphären bestehen aus einem dreidimensionalen Modell für die Untersuchung und Expansion von CSC. In diesem Modell werden die Zellsuspensionen aus Zelllinien und aus Blut- oder Tumorproben in einem Medium kultiviert, das mit Wachstumsfaktoren ergänzt wird, nämlich epidermalem Wachstumsfaktor (EGF) und Basis-Fibroblasten-Wachstumsfaktor (bFGF), ohne fetales Rinderserum und unter nicht haftenden Bedingungen17. Hemmung der Zelladhäsion führt zum Tod durch Anoikis von differenzierten Zellen18. Kugeln werden aus dem klonalen Wachstum einer isolierten Zelle abgeleitet. Zu diesem Zweck werden die Zellen mit geringer Dichte verteilt, um Zellfusion und Aggregation zu vermeiden19. Eine weitere Strategie umfasst die Verwendung von halbkonsolidierter Methylcellulose20.
Das kugelbildende Protokoll gewann an Popularität in Derise und Erweiterung von CSC, aufgrund von Zeit und Kosten und technischen, profitablen und reproduzierbaren Gründen21,22. Trotz einiger Reserven, deren Ausmaß die Kugelbildung CSC widerspiegelt, besteht eine Neigung von Stammzellen, unter nicht anhaftenden Bedingungen mit dem charakteristischen Phänotyp zu wachsen, der der nativen Mikroumgebung ähnelt21. Keine der verfügbaren Methoden zur Isolierung von CSC von soliden Tumoren hat eine vollständige Effizienz, was die Bedeutung der Entwicklung spezifischerer Marker oder Kombinationen von Methoden und Markern unterstreicht.
In diesem Protokoll beschreiben wir die Isolierung von CSC mit dem kugelbildenden Protokoll, mit dem Prinzip des einzelzelligen Wachstums unter nicht haftenden Bedingungen und der Fähigkeit, einen differenzierten Phänotyp zu erzeugen. Eine schematische Darstellung dieser Prozedur ist in Abbildung 1dargestellt. Wir beschreiben auch die Charakterisierung mit Oberflächenmarkern und ALDH-Expression für CSC, sowohl für Brust- als auch für gynäkologische Tumorzellenlinien und Proben von Primärtumoren.
Protokoll
Dieses Protokoll wurde gemäß den ethischen Richtlinien der Tumorbank des Coimbra Hospital and Universitary Center (CHUC) durchgeführt und von der ChuC-Ethikkommission für Gesundheit und der portugiesischen Nationalen Datenschutzkommission genehmigt.
1. Sphere-forming Protocol und Derived Adherent Populations from Continuous Cell Cultures
HINWEIS: Führen Sie alle Verfahren unter strengen sterilen Bedingungen durch.
- Herstellung von nicht haftenden Suspensionskulturkolben oder Platten durch Beschichten der Wachstumsfläche mit Poly(2-Hydroxyethyl-Methacrylat (Poly-HEMA)
- Bereiten Sie eine 15 mg/ml-Lösung vor, indem Sie Poly-HEMA in absolutem Ethanol bei 65 °C rühren. Mantelzellkulturkolben oder Platten mit 50 l/cm2.
- Bei 37 °C im Trockenschrank trocknen lassen. Falls erforderlich, die Platten einwickeln und bei Raumtemperatur lagern.
- Vorbereitung der Kugelkultivierungsmedien (SCM)
- Eine 2%ige Methylcelluloselösung in Reinstwasser zubereiten und im Autoklaven sterilisieren. Methylcellulose ist tendenziell leichter durch Abkühlen zu verrechnen; Daher das Pulver in Wasser bei 80 °C verteilen und rühren, bisgekühlt 23.
- Bereiten Sie eine zweifache konzentrierte Lösung von SCM (Lagerlösung) vor. SCM Arbeitslösung enthält DMEM-F12, ergänzt mit 100 mM Putrescin, 1% Insulin, Transferrin, Selen und 1% antimykotische Lösung (10.000 U/ml Penicillin, 10 mg/ml Streptomycin und 25 g/ml Amphotericin B).
- Zur Herstellung des SCM gleiche Volumina der SCM-Lagerlösung mit der 2%-Lösung von Methylcellulose zu mischen.
- Vervollständigen Sie das Medium unmittelbar vor der Verwendung, indem Sie 10 ng/ml epidermalen Wachstumsfaktor (EFG) und 10 ng/ml Basis-Fibroblasten-Wachstumsfaktor (bFGF) hinzufügen.
- Wenn mehr straffzellige Zelllinien verwendet werden, ergänzen Sie das Medium mit 0,4% Rinderserumalbumin, was ein Vorteil sein könnte.
- Beginnen Sie mit einem Kolben von MCF7 oder HCC1806 Brustkrebs oder ECC-1 oder RL95-2 Endometriumkrebszellen (oder anderen Krebszellen der Wahl) mit 80% bis 90% Zusammenfluss.
- Entsorgen Sie die Zellkulturmedien, waschen Sie sie mit Phosphatgepufferter Salinelösung (PBS) und lösen Sie die Zellen mit Trypsin-EDTA (1 bis 2 ml für einen 75 cm2 Zellkulturkolben).
- Fügen Sie Zellkulturmedien (2 bis 4 ml für einen 75 cm2 Zellkulturkolben) und Zentrifugen bei 200 x g für 5 min hinzu, um Enzyme zu entsorgen.
- Setzen Sie das Pellet in einem bekannten Volumen von Zellkulturmedien und Pipetten nach oben und unten aus, um eine Einzelzellsuspension zu gewährleisten. Zu diesem Zweck kann ein 40-m-Zellsieb verwendet werden.
- Zählen Sie die Zellen im Hämozytometer und berechnen Sie die Zellkonzentration der Zellsuspension. Nutzen Sie diesen Schritt, um die Beobachtung einer Einzelzellsuspension sicherzustellen. Sorgfältige Zellzählung ist wichtig, um die Auswirkungen von Behandlungen genau zu quantifizieren.
- Setzen Sie die ermittelte Menge der Zellsuspension in SCM komplettes Medium und übertragen Sie auf poly-HEMA beschichtete Gerichte. Als Referenzwert für die Saatdichte betrachten Sie 500 bis 2000 Zellen/cm2.
HINWEIS: Die Optimierung der Saatdichte und Der Kulturzeit für jede Zelllinie wird sehr empfohlen24. - Bei 37 °C und 5%CO2 für 2 Tage inkubieren, ohne die Platten zu stören.
- Wiederherstellung der Konzentration von Wachstumsfaktoren durch Zugabe von 10 ng/mL EFG und 10 ng/mL bFGF zu den Zellkulturmedien. Wiederholen Sie diesen Schritt alle zwei Tage.
- Inkubieren Sie bei 37 °C und 5%CO2 bis 5 Tage nach der Beschichtung (dies kann je nach Zelllinie von 3 bis 12 Tagen variieren), um Kugeln zu erhalten, die die Morphologie von Suspensionskugel-förmigen Zellkolonien darstellen.
- Verwenden oder sammeln Sie die Kugeln, durch Pipettieren, für die Experimente.
- Um abgeleitete Anhängerpopulationen zu erhalten, platzieren Sie die Kugeln in Standardkulturbedingungen, bzw. der verwendeten Zelllinie. 1 bis 2 Tage später ist es möglich, eine Monoschicht von Zellen zu beobachten, die um anhängliche Sphären wachsen, was eine Morphologie ähnlich der Zelllinie des Ursprungs darstellt.
2. Kugelbildner-Protokoll aus menschlichen Tumorproben
HINWEIS: Die Verwendung menschlicher Proben zu Forschungszwecken muss den Rechtsvorschriften der einzelnen Länder entsprechen und von der Ethikkommission der beteiligten Institutionen genehmigt werden.
- Bereiten Sie die Transportmedien vor, die DMEM/F12 enthalten, ergänzt mit 10% fetalem Rinderserum (FBS) und 2% antimykotischer Lösung (10.000 U/ml Penicillin, 10 mg/ml Streptomycin und 25 g/ml Amphotericin B).
- Bereiten Sie die Verdauungsmedien mit DMEM/F12 vor, ergänzt mit 10% FBS, 1% antimykotischer Lösung, 1 mg/ml Typ IV Kollagenase und 100 g/ml DNAse I.
- Bereiten Sie das Enzym-Inaktivierungsmedium vor, das DMEM/F12 enthält, ergänzt durch 10% FBS und 1% antimykotische Lösung (10.000 U/ml Penicillin, 10 mg/ml Streptomycin und 25 g/ml Amphotericin B).
- Bereiten Sie den SCM wie in Abschnitt 1.2 beschrieben vor.
- Erhalten Sie die Probe während der makroskopischen Untersuchung des operativen Stückes so schnell wie möglich nach chirurgischer Entfernung.
- Legen Sie die Proben in Transportmedien und übertragen Sie sie an das Labor für die Verarbeitung. Die Probenverarbeitung sollte innerhalb von 1 h nach der Entnahme beginnen, um die Erfolgsrate des Verfahrens zu verbessern. Wenden Sie bei der Probensammlung Vorsicht walten. Behandeln Sie die Proben sorgfältig. Vermeiden Sie die Verwendung von nekrotischen oder kauterisierten Zonen.
- Unter der sterilen Durchflusskammer die Probe auf eine Schale geben und mit einem Skalpell in kleinere Stücke (ca. 1 mm3)schneiden.
- Inkubieren Sie das menschliche Gewebe in einem Rohr mit Verdauungsmedien in einem rotierenden Shaker bis zu 180 min bei 37 °C. Identifizieren Sie diese Röhre als Tube A.
- Ersetzen Sie die Enzymlösung alle 15 min.
- Sammeln Sie die Verdauungsmedien (ohne Gewebefragmente zu entfernen) und übertragen Sie es durch ein 40-m-Zellsieb auf eine neue Tube, die halb gefüllt mit Enzym-Inaktivierungsmedien ist. Bewahren Sie dieses Rohr bei Raumtemperatur auf und identifizieren Sie es als Tube B.
- Fügen Sie Tube A neue Verdauungsmedien hinzu und geben Sie sie bei 37 °C an den rotierenden Shaker zurück.
- Überprüfen Sie bei jeder Sammlung die Zelllebensfähigkeit mithilfe der Trypan-Blue-Ausschlussmethode.
- Wiederholen Sie diesen Vorgang für 180 min oder bis die Zellzahl deutlich niedriger ist.
- Inkubieren Sie die Gewebefragmente in Tube A in einer zweiten Verdauungslösung, die gleiche Teile von Accutase und Trypsin-EDTA enthält, unter Rühren für 10 min bei 37 °C.
- Fügen Sie das Enzym-Inaktivierungsmedium zu Tube A hinzu und filtern Sie den Inhalt durch ein 40-m-Zellsieb in Tube B.
- Zentrifugieren Sie die Zellsuspension in Tube B bei 200 x g für 10 min.
- Setzen Sie das Pellet im SCM aus und überprüfen Sie die Zellkonzentration mit einem Hämozytometer.
- Setzen Sie die ermittelte Menge der Zellsuspension in SCM aus und übertragen Sie sie auf poly-HEMA-beschichtete Schalen (siehe Schritt 1.1) mit einer Sädichte von 4000Zellen/cm2.
- Bei 37 °C und 5%CO2 für 2 Tage inkubieren, ohne die Platten zu stören.
- Wiederherstellung der Konzentration von Wachstumsfaktoren durch Zugabe von 10 ng/mL EFG und 10 ng/mL bFGF zu den Zellkulturmedien.
HINWEIS: Sie müssen dies alle zwei Tage tun. - Bei 37 °C und 5% CO2 bis 5 Tage nach der Beschichtung (dies kann bis zu 12 Tage variieren) zu brüten, um Kugeln zu erhalten, die die Morphologie von Suspensionskugel-förmigen Zellkolonien darstellen.
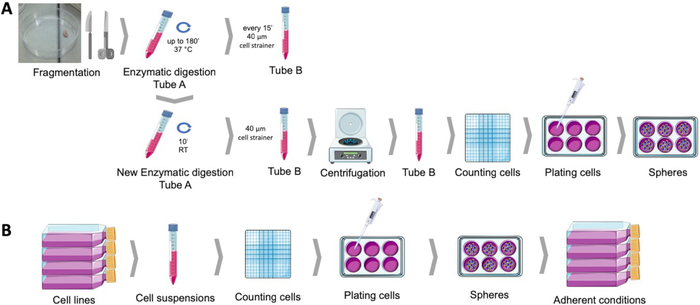
Abbildung 1: Gewinnung von Krebsstammzellen aus menschlichen Endometriumtumorproben (A) und Brust- und gynäkologischen Krebszelllinien (B). Menschliche Tumorproben werden fragmentiert, enzymatisch verdaut und in Kugelbaumittel zu poly-HEMA-beschichteten Schalen verfliegt. Krebszelllinien werden getrennt, Zellsuspensionen gezählt und einzelne Zellen werden bei geringer Dichte unter geeigneten Bedingungen in poly-HEMA-beschichtete Platten verteilt. Die erhaltenen Sphären, wenn sie unter anhaftenden Kulturbedingungen platziert werden, erzeugen abgeleitete Anhängerpopulationen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Kugelbildende Kapazität, Selbsterneuerung und Kugelprojektionsbereich
HINWEIS: Die kugelbildende Kapazität ist die Fähigkeit einer Tumorzellpopulation, Kugeln zu erzeugen. Selbsterneuerung ist die Fähigkeit von Kugelzellen, neue Kolonien von kugelförmigen Zellen in Suspension zu produzieren. Die Kugelprojektionsfläche ist repräsentativ für die von der Kugel besetzte Fläche und damit ausdrucksstark für ihre Größe und die Anzahl der Zellteilungen, die in einem bestimmten Zeitraum durchlaufen wurden.
- Bestimmung der kugelbildenden Kapazität
- Nach Abschluss des kugelbildenden Protokolls die Kugeln in einem Zentrifugenrohr und zentrifugieren bei 125 x g für 5 min sammeln.
- Entsorgen Sie den SCM und hängen Sie das Pellet vorsichtig in einem bekannten Volumen von frischen Medien aus. Mit dem Ziel, die Sphären zu konzentrieren, um das Zählen zu erleichtern, die Kugeln in einem kleinen Medienvolumen auszusetzen. Achten Sie darauf, die Kugeln nicht zu stören.
- Verwenden Sie ein Hämozytometer, um die Kugeln mit einem Durchmesser von mehr als 40 m zu zählen. Alternativ können Kugeln direkt auf der Platte gezählt werden, indem ein mikroskopisch mit einem Graticule25 oder mit einem automatisierten System26,27ausgestattet verwendet wird.
- Berechnen Sie das Prozentuale Verhältnis der erhaltenen Kugeln im Vergleich zur Anzahl der anfangs plattierten Zellen.
- Bestimmen der Selbsterneuerung
- Nach Abschluss des kugelbildenden Protokolls die Kugeln in einem Zentrifugenrohr und zentrifugieren bei 125 x g für 5 min sammeln.
- Entsorgen Sie die Kugelkultivierungsmedien und hängen Sie das Pellet vorsichtig in Trypsin-EDTA aus.
- Bis zu 5 min bei 37 °C inkubieren.
- Fügen Sie Enzyminaktivierungsmedien und Pipetten nach oben und unten hinzu, um eine Einzelzellsuspension zu gewährleisten.
- Mit einem Hämozytometer und der Trypan-Blau-Ausschlussmethode zählen Sie die lebensfähigen Zellen in der Suspension.
- Initiieren Sie das kugelbildende Protokoll, wie in Abschnitt 1 beschrieben.
- Verwenden Sie nach 8 Tagen ein Hämozytometer, um die Kugeln mit einem Durchmesser von mehr als 40 m zu zählen.
- Berechnen Sie das Prozentuale Verhältnis der erhaltenen Kugeln im Vergleich zur Anzahl der anfangs plattierten Zellen.
- Bestimmung der Kugelprojektionsfläche
- Um den von den Kugeln belegten Bereich auszuwerten, erhalten Sie Bilder von mindestens 10 zufälligen Feldern pro Zustand in einem invertierten Mikroskop, das mit einem Bildaufnahmemodul ausgestattet ist. Eine Vergrößerung von 100X bis 400X wird empfohlen.
- Analysieren Sie Bilder mit Bildgebungssoftware, wie z. B. ImageJ-Software28, indem Sie den Kugeln entsprechende Bereiche zeichnen und deren Fläche in Pixelmessen messen.
- Berechnen Sie die Kugelprojektionsfläche als durchschnittliche Fläche der gemessenen Pixel.
4. KrebsStammzellmarker-Bewertung mit Durchflusszytometrie
HINWEIS: CD44+/CD24-/low phänotyp wurde konsequent mit Brust- und gynäkologischen Krebsstammzellen assoziiert. Das beschriebene Verfahren kann verwendet werden, um diese und andere Zelloberflächenmarker auszuwerten.
- Nach Abschluss des kugelbildenden Protokolls die Kugeln in einem Zentrifugenrohr und zentrifugieren bei 125 x g für 5 min sammeln.
- Entsorgen Sie den SCM und hängen Sie das Pellet vorsichtig in Trypsin-EDTA aus.
- Bis zu 5 min bei 37 °C inkubieren.
- Fügen Sie Enzyminaktivierungsmedien und Pipetten nach oben und unten hinzu, um eine Einzelzellsuspension zu gewährleisten.
- Zentrifugieren Sie bei 125 x g für 5 min, entsorgen Sie den Überstand und hängen Sie die Zellen in PBS sanft aus.
- Lassen Sie die Zellen 30 min in Suspension ruhen, um die Rückgewinnung der Membrankonformation zu gewährleisten.
- Zählen Sie die Zellen in der Suspension mit einem Hämozytometer und der Trypan-Blau-Ausschlussmethode.
- Stellen Sie das Volumen der Zellsuspension auf 106 Zellen/500 l ein.
- Inkubieren Sie mit den monoklonalen Antikörpern gemäß den Anweisungen der Lieferanten (Konzentration, Zeit, Temperatur und Licht/Dunkel) und unter Berücksichtigung des in Tabelle 2 dargestellten Versuchssatzes oder der in Tabelle 1angegebenen Marker.
- Führen Sie unmittelbar nach der Färbung die zytometrische Durchflussanalyse mit einem Durchflusszytometer mit geeigneten Detektionsmodulen durch.
- Standardisieren Sie die Zytometer-Einrichtung nach Denkprotokollen des EuroFlow-Konsortiums29.
- Richten Sie primäre Tore basierend auf der vorwärts- und seitenstreuenden Basis ein, ausgenommen Schutt und abgestorbene Zellen. Dies kann durch die gleichzeitige Kennzeichnung mit Anhang V und das Gating negativer Zellen verbessert werden.
- Setzen Sie Fluoreszenztore basierend auf den ungefärbten Proben und kompensation für eine spektrale Überlappung mit einzelnen gebeizten Kontrollen.
5. Krebs Stammzell Marker Bewertung mit Western Blot
HINWEIS: Zusätzlich zur ALDH1-Aktivität wurde eine hohe Expression dieses Markers konsequent mit Brust- und gynäkologischen Krebsstammzellen13,14assoziiert. Das beschriebene Verfahren kann verwendet werden, um diese und andere Zellmarker auszuwerten.
- Nach Abschluss des kugelbildenden Protokolls die Kugeln in einem Zentrifugenrohr und zentrifugieren bei 125 x g für 5 min sammeln.
- Vorbereitung der gesamten Zelle lysiert
- Legen Sie die Zentrifugenrohre auf Eis und entsorgen Sie den Überstand, ohne das Pellet zu stören.
- Das Pellet mit 1 ml kaltem PBS waschen und durch Zentrifugation entsorgen.
- Setzen Sie das Pellet in einem kleinen Volumen (200-500 l) ripA-Lysepuffer30 (NaCl 150 mM, Tris-HCl 1,50 mM pH 7,4, Triton-X100 1% vol./vol., Natriumdesoxycholsäure 0,5% Wt./Vol., Natriumdodecylsulfat 0,5% Wt./Vol.) ergänzt mit cOmplete Mini und Dithiothreitol 1 mM.
- Halten Sie die Proben kalt (auf Eis), unterwerfen Sie sie Wirbel und Beschallung mit einer 30% Amplitude.
- Zentrifugieren Sie die Proben für 15 min bei 14.000 x g in einer auf 4 °C eingestellten gekühlten Zentrifuge.
- Übertragen Sie die Überräube auf neue, richtig identifizierte Mikroröhren.
- Bestimmen Sie die Proteinkonzentrationen mit den BCA- oder Bradford-Assays31.
- Bewahren Sie die Proben bei Bedarf bei -80 °C bis zur weiteren Western-Blot-Analyse auf.
- Durchführung von Probendenaturierung, Elektrophorese, Elektronentransfer und Proteindetektion nach Standard-Western-Blotting-Protokollen, wiebeschrieben 32,33,34.
Ergebnisse
Das kugelbildende Protokoll ermöglicht es, kugelförmige Kolonien in Suspension aus mehreren Endometrium- und Brustkrebszelllinien (Abbildung 2A) oder nach sanfter enzymatischer Vergärung von Gewebe aus menschlichen Tumorproben (Abbildung 2E) zu erhalten. In beiden Fällen werden einige Tage nach der Beschichtung monoklonale sphärische Kolonien in Suspension erhalten. Sowohl Endometrium- als auch Brustkrebssphären führen zu...
Diskussion
Dieses Protokoll beschreibt einen Ansatz zur Gewinnung von Tumorsphären aus Krebszelllinien und primären menschlichen Proben. Tumorsphären werden in einer Unterpopulation mit Stammzell-ähnlichen Eigenschaften angereichert36. Diese Anreicherung in CSC ist abhängig von der Lebensfähigkeit in einer ankerfreien Umgebung, während differenzierte Zellen auf die Haftung auf einem Substrat angewiesen sind37. Da die primäre Beschichtung von Tumorzellen in einer Umgebung mit g...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Studie wurde von der Portugiesischen Gesellschaft für Gynäkologie durch den Forschungspreis 2016 und von CIMAGO finanziert. Cnc. IBILI wird von der Foundation for Science and Technology, Portugal (UID/NEU/04539/2013) unterstützt und von FEDER-COMPETE (POCI-01-0145-FEDER-007440) kofinanziert. Die Tumorbank des Coimbra Hospital and Universitary Center (CHUC), die von der Ethikkommission für Gesundheit des CHUC und der portugiesischen Nationalen Datenschutzkommission genehmigt wurde, war die Quelle von Endometriumproben von Patienten, die beim Gynäkologiedienst der Einrichtung durchgeführt wurden. Abbildung 1 wurde mit Servier Medical Art erstellt, erhältlich bei www.servier.com.
Materialien
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Merck Millipore | 100983 | |
| Accutase | Gibco | A1110501 | StemPro Accutas Cell Dissociation Reagent |
| ALDH antibody | Santa Cruz Biotechnology | SC166362 | |
| Annexin V FITC | BD Biosciences | 556547 | |
| Antibiotic antimycotic solution | Sigma | A5955 | |
| BCA assay | Thermo Scientific | 23225 | Pierce BCA Protein Assay Kit |
| Bovine serum albumin | Sigma | A9418 | |
| CD133 antibody | Miteny Biotec | 293C3-APC | Allophycocyanin (APC) |
| CD24 antibody | BD Biosciences | 658331 | Allophycocyanin-H7 (APC-H7) |
| CD44 antibody | Biolegend | 103020 | Pacific Blue (PB) |
| Cell strainer | BD Falcon | 352340 | 40 µM |
| Collagenase, type IV | Gibco | 17104-019 | |
| cOmplete Mini | Roche | 118 361 700 0 | |
| Dithiothreitol | Sigma | 43815 | |
| DMEM-F12 | Sigma | D8900 | |
| DNAse I | Roche | 11284932001 | |
| ECC-1 | ATCC | CRL-2923 | Human endometrium adenocarcinoma cell line |
| Epidermal growth factor | Sigma | E9644 | |
| Fibroblast growth factor basic | Sigma | F0291 | |
| Haemocytometer | VWR | HERE1080339 | |
| HCC1806 | ATCC | CRL-2335 | Human mammary squamous cell carcinoma cell line |
| Insulin, transferrin, selenium Solution | Gibco | 41400045 | |
| MCF7 | ATCC | HTB-22 | Human mammary adenocarcinoma cell line |
| Methylcellulose | AlfaAesar | 45490 | |
| NaCl | JMGS | 37040005002212 | |
| Poly(2-hydroxyethyl-methacrylate | Sigma | P3932 | |
| Putrescine | Sigma | P7505 | |
| RL95-2 | ATCC | CRL-1671 | Human endometrium carcinoma cell line |
| Sodium deoxycholic acid | JMS | EINECS 206-132-7 | |
| Sodium dodecyl sulfate | Sigma | 436143 | |
| Tris | JMGS | 20360000BP152112 | |
| Triton-X 100 | Merck | 108603 | |
| Trypan blue | Sigma | T8154 | |
| Trypsin-EDTA | Sigma | T4049 | |
| ß-actin antibody | Sigma | A5316 |
Referenzen
- Hardin, H., Zhang, R., Helein, H., Buehler, D., Guo, Z., Lloyd, R. V. The evolving concept of cancer stem-like cells in thyroid cancer and other solid tumors. Laboratory Investigation. 97 (10), 1142 (2017).
- Plaks, V., Kong, N., Werb, Z. The Cancer Stem Cell Niche: How Essential Is the Niche in Regulating Stemness of Tumor Cells?. Cell Stem Cell. 16 (3), 225-238 (2015).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells in solid tumours accumulating evidence and unresolved questions. Nature reviews. Cancer. 8, 755-768 (2008).
- Allegra, A., et al. The Cancer Stem Cell Hypothesis: A Guide to Potential Molecular Targets. Cancer Investigation. 32 (9), 470-495 (2014).
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proceedings of the National Academy of Sciences. 100 (7), 3983-3988 (2003).
- Friel, A. M., et al. Functional analyses of the cancer stem cell-like properties of human endometrial tumor initiating cells. Cell Cycle. 7 (2), 242-249 (2008).
- Zhang, S., et al. Identification and Characterization of Ovarian Cancer-Initiating Cells from Primary Human Tumors. Cancer Research. 68 (11), 4311-4320 (2008).
- Bapat, S. A., Mali, A. M., Koppikar, C. B., Kurrey, N. K. Stem and progenitor-like cells contribute to the aggressive behavior of human epithelial ovarian cancer. Cancer research. 65 (8), 3025-3029 (2005).
- Carvalho, M. J., Laranjo, M., Abrantes, A. M., Torgal, I., Botelho, M. F., Oliveira, C. F. Clinical translation for endometrial cancer stem cells hypothesis. Cancer and Metastasis Reviews. 34 (3), 401-416 (2015).
- Morel, A. P., Lièvre, M., Thomas, C., Hinkal, G., Ansieau, S., Puisieux, A. Generation of Breast Cancer Stem Cells through Epithelial-Mesenchymal Transition. PLoS ONE. 3 (8), e2888 (2008).
- Tirino, V., et al. Cancer stem cells in solid tumors: an overview and new approaches for their isolation and characterization. The FASEB Journal. 27 (1), 13 (2013).
- Ajani, J. A., et al. ALDH-1 expression levels predict response or resistance to preoperative chemoradiation in resectable esophageal cancer patients. Molecular Oncology. 8 (1), 142-149 (2014).
- Carvalho, M. J., et al. Endometrial Cancer Spheres Show Cancer Stem Cells Phenotype and Preference for Oxidative Metabolism. Pathology and Oncology Research. , (2018).
- Laranjo, M., et al. Mammospheres of hormonal receptor positive breast cancer diverge to triple-negative phenotype. The Breast. 38, 22-29 (2018).
- Cui, M., et al. Non-Coding RNA Pvt1 Promotes Cancer Stem Cell–Like Traits in Nasopharyngeal Cancer via Inhibiting miR-1207. Pathology & Oncology Research. , (2018).
- Deng, S., et al. Distinct expression levels and patterns of stem cell marker, aldehyde dehydrogenase isoform 1 ALDH1), in human epithelial cancers. PloS one. 5 (4), e10277 (2010).
- Weiswald, L. B., Guinebretière, J. M., Richon, S., Bellet, D., Saubaméa, B., Dangles-Marie, V. In situ protein expression in tumour spheres: development of an immunostaining protocol for confocal microscopy. BMC Cancer. 10 (1), 106 (2010).
- Weiswald, L. B., Bellet, D., Dangles-Marie, V. Spherical Cancer Models in Tumor Biology. Neoplasia. 17 (1), 1-15 (2015).
- Picon-Ruiz, M., et al. Low adherent cancer cell subpopulations are enriched in tumorigenic and metastatic epithelial-to-mesenchymal transition-induced cancer stem-like cells. Scientific Reports. 6 (1), 1-13 (2016).
- Dontu, G., et al. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells. Genes & development. 17 (10), 1253-1270 (2003).
- Ballout, F., et al. Sphere-Formation Assay: Three-Dimensional in vitro Culturing of Prostate Cancer Stem/Progenitor Sphere-Forming Cells. Frontiers in Oncology. 8 (August), 1-14 (2018).
- Ishiguro, T., Ohata, H., Sato, A., Yamawaki, K., Enomoto, T., Okamoto, K. Tumor-derived spheroids: Relevance to cancer stem cells and clinical applications. Cancer Science. 108 (3), 283-289 (2017).
- Noseda, M., Nasatto, P., Silveira, J., Pignon, F., Rinaudo, M., Duarte, M. Methylcellulose, a Cellulose Derivative with Original Physical Properties and Extended Applications. Polymers. 7 (5), 777-803 (2015).
- Shaw, F. L., et al. A detailed mammosphere assay protocol for the quantification of breast stem cell activity. Journal of Mammary Gland Biology and Neoplasia. 17 (2), 111-117 (2012).
- Zhou, M., et al. LncRNA-Hh Strengthen Cancer Stem Cells Generation in Twist-Positive Breast Cancer via Activation of Hedgehog Signaling Pathway. Stem cells (Dayton, Ohio). 34 (1), 55-66 (2016).
- Ha, J. R., et al. Integration of Distinct ShcA Signaling Complexes Promotes Breast Tumor Growth and Tyrosine Kinase Inhibitor Resistance. Molecular cancer research MCR. 16 (5), 894-908 (2018).
- Jurmeister, S., et al. Identification of potential therapeutic targets in prostate cancer through a cross-species approach. EMBO molecular medicine. 10 (3), (2018).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature methods. 9 (7), 671-675 (2012).
- Kalina, T., et al. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols. Leukemia. 26 (9), 1986-2010 (2012).
- Peach, M., Marsh, N., Miskiewicz, E. I., MacPhee, D. J. . Solubilization of Proteins: The Importance of Lysis Buffer Choice. , 49-60 (2015).
- Olson, B. J. S. C. Assays for Determination of Protein Concentration. Current Protocols in Pharmacology. , A.3A.1-A.3A.32 (2016).
- Eslami, A., Lujan, J. Western Blotting: Sample Preparation to Detection. Journal of Visualized Experiments. (44), 1-2 (2010).
- Silva, J. M., McMahon, M. The Fastest Western in Town: A Contemporary Twist on the Classic Western Blot Analysis. Journal of Visualized Experiments. 84 (84), 1-8 (2014).
- Oldknow, K. J., et al. A Guide to Modern Quantitative Fluorescent Western Blotting with Troubleshooting Strategies. Journal of Visualized Experiments. 8 (93), 1-10 (2014).
- Serambeque, B. . Células estaminais do cancro do endométrio - a chave para o tratamento personalizado? [Stem Cells of Endometrial Cancer: The Key to Personalized Treatment?]. , (2018).
- Lee, C. H., Yu, C. C., Wang, B. Y., Chang, W. W. Tumorsphere as an effective in vitro platform for screening anti-cancer stem cell drugs. Oncotarget. 7 (2), (2015).
- De Luca, A., et al. Mitochondrial biogenesis is required for the anchorage-independent survival and propagation of stem-like cancer cells. Oncotarget. 6 (17), (2015).
- Masuda, A., et al. An improved method for isolation of epithelial and stromal cells from the human endometrium. Journal of Reproduction and Development. 62 (2), 213-218 (2016).
- Del Rio-Tsonis, K., et al. Facile isolation and the characterization of human retinal stem cells. Proceedings of the National Academy of Sciences. 101 (44), 15772-15777 (2004).
- Wang, L., Guo, H., Lin, C., Yang, L., Wang, X. I. Enrichment and characterization of cancer stem-like cells from a cervical cancer cell line. Molecular Medicine Reports. 9 (6), 2117-2123 (2014).
- Chen, Y. C., et al. High-throughput single-cell derived sphere formation for cancer stem-like cell identification and analysis. Scientific Reports. 6 (April), 1-12 (2016).
- Kim, J., Jung, J., Lee, S. J., Lee, J. S., Park, M. J. Cancer stem-like cells persist in established cell lines through autocrine activation of EGFR signaling. Oncology Letters. 3 (3), 607-612 (2012).
- Hwang-Verslues, W. W., et al. Multiple Lineages of Human Breast Cancer Stem/Progenitor Cells Identified by Profiling with Stem Cell Markers. PloS one. 4 (12), e8377 (2009).
- Feng, Y., et al. Metformin reverses stem cell-like HepG2 sphere formation and resistance to sorafenib by attenuating epithelial-mesenchymal transformation. Molecular Medicine Reports. 18 (4), 3866-3872 (2018).
- Wang, H., Paczulla, A., Lengerke, C. Evaluation of Stem Cell Properties in Human Ovarian Carcinoma Cells Using Multi and Single Cell-based Spheres Assays. Journal of Visualized Experiments. (95), 1-11 (2015).
- Stebbing, J., Lombardo, Y., Coombes, C. R., de Giorgio, A., Castellano, L. Mammosphere Formation Assay from Human Breast Cancer Tissues and Cell Lines. Journal of Visualized Experiments. (97), 1-5 (2015).
- Zhao, H., et al. Sphere-forming assay vs. organoid culture: Determining long-term stemness and the chemoresistant capacity of primary colorectal cancer cells. International Journal of Oncology. 54 (3), 893-904 (2019).
- Bagheri, V., et al. Isolation and identification of chemotherapy-enriched sphere-forming cells from a patient with gastric cancer. Journal of Cellular Physiology. 233 (10), 7036-7046 (2018).
- Kaowinn, S., Kaewpiboon, C., Koh, S., Kramer, O., Chung, Y. STAT1-HDAC4 signaling induces epithelial-mesenchymal transition and sphere formation of cancer cells overexpressing the oncogene, CUG2. Oncology Reports. , 2619-2627 (2018).
- Lonardo, E., Cioffi, M., Sancho, P., Crusz, S., Heeschen, C. Studying Pancreatic Cancer Stem Cell Characteristics for Developing New Treatment Strategies. Journal of Visualized Experiments. (100), 1-9 (2015).
- Lu, H., et al. Targeting cancer stem cell signature gene SMOC-2 Overcomes chemoresistance and inhibits cell proliferation of endometrial carcinoma. EBioMedicine. 40, 276-289 (2019).
- Bu, P., Chen, K. Y., Lipkin, S. M., Shen, X. Asymmetric division: a marker for cancer stem cells. Oncotarget. 4 (7), (2013).
- Islam, F., Qiao, B., Smith, R. A., Gopalan, V., Lam, A. K. Y. Cancer stem cell: fundamental experimental pathological concepts and updates. Experimental and molecular pathology. 98 (2), 184-191 (2015).
- Liu, W., et al. Comparative characterization of stem cell marker expression, metabolic activity and resistance to doxorubicin in adherent and spheroid cells derived from the canine prostate adenocarcinoma cell line CT1258. Anticancer research. 35 (4), 1917-1927 (2015).
- Broadley, K. W. R., et al. Side Population is Not Necessary or Sufficient for a Cancer Stem Cell Phenotype in Glioblastoma Multiforme. STEM CELLS. 29 (3), 452-461 (2011).
- Cojoc, M., Mäbert, K., Muders, M. H., Dubrovska, A. A role for cancer stem cells in therapy resistance: Cellular and molecular mechanisms. Seminars in Cancer Biology. 31, 16-27 (2015).
- Batlle, E., Clevers, H. Cancer stem cells revisited. Nature Medicine. 23 (10), 1124-1134 (2017).
- Zhang, X. L., Jia, Q., Lv, L., Deng, T., Gao, J. Tumorspheres Derived from HCC Cells are Enriched with Cancer Stem Cell-like Cells and Present High Chemoresistance Dependent on the Akt Pathway. Anti-cancer agents in medicinal chemistry. 15 (6), 755-763 (2015).
- Fukamachi, H., et al. CD49fhigh Cells Retain Sphere-Forming and Tumor-Initiating Activities in Human Gastric Tumors. PLoS ONE. 8 (8), e72438 (2013).
- Gao, M. Q., Choi, Y. P., Kang, S., Youn, J. H., Cho, N. H. CD24+ cells from hierarchically organized ovarian cancer are enriched in cancer stem cells. Oncogene. 29 (18), 2672-2680 (2010).
- Cariati, M., et al. Alpha-6 integrin is necessary for the tumourigenicity of a stem cell-like subpopulation within the MCF7 breast cancer cell line. International Journal of Cancer. 122 (2), 298-304 (2008).
- López, J., Valdez-Morales, F. J., Benítez-Bribiesca, L., Cerbón, M., Carrancá, A. Normal and cancer stem cells of the human female reproductive system. Reproductive Biology and Endocrinology. 11 (1), 53 (2013).
- Alvero, A. B., et al. Molecular phenotyping of human ovarian cancer stem cells unravels the mechanisms for repair and chemoresistance. Cell Cycle. 8 (1), 158-166 (2009).
- Charafe-Jauffret, E., Ginestier, C., Birnbaum, D. Breast cancer stem cells: tools and models to rely on. BMC Cancer. 9 (1), 202 (2009).
- Leccia, F., et al. ABCG2, a novel antigen to sort luminal progenitors of BRCA1- breast cancer cells. Molecular Cancer. 13 (1), 213 (2014).
- Croker, A. K., Allan, A. L. Inhibition of aldehyde dehydrogenase (ALDH) activity reduces chemotherapy and radiation resistance of stem-like ALDHhiCD44+ human breast cancer cells. Breast Cancer Research and Treatment. 133 (1), 75-87 (2012).
- Sun, M., et al. Enhanced efficacy of chemotherapy for breast cancer stem cells by simultaneous suppression of multidrug resistance and antiapoptotic cellular defense. Acta Biomaterialia. 28, 171-182 (2015).
- Shao, J., Fan, W., Ma, B., Wu, Y. Breast cancer stem cells expressing different stem cell markers exhibit distinct biological characteristics. Molecular Medicine Reports. 14 (6), 4991-4998 (2016).
- Croker, A. K., et al. High aldehyde dehydrogenase and expression of cancer stem cell markers selects for breast cancer cells with enhanced malignant and metastatic ability. Journal of Cellular and Molecular Medicine. 13 (8b), 2236-2252 (2009).
- Cheung, S. K. C., et al. Stage-specific embryonic antigen-3 (SSEA-3) and β3GalT5 are cancer specific and significant markers for breast cancer stem cells. Proceedings of the National Academy of Sciences. 113 (4), 960-965 (2016).
- Meyer, M. J., Fleming, J. M., Lin, A. F., Hussnain, S. A., Ginsburg, E., Vonderhaar, B. K. CD44 pos CD49f hi CD133/2 hi Defines Xenograft-Initiating Cells in Estrogen Receptor–Negative Breast Cancer. Cancer Research. 70 (11), 4624-4633 (2010).
- Ahn, S. M., Goode, R. J. A., Simpson, R. J. Stem cell markers: Insights from membrane proteomics?. PROTEOMICS. 8 (23-24), 4946-4957 (2008).
- Chefetz, I., et al. TLR2 enhances ovarian cancer stem cell self-renewal and promotes tumor repair and recurrence. Cell Cycle. 12 (3), 511-521 (2013).
- Alvero, A. B., et al. Stem-Like Ovarian Cancer Cells Can Serve as Tumor Vascular Progenitors. Stem Cells. 27 (10), 2405-2413 (2009).
- Yin, G., et al. Constitutive proteasomal degradation of TWIST-1 in epithelial–ovarian cancer stem cells impacts differentiation and metastatic potential. Oncogene. 32 (1), 39-49 (2013).
- Wei, X., et al. Mullerian inhibiting substance preferentially inhibits stem/progenitors in human ovarian cancer cell lines compared with chemotherapeutics. Proceedings of the National Academy of Sciences. 107 (44), 18874-18879 (2010).
- Meirelles, K., et al. Human ovarian cancer stem/progenitor cells are stimulated by doxorubicin but inhibited by Mullerian inhibiting substance. Proceedings of the National Academy of Sciences. 109 (7), 2358-2363 (2012).
- Shi, M. F., et al. Identification of cancer stem cell-like cells from human epithelial ovarian carcinoma cell line. Cellular and Molecular Life Sciences. 67 (22), 3915-3925 (2010).
- Meng, E., et al. CD44+/CD24− ovarian cancer cells demonstrate cancer stem cell properties and correlate to survival. Clinical & Experimental Metastasis. 29 (8), 939-948 (2012).
- Witt, A. E., et al. Identification of a cancer stem cell-specific function for the histone deacetylases, HDAC1 and HDAC7, in breast and ovarian. Oncogene. 36 (12), 1707-1720 (2017).
- Wu, H., Zhang, J., Shi, H. Expression of cancer stem markers could be influenced by silencing of p16 gene in HeLa cervical carcinoma cells. European journal of gynaecological oncology. 37 (2), 221-225 (2016).
- Huang, R., Rofstad, E. K. Cancer stem cells (CSCs), cervical CSCs and targeted therapies. Oncotarget. 8 (21), 35351-35367 (2017).
- Zhang, X., et al. Imatinib sensitizes endometrial cancer cells to cisplatin by targeting CD117-positive growth-competent cells. Cancer Letters. 345 (1), 106-114 (2014).
- Luo, L., et al. Ovarian cancer cells with the CD117 phenotype are highly tumorigenic and are related to chemotherapy outcome. Experimental and Molecular Pathology. 91 (2), 596-602 (2011).
- Zhao, P., Lu, Y., Jiang, X., Li, X. Clinicopathological significance and prognostic value of CD133 expression in triple-negative breast carcinoma. Cancer Science. 102 (5), 1107-1111 (2011).
- Ferrandina, G., et al. Expression of CD133-1 and CD133-2 in ovarian cancer. International Journal of Gynecologic Cancer. 18 (3), 506-514 (2008).
- Rutella, S., et al. Cells with characteristics of cancer stem/progenitor cells express the CD133 antigen in human endometrial tumors. Clinical cancer research an official journal of the American Association for Cancer Research. 15 (13), 4299-4311 (2009).
- Friel, A. M., et al. Epigenetic regulation of CD133 and tumorigenicity of CD133 positive and negative endometrial cancer cells. Reproductive Biology and Endocrinology. 8 (1), 147 (2010).
- Nakamura, M., et al. Prognostic impact of CD133 expression as a tumor-initiating cell marker in endometrial cancer. Human Pathology. 41 (11), 1516-1529 (2010).
- Saha, S. K., et al. KRT19 directly interacts with β-catenin/RAC1 complex to regulate NUMB-dependent NOTCH signaling pathway and breast cancer properties. Oncogene. 36 (3), 332-349 (2017).
- LV, X., Wang, Y., Song, Y., Pang, X., Li, H. Association between ALDH1+/CD133+ stem-like cells and tumor angiogenesis in invasive ductal breast carcinoma. Oncology Letters. 11 (3), 1750-1756 (2016).
- Ruscito, I., et al. Exploring the clonal evolution of CD133/aldehyde-dehydrogenase-1 (ALDH1)-positive cancer stem-like cells from primary to recurrent high-grade serous ovarian cancer (HGSOC). A study of the Ovarian Cancer Therapy–Innovative Models Prolong Survival (OCTIPS). European Journal of Cancer. 79, 214-225 (2017).
- Sun, Y., et al. Isolation of Stem-Like Cancer Cells in Primary Endometrial Cancer Using Cell Surface Markers CD133 and CXCR4. Translational Oncology. 10 (6), 976-987 (2017).
- Rahadiani, N., et al. Expression of aldehyde dehydrogenase 1 (ALDH1) in endometrioid adenocarcinoma and its clinical implications. Cancer Science. 102 (4), 903-908 (2011).
- Mamat, S., et al. Transcriptional Regulation of Aldehyde Dehydrogenase 1A1 Gene by Alternative Spliced Forms of Nuclear Factor Y in Tumorigenic Population of Endometrial Adenocarcinoma. Genes & Cancer. 2 (10), 979-984 (2011).
- Mukherjee, S. A., et al. Non-migratory tumorigenic intrinsic cancer stem cells ensure breast cancer metastasis by generation of CXCR4+ migrating cancer stem cells. Oncogene. 35 (37), 4937-4948 (2016).
- Lim, E., et al. Aberrant luminal progenitors as the candidate target population for basal tumor development in BRCA1 mutation carriers. Nature Medicine. 15 (8), 907-913 (2009).
- Liang, Y. J., et al. Interaction of glycosphingolipids GD3 and GD2 with growth factor receptors maintains breast cancer stem cell phenotype. Oncotarget. 8 (29), 47454-47473 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten