A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ספירה מדויקת של זקיקים בשחלות עכברים למבוגרים
In This Article
Summary
כאן, אנו מתארים, להשוות, ולהשוות שתי טכניקות שונות לספירת זקיק מדויקת של רקמות השחלות עכבר קבוע.
Abstract
יונקים נקביים המתרבים מינית נולדים עם כל אספקת ביציות לכל החיים שלהם. ביציות לא בוגרות ורגיעה נמצאות בתוך זקיקים ראשוניים, יחידת האחסון של הנבט הנשי. הם אינם מתחדשים, ולכן מספרם בלידה ושיעור האובדן שלאחר מכן מכתיב במידה רבה את תוחלת החיים הפורייה הנשית. כימות מדויק של מספרי זקיקים ראשוניים אצל נשים ובעלי חיים חיוני לקביעת ההשפעה של תרופות ורעילים על שמורת השחלות. כמו כן, יש צורך להעריך את הצורך, ואת ההצלחה של, טכניקות שימור פוריות קיימות ומתפתחות. נכון לעכשיו, אין שיטות קיימות כדי למדוד במדויק את מספר הזקיקים הקדמוניים המרכיבים את עתודת השחלות אצל נשים. יתר על כן, קבלת רקמת השחלות מבעלי חיים גדולים או מינים בסכנת הכחדה לניסויים היא לעתים קרובות לא ריאלי. לכן, עכברים הפכו מודל חיוני עבור מחקרים כאלה, ואת היכולת להעריך מספרי זקיק ראשוני בשחלות עכבר שלמות הוא כלי קריטי. עם זאת, דיווחים על מספרי זקיקים מוחלטים בשחלות העכבר בספרות הם משתנים מאוד, מה שמקשה על השוואה ו/או שכפול נתונים. זאת בשל מספר גורמים, כולל מתח, גיל, קבוצות טיפול, כמו גם הבדלים טכניים בשיטות הספירה המועסקים. במאמר זה, אנו מספקים מדריך הדרכה שלב אחר שלב להכנת מקטעים היסטולוגיים ולספירת זקיקים ראשוניים בשחלות עכבר בשתי שיטות שונות: [1] סטריאולוגיה, המסתמכת על טכניקת מפרק השבר/אופטי; ו[2] טכניקת הספירה הישירה. חלק מהיתרונות והחסרונות המרכזיים של כל שיטה יודגשו כך שניתן יהיה לשפר את השחזור בתחום ולאפשר לחוקרים לבחור את השיטה המתאימה ביותר למחקריהם.
Introduction
הביציות הלא בוגרות, שנעצרו באופן מיוטי, המאוחסנות בתוך זקיקים ראשוניים בשחלה, הן יחידת האחסון של הנבט הנשי ומהוות את שמורת השחלות לכל החיים של הפרט. מספרי זקיק ראשוני לרדת באופן טבעי עם גיל1, או לחילופין, יכול להיות מדולדל בטרם עת בעקבות חשיפה לכימיקלים אקסוגני, כולל כמה תרופות רעילים סביבתיים באוויר, מזון ומים2. בהינתן שמספר הזקיק הקדמוני הוא סופי, כמות ואיכות הזקיקים הנמצאים בשחלה קובעות במידה רבה את פוריות הנשית ואת בריאות הצאצאים. לכן, כימות מדויק של מספר זקיק ראשוני אצל נשים חיוני להערכת ההשפעות מחוץ ליעד של עלבונות אקסוגני על עתודת השחלות.
אצל נשים, ניתוח של השחלה כולה הוא בדרך כלל לא אפשרי, ולכן אמצעים פונדקאיים לא פולשניים של עתודת השחלות חייב להיות מנוצל בסביבה קלינית. הורמון אנטי Mϋllerian (AMH) הוא הסמן הביולוגי הפונדקאי הנפוץ ביותר קלינית3. רמות AMH בסרום נמדדות לעתים קרובות אצל נשים בגיל אימהי מתקדם, או לפני ואחרי טיפול בסרטן, כגון כימותרפיה. עם זאת, AMH מופק על ידי זקיקים גדל ולא על ידי זקיקים ראשוניים, ולכן, רמות הסרום אינם מודיעים על מספר זקיק ראשוני מוחלט.
עם היעדר שיטות כדי לקבוע במדויק את מספר הזקיק הקדמוני אצל נשים באתרו, ספירת זקיקי השחלות במודלים בעלי חיים קטנים, כגון מכרסמים, נשאר כלי מחקר חיוני כדי להעריך את המידה שבה עלבונות אקסוגני להשפיע על זקיקים ראשוניים ובכך, פוריות. למרבה הצער, דיווחים לאורך הספרות של מספרי זקיק ראשוניים במודלים מכרסמים הם משתנים מאוד4. סיבה מרכזית לכך היא הבדלים טכניים שדווחו בהרחבה בשיטת הספירה שננקטה. בעיקר, ישנן שתי טכניקות שונות המתוארות בספרות לספירת זקיקים ראשוניים בעכברים. אלה כוללים סטריאולוגיה, אשר משתמשת בשיטת מפרק אופטי שבר, וספירת זקיק ישירה.
סטריאולוגיה נחשבת תקן הזהב כפי שהוא משתמש דגימה אקראית אחידה שיטתית5, מה שהופך אותו השיטה המדויקת ביותר של כימות מספר זקיק ראשוני בעכבר כולו, או שחלותעכברוש 4,6,7. הסטריאולוגיה אינה משוחדת, שכן היא מהווה את המבנה התלת מימדי של מושא העניין8. בשיטת מפרק/שבר אופטי, מוחלות שלוש רמות דגימה כדי לכמת זקיקים ראשוניים באמצעות מקטעי רקמה עבים (למשל, 20 מיקרומטר) בתוך שבר ידוע של השחלה הכוללת של העכבר. ראשית, מרווח הדגימה נבחר (למשל, כל מקטע3) בהתחלה אקראית (דגימת שבר 1, f1)4. לאחר מכן נדגמים חלקים באופן שיטתי ואחיד מנקודה זו דרך השחלה כולה. לאחר מכן, מסגרת ספירה לא משוחדת מודבקת על החלק השחלתי ומוזזת בהדרגה לאורך רשת ספירה מוגדרת ואקראית (דגימת שבר 2, f2)8. לבסוף, חלק ידוע של עובי המקטע נדגם אופטית (למשל, 10 מיקרומטר) וזקיקים בתוך אזור זה נספרים (דגימת שבר 3, f3)4. מספר הזקיק הגולמי מוכפל בהיפוך של שברי דגימה אלה כדי להשיג את הערך הסופי. שיטה זו דורשת הכשרה וציוד מומחים, כולל מיקרוסקופ עם שלב ממונע המונע על ידי תוכנה סטריאולוגית. רקמות צריך להישמר בתיקון של Bouin מיוחד, מוטבע שרף glycolmethacrylate כדי לאפשר מקטעי רקמה עבה להיחתך באמצעות microtome שרף glycolmethacrylate עם סכין זכוכית. שיטה זו נועדה להסביר הצטמקות רקמות ועיוות, כדי לשמר בצורה הטובה ביותר את המבנה המורפולוגי התלת מימדי של השחלה וזקיקים9.
ספירת זקיקים ישירה היא השיטה הנפוצה ביותר לספירת זקיקים10. קיבועים נפוצים יותר (כלומר, פורמלין) ניתן להשתמש, ואחריו הטמעת שעווה פרפין וסעיף סדרתי ממצה באמצעות microtome סטנדרטי בעובי של בין 4-6 מיקרומטר. זקיקים נספרים באופן שיטתי במקטע הרקמה כולו במרווח מוגדר, ולאחר מכן מוכפלים בהיפוך של מרווח הדגימה כדי להשיג את הערכת הזקיק הכוללת. שיטה זו היא מהירה, קלה, ניתן לבצע באמצעות רקמות בארכיון, ומוכן באמצעות טכניקות היסטולוגיות סטנדרטיות. זה דורש רק מיקרוסקופ אור עם יכולות הדמיה סטנדרטיות. עם זאת, למרות יתרונות אלה, ספירת זקיקים ישירה חסרה את הדיוק ואת הפרמטרים ספירה קפדנית של סטריאולוגיה, מה שהופך אותו נוטה יותר הטיה החוקר. בנוסף, רקמות עלולות לעבור הצטמקות ועיוות במהלך העיבוד, לשבש את השלמות והמורפולוגיה של השחלה ובכך להקשות על סיווג זקיק וכימות.
מטרת מאמר זה היא לתאר שתי שיטות נפוצות להערכת כמותית של מספר זקיק ראשוני בשחלות עכבר: סטריאולוגיה וספירת זקיקים ישירה. אנו נספק פרוטוקולים מפורטים לשתי שיטות אלה ונדגיש כמה מהחוזקות והחולשות שלהם, על מנת לשפר את הרבייה בתחום שלנו ולאפשר לחוקרים לקבל החלטה מושכלת של שיטת הספירה המתאימה ביותר למחקריהם.
Protocol
השחלות נאספו מעכברי C57BL6J נקבה. כל ההליכים והניסויים בבעלי חיים בוצעו בהתאם לקוד הנוהג האוסטרלי של NHMRC לטיפול ושימוש בבעלי חיים ואושרו על ידי ועדת האתיקה של בעלי חיים בפלטפורמת המחקר בבעלי חיים של מונאש.
הערה: סוכן כימותרפיה הראה לרוקן ביציות זקיק ראשוני, כפי שנקבע באמצעות סטריאולוגיה11 וספירות ישירות12,13 שימש בדו"ח זה כדי להשוות את שתי שיטות הספירה באותה חיה. נקבה, 8 שבועות (מבוגר צעיר) עכברים נשקלו לפני זריקה תוך-פרטית אחת של 75 מ"ג / קילוגרם / bodyweight של ציקלופוספאמיד, או בקרת רכב מלוחים (n = 5 / קבוצה). מינון זה הוכח לגרום כ 50% דלדול של זקיקים ראשוניים, אבל לא דווח לגרום לתחלואה או תמותה בעכברים14. השחלות נקצרו 48 שעות לאחר הטיפול. שחלה אחת מכל בעל חיים תוקנה בתמיסת פורמלין ניטרלית של 10% (v/v) למשך 24 שעות, והשנייה תוקנה בתמיסה של בואן למשך 24 שעות. הרקמה הוטבעה אז שרף glycolmethacrylate ו חתך באופן סדרתי ב 20 מיקרומטר, או פרפין חתך סדרתי ב 5 מיקרומטר. כל הרקמות היו מוכתמות בחומצה תקופתית שיף והמטוטוקסילין.
1. הכנה היסטולוגית: קיבעון, עיבוד, הטמעה וקטע של שחלות עכבר
- לנתח את השחלות העכבר על ידי גיזום oviduct ואת כל השומן שמסביב, מבלי לפגוע או לחתוך את השחלה עצמה. במידת הצורך, השתמשו במיקרוסקופ מנתח ובלהב דק לשלב זה (איור 1A).
- לתקן רקמות מיד על ידי הצבת לתוך צינור קטן שכותרתו המכילה את התיקון של Bouin (סטריאולוגיה), או פורמלין קיבוע (ספירה ישירה) במשך 24 שעות (איור 1B),לפני העברת רקמות לתוך 70% אתנול.
הערה: מורפולוגיה של זקיק שמורה בצורה הטובה ביותר בתוך רקמת השחלות הקבועה של בואן, המוטבעת בשרף גליקולמתאקרילאט(איור 2). - לעבד שחלות קבועות שלמות ולאחר מכן להטביע שרף glycolmethacrylate עבור סטריאולוגיה (קובץ משלים 1), או שעווה פרפין לספירה ישירה באמצעות פרוטוקול היסטולוגי סטנדרטי.
התראה: שף רעיל, לכן ודא שכל שלבי עיבוד הרקמות מבוצעים במכסה המנוע של האדים והכפפות שחוקות בכל עת. - השתמש במיקרוטום מיוחד של שרפין מתאקרילאט(איור 1C)המצויד בסכיןזכוכית (איור 1D)כדי לחתוך באופן ממצה מקטעי שרפים עבים של גליקולמתאקרילאט (למשל, 20 מיקרומטר). לאסוף את המקטעים במרווח קבוע (למשל, כל קטע 3) על שקופיות מיקרוסקופזכוכית עבור סטריאולוגיה.
- השתמש microtome סטנדרטי לחתוך מקטעי פרפין דק (למשל, 4-6 מיקרומטר). לאסוף מקטעי רקמה במרווח זמן קבוע (למשל, כל קטע 9) על שקופית מיקרוסקופזכוכית לספירת זקיק ישירה.
- הכתים את השקופיות בחומצה המחזורית שיף והמטוטוקסילין(קובץ משלים 2).
- כריכה עם DPX סטנדרטי למקטעי פרפין, או DPX עבה למקטעי צואה גליקולמתאקרילאט(איור 1E).
התראה: גליקולמטהקרילט שרפין DPX הוא מסוכן, אז לבצע את השלב הזה כדי אדים מכסה המנוע.
הערה: גליקולמטהקרילט תריס DPX הוא צמיג מאוד. יש להקפיד על כיסוי הזכוכית בחוזקה על ידי לחיצה עליו עם מרית כדי להבטיח שה-DPX יפוזר באופן שווה ודקה, ואין בועות אוויר מתחת לכיסוי(איור 1F).
2. הערכה סטריאולוגית של מספר זקיק ראשוני באמצעות השבר האופטי
- הפעל את המחשב, את יחידת הבקרה מרובת הפקדים, את המצלמה ואת מקור האור בתוך הגדרת הסטריאולוגיה והגדר את מטרת המיקרוסקופ להגדלה נמוכה (למשל, 10x).
- פתח את תוכנת הסטריאולוגיה.
- שים את השקופית הראשונה בצורה מאובטחת על במת המיקרוסקופ.
- התאימו את החשיפה לאור באמצעות בדיקת 'אוטומטי' תחת 'חשיפה' בחלונית 'הגדרות מצלמה' (איור משלים 1A). לחלופין, כוונן ידנית את החשיפה לאור.
- השתמש בג'ויסטיק כדי לאתר את דגימת הרקמה הראשונה ולהביא את המדגם לפוקוס.
- התאם את האיזון הלבן, על-ידי לחיצה על הגדרות נוספות (הממוקמות בפינה השמאלית התחתונה של החלונית 'הגדרות מצלמה') ולאחר מכן לחץ על איזון לבן ולחץ על אוטומטי (איור משלים 1B). לחלופין, לחץ על לחצן איזון לבן הסמוך ללחצן הגדרות נוספות (או בחר אזור בהגדרות נוספות), כדי להגדיר את האיזון הלבן באופן ידני על-ידי בחירת אזור לבן במקטע.
- עבור לתפריט הנפתח בדיקות ולחץ על זרימת עבודה של משבר אופטי. לאחר מכן לחץ על התחל פרוייקט חדש ולחץ על אישור.
- אם נשמרה תצורת דגימה קיימת, תחת פרמטרי דגימה, לחץ על כן | אני לא יודע מה לעשות ובחר את תצורת הדגימה הרצויה.
- אם לא, לחץ על לא והזן ידנית את פרטי המקטע הטורי (איור משלים 1C) והגדר את תצורת הבדיקה בשלב 2.13.
- לחץ על הבא, הגדר את המיקרוסקופ להגדלה נמוכה ובחר הגדלה 10x מהתפריט הנפתח.
- לחץ על הבא, ולאחר מכן לעקוב אחר כל החלק השחלות - להתחיל על ידי לחיצה שמאלה סביב המקטע ובסוף, לחץ באמצעות לחצן העכבר הימני ובחר סגור מיתאר.
- לחץ על הבא, הגדר את המיקרוסקופ להגדלה גבוהה ובחר הגדלה 100x שמן מהתפריט הנפתח.
- מניחים טיפת שמן על מקטע הרקמה בשקופית ומעבירים את מטרת המיקרוסקופ להגדלה של 100x.
- כוונן את החשיפה לאור (כמו בשלב 2.4) ולחץ על הבא.
- הגדר את פרמטרי הדגימה כדי להגדיר את תצורת הבדיקה. כאן, מסגרת הספירה הוגדרה ל- 47.5 מיקרומטר x 47.5 מיקרומטר (2,256.25 מיקרומטר2) ואורך השלב הוגדר ל- 100 מיקרומטר x 100 מיקרומטר (10,000 מיקרומטר2) (איור משלים 2). לאחר שנקבעו פרמטרי הדגימה, שמור את התבנית ופתח מחדש במהלך הפעלות הניתוח הבאות בשלב 2.7.
- לחץ על התחל לספור (איור משלים 1D). התמקד בחלק העליון של המדגם, לחץ על אישור והתחל לספור.
- השתמש ידית התמקדות לנוע דרך עומק דגימת 10 מיקרומטר ולספור את כל הזקיקים הקדמוניים אשר גרעין ביצית נכנס לפוקוס. לחץ על הבא כדי לעבור לאזור הבא.
- לסווג זקיקים כמו ראשוני אם ביצית מוקף בתאי גרנולוזה קשקשיים (שטוחים), אך ללא תאי גרנולוזה cuboidal (איור 2A).
הערה: זקיקים ראשוניים נבדלים מזקיקים בינוניים/מעבריים, הכוללים שילוב של תאי גרנולוזה קובידליים וקבורתיים (איור 2B),וזקיקים ראשוניים, המוקפים בעיקר בתאי גרנולוזה קוביואידיים(איור 2C). יש לכמת מחלקות זקיק אלה בנפרד. - לספור רק זקיקים שבהם גרעין ביצית גלוי. גרעין ביצית חייב להופיע בתוך מסגרת הספירה או לגעת בקווי ההכללה הירוקים של מסגרת הספירה(איור משלים 1E,F).
- אם גרעין ביצית נופל מחוץ למסגרת הספירה (איור משלים 1G) או נוגע בקווי ההדרה האדומים של מסגרת הספירה, אל תספור זקיק זה.
- בעת הערכת דלדול זקיק ראשוני בתגובה לכימיקל אקסוגני (למשל, כימותרפיה), ודא שכל הזקיקים שנספרו בריאים ולכן יש להם מורפולוגיה נורמלית (איור 2). לספור כל זקיקים חריגים או אטרטיים בנפרד. לעתים קרובות, מוות זקיק הוא המושרה על ידי עלבונות כגון כימותרפיה, וכימות של זקיקי אטרטית צריך להתקבל בנפרד על מנת להבחין בין זקיקים בריאים אטרטיים, כמו רק זקיקים בריאים מרכיבים את שמורת השחלות15.
- לסווג זקיקים כמו ראשוני אם ביצית מוקף בתאי גרנולוזה קשקשיים (שטוחים), אך ללא תאי גרנולוזה cuboidal (איור 2A).
- לאחר השלמת הספירה במקטע זה, בצע אחת מהפעולות הבאות:
- לחץ על הוסף מקטע חדשולאחר מכן חזור לשלב 2.3 כדי להגדיר את המקטע הבא לספירה.
- לחץ על סיימתי לספור כדי לסיים את ההפעלה. להחזיר את המטרה 10x, לצאת התוכנה סטריאולוגיה לכבות את מקור האור, מצלמה, יחידת בקרה מרובה ומחשב.
- השג את מספר הזקיק הגולמי (Q) מכל מקטע רקמה שנדגם מהשחלה כולה, ולאחר מכן באמצעות גיליון אלקטרוני, השתמש במשוואה שלהלן כדי לקבל את הערך הסופי מכל בעל חיים משוכפל (N)4.
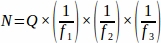 איפה:
איפה:
N = המספר המשוער הכולל של זקיקים בתוך השחלה.
Q = ספירת זקיקים ראשונית גולמית.
f1 = מרווח דגימה. כל קטעשלישי נדגם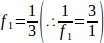 כך.
כך.
f2 = קשרי גומלין בין מסגרת הספירה (אזור לדוגמה) לבין צעד, מחושב כ . מאז אזור המדגם היה 2256 מיקרומטר2 (47.5 מיקרומטר x 47.5 מיקרומטר) ואת אזור צעד היה 10000 מיקרומטר2 (100 מיקרומטר x 100 מיקרומטר),
. מאז אזור המדגם היה 2256 מיקרומטר2 (47.5 מיקרומטר x 47.5 מיקרומטר) ואת אזור צעד היה 10000 מיקרומטר2 (100 מיקרומטר x 100 מיקרומטר),  .
.
f3 = שבר של קטע השחלות שנדגם. מאז 10 מיקרומטר של סעיף 20 מיקרומטר נדגם,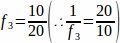 .
.
לכן,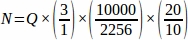 .
.
הערה: פרוטוקול זה מתאר כיצד ליישם עקרונות אלה של ניתוחים סטריאולוגיים באמצעות תוכנה סטריאולוגית מצוטט נרחב (טבלה של חומרים); עם זאת, תוכנה סטריאולוגית אחרת זמינה. העקרונות המיושמים במהלך ניתוחים סטריאולוגיים של זקיקי השחלות זהים, ללא קשר לתוכנה המשמשת להגדרת הפרמטרים. סטריאולוגיה היא המדויקת ביותר כאשר 100 או יותר אובייקטים נספרים בשחלת עכברבוגרת 4, כמו זה נותן מקדם של שגיאה עבור האומדן מתחת 10%16. פרמטרי הדגימה המתוארים כאן עברו אופטימיזציה כדי להבטיח מינימום של כ -100 אובייקטים (כלומר, זקיקים ראשוניים, מעבריים וראשיים) ניתן לספור בשחלות C57BL6J מסוג מבוגרים. מחקר פיילוט יכול להתבצע כולל גודל מדגם קטן כדי לקבוע את פרמטרי הדגימה האופטימליים, כגון מרווח ומספר המקטעים שיש לנתח ומספר הניתוחים האופטיים בתוך הסעיפים שנדגמו17.
3. הערכת מספר זקיק ראשוני על ידי ספירות זקיק השחלות הישירות
- הנח את שקופית המיקרוסקופ בצורה מאובטחת תחת מיקרוסקופ אור סטנדרטי ובצע ספירות ישירות כדי להשיג מספר זקיק ראשוני גולמי.
- לסווג זקיקים כמו הקדמוני אם ביצית גלוי בבירור והוא מוקף בתאי גרנולוזה קשקשיים (שטוחים), אבל אין תאי גרנולוזה cuboidal (איור 2D).
הערה: זקיקים קדמוניים נבדלים מזקיקים בינוניים/מעבריים, הכוללים שילוב של תאי גרנולוזה קובידליים וקבורתיים (איור 2E)וזקיקים ראשוניים, המוקפים בעיקר בתאי גרנולוזה קוביואידיים(איור 2F). יש לכמת מחלקות זקיק אלה בנפרד. - ודא שכל הזקיקים שנספרו בריאים ולכן יש להם מורפולוגיה נורמלית (איור 2). לספור כל זקיקים חריגים או אטרטיים בנפרד, כמו רק זקיקים בריאים להרכיב את השמורה השחלות.
- לסווג זקיקים כמו הקדמוני אם ביצית גלוי בבירור והוא מוקף בתאי גרנולוזה קשקשיים (שטוחים), אבל אין תאי גרנולוזה cuboidal (איור 2D).
- לחלופין, קח פוטומיקרוגרפים מרובים או תפורים בעוצמה גבוהה (למשל, 20x) של כל מקטע רקמת השחלות כדי לבצע ספירות על-ידי פתיחת קבצי התמונה. ניתן לעשות זאת באופן ידני, או באמצעות סורק שקופיות אוטומטי.
- השג את מספר הזקיק הגולמי (Q) מכל מקטע רקמה שנדגם מהשחלה כולה במרווח שנקבע מראש. הכפל מספר זה בהיפוך של שבר הדגימה כדי להשיג את הערך הסופי עבור כל בעל חיים משכפל (N), באמצעות המשוואה שלהלן.
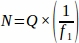 איפה:
איפה:
N = המספר המשוער הכולל של זקיקים בתוך השחלה.
ש = ספירת זקיקים גולמיים (מכל סוג בנפרד, מחושב בנפרד).
f1 = מרווח דגימה. כל קטע9 נדגם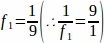 כך.
כך.
לכן,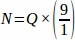 .
.
תוצאות
מודל מאופיין היטב של דלדול זקיק שימש, לפיה עכברים נקבה צעירה מבוגרת ניתנו מנה אחת של כימותרפיה ציקלופוספאמיד, או בקרת רכב מלוחים (n = 5 / קבוצה) ושתי השחלות נקצרו מכל בעל חיים לאחר 48 שעות. שחלה אחת לכל חיה הוכנה כמתואר בשלב 1 עבור כל אחת משתי השיטות: סטריאולוגיה או ספירה ישירה. השחלה השמאלית והי?...
Discussion
מאמר זה מספק פרוטוקול שלב אחר שלב עבור טכניקת תקן הזהב לספירת זקיקים ראשוניים של העכבר, סטריאולוגיה, ואת השיטה הנפוצה יותר של ספירת זקיקים ישירה. טיפול כימותרפי שימש כדי להשוות ולהשוות את התוצאות שהתקבלו משתי שיטות שונות אלה בתוך השחלה השמאלית והימנית מאותה חיה. שתי השיטות חשפו שונות גבוה...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו התאפשרה באמצעות תמיכה ממשלתית ויקטוריאנית בתשתיות תפעוליות וממשלת אוסטרליה NHMRC IRIISS ונתמכה על ידי מימון המועצה הלאומית לבריאות ומחקר רפואי (ALW #1120300) ומועצת המחקר האוסטרלית (KJH #FT190100265). המחברים רוצים להכיר בתמיכה הטכנית של פלטפורמת המחקר בבעלי חיים מונאש, פלטפורמת היסטולוגיה מונאש ומתקן הדמיה מיקרו מונאש.
Materials
| Name | Company | Catalog Number | Comments |
| 1-Butanol (HPLC) | Fisher Chemical | #A383-1 | |
| Acid alcohol | Amber Scientific | #ACDL | |
| Bouin’s fixative | Sigma-Aldrich | #HT10132 | Picric acid 0.9% (w/v), formaldehyde 9% (v/v), acetic acid 5% (w/v) |
| Cyclophosphamide | Sigma-Aldrich | #C0768-5G | |
| Dibutylphthalate Polystyrene Xylene (DPX) | Sigma-Aldrich | #06522 | |
| Ethanol | Amber Scientific | #ETH | Ethanol 100% |
| Micro Feather opthalmic scalpel with aluminium handle | Designs for Vision | #FEA-745-SR | Feather blade for dissections (seen in Figure 1) |
| Formalin fixative | Australian Biostain | #ANBFC | |
| Glass coverslip | Thermo Scientific | #MENCS22501GP | 22 mm x 50 mm |
| Glycomethacrylate resin RM2165 microtome | Leica Microsystems | #RM2165 | |
| Glycolmethacrylate DPX | *made in house | *Mix 1.5 L Xylene; 800 g polystyrene pellets; 100mL Dibutyl phthalate for 3 weeks | |
| Histolene | Trajan | #11031 | |
| Mayer’s haematoxylin | Amber Scientific | #MH | |
| Olympus BX50 microscope | Olympus | #BX50 | Brightfield microscope fitted with 10x dry & 100x oil immersion objective (numerical aperture 1.3) |
| Olympus immersion oil type-F | Olympus | #IMMOIL-F30CC | |
| Olympus TH4-200 light source | Olympus | #TH4-200 | |
| Paraffin wax | Sigma-Aldrich | #03987 | |
| Periodic acid | Trajan | #PERI1% | Periodic acid 1% |
| Rotary Microtome CUT 4060 | MicroTec | #4060R/F | Used to cut paraffin sections |
| Schiff’s reagent | Trajan | #SCHF | |
| Scott's tap water | Amber Scientific | #SCOT | Potassium carbonate, magnesium sulphate, water |
| StereoInvestigator Stereological System | MBF Bioscience | Includes StereoInvestigator software, multi-control unit, automatic stage and joystick | |
| Superfrost microscope slides | Thermo Scientific | #MENSF41296SP | 1 mm, 72 pcs |
| Technovit 7100 Plastic embedding system | Emgrid Australia | #64709003 | 500 mL/5 x 1 g/40 mL |
| Technovit 3040 yellow | Emgrid Australia | #64708805 | 100 g/80 mL |
References
- Stringer, J. M., Winship, A., Liew, S. H., Hutt, K. The capacity of oocytes for DNA repair. Cellular and Molecular Life Sciences. 75 (15), 2777-2792 (2018).
- Winship, A. L., Stringer, J. M., Liew, S. H., Hutt, K. J. The importance of DNA repair for maintaining oocyte quality in response to anti-cancer treatments, environmental toxins and maternal ageing. Human Reproduction Update. 24 (2), 119-134 (2018).
- Broer, S. L., Broekmans, F. J., Laven, J. S., Fauser, B. C. Anti-Mullerian hormone: ovarian reserve testing and its potential clinical implications. Human Reproduction Update. 20 (5), 688-701 (2014).
- Myers, M., Britt, K. L., Wreford, N. G., Ebling, F. J., Kerr, J. B. Methods for quantifying follicular numbers within the mouse ovary. Reproduction. 127 (5), 569-580 (2004).
- Boyce, R. W., Dorph-Petersen, K. A., Lyck, L., Gundersen, H. J. Design-based stereology: introduction to basic concepts and practical approaches for estimation of cell number. Toxicologic Pathology. 38 (7), 1011-1025 (2010).
- Ristic, N., et al. Maternal dexamethasone treatment reduces ovarian follicle number in neonatal rat offspring. Journal of Microscopy. 232 (3), 549-557 (2008).
- Soleimani Mehranjani, M., Mansoori, T. Stereological study on the effect of vitamin C in preventing the adverse effects of bisphenol A on rat ovary. International Journal of Reproductive Biomedicine (Yazd). 14 (6), 403-410 (2016).
- Brown, D. L. Bias in image analysis and its solution: unbiased stereology. Journal of Toxicologic Pathology. 30 (3), 183-191 (2017).
- Hasselholt, S., Lykkesfeldt, J., Overgaard Larsen, J. Thick methacrylate sections devoid of lost caps simplify stereological quantifications based on the optical fractionator design. Anatomical Record (Hoboken). 298 (12), 2141-2150 (2015).
- Tilly, J. L. Ovarian follicle counts--not as simple as 1, 2, 3. Reproductive Biology and Endocrinology. 1, 11 (2003).
- Nguyen, Q. N., et al. Loss of PUMA protects the ovarian reserve during DNA-damaging chemotherapy and preserves fertility. Cell Death and Disease. 9 (6), 618 (2018).
- Meirow, D., Assad, G., Dor, J., Rabinovici, J. The GnRH antagonist cetrorelix reduces cyclophosphamide-induced ovarian follicular destruction in mice. Human Reproduction. 19 (6), 1294-1299 (2004).
- Winship, A. L., et al. The PARP inhibitor, olaparib, depletes the ovarian reserve in mice: implications for fertility preservation. Human Reproduction. , (2020).
- Meirow, D., Lewis, H., Nugent, D., Epstein, M. Subclinical depletion of primordial follicular reserve in mice treated with cyclophosphamide: clinical importance and proposed accurate investigative tool. Human Reproduction. 14 (7), 1903-1907 (1999).
- Nguyen, Q. N., et al. Cisplatin- and cyclophosphamide-induced primordial follicle depletion is caused by direct damage to oocytes. Molecular Human Reproduction. , (2019).
- Gundersen, H. J., Jensen, E. B. The efficiency of systematic sampling in stereology and its prediction. Journal of Microscopy. 147, 229-263 (1987).
- Olesen, M. V., Needham, E. K., Pakkenberg, B. The Optical Fractionator Technique to Estimate Cell Numbers in a Rat Model of Electroconvulsive Therapy. Journal of Visualized Experiments. (125), e55737 (2017).
- Findlay, J. K., Hutt, K. J., Hickey, M., Anderson, R. A. How Is the Number of Primordial Follicles in the Ovarian Reserve Established. Biology of Reproduction. 93 (5), 111 (2015).
- Omari, S., et al. Mcl-1 is a key regulator of the ovarian reserve. Cell Death and Disease. 6, 1755 (2015).
- Winship, A. L., Bakai, M., Sarma, U., Liew, S. H., Hutt, K. J. Dacarbazine depletes the ovarian reserve in mice and depletion is enhanced with age. Scientific Reports. 8 (1), 6516 (2018).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. An accurate, simple method for unbiased determination of primordial follicle number in the primate ovary. Biology of Reproduction. 56 (4), 909-915 (1997).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. Morphometric analysis of primordial follicle number in pigtailed monkey ovaries: symmetry and relationship with age. Biology of Reproduction. 61 (2), 553-556 (1999).
- Charleston, J. S., et al. Estimating human ovarian non-growing follicle number: the application of modern stereology techniques to an old problem. Human Reproduction. 22 (8), 2103-2110 (2007).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and nongrowing follicle counts according to the Stages of Reproductive Aging Workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Hansen, K. R., et al. A new model of reproductive aging: the decline in ovarian non-growing follicle number from birth to menopause. Human Reproduction. 23 (3), 699-708 (2008).
- Sonigo, C., et al. High-throughput ovarian follicle counting by an innovative deep learning approach. Scientific Reports. 8 (1), 13499 (2018).
- McKey, J., Cameron, L. A., Lewis, D., Batchvarov, I. S., Capel, B. Combined iDISCO and CUBIC tissue clearing and lightsheet microscopy for in toto analysis of the adult mouse ovarydagger. Biology of Reproduction. 102 (5), 1080-1089 (2020).
- Kagami, K., Shinmyo, Y., Ono, M., Kawasaki, H., Fujiwara, H. Three-dimensional evaluation of murine ovarian follicles using a modified CUBIC tissue clearing method. Reproductive Biology and Endocrinology. 16 (1), 72 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved