É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Enumeração de folículo preciso em ovários de rato adulto
Neste Artigo
Resumo
Aqui, descrevemos, comparamos e contrastamos duas técnicas diferentes para a contagem precisa de folículos de tecidos ovarianos fixos do rato.
Resumo
Mamíferos fêmeas sexualmente reprodutos nascem com todo o seu suprimento de oócitos. Oócitos imaturos e quiescentes são encontrados dentro de folículos primordiais, a unidade de armazenamento da germina feminina. Eles não são renováveis, assim seu número ao nascer e a taxa subsequente de perda dita em grande parte a vida fértil feminina. A quantificação precisa dos números de folículos primordiais em mulheres e animais é essencial para determinar o impacto de medicamentos e toxicantes na reserva ovariana. Também é necessário avaliar a necessidade e o sucesso das técnicas de preservação da fertilidade existentes e emergentes. Atualmente, não existem métodos para medir com precisão o número de folículos primordiais que compõem a reserva ovariana em mulheres. Além disso, a obtenção de tecido ovariano de animais grandes ou espécies ameaçadas para experimentação muitas vezes não é viável. Assim, os camundongos tornaram-se um modelo essencial para tais estudos, e a capacidade de avaliar números de folículos primordiais em ovários inteiros de camundongos é uma ferramenta crítica. No entanto, os relatos de números absolutos de folículos em ovários de camundongos na literatura são altamente variáveis, dificultando a comparação e/ou replicação de dados. Isso se deve a uma série de fatores, incluindo tensão, idade, grupos de tratamento, bem como diferenças técnicas nos métodos de contagem empregados. Neste artigo, fornecemos um guia instrutivo passo a passo para preparar seções histológicas e contar folículos primordiais em ovários de camundongos usando dois métodos diferentes: [1] estereologia, que conta com a técnica de dissetor fracionado/óptico; e [2] a técnica de contagem direta. Algumas das principais vantagens e desvantagens de cada método serão destacadas para que a reprodutibilidade possa ser melhorada no campo e para permitir que os pesquisadores selecionem o método mais adequado para seus estudos.
Introdução
Os oócitos imaturos e meioticamente presos armazenados dentro de folículos primordiais no ovário são a unidade de armazenamento da germe feminina e compõem a reserva ovariana vitalícia de um indivíduo. Os números de folículos primordiais diminuem naturalmente com a idade1, ou alternativamente, podem ser prematuramente esgotados após a exposição a produtos químicos exógenos, incluindo alguns fármacos e tóxicos ambientais no ar, alimentos e água2. Dado que o número primordial do folículo é finito, a quantidade e a qualidade dos folículos presentes dentro do ovário determinam em grande parte a fertilidade feminina e a saúde dos filhos. Assim, a quantificação precisa do número de folículos primordiais nas mulheres é essencial para avaliar os impactos fora do alvo de insultos exógenos na reserva ovariana.
Nas mulheres, a análise de todo o ovário geralmente não é possível, portanto, medidas não invasivas de substituto da reserva ovariana devem ser utilizadas em um ambiente clínico. O hormônio anti-Mϋllerian (AMH) é o biomarcador substituto mais utilizado clinicamente3. Os níveis de AMH do soro são frequentemente medidos em mulheres com idade materna avançada, ou antes e depois do tratamento do câncer, como a quimioterapia. No entanto, a AMH é produzida por folículos crescentes e não por folículos primordiais, e, portanto, os níveis de soro não informam sobre o número absoluto de folículos primordiais.
Com a ausência de métodos para determinar com precisão o número de folículos primordiais em mulheres in situ, contar folículos ovarianos em pequenos modelos animais, como roedores, continua sendo uma ferramenta de pesquisa essencial para avaliar o grau pelo qual insultos exógenos impactam nos folículos primordiais e, portanto, na fertilidade. Infelizmente, porém, os relatos ao longo da literatura de números de folículos primordiais em modelos de roedores são altamentevariáveis 4. Uma das principais razões para isso são as diferenças técnicas amplamente relatadas no método de contagem empregado. Predominantemente, existem duas técnicas diferentes descritas na literatura para enumerar folículos primordiais em camundongos. Estes incluem estereologia, que emprega o método de dissetor óptico fracionado, e contagem direta de folículos.
A estereologia é amplamente considerada o padrão-ouro, pois utiliza amostragem aleatória uniforme sistemática5, tornando-se o método mais preciso de quantificar o número de folículo primordial em todo o rato, ou ovários de ratos4,6,7. A estereologia é imparcial, pois explica a estrutura tridimensional do objeto de interesse8. Utilizando um método de dissetor/fracionado óptico, três níveis de amostragem são aplicados para quantificar folículos primordiais usando seções de tecido grosso (por exemplo, 20 μm) dentro de uma fração conhecida do ovário total do rato. Em primeiro lugar, o intervalo amostral é escolhido (por exemplo, cada 3seção) em um início aleatório (fração amostral 1, f1)4. As seções são então amostradas de forma sistemática e uniforme a partir deste ponto através de todo o ovário. Em seguida, um quadro de contagem imparcial é sobreposto sobre a seção ovariana e movido progressivamente ao longo de uma grade de contagem definida e aleatória (fração amostral 2, f2)8. Por fim, uma fração conhecida da espessura da seção é amostrada opticamente (por exemplo, 10 μm) e folículos dentro desta área são contados (fração amostral 3, f3)4. O número do folículo bruto é multiplicado pelo inverso dessas frações amostrais para obter o valor final. Este método requer treinamento especializado e equipamentos, incluindo um microscópio com um estágio motorizado conduzido por software stereológico. Os tecidos devem ser preservados em um fixador especializado de Bouin, e embutidos na resina glicolmetatocrila para permitir que seções de tecido grosso sejam cortadas usando um microtome de resina glicolmetatocrila com uma faca de vidro. Este método é projetado para explicar o encolhimento e deformação tecidual, para preservar melhor a estrutura morfológica tridimensional do ovário e dos folículos9.
A contagem direta de folículos é o método mais utilizado para contar folículos10. Fixativos mais comuns (ou seja, formalina) podem ser usados, seguidos de incorporação de cera de parafina e seção serial exaustiva usando um microtome padrão com uma espessura entre 4-6 μm. Os folículos são sistematicamente contados em toda a seção tecidual em um intervalo definido e multiplicados pelo inverso do intervalo amostral para obter a estimativa total do folículo. Este método é rápido, fácil, pode ser realizado usando tecidos arquivados, e preparado usando técnicas histológicas padrão. Requer apenas um microscópio leve com recursos de imagem padrão. No entanto, apesar dessas vantagens, a contagem direta de folículos carece da precisão e dos rigorosos parâmetros de contagem de estereologia, tornando-o mais propenso ao viés do investigador. Além disso, os tecidos podem sofrer encolhimento e deformação durante o processamento, interrompendo a integridade e a morfologia do ovário e dificultando a classificação e quantificação do folículo.
O objetivo deste artigo é descrever dois métodos comumente utilizados para avaliar quantitativamente o número de folículos primordiais nos ovários do rato: estereologia e contagem direta de folículos. Forneceremos protocolos detalhados para esses dois métodos e destacaremos alguns de seus pontos fortes e fracos, a fim de melhorar a reprodutibilidade em nosso campo e permitir que os pesquisadores tossem uma decisão informada do método de contagem mais adequado para seus estudos.
Protocolo
Os ovários foram coletados de camundongos C57BL6J femininos. Todos os procedimentos e experimentos em animais foram realizados de acordo com o Código australiano de Prática para o Cuidado e Uso de Animais e aprovados pelo Comitê de Ética Animal da Plataforma de Pesquisa Animal de Monash.
NOTA: Um agente quimioterápico mostrou esgotar oócitos folículos primordiais, conforme determinado por meio da estereologia11 e conta 12diretas12,13 foi utilizado neste relatório para comparar os dois métodos de contagem no mesmo animal. Camundongos do sexo feminino, de 8 semanas de idade (adulto jovem) foram pesados antes de uma única injeção intraperitoneal de 75 mg/kg/peso corporal de ciclofosfamatida, ou controle de veículo salino (n=5/grupo). Esta dose tem sido demonstrada como causando um esgotamento aproximado de 50% dos folículos primordiais, mas não relatada para causar morbidade ou mortalidade em camundongos14. Os ovários foram colhidos 48 horas após o tratamento. Um ovário de cada animal foi fixado em 10% (v/v) solução de formalina tamponada neutra por 24 horas, e o outro fixado na solução de Bouin por 24 horas. O tecido foi então incorporado em resina glicolmethacrilato e seção serial em 20 μm, ou em parafina e seção serial em 5 μm. Todos os tecidos estavam manchados com ácido periódico Schiff e hematoxilina.
1. Preparação histológica: fixação, processamento, incorporação e secção de ovários de rato
- Dissecar os ovários do rato aparando o oviduto e toda a gordura circundante, sem danificar ou cortar o ovário em si. Se necessário, utilize um microscópio de dissecação e lâmina fina para esta etapa(Figura 1A).
- Fixar os tecidos imediatamente colocando em um pequeno tubo rotulado contendo fixação (estereologia) de Bouin ou fixação formalina (contagens diretas) por 24 horas(Figura 1B),antes de transferir tecidos para 70% de etanol.
NOTA: A morfologia folículo é melhor conservada dentro do tecido ovariano fixo de Bouin, embutido na resina glicolmetatocrila(Figura 2). - Processe ovários fixos inteiros e, em seguida, incorpore resina glicolmethacrilato para estereologia(Arquivo Suplementar 1), ou cera de parafina para contagens diretas usando um protocolo histológico padrão.
ATENÇÃO: A resina é tóxica, por isso certifique-se de que todas as etapas de processamento de tecidos sejam realizadas em um capô de fumaça e as luvas sejam usadas o tempo todo. - Use um microtome de resina especializada(Figura 1C)equipado com uma faca de vidro (Figura 1D) para cortar exaustivamente seções de resina glicolmetatocrilato grossa (por exemplo, 20 μm). Colete as seções em um intervalo regular (por exemplo, cadaseção 3) em slides de microscópio de vidro para estereologia.
- Use um microtome padrão para cortar seções finas de parafina (por exemplo, 4-6 μm). Colete seções de tecido em um intervalo regular (por exemplo, a cada 9seção) em um slide de microscópio de vidro para contagem direta de folículos.
- Colorisse os slides com ácido periódico Schiff e hematomatoxilina(Arquivo Suplementar 2).
- Tampar com DPX padrão para seções de parafina, ou DPX espesso para seções de resina glicolmethacrila(Figura 1E).
ATENÇÃO: Resina de glicolmetatocrila A DPX é perigosa, por isso realize esta etapa no capô da fumaça.
NOTA: Resina glicolmetatocrila DPX é extremamente viscoso. A mancha de vidro deve ser aderida firmemente pressionando-a para baixo com uma espátula para garantir que o DPX esteja uniforme e finamente disperso, e não há bolhas de ar presentes sob o deslizamento de cobertura(Figura 1F).
2. Estimativa esterológica do número do folículo primordial usando o fracionado óptico
- Ligue o computador, a unidade de multicontrole, a câmera e a fonte de luz dentro da configuração de estereologia e defina o objetivo do microscópio para uma baixa ampliação (por exemplo, 10x).
- Abra o software de estereologia.
- Coloque o primeiro slide com segurança no estágio do microscópio.
- Ajuste a exposição à luz verificando-se automaticamente em exposição no painel Configurações da câmera (Figura Suplementar 1A). Alternativamente, ajuste manualmente a exposição à luz.
- Use o joystick para localizar a primeira amostra de tecido e colocar a amostra em foco.
- Ajuste o balanço de branco, clicando em Mais Configurações (localizado no canto inferior direito do painel Configurações da câmera) e clique em Balanço de Branco e clique em Automático ( FiguraSuplementar 1B). Como alternativa, clique no botão Balanço branco adjacente ao botão Mais Configurações (ou Selecione Área em Mais Configurações),para definir o balanço de branco manualmente selecionando uma área branca na seção.
- Vá para o menu de soltar sondas e clique em Optical Fractionator Workflow. Em seguida, clique em Iniciar novo projeto e clique em OK.
- Se uma configuração de amostragem existente tiver sido salva, sob parâmetros de amostragem clique em Sim | ...eu não vou. e selecione a configuração de amostragem desejada.
- Caso não, clique em Não e digite manualmente as informações da seção serial(Figura Suplementar 1C) e defina a configuração do teste na etapa 2.13.
- Clique em Next, defina o microscópio como Baixa Ampliação e escolha a ampliação de 10x no menu suspenso.
- Clique em Nexte, em seguida, trace toda a seção ovariana - comece pela esquerda clicando ao redor da seção e no final, clique com o botão direito do mouse e escolha Contorno Próximo.
- Clique em Next, defina o microscópio para Alta Ampliação e escolha a ampliação de óleo 100x no menu suspenso.
- Coloque uma gota de óleo na seção de tecido na lâmina e mova o objetivo do microscópio para a ampliação de 100x.
- Ajuste a exposição à luz (como na etapa 2.4) e clique em Next.
- Configure os Parâmetros de Amostragem para definir a configuração da sonda. Aqui, o quadro de contagem foi definido para 47,5 μm x 47,5 μm (2.256,25 μm2) e o comprimento da etapa foi definido para 100 μm x 100 μm (10.000 μm2)(Figura Suplementar 2). Uma vez estabelecidos os parâmetros de amostragem, salve o modelo e reassente novamente durante as sessões de análise subsequentes na etapa 2.7.
- Clique em Iniciar a Contagem (Figura Suplementar 1D). Concentre-se no topo da amostra, clique em OK e comece a contar.
- Use o botão de focalamento para mover-se através da profundidade amostral de 10 μm e contar quaisquer folículos primordiais cujo núcleo oócito entra em foco. Clique em Seguir para passar para a próxima área.
- Classificar folículos como primordial se o oócito estiver cercado por células escânneas (achatadas) de granulosa, mas sem células de granulosa cuboidal(Figura 2A).
NOTA: Os folículos primordiais são distintos dos folículos intermediários/transitórios, que compreendem uma combinação de células de granulosa cuboidal e escamosa(Figura 2B),e folículos primários, que são cercados predominantemente por células de granulosa cuboidal(Figura 2C). Estas classes folículos devem ser quantificadas separadamente. - Só contam folículos em que o núcleo oócito é visível. O núcleo oócito deve aparecer dentro do quadro de contagem ou estar tocando as linhas de inclusão verde do quadro de contagem (Figura Suplementar 1E,F).
- Se o núcleo oócito ficar fora do quadro de contagem(Figura Suplementar 1G) ou tocar nas linhas vermelhas de exclusão do quadro de contagem, não conte este folículo.
- Ao avaliar o esgotamento do folículo primordial em resposta a um produto químico exógeno (por exemplo, quimioterapia), certifique-se de que todos os folículos contados sejam saudáveis e, portanto, tenham morfologia normal(Figura 2). Conte todos os folículos anormais ou atreóticos separadamente. Muitas vezes, a morte folículo é induzida por insultos como a quimioterapia, e a quantificação dos folículos atreticos deve ser obtida separadamente, a fim de distinguir entre folículos saudáveis e atrápticos, pois apenas folículos saudáveis compõem a reserva ovariana15.
- Classificar folículos como primordial se o oócito estiver cercado por células escânneas (achatadas) de granulosa, mas sem células de granulosa cuboidal(Figura 2A).
- Uma vez que a contagem esteja completa nessa seção, faça um dos seguintes:
- Clique em Adicionar nova seçãoe, em seguida, retorne ao passo 2.3 para configurar a próxima seção para contar.
- Clique em I've Finished Counting para terminar a sessão. Retorne o objetivo para 10x, saia do software de estereologia e desligue a fonte de luz, câmera, unidade multicontrole e computador.
- Obtenha a soma do número do folículo bruto (Q) de cada seção de tecido amostrada de todo o ovário, em seguida, usando uma planilha, use a equação abaixo para obter o valor final de cada animal de réplica (N)4.
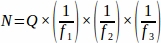 onde:
onde:
N = Número total estimado de folículos dentro do ovário.
Q = Contagem de folículos primordiais brutos.
f1 = Intervalo amostral. A cada 3ª seção foi amostrada assim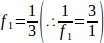 .
.
f2 = Relação entre o quadro de contagem (área de amostra) e o stepper, calculado como . Uma vez que a área amostral foi de 2256 μm2 (47,5 μm x 47,5 μm) e a área do passo foi de 10000 μm2 (100 μm x 100 μm),
. Uma vez que a área amostral foi de 2256 μm2 (47,5 μm x 47,5 μm) e a área do passo foi de 10000 μm2 (100 μm x 100 μm),  .
.
f3 = Fração de seção ovariana amostrada. Desde que 10 μm da seção de 20 μm foi amostrada,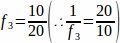 .
.
Portanto,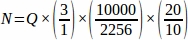 .
.
NOTA: Este protocolo descreve como aplicar esses princípios de análises esterológicas utilizando um software de estereologia amplamente citado (Tabela de Materiais); no entanto, outros softwares esterológicos estão disponíveis. Os princípios aplicados durante as análises eseléológicas dos folículos ovarianos são os mesmos, independentemente do software utilizado para configurar os parâmetros. A estereologia é mais precisa quando 100 ou mais objetos são contados em um ovário de rato adulto4, pois isso dá um coeficiente de erro para a estimativa abaixo de 10%16. Os parâmetros amostrais aqui descritos foram otimizados para garantir que um mínimo de aproximadamente 100 objetos (ou seja, folículos primordiais, transitórios e primários) possam ser contados no controle de ovários C57BL6J adultos. Um estudo piloto pode ser realizado incluindo um pequeno tamanho amostral para estabelecer os parâmetros amostrais ideais, como o intervalo e o número de seções a serem analisadas e o número de dissetores ópticos dentro das seções amostradas17.
3. Estimativa do número do folículo primordial por contagem direta de folículo ovariano
- Coloque o slide do microscópio com segurança sob um microscópio de luz padrão e execute contagens diretas para obter o número do folículo primordial bruto.
- Classificar folículos como primordial se o oócito for claramente visível e estiver cercado por células de granulosa escânparadas (achatadas), mas sem células de granulosa cuboidal(Figura 2D).
NOTA: Os folículos primordiais são distintos dos folículos intermediários/transitórios, que compreendem uma combinação de células de granulosa cuboidal e es es escânnea(Figura 2E),e folículos primários, que são cercados predominantemente por células de granulosa cuboidal(Figura 2F). Estas classes folículos devem ser quantificadas separadamente. - Certifique-se de que todos os folículos contados são saudáveis e, portanto, têm morfologia normal(Figura 2). Conte todos os folículos anormais ou atreóticos separadamente, pois apenas folículos saudáveis compõem a reserva ovariana.
- Classificar folículos como primordial se o oócito for claramente visível e estiver cercado por células de granulosa escânparadas (achatadas), mas sem células de granulosa cuboidal(Figura 2D).
- Alternativamente, tome fotomicógrafos múltiplos ou costurados de alta potência (por exemplo, 20x) de toda a seção de tecido ovariano para executar a contagem, abrindo os arquivos de imagem(s). Isso pode ser feito manualmente ou usando um scanner de slides automatizado.
- Obtenha a soma do número do folículo bruto (Q) de cada seção de tecido amostrada de todo o ovário no intervalo predeterminado. Multiplique este número pelo inverso da fração amostral para obter o valor final para cada animal de réplica (N), utilizando a equação abaixo.
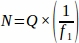 onde:
onde:
N = Número total estimado de folículos dentro do ovário.
Q = Contagem de folículos brutos (de cada tipo individual, calculado separadamente).
f1 = Intervalo amostral. Todas as 9seções foram amostradas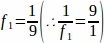 assim.
assim.
Portanto,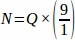 .
.
Resultados
Utilizou-se um modelo bem caracterizado de esgotamento folículo, pelo qual foram administrados camundongos adultos jovens de uma única dose de quimioterapia ciclofosfamida, ou controle de veículo salino (n=5/grupo) e ambos os ovários foram colhidos de cada animal após 48 horas. Um ovário por animal foi preparado como descrito no Passo 1 para cada um dos dois métodos: estereologia ou contagem direta. O ovário esquerdo e direito de cada animal foi aleatoriamente atribuído a cada grupo. Esses dados mostram que, ao ...
Discussão
Este artigo fornece um protocolo passo-a-passo para a técnica padrão-ouro para enumerar folículos primordiais do rato, estereologia e o método mais comumente empregado de contagem direta de folículos. O tratamento quimioterápico foi utilizado para comparar e contrastar os resultados obtidos a partir desses dois métodos diferentes dentro do ovário esquerdo e direito do mesmo animal. Ambos os métodos revelaram alta variabilidade inter-animal em números de folículos primordiais. Um esgotamento significativo da re...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi viabilizado através do Apoio à Infraestrutura Operacional do Governo do Estado vitoriano e do Governo Australiano NHMRC IRIISS e apoiado por financiamento do National Health and Medical Research Council (ALW #1120300) e do Australian Research Council (KJH #FT190100265). Os autores gostariam de reconhecer o apoio técnico da Plataforma monash de pesquisa animal, da Plataforma de Histologia Monash e da instalação Monash Micro Imaging.
Materiais
| Name | Company | Catalog Number | Comments |
| 1-Butanol (HPLC) | Fisher Chemical | #A383-1 | |
| Acid alcohol | Amber Scientific | #ACDL | |
| Bouin’s fixative | Sigma-Aldrich | #HT10132 | Picric acid 0.9% (w/v), formaldehyde 9% (v/v), acetic acid 5% (w/v) |
| Cyclophosphamide | Sigma-Aldrich | #C0768-5G | |
| Dibutylphthalate Polystyrene Xylene (DPX) | Sigma-Aldrich | #06522 | |
| Ethanol | Amber Scientific | #ETH | Ethanol 100% |
| Micro Feather opthalmic scalpel with aluminium handle | Designs for Vision | #FEA-745-SR | Feather blade for dissections (seen in Figure 1) |
| Formalin fixative | Australian Biostain | #ANBFC | |
| Glass coverslip | Thermo Scientific | #MENCS22501GP | 22 mm x 50 mm |
| Glycomethacrylate resin RM2165 microtome | Leica Microsystems | #RM2165 | |
| Glycolmethacrylate DPX | *made in house | *Mix 1.5 L Xylene; 800 g polystyrene pellets; 100mL Dibutyl phthalate for 3 weeks | |
| Histolene | Trajan | #11031 | |
| Mayer’s haematoxylin | Amber Scientific | #MH | |
| Olympus BX50 microscope | Olympus | #BX50 | Brightfield microscope fitted with 10x dry & 100x oil immersion objective (numerical aperture 1.3) |
| Olympus immersion oil type-F | Olympus | #IMMOIL-F30CC | |
| Olympus TH4-200 light source | Olympus | #TH4-200 | |
| Paraffin wax | Sigma-Aldrich | #03987 | |
| Periodic acid | Trajan | #PERI1% | Periodic acid 1% |
| Rotary Microtome CUT 4060 | MicroTec | #4060R/F | Used to cut paraffin sections |
| Schiff’s reagent | Trajan | #SCHF | |
| Scott's tap water | Amber Scientific | #SCOT | Potassium carbonate, magnesium sulphate, water |
| StereoInvestigator Stereological System | MBF Bioscience | Includes StereoInvestigator software, multi-control unit, automatic stage and joystick | |
| Superfrost microscope slides | Thermo Scientific | #MENSF41296SP | 1 mm, 72 pcs |
| Technovit 7100 Plastic embedding system | Emgrid Australia | #64709003 | 500 mL/5 x 1 g/40 mL |
| Technovit 3040 yellow | Emgrid Australia | #64708805 | 100 g/80 mL |
Referências
- Stringer, J. M., Winship, A., Liew, S. H., Hutt, K. The capacity of oocytes for DNA repair. Cellular and Molecular Life Sciences. 75 (15), 2777-2792 (2018).
- Winship, A. L., Stringer, J. M., Liew, S. H., Hutt, K. J. The importance of DNA repair for maintaining oocyte quality in response to anti-cancer treatments, environmental toxins and maternal ageing. Human Reproduction Update. 24 (2), 119-134 (2018).
- Broer, S. L., Broekmans, F. J., Laven, J. S., Fauser, B. C. Anti-Mullerian hormone: ovarian reserve testing and its potential clinical implications. Human Reproduction Update. 20 (5), 688-701 (2014).
- Myers, M., Britt, K. L., Wreford, N. G., Ebling, F. J., Kerr, J. B. Methods for quantifying follicular numbers within the mouse ovary. Reproduction. 127 (5), 569-580 (2004).
- Boyce, R. W., Dorph-Petersen, K. A., Lyck, L., Gundersen, H. J. Design-based stereology: introduction to basic concepts and practical approaches for estimation of cell number. Toxicologic Pathology. 38 (7), 1011-1025 (2010).
- Ristic, N., et al. Maternal dexamethasone treatment reduces ovarian follicle number in neonatal rat offspring. Journal of Microscopy. 232 (3), 549-557 (2008).
- Soleimani Mehranjani, M., Mansoori, T. Stereological study on the effect of vitamin C in preventing the adverse effects of bisphenol A on rat ovary. International Journal of Reproductive Biomedicine (Yazd). 14 (6), 403-410 (2016).
- Brown, D. L. Bias in image analysis and its solution: unbiased stereology. Journal of Toxicologic Pathology. 30 (3), 183-191 (2017).
- Hasselholt, S., Lykkesfeldt, J., Overgaard Larsen, J. Thick methacrylate sections devoid of lost caps simplify stereological quantifications based on the optical fractionator design. Anatomical Record (Hoboken). 298 (12), 2141-2150 (2015).
- Tilly, J. L. Ovarian follicle counts--not as simple as 1, 2, 3. Reproductive Biology and Endocrinology. 1, 11 (2003).
- Nguyen, Q. N., et al. Loss of PUMA protects the ovarian reserve during DNA-damaging chemotherapy and preserves fertility. Cell Death and Disease. 9 (6), 618 (2018).
- Meirow, D., Assad, G., Dor, J., Rabinovici, J. The GnRH antagonist cetrorelix reduces cyclophosphamide-induced ovarian follicular destruction in mice. Human Reproduction. 19 (6), 1294-1299 (2004).
- Winship, A. L., et al. The PARP inhibitor, olaparib, depletes the ovarian reserve in mice: implications for fertility preservation. Human Reproduction. , (2020).
- Meirow, D., Lewis, H., Nugent, D., Epstein, M. Subclinical depletion of primordial follicular reserve in mice treated with cyclophosphamide: clinical importance and proposed accurate investigative tool. Human Reproduction. 14 (7), 1903-1907 (1999).
- Nguyen, Q. N., et al. Cisplatin- and cyclophosphamide-induced primordial follicle depletion is caused by direct damage to oocytes. Molecular Human Reproduction. , (2019).
- Gundersen, H. J., Jensen, E. B. The efficiency of systematic sampling in stereology and its prediction. Journal of Microscopy. 147, 229-263 (1987).
- Olesen, M. V., Needham, E. K., Pakkenberg, B. The Optical Fractionator Technique to Estimate Cell Numbers in a Rat Model of Electroconvulsive Therapy. Journal of Visualized Experiments. (125), e55737 (2017).
- Findlay, J. K., Hutt, K. J., Hickey, M., Anderson, R. A. How Is the Number of Primordial Follicles in the Ovarian Reserve Established. Biology of Reproduction. 93 (5), 111 (2015).
- Omari, S., et al. Mcl-1 is a key regulator of the ovarian reserve. Cell Death and Disease. 6, 1755 (2015).
- Winship, A. L., Bakai, M., Sarma, U., Liew, S. H., Hutt, K. J. Dacarbazine depletes the ovarian reserve in mice and depletion is enhanced with age. Scientific Reports. 8 (1), 6516 (2018).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. An accurate, simple method for unbiased determination of primordial follicle number in the primate ovary. Biology of Reproduction. 56 (4), 909-915 (1997).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. Morphometric analysis of primordial follicle number in pigtailed monkey ovaries: symmetry and relationship with age. Biology of Reproduction. 61 (2), 553-556 (1999).
- Charleston, J. S., et al. Estimating human ovarian non-growing follicle number: the application of modern stereology techniques to an old problem. Human Reproduction. 22 (8), 2103-2110 (2007).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and nongrowing follicle counts according to the Stages of Reproductive Aging Workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Hansen, K. R., et al. A new model of reproductive aging: the decline in ovarian non-growing follicle number from birth to menopause. Human Reproduction. 23 (3), 699-708 (2008).
- Sonigo, C., et al. High-throughput ovarian follicle counting by an innovative deep learning approach. Scientific Reports. 8 (1), 13499 (2018).
- McKey, J., Cameron, L. A., Lewis, D., Batchvarov, I. S., Capel, B. Combined iDISCO and CUBIC tissue clearing and lightsheet microscopy for in toto analysis of the adult mouse ovarydagger. Biology of Reproduction. 102 (5), 1080-1089 (2020).
- Kagami, K., Shinmyo, Y., Ono, M., Kawasaki, H., Fujiwara, H. Three-dimensional evaluation of murine ovarian follicles using a modified CUBIC tissue clearing method. Reproductive Biology and Endocrinology. 16 (1), 72 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados