Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yetişkin Fare Yumurtalıklarında Doğru Folikül Numaralandırması
Bu Makalede
Özet
Burada, sabit fare yumurtalık dokularının doğru folikül sayımı için iki farklı tekniği açıklıyor, karşılaştırıyor ve karşılaştırıyoruz.
Özet
Cinsel olarak üreyen dişi memeliler, ömür boyu oosit tedariki ile doğarlar. Olgunlaşmamış, sessiz oositler, dişi mikrop hattının depolama birimi olan ilkel foliküllerde bulunur. Yenilenemezler, bu nedenle doğumdaki sayıları ve sonraki kayıp oranları büyük ölçüde kadın doğurganlık ömrünü belirler. Kadınlarda ve hayvanlarda ilkel folikül sayılarının doğru ölçülmesi, ilaçların ve toksikantların yumurtalık rezervi üzerindeki etkisini belirlemek için gereklidir. Mevcut ve gelişmekte olan doğurganlık koruma tekniklerine duyulan ihtiyacı ve başarısını değerlendirmek için de gereklidir. Şu anda, kadınlarda yumurtalık rezervini oluşturan ilkel foliküllerin sayısını doğru bir şekilde ölçmek için herhangi bir yöntem bulunmamaktadır. Ayrıca, deney için büyük hayvanlardan veya nesli tükenmekte olan türlerden yumurtalık dokusu elde etmek genellikle mümkün değildir. Bu nedenle, fareler bu tür çalışmalar için önemli bir model haline gelmiştir ve tüm fare yumurtalıklarındaki ilkel folikül sayılarını değerlendirme yeteneği kritik bir araçtır. Bununla birlikte, literatürde fare yumurtalıklarındaki mutlak folikül sayıları raporları oldukça değişkendir, bu da verilerin karşılaştırılmasını ve/veya çoğaltılmasını zorlaştırır. Bunun nedeni, zorlanma, yaş, tedavi grupları gibi bir dizi faktörün yanı sıra kullanılan sayım yöntemlerindeki teknik farklılıklardır. Bu yazıda, histolojik bölümlerin hazırlanması ve fare yumurtalıklarındaki ilkel foliküllerin sayılması için iki farklı yöntem kullanarak adım adım bir öğretim kılavuzu sunuyoruz: [1] fraksiyonör / optik distör tekniğine dayanan stereoloji; ve [2] doğrudan sayım tekniği. Her yöntemin bazı temel avantajları ve dezavantajları vurgulanacak, böylece sahada tekrarlanabilirlik geliştirilebilir ve araştırmacıların çalışmaları için en uygun yöntemi seçmelerini sağlayacaktır.
Giriş
Yumurtalıktaki ilkel foliküller içinde depolanan olgunlaşmamış, meiyotik olarak tutuklanmış oositler, kadın germline için depolama birimidir ve bireyin yaşam boyu yumurtalık rezervini oluşturur. İlkel folikül sayıları1yaşla birlikte doğal olarak azalır veya alternatif olarak, hava, gıda ve sudaki bazı farmasötikler ve çevresel toksik maddeler de dahil olmak üzere ekzojen kimyasallara maruz kaldıktan sonra erken tükenebilir2. İlkel folikül sayısının sınırlı olduğu göz önüne alındığında, yumurtalıkta bulunan foliküllerin miktarı ve kalitesi büyük ölçüde kadın doğurganlığını ve yavru sağlığını belirler. Bu nedenle, kadınlarda ilkel folikül sayısının doğru ölçülmesi, eksojen hakaretlerin yumurtalık rezervi üzerindeki hedef dışı etkilerini değerlendirmek için gereklidir.
Kadınlarda, tüm yumurtalığın analizi genellikle mümkün değildir, bu nedenle yumurtalık rezervinin invaziv olmayan taşıyıcı önlemleri klinik bir ortamda kullanılmalıdır. Anti-Mϋllerian hormonu (AMH) klinik olarak en yaygın kullanılan taşıyıcı biyobelirteçtir3. Serum AMH düzeyleri genellikle ileri anne çağındaki kadınlarda veya kemoterapi gibi kanser tedavisinden önce ve sonra ölçülür. Bununla birlikte, AMH ilkel foliküller tarafından değil, büyüyen foliküller tarafından üretilir ve bu nedenle serum seviyeleri mutlak ilkel folikül sayısı hakkında bilgi vermemektedir.
Kadınlarda ilkel folikül sayısını doğru bir şekilde belirlemek için yöntemlerin bulunmaması ile in situ, kemirgenler gibi küçük hayvan modellerinde yumurtalık köklerini saymak, eksojen hakaretlerin ilkel foliküller ve dolayısıyla doğurganlık üzerindeki etkisini değerlendirmek için gerekli bir araştırma aracı olmaya devam etmektedir. Ne yazık ki, kemirgen modellerinde ilkel folikül sayılarının literatürü boyunca raporlar oldukça değişkendir4. Bunun önemli bir nedeni, kullanılan sayım yöntemindeki teknik farklılıklar yaygın olarak bildirilmektedir. Ağırlıklı olarak, literatürde farelerde ilkel foliküllerin numaralandırması için açıklanan iki farklı teknik vardır. Bunlar, fraksiyonatör optik disektör yöntemini kullanan stereoloji ve doğrudan folikül sayılarını içerir.
Stereology yaygın olarak kullanılan altın standart sistematik tekdüze rastgele örnekleme5, bütün fare veya sıçan yumurtalıkları4,6,7ilkel folikül sayısını ölçmenin en doğru yöntemidir. Stereology, ilgi çekici nesnenin üç boyutlu yapısını oluşturduğu için tarafsızdır8. Optik bir disektör/fraksiyonatör yöntemi kullanılarak, toplam fare yumurtalığının bilinen bir fraksiyonu içinde kalın doku bölümleri (örneğin, 20 μm) kullanılarak ilkel folikülleri ölçmek için üç örnekleme seviyesi uygulanır. İlk olarak, örnekleme aralığı rastgele bir başlangıçta (örneğin, her 3rd bölümde) seçilir (örnekleme fraksiyonu 1, f1)4. Bölümler daha sonra bu noktadan tüm yumurtalık boyunca sistematik, düzgün bir şekilde örneklenir. Daha sonra, tarafsız bir sayım çerçevesi yumurtalık bölümünün üzerine bindirilir ve tanımlı, randomize bir sayım ızgarası boyunca aşamalı olarak hareket ettirilir (örnekleme fraksiyonu 2, f2)8. Son olarak, kesit kalınlığının bilinen bir kısmı optik olarak örneklenir (örneğin, 10 μm) ve bu alandaki foliküller sayılır (örnekleme fraksiyonu 3, f3)4. Ham folikül sayısı, nihai değeri elde etmek için bu örnekleme fraksiyonlarının tersi ile çarpılır. Bu yöntem, stereolojik yazılım tarafından tahrik edilen motorlu bir aşamaya sahip bir mikroskop da dahil olmak üzere uzman eğitimi ve ekipmanı gerektirir. Dokular özel bir Bouin fiksatifinde korunmalı ve cam bıçaklı glikolmethakrilat reçine mikrotom kullanılarak kalın doku bölümlerinin kesilmesini sağlamak için glikolmethakrilat reçinesine gömülmelidir. Bu yöntem, yumurtalık ve foliküllerin üç boyutlu morfolojik yapısını en iyi şekilde korumak için doku büzülme ve deformasyonunu hesaba katmak için tasarlanmıştır9.
Doğrudan folikül sayımı, folikülleri saymak için en sık kullanılan yöntemdir10. Daha yaygın fiksatifler (formalin) kullanılabilir, ardından parafin balmumu gömme ve 4-6 μm arasında bir kalınlıkta standart bir mikrotom kullanılarak kapsamlı seri kesitler kullanılabilir. Foliküller tüm doku bölümünde tanımlanmış bir aralıkta sistematik olarak sayılır ve daha sonra toplam folikül tahminini elde etmek için örnekleme aralığının tersi ile çarpılır. Bu yöntem hızlı, kolaydır, arşivlenmiş dokular kullanılarak yapılabilir ve standart histolojik teknikler kullanılarak hazırlanabilir. Standart görüntüleme yeteneklerine sahip sadece bir ışık mikroskobu gerektirir. Bununla birlikte, bu avantajlara rağmen, doğrudan folikül sayımı, stereolojinin doğruluğundan ve katı sayım parametrelerinden yoksun olduğundan, araştırmacı önyargısına daha yatkın hale getirir. Ek olarak, dokular işlem sırasında büzülme ve deformasyona uğrayabilir, yumurtalığın bütünlüğünü ve morfolojisini bozabilir ve böylece folikül sınıflandırmasını ve nicelleştirmeyi zorlaştırabilir.
Bu makalenin amacı, fare yumurtalıklarındaki ilkel folikül sayısını nicel olarak değerlendirmek için yaygın olarak kullanılan iki yöntemi açıklamaktır: stereoloji ve doğrudan folikül sayımı. Alanımızda tekrarlanabilirliği artırmak ve araştırmacıların çalışmaları için en uygun sayım yöntemi hakkında bilinçli bir karar vermelerini sağlamak için bu iki yöntem için ayrıntılı protokoller sağlayacağız ve bazı güçlü ve zayıf yönlerini vurgulayacağız.
Protokol
Yumurtalıklar dişi C57BL6J farelerinden toplanarak elde edildi. Tüm hayvan prosedürleri ve deneyleri NHMRC Avustralya Hayvanların Bakımı ve Kullanımı Uygulama Kuralları'na uygun olarak gerçekleştirilmesi ve Monash Hayvan Araştırma Platformu Hayvan Etik Komitesi tarafından onaylanması.
NOT: Bu raporda, aynı hayvandaki iki sayım yöntemini karşılaştırmak için stereoloji 11 ve doğrudansayımlar 12 ,13kullanılarak belirlenen ilkel folikül oositlerini tükendiğini gösteren bir kemoterapi ajanı kullanılmıştır. Kadın, 8 haftalık (genç yetişkin) fareler, siklofosfaminit veya tuzlu araç kontrolünün (n=5/grup) 75 mg/kg/vücut ağırlığına sahip tek bir intraperitoneal enjeksiyondan önce tartıldı. Bu dozun ilkel foliküllerin yaklaşık% 50 tükenmesine neden olduğu gösterilmiştir, ancak farelerde morbidite veya mortaliteye neden olduğubildirilmemiştir 14. Yumurtalıklar tedaviden 48 saat sonra hasat edildi. Her hayvandan bir yumurtalık 24 saat boyunca% 10 (v / v) nötr tamponlu formalin çözeltisinde, diğeri ise Bouin'in çözeltisinde 24 saat boyunca sabitlendi. Doku daha sonra glikolmethakrilat reçinesine gömüldü ve seri olarak 20 μm'de veya parafin ve seri olarak 5 μm'de bölümlere yerleştirildi. Tüm dokular periyodik asit Schiff ve hematoksilin ile boyandı.
1. Histolojik hazırlık: sabitleme, işleme, gömme ve fare yumurtalıklarını bölümleme
- Yumurtalığın kendisine zarar vermeden veya kesmeden, yumurtalığı ve çevresindeki tüm yağı keserek fare yumurtalıklarını parçalara ayrıştırın. Gerekirse, bu adım için bir diseksiyon mikroskobu ve ince bıçak kullanın (Şekil 1A).
- Dokuları% 70 etanol içine aktarmadan önce, Bouin'in fiksatif (stereolojisi) veya formalin fiksatif (doğrudan sayımları) içeren küçük bir etiketli tüpe 24 saat boyunca(Şekil 1B)yerleştirerek dokuları hemen düzeltin.
NOT: Folikül morfolojisi en iyi Bouin'in glikolmethakrilat reçinesine gömülü sabit yumurtalık dokusunda korunur (Şekil 2). - Tüm sabit yumurtalıkları işleyin ve daha sonra standart bir histolojik protokol kullanarak doğrudan sayımlar için glikolmethakrilat reçinesine(Ek Dosya 1) veya parafin balmumuna gömün.
DİkKAT: Reçine toksiktir, bu nedenle tüm doku işleme adımlarının duman kaputunda gerçekleştirilmesini ve eldivenlerin her zaman giyilmesini sağlayın. - Kalın glikolmethakrilat reçine bölümlerini (örneğin, 20 μm) kapsamlı bir şekilde kesmek için cam bıçakla (Şekil 1D) donatılmış özel bir reçine methakrilat mikrotom ( Şekil1C) kullanın. Bölümleri düzenli aralıklarla (örneğin, her 3rd bölümde) stereoloji için cam mikroskop slaytları üzerine toplayın.
- İnce parafin bölümlerini kesmek için standart bir mikrotom kullanın (örneğin, 4-6 μm). Doku bölümlerini düzenli aralıklarla (örneğin, her9. bölümde bir) doğrudan folikül sayısı için cam mikroskop kaydırağından toplayın.
- Slaytları periyodik asit Schiff ve hematoksilin ile lekeleyin (Ek Dosya 2).
- Parafin bölümleri için standart DPX veya glikolmethakrilat reçine bölümleri için kalın DPX ile kapak (Şekil 1E).
DİkKAT: Glikolmethakrilat reçine DPX tehlikelidir, bu nedenle bu adımı davlumbaz dumanlamak için gerçekleştirin.
NOT: Glikolmethakrilat reçine DPX son derece viskozdur. Cam kapak, DPX'in eşit ve ince bir şekilde dağıldığından ve kapak kılıfı altında hava kabarcıkları olmadığından emin olmak için bir spatula ile bastırılarak sıkıca tutturılmalıdır (Şekil 1F).
2. Optik fraksiyonatör kullanılarak ilkel folikül sayısının stereolojik tahmini
- Bilgisayarı, çoklu kontrol ünitesini, kamerayı ve stereoloji kurulumundaki ışık kaynağını açın ve mikroskop hedefini düşük büyütmeye (örn. 10x) ayarlayın.
- Stereology yazılımını açın.
- İlk slaytı mikroskop aşamasına güvenli bir şekilde koyun.
- Kamera Ayarları panelinde Pozlama altında Otomatik'i kontrol derek ışık pozlamasını ayarlayın(Tamamlayıcı Şekil 1A). Alternatif olarak, ışığa maruz kalmayı manuel olarak ayarlayın.
- İlk doku örneğini bulmak ve numuneyi odak noktasına getirmek için joystick'i kullanın.
- Beyaz dengesini, Diğer Ayarlar'a tıklayarak (Kamera Ayarları panelinin sağ alt kısmında bulunur) ve ardından Beyaz Dengesi'ne tıklayın ve Otomatik (Tamamlayıcı Şekil 1B)'e tıklayın. Alternatif olarak, bölümde beyaz bir alan seçerek beyaz dengesini el ile ayarlamak için Diğer Ayarlar düğmesinin (veya Diğer Ayarlar'da Alan Seç) bitişik Beyaz Dengesi düğmesini tıklatın.
- Problar açılır menüsüne gidin ve Optik Kesirleyici İş Akışı'nı tıklatın. Ardından Yeni Projeyi Başlat'ı ve Tamam'ı tıklatın.
- Varolan bir örnekleme yapılandırması kaydedilmişse, Örnekleme Parametreleri'nin altında Evet | ... ve istediğiniz örnekleme yapılandırmasını seçin.
- Değilse, Hayır'ı tıklatın ve seri bölüm bilgilerini (Tamamlayıcı Şekil 1C)el ile girin ve 2.13.
- İleri'ye tıklayın, mikroskobu Düşük Büyütme olarak ayarlayın ve açılır menüden 10x büyütmeyi seçin.
- İleri'ye tıklayın ve sonra tüm yumurtalık bölümünün etrafını takip edin - bölümün etrafına sol tıklayarak başlayın ve sonunda sağ tıklatın ve Kontur Kapat'ı seçin.
- İleri'ye tıklayın, mikroskobu Yüksek Büyütme olarak ayarlayın ve açılır menüden 100x Yağ büyütmeyi seçin.
- Slayttaki doku bölümüne bir damla yağ yerleştirin ve mikroskop hedefini 100x büyütmeye taşıyın.
- Işığa pozlamayı ayarlayın (adım 2.4'te olduğu gibi) ve İleri 'yitıklatın.
- Prob yapılandırmasını tanımlamak için Örnekleme Parametrelerini ayarlayın. Burada, sayım çerçevesi 47,5 μm x 47,5 μm (2,256,25 μm2)olarak ayarlanmış ve adım uzunluğu 100 μm x 100 μm (10.000 μm2) ( Ek Şekil 2 ) olarakayarlanmıştır. Örnekleme parametreleri oluşturulduktan sonra şablonu kaydedin ve 2.7.
- Saymaya Başla 'ya tıklayın (Tamamlayıcı Şekil 1D). Örneğin en üstüne odaklanın, Tamam'ı tıklatın ve saymaya başlayın.
- 10 μm örnekleme derinliğinde hareket etmek ve oosit çekirdeği odak noktasına gelen ilkel kökleri saymak için odaklama düğmesini kullanın. Sonraki alana geçmek için İleri'yi tıklatın.
- Oosit skuamöz (düzleştirilmiş) granüloza hücreleri ile çevriliyse, ancak küboidal granüloza hücreleri yoksa folikülleri ilkel olarak sınıflandırın (Şekil 2A).
NOT: İlkel foliküller, ağırlıklı olarak küboidal granüloza hücreleri ile çevrili olan küboidal ve skuamöz granüloza hücrelerinin(Şekil 2B)ve birincil foliküllerin birleşiminden oluşan ara/geçiş köklerinden farklıdır (Şekil 2C). Bu folikül sınıfları ayrı ayrı ölçülmelidir. - Sadece oosit çekirdeğinin görünür olduğu folikülleri sayın. Oosit çekirdeği sayım çerçevesinde görünmeli veya sayım çerçevesinin yeşil ekleme satırlarına dokunmalıdır(Tamamlayıcı Şekil 1E,F).
- Oosit çekirdeği sayım çerçevesinin dışına düşerse (Tamamlayıcı Şekil 1G) veya sayım çerçevesinin kırmızı dışlama çizgilerine dokunursa, bu folikülü saymayın.
- Eksojen bir kimyasala (örneğin kemoterapi) yanıt olarak ilkel folikül tükenmesini değerlendirirken, sayılan tüm foliküllerin sağlıklı olduğundan ve böylece normal morfolojiye sahip olduğundan emin olun (Şekil 2). Anormal veya atretic folikülleri ayrı ayrı sayın. Genellikle, folikül ölümü kemoterapi gibi hakaretlerle tetiklenmiştir ve atretic foliküllerin nicelliği, sadece sağlıklı foliküller yumurtalık rezervini oluşturduğundan, sağlıklı ve atretic folikülleri ayırt etmek için ayrı ayrı elde edilmelidir15.
- Oosit skuamöz (düzleştirilmiş) granüloza hücreleri ile çevriliyse, ancak küboidal granüloza hücreleri yoksa folikülleri ilkel olarak sınıflandırın (Şekil 2A).
- Bu bölümde sayım tamamlandıktan sonra aşağıdakilerden birini yapın:
- Yeni Bölüm Ekle 'yitıklatın ve sonraki bölümü sayım için ayarlamak üzere 2.3.
- Oturumu sonlandırmak için Sayımı Bitirdim'i tıklatın. Hedefi 10x'e döndürün, stereoloji yazılımından çıkın ve ışık kaynağını, kamerayı, çoklu kontrol birimini ve bilgisayarı kapatın.
- Tüm yumurtalıktan örneklenmiş her doku bölümünden toplam ham folikül numarasını (Q) alın, ardından bir elektronik tablo kullanarak, her çoğaltma hayvanından (N)4'tennihai değeri elde etmek için aşağıdaki denklemi kullanın.
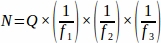 nerede:
nerede:
N = Yumurtalık içindeki toplam tahmini folikül sayısı.
S = Ham ilkel folikül sayısı.
f1 = Örnekleme aralığı. Her 3rd bölüm böylece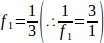 örneklenmiş.
örneklenmiş.
f2 = Sayım çerçevesi (örnek alan) ve step arasındaki ilişki, olarak hesaplanır. Numune alanı 2256 μm 2 (47,5μm x 47,5 μm) ve step alanı 10000 μm2 (100 μm x 100 μm),
hesaplanır. Numune alanı 2256 μm 2 (47,5μm x 47,5 μm) ve step alanı 10000 μm2 (100 μm x 100 μm),  .
.
f3 = Yumurtalık kesiri örneklenmiş. 20 μm'lik bölümün 10 μm'si örneklendiklerinden,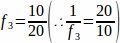 .
.
Bu nedenle,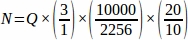 .
.
NOT: Bu protokol, yaygın olarak atıfta bulunulan bir stereoloji yazılımı kullanılarak bu stereolojik analizilkelerininnasıl uygulanacağını açıklar ( Malzeme Tablosu ); ancak, başka stereolojik yazılımlar mevcuttur. Yumurtalık köklerinin stereolojik analizleri sırasında uygulanan ilkeler, parametreleri ayarlamak için kullanılan yazılımdan bağımsız olarak aynıdır. Stereology en doğru 100 veya daha fazla nesne yetişkin bir fare yumurtalığında sayıldığında4, bu% 10'un altındaki tahmin için bir hata katsayısı verir16. Burada özetlenen örnekleme parametreleri, yetişkin vahşi tip C57BL6J yumurtalıklarının kontrol altında sayılabilmesi için en az 100 nesnenin (yani ilkel, geçiş ve birincil foliküller) sayılabilmesini sağlamak için optimize edilmiştir. Analiz edilecek bölümlerin aralığı ve sayısı ve örneklenen bölümlerdeki optik disissektör sayısı gibi en uygun örnekleme parametrelerini belirlemek için küçük bir örnekleme boyutu içeren bir pilot çalışma yapılabilir17.
3. İlkel folikül sayısının doğrudan yumurtalık folikül sayılarının tahmini
- Mikroskop kaydıramasını standart bir ışık mikroskobu altına güvenli bir şekilde yerleştirin ve ham ilkel folikül numarası elde etmek için doğrudan sayımlar gerçekleştirin.
- Oosit açıkça görünüyorsa ve skuamöz (düzleştirilmiş) granüloza hücreleri ile çevriliyse, ancak küboidal granüloza hücreleri yoksa folikülleri ilkel olarak sınıflandırın (Şekil 2D).
NOT: İlkel foliküller, ağırlıklı olarak küboidal granüloza hücreleri ile çevrili olan küboidal ve skuamöz granüloza hücrelerinin(Şekil 2E)ve birincil foliküllerin bir kombinasyonunu içeren ara/geçiş köklerinden farklıdır (Şekil 2F). Bu folikül sınıfları ayrı ayrı ölçülmelidir. - Sayılan tüm foliküllerin sağlıklı olduğundan ve böylece normal morfolojiye sahip olduğundan emin olun (Şekil 2). Sadece sağlıklı foliküller yumurtalık rezervini oluşturduğundan, anormal veya atretic folikülleri ayrı ayrı sayın.
- Oosit açıkça görünüyorsa ve skuamöz (düzleştirilmiş) granüloza hücreleri ile çevriliyse, ancak küboidal granüloza hücreleri yoksa folikülleri ilkel olarak sınıflandırın (Şekil 2D).
- Alternatif olarak, görüntü dosyalarını açarak sayımları gerçekleştirmek için tüm yumurtalık dokusu bölümünün birden fazla veya dikişli yüksek güçlü (örneğin, 20x) fotomikrograflarını alın. Bu, el ile veya otomatik slayt tarayıcısı kullanılarak yapılabilir.
- Önceden belirlenmiş aralıkta tüm yumurtalıktan örneklenen her doku bölümünden toplam ham folikül sayısını (Q) alın. Aşağıdaki denklemi kullanarak her çoğaltma hayvanının (N) son değerini elde etmek için bu sayıyı örnekleme kesirinin tersiyle çarpın.
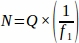 nerede:
nerede:
N = Yumurtalık içindeki toplam tahmini folikül sayısı.
S = Ham folikül sayısı (her bir türün ayrı ayrı hesaplanmıştır).
f1 = Örnekleme aralığı. Her9. bölümden böylece örneklenmiş.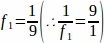
Bu nedenle,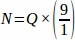 .
.
Sonuçlar
Genç yetişkin dişi farelere tek doz siklofosfaminid kemoterapisi veya salin araç kontrolü (n=5/grup) uygulandığı ve her iki yumurtalığın 48 saat sonra her hayvandan toplandığı iyi karakterize edilmiş bir folikül tükenme modeli kullanılmıştır. İki yöntemin her biri için Adım 1'de açıklandığı gibi hayvan başına bir yumurtalık hazırlandı: stereoloji veya doğrudan sayımlar. Her hayvanın sol ve sağ yumurtalığı her gruba rastgele atandı. Bu veriler, stereoloji kullanırken, kemoterapi...
Tartışmalar
Bu makalede, fare ilkel folikülleri, stereolojiyi ve daha yaygın olarak kullanılan doğrudan folikül sayma yöntemini numaralandırmak için altın standart tekniği için adım adım bir protokol sağlanmıştır. Kemoterapi tedavisi, sol ve sağ yumurtalık içinde bu iki farklı yöntemden elde edilen sonuçları aynı hayvandan karşılaştırmak ve karşılaştırmak için kullanılmıştır. Her iki yöntem de ilkel folikül sayılarında hayvanlar arası yüksek değişkenliği ortaya koydu. Yumurtalık rezerv...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma Victoria Eyalet Hükümeti Operasyonel Altyapı Desteği ve Avustralya Hükümeti NHMRC IRIISS aracılığıyla mümkün oldu ve Ulusal Sağlık ve Tıbbi Araştırma Konseyi (ALW #1120300) ve Avustralya Araştırma Konseyi 'nden (KJH #FT190100265) finanse edildi. Yazarlar Monash Hayvan Araştırma Platformu, Monash Histoloji Platformu ve Monash Mikro Görüntüleme tesisinin teknik desteğini kabul etmek istiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1-Butanol (HPLC) | Fisher Chemical | #A383-1 | |
| Acid alcohol | Amber Scientific | #ACDL | |
| Bouin’s fixative | Sigma-Aldrich | #HT10132 | Picric acid 0.9% (w/v), formaldehyde 9% (v/v), acetic acid 5% (w/v) |
| Cyclophosphamide | Sigma-Aldrich | #C0768-5G | |
| Dibutylphthalate Polystyrene Xylene (DPX) | Sigma-Aldrich | #06522 | |
| Ethanol | Amber Scientific | #ETH | Ethanol 100% |
| Micro Feather opthalmic scalpel with aluminium handle | Designs for Vision | #FEA-745-SR | Feather blade for dissections (seen in Figure 1) |
| Formalin fixative | Australian Biostain | #ANBFC | |
| Glass coverslip | Thermo Scientific | #MENCS22501GP | 22 mm x 50 mm |
| Glycomethacrylate resin RM2165 microtome | Leica Microsystems | #RM2165 | |
| Glycolmethacrylate DPX | *made in house | *Mix 1.5 L Xylene; 800 g polystyrene pellets; 100mL Dibutyl phthalate for 3 weeks | |
| Histolene | Trajan | #11031 | |
| Mayer’s haematoxylin | Amber Scientific | #MH | |
| Olympus BX50 microscope | Olympus | #BX50 | Brightfield microscope fitted with 10x dry & 100x oil immersion objective (numerical aperture 1.3) |
| Olympus immersion oil type-F | Olympus | #IMMOIL-F30CC | |
| Olympus TH4-200 light source | Olympus | #TH4-200 | |
| Paraffin wax | Sigma-Aldrich | #03987 | |
| Periodic acid | Trajan | #PERI1% | Periodic acid 1% |
| Rotary Microtome CUT 4060 | MicroTec | #4060R/F | Used to cut paraffin sections |
| Schiff’s reagent | Trajan | #SCHF | |
| Scott's tap water | Amber Scientific | #SCOT | Potassium carbonate, magnesium sulphate, water |
| StereoInvestigator Stereological System | MBF Bioscience | Includes StereoInvestigator software, multi-control unit, automatic stage and joystick | |
| Superfrost microscope slides | Thermo Scientific | #MENSF41296SP | 1 mm, 72 pcs |
| Technovit 7100 Plastic embedding system | Emgrid Australia | #64709003 | 500 mL/5 x 1 g/40 mL |
| Technovit 3040 yellow | Emgrid Australia | #64708805 | 100 g/80 mL |
Referanslar
- Stringer, J. M., Winship, A., Liew, S. H., Hutt, K. The capacity of oocytes for DNA repair. Cellular and Molecular Life Sciences. 75 (15), 2777-2792 (2018).
- Winship, A. L., Stringer, J. M., Liew, S. H., Hutt, K. J. The importance of DNA repair for maintaining oocyte quality in response to anti-cancer treatments, environmental toxins and maternal ageing. Human Reproduction Update. 24 (2), 119-134 (2018).
- Broer, S. L., Broekmans, F. J., Laven, J. S., Fauser, B. C. Anti-Mullerian hormone: ovarian reserve testing and its potential clinical implications. Human Reproduction Update. 20 (5), 688-701 (2014).
- Myers, M., Britt, K. L., Wreford, N. G., Ebling, F. J., Kerr, J. B. Methods for quantifying follicular numbers within the mouse ovary. Reproduction. 127 (5), 569-580 (2004).
- Boyce, R. W., Dorph-Petersen, K. A., Lyck, L., Gundersen, H. J. Design-based stereology: introduction to basic concepts and practical approaches for estimation of cell number. Toxicologic Pathology. 38 (7), 1011-1025 (2010).
- Ristic, N., et al. Maternal dexamethasone treatment reduces ovarian follicle number in neonatal rat offspring. Journal of Microscopy. 232 (3), 549-557 (2008).
- Soleimani Mehranjani, M., Mansoori, T. Stereological study on the effect of vitamin C in preventing the adverse effects of bisphenol A on rat ovary. International Journal of Reproductive Biomedicine (Yazd). 14 (6), 403-410 (2016).
- Brown, D. L. Bias in image analysis and its solution: unbiased stereology. Journal of Toxicologic Pathology. 30 (3), 183-191 (2017).
- Hasselholt, S., Lykkesfeldt, J., Overgaard Larsen, J. Thick methacrylate sections devoid of lost caps simplify stereological quantifications based on the optical fractionator design. Anatomical Record (Hoboken). 298 (12), 2141-2150 (2015).
- Tilly, J. L. Ovarian follicle counts--not as simple as 1, 2, 3. Reproductive Biology and Endocrinology. 1, 11 (2003).
- Nguyen, Q. N., et al. Loss of PUMA protects the ovarian reserve during DNA-damaging chemotherapy and preserves fertility. Cell Death and Disease. 9 (6), 618 (2018).
- Meirow, D., Assad, G., Dor, J., Rabinovici, J. The GnRH antagonist cetrorelix reduces cyclophosphamide-induced ovarian follicular destruction in mice. Human Reproduction. 19 (6), 1294-1299 (2004).
- Winship, A. L., et al. The PARP inhibitor, olaparib, depletes the ovarian reserve in mice: implications for fertility preservation. Human Reproduction. , (2020).
- Meirow, D., Lewis, H., Nugent, D., Epstein, M. Subclinical depletion of primordial follicular reserve in mice treated with cyclophosphamide: clinical importance and proposed accurate investigative tool. Human Reproduction. 14 (7), 1903-1907 (1999).
- Nguyen, Q. N., et al. Cisplatin- and cyclophosphamide-induced primordial follicle depletion is caused by direct damage to oocytes. Molecular Human Reproduction. , (2019).
- Gundersen, H. J., Jensen, E. B. The efficiency of systematic sampling in stereology and its prediction. Journal of Microscopy. 147, 229-263 (1987).
- Olesen, M. V., Needham, E. K., Pakkenberg, B. The Optical Fractionator Technique to Estimate Cell Numbers in a Rat Model of Electroconvulsive Therapy. Journal of Visualized Experiments. (125), e55737 (2017).
- Findlay, J. K., Hutt, K. J., Hickey, M., Anderson, R. A. How Is the Number of Primordial Follicles in the Ovarian Reserve Established. Biology of Reproduction. 93 (5), 111 (2015).
- Omari, S., et al. Mcl-1 is a key regulator of the ovarian reserve. Cell Death and Disease. 6, 1755 (2015).
- Winship, A. L., Bakai, M., Sarma, U., Liew, S. H., Hutt, K. J. Dacarbazine depletes the ovarian reserve in mice and depletion is enhanced with age. Scientific Reports. 8 (1), 6516 (2018).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. An accurate, simple method for unbiased determination of primordial follicle number in the primate ovary. Biology of Reproduction. 56 (4), 909-915 (1997).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. Morphometric analysis of primordial follicle number in pigtailed monkey ovaries: symmetry and relationship with age. Biology of Reproduction. 61 (2), 553-556 (1999).
- Charleston, J. S., et al. Estimating human ovarian non-growing follicle number: the application of modern stereology techniques to an old problem. Human Reproduction. 22 (8), 2103-2110 (2007).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and nongrowing follicle counts according to the Stages of Reproductive Aging Workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Hansen, K. R., et al. A new model of reproductive aging: the decline in ovarian non-growing follicle number from birth to menopause. Human Reproduction. 23 (3), 699-708 (2008).
- Sonigo, C., et al. High-throughput ovarian follicle counting by an innovative deep learning approach. Scientific Reports. 8 (1), 13499 (2018).
- McKey, J., Cameron, L. A., Lewis, D., Batchvarov, I. S., Capel, B. Combined iDISCO and CUBIC tissue clearing and lightsheet microscopy for in toto analysis of the adult mouse ovarydagger. Biology of Reproduction. 102 (5), 1080-1089 (2020).
- Kagami, K., Shinmyo, Y., Ono, M., Kawasaki, H., Fujiwara, H. Three-dimensional evaluation of murine ovarian follicles using a modified CUBIC tissue clearing method. Reproductive Biology and Endocrinology. 16 (1), 72 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır