Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Dénombrement précis des follicules chez les ovaires de souris adultes
Dans cet article
Résumé
Ici, nous décrivons, comparons, et contrastons deux techniques différentes pour le comptage précis de follicule des tissus ovariens fixes de souris.
Résumé
Les mammifères femelles se reproduisant sexuellement naissent avec tout leur approvisionnement en ovocytes tout au long de leur vie. Les ovocytes immatures et tranquilles se trouvent dans les follicules primordiaux, l’unité de stockage de la lignée germinale femelle. Ils ne sont pas renouvelables, donc leur nombre à la naissance et le taux de perte qui en résulte dictent en grande partie la durée de vie fertile des femelles. Une quantification précise du nombre de follicules primordiaux chez les femmes et les animaux est essentielle pour déterminer l’impact des médicaments et des toxiques sur la réserve ovarienne. Elle est également nécessaire pour évaluer la nécessité et le succès des techniques existantes et émergentes de préservation de la fertilité. Actuellement, aucune méthode n’existe pour mesurer avec précision le nombre de follicules primordiaux comprenant la réserve ovarienne chez les femmes. En outre, il n’est souvent pas possible d’obtenir du tissu ovarien de gros animaux ou d’espèces en voie de disparition à des fins expérimentales. Ainsi, les souris sont devenues un modèle essentiel pour de telles études, et la capacité d’évaluer le nombre primordial de follicules dans les ovaires entiers de souris est un outil essentiel. Cependant, les rapports du nombre absolu de follicules dans les ovaires de souris dans la littérature sont très variables, ce qui rend difficile la comparaison et/ou la réplication des données. Cela est dû à un certain nombre de facteurs, y compris la souche, l’âge, les groupes de traitement, ainsi que les différences techniques dans les méthodes de comptage utilisées. Dans cet article, nous fournissons un guide d’instruction étape par étape pour la préparation des sections histologiques et le comptage des follicules primordiaux dans les ovaires de souris en utilisant deux méthodes différentes: [1] stéréologie, qui repose sur la technique de fractionnement / dissecteur optique; et [2] la technique du comptage direct. Certains des principaux avantages et inconvénients de chaque méthode seront mis en évidence afin que la reproductibilité puisse être améliorée sur le terrain et pour permettre aux chercheurs de choisir la méthode la plus appropriée pour leurs études.
Introduction
Les ovocytes immatures et méiotically-arrêtés stockés dans les follicules primordiaux dans l’ovaire sont l’unité de stockage pour la lignée germinale femelle et comprennent la réserve ovarienne à vie d’un individu. Le nombre de follicules primordiaux diminue naturellement avec l’âgede 1, ou bien, peut être prématurément épuisé à la suite d’une exposition à des produits chimiques exogènes, y compris certains produits pharmaceutiques et toxiques environnementaux dans l’air, les aliments et l’eau2. Étant donné que le nombre de follicules primordiaux est fini, la quantité et la qualité des follicules présents dans l’ovaire déterminent en grande partie la fertilité féminine et la santé de la progéniture. Ainsi, la quantification précise du nombre primordial de follicule chez les femmes est essentielle pour évaluer les impacts hors cible des insultes exogènes sur la réserve ovarienne.
Chez les femmes, l’analyse de l’ovaire entier n’est généralement pas possible, ainsi des mesures de substitution non invasives de la réserve ovarienne doivent être utilisées dans un cadre clinique. L’hormone anti-Mϋllerienne (AMH) est le biomarqueur de substitution le plus largement utilisé cliniquement3. Les taux sériques d’AMH sont souvent mesurés chez les femmes d’âge maternel avancé, ou avant et après le traitement du cancer, comme la chimiothérapie. Cependant, l’AMH est produite par la croissance des follicules et non par les follicules primordiaux, et ainsi, les niveaux de sérum n’informent pas sur le nombre absolu de follicules primordiaux.
En l’absence de méthodes pour déterminer avec précision le nombre de follicules primordiaux chez les femmes in situ,le comptage des follicules ovariens chez les petits modèles animaux, tels que les rongeurs, reste un outil de recherche essentiel pour évaluer le degré d’impact des insultes exogènes sur les follicules primordiaux et donc sur la fertilité. Malheureusement, les rapports dans toute la littérature sur les nombres primordiaux de follicules dans les modèles de rongeurs sont très variables4. L’une des principales raisons en est les différences techniques largement rapportées dans la méthode de comptage utilisée. Principalement, il existe deux techniques différentes décrites dans la littérature pour énumérer les follicules primordiaux chez la souris. Ceux-ci incluent la stéréologie, qui utilise la méthode du dissecteur optique du fractionneur, et le nombre direct de follicules.
La stéréologie est largement considérée comme l’étalon-or car elle utilise un échantillonnage aléatoire uniforme systématique5,ce qui en fait la méthode la plus précise de quantification du nombre de follicules primordiaux chez les ovaires entiers de souris ou de rats4,6,7. La stéréologie est impartiale, car elle tient compte de la structure tridimensionnelle de l’objet d’intérêt8. À l’aide d’une méthode de dissecteur/fractionneur optique, trois niveaux d’échantillonnage sont appliqués pour quantifier les follicules primordiaux à l’aide de sections tissulaires épaisses (p. ex. 20 μm) dans une fraction connue de l’ovaire total de la souris. Tout d’abord, l’intervalle d’échantillonnage est choisi (par exemple, chaque3ème section) à un départ aléatoire (fraction d’échantillonnage 1, f1)4. Les sections sont ensuite échantillonnées de manière systématique et uniforme à partir de ce point à travers l’ovaire entier. Ensuite, une base de comptage non biaisée se superpose à la section ovarienne et se déplace progressivement le long d’une grille de comptage définie et randomisée (fraction d’échantillonnage 2,f2)8. Enfin, une fraction connue de l’épaisseur de la section est échantillonnée optiquement (par exemple, 10 μm) et les follicules à l’intérieur de cette zone sont comptés (fraction d’échantillonnage 3,f3)4. Le nombre de follicules bruts est multiplié par l’inverse de ces fractions d’échantillonnage pour obtenir la valeur finale. Cette méthode nécessite une formation et un équipement d’experts, y compris un microscope avec un étage motorisé piloté par un logiciel téréologique. Les tissus doivent être conservés dans un fixateur de Bouin spécialisé et incorporés dans de la résine de glycolméthacrylate pour permettre de couper des sections de tissus épaisses à l’aide d’un microtome de résine de glycolméthacrylate avec un couteau en verre. Cette méthode est conçue pour tenir compte du rétrécissement et de la déformation des tissus, afin de préserver au mieux la structure morphologique tridimensionnelle de l’ovaire et des follicules9.
Le comptage direct des follicules est la méthode la plus fréquemment utilisée pour compter les follicules10. Des fixateurs plus courants (c.-à-d. le forcine) peuvent être utilisés, suivis de l’encastrement de cire de paraffine et du sectionnement exhaustif en série à l’aide d’un microtome standard à une épaisseur comprise entre 4 et 6 μm. Les follicules sont systématiquement comptés dans toute la section tissulaire à un intervalle défini, puis multipliés par l’inverse de l’intervalle d’échantillonnage pour obtenir l’estimation du follicule total. Cette méthode est rapide, facile, peut être réalisée à l’aide de tissus archivés et préparée à l’aide de techniques histologiques standard. Il ne nécessite qu’un microscope optique avec des capacités d’imagerie standard. Cependant, en dépit de ces avantages, le comptage direct de follicule manque de la précision et des paramètres stricts de comptage de la stéréologie, ce qui le rend plus enclin au biais d’investigateur. En outre, les tissus peuvent subir un rétrécissement et une déformation pendant le traitement, perturbant l’intégrité et la morphologie de l’ovaire et rendant ainsi la classification et la quantification des follicules difficiles.
Le but de cet article est de décrire deux méthodes couramment utilisées pour évaluer quantitativement le nombre primordial de follicule dans les ovaires de souris : stéréologie et comptage direct de follicule. Nous fournirons des protocoles détaillés pour ces deux méthodes et mettrons en évidence certaines de leurs forces et faiblesses, afin d’améliorer la reproductibilité dans notre domaine et de permettre aux chercheurs de prendre une décision éclairée quant à la méthode de comptage la plus appropriée pour leurs études.
Protocole
Des ovaires ont été prélevés sur des souris femelles C57BL6J. Toutes les procédures et expériences sur les animaux ont été effectuées conformément au code de pratique australien NHMRC pour le soin et l’utilisation des animaux et approuvées par le comité d’éthique animale de la plate-forme de recherche sur les animaux Monash.
REMARQUE: Un agent chimiothérapeutique montré pour épuiser les ovocytes primordiaux de follicule, tel que déterminé utilisant la stéréologie11 et les comptes directs12,13 a été employé dans ce rapport pour comparer les deux méthodes de comptage chez le même animal. Des souris femelles, âgées de 8 semaines (jeunes adultes) ont été pesées avant une injection intrapéritonéale simple de 75 mg/kg/poids corporel de cyclophosphamide, ou un contrôle de véhicule salin (n = 5/groupe). Il a été démontré que cette dose provoque un épuisement d’environ 50% des follicules primordiaux, mais n’a pas été signalée comme entraînant une morbidité ou une mortalité chez la souris14. Les ovaires ont été récoltés 48 heures après traitement. Un ovaire de chaque animal a été fixé dans une solution de forcine tamponnée neutre à 10% (v/v) pendant 24 heures, et l’autre fixé dans la solution de Bouin pendant 24 heures. Les tissus ont ensuite été incorporés dans de la résine de glycolméthacrylate et sectionnés en série à 20 μm, ou dans de la paraffine et sectionnés en série à 5 μm. Tous les tissus ont été souillés avec schiff acide périodique et haematoxylin.
1. Préparation histologique: fixation, traitement, incorporation et sectionnement des ovaires de souris
- Disséquer les ovaires de la souris en coupant l’oviducte et toute la graisse environnante, sans endommager ou couper l’ovaire lui-même. Si nécessaire, utilisez un microscope à dissection et une lame fine pour cette étape(Figure 1A).
- Fixer les tissus immédiatement en les plaçant dans un petit tube marqué contenant soit le fixateur de Bouin (stéréologie), soit le fixateur de forcén (comptes directs) pendant 24 heures(figure 1B),avant de transférer les tissus dans de l’éthanol à 70 %.
REMARQUE: La morphologie du follicule est mieux conservée dans le tissu ovarien fixe de Bouin, incorporé dans la résine de glycolméthacrylate (Figure 2). - Traiter des ovaires fixes entiers, puis les incorporer dans la résine glycolméthacrylate pour la stéréologie(fichier supplémentaire 1),ou de la cire de paraffine pour les comptages directs à l’aide d’un protocole histologique standard.
ATTENTION: La résine est toxique, alors assurez-vous que toutes les étapes de traitement des tissus sont effectuées dans une hotte et que les gants sont portés en tout temps. - Utiliser un microtome spécialisé en méthacrylate de résine(figure 1C)muni d’un couteau en verre(figure 1D)pour couper de façon exhaustive des sections épaisses de résine de glycolméthacrylate (p. ex. 20 μm). Recueillir les sections à intervalles réguliers (par exemple, chaque3ème section) sur des lames de microscope en verre pour la stéréologie.
- Utilisez un microtome standard pour couper de fines sections de paraffine (p. ex. 4 à 6 μm). Recueillir des sections de tissu à intervalles réguliers (p. ex., chaque 9e section) sur une lame de microscope en verre pour le compte direct de follicules.
- Colorer les lames avec de l’acide périodique Schiff et de l’hématoxyline (Dossier supplémentaire 2).
- Lamelle de couverture avec DPX standard pour les sections de paraffine, ou DPX épais pour les sections de résine de glycolméthacrylate (Figure 1E).
ATTENTION: La résine de glycolméthacrylate DPX est dangereuse, alors effectuez cette étape pour fumer le capot.
REMARQUE: La résine de glycolméthacrylate DPX est extrêmement visqueuse. La lamelle de couverture en verre doit être collée fermement en la pressant vers le bas avec une spatule pour s’assurer que le DPX est uniformément et finement dispersé, et qu’il n’y a pas de bulles d’air sous la lamelle de couverture(Figure 1F).
2. Estimation histologique du nombre de follicules primordiaux à l’aide du fractionneur optique
- Allumez l’ordinateur, l’unité de contrôle multiple, la caméra et la source lumineuse dans la configuration stéréology et réglez l’objectif du microscope sur un faible grossissement (par exemple, 10x).
- Ouvrez le logiciel de stéréologie.
- Placez la première lame solidement sur l’étage du microscope.
- Réglez l’exposition à la lumière en cochant Automatique sous Exposition dans le panneau Paramètres de la caméra (Figure 1A supplémentaire). Vous pouvez également ajuster manuellement l’exposition à la lumière.
- Utilisez le joystick pour localiser le premier échantillon de tissu et mettre l’échantillon au point.
- Réglez la balance des blancs, soit en cliquant sur Plus de paramètres (situé en bas à droite du panneau Paramètres de la caméra), puis cliquez sur Balance des blancs et cliquez sur Automatique (Figure supplémentaire 1B). Vous pouvez également cliquer sur le bouton Balance des blancs adjacent au bouton Plus de paramètres (ou Sélectionner une zone dans Plus de paramètres), pour définir la balance des blancs manuellement en sélectionnant une zone blanche sur la section.
- Accédez au menu déroulant Sondes et cliquez sur Flux de travail du fractionneur optique. Cliquez ensuite sur Démarrer un nouveau projet, puis sur OK.
- Si une configuration d’échantillonnage existante a été enregistrée, sous Paramètres d’échantillonnage, cliquez sur Oui | Il y a un. et sélectionnez la configuration d’échantillonnage souhaitée.
- Sinon, cliquez sur Non et entrez manuellement les informations de section série(figure supplémentaire 1C)et définissez la configuration de la sonde à l’étape 2.13.
- Cliquez sur Suivant, réglez le microscope sur Faible grossissement et choisissez Grossissement 10x dans le menu déroulant.
- Cliquez sur Suivant, puis tracez toute la section ovarienne - commencez par cliquer à gauche autour de la section et à la fin, faites un clic droit et choisissez Fermer le contour.
- Cliquez sur Suivant, réglez le microscope sur Grossissement élevé et choisissez Grossissement d’huile 100x dans le menu déroulant.
- Placez une goutte d’huile sur la section tissulaire de la lame et déplacez l’objectif du microscope à un grossissement de 100x.
- Ajustez l’exposition à la lumière (comme à l’étape 2.4) et cliquez sur Suivant.
- Configurez les paramètres d’échantillonnage pour définir la configuration de la sonde. Ici, la trame de comptage a été réglée à 47,5 μm x 47,5 μm (2 256,25 μm2)et la longueur du pas a été définie sur 100 μm x 100 μm (10 000 μm2)(Figure supplémentaire 2). Une fois les paramètres d’échantillonnage établis, enregistrez le modèle et ouvrez-le à nouveau au cours des séances d’analyse suivantes à l’étape 2.7.
- Cliquez sur Démarrer le comptage (Figure supplémentaire 1D). Concentrez-vous sur le haut de l’exemple, cliquez sur OK et commencez à compter.
- Utilisez le bouton de mise au point pour parcourir la profondeur d’échantillonnage de 10 μm et comptez tous les follicules primordiaux dont le noyau ovocytaire se met au point. Cliquez sur Suivant pour passer à la zone suivante.
- Classer les follicules comme primordiaux si l’ovocyte est entouré de cellules de granulosa malpighiennes (aplaies), mais pas de cellules de granulosa cubiques (Figure 2A).
REMARQUE : Les follicules primordiaux sont distincts des follicules intermédiaires/transitoires, qui comprennent une combinaison de cellules de granulosa cuboïde et malpighiennes(figure 2B)et de follicules primaires, qui sont entourés principalement de cellules de granulosa cubique(figure 2C). Ces classes de follicules doivent être quantifiées séparément. - Ne comptez que les follicules dans lesquels le noyau de l’ovocyte est visible. Le noyau de l’ovocyte doit apparaître dans le cadre de comptage ou toucher les lignes d’inclusion vertes du cadre de comptage(figure supplémentaire 1E,F).
- Si le noyau ovocytaire tombe en dehors du cadre de comptage(figure supplémentaire 1G)ou touche les lignes d’exclusion rouges du cadre de comptage, ne comptez pas ce follicule.
- Lors de l’évaluation de l’épuisement primordial des follicules en réponse à un produit chimique exogène (p. ex. chimiothérapie), s’assurer que tous les follicules comptés sont sains et ont donc une morphologie normale (Figure 2). Comptez séparément tous les follicules anormaux ou atrétiques. Souvent, la mort des follicules est induite par des insultes telles que la chimiothérapie, et la quantification des follicules atrétiques doit être obtenue séparément afin de distinguer les follicules sains des follicules atrétiques, car seuls les follicules sains constituent la réserve ovarienne15.
- Classer les follicules comme primordiaux si l’ovocyte est entouré de cellules de granulosa malpighiennes (aplaies), mais pas de cellules de granulosa cubiques (Figure 2A).
- Une fois le comptage terminé sur cette section, effectuez l’une des opérations suivantes :
- Cliquez sur Ajouter une nouvelle section, puis revenez à l’étape 2.3 pour configurer la section suivante pour le comptage.
- Cliquez sur J’ai terminé le comptage pour terminer la session. Retournez l’objectif à 10x, quittez le logiciel de stéréologie et éteignez la source de lumière, la caméra, l’unité de contrôle multiple et l’ordinateur.
- Obtenir la somme du nombre de follicules bruts (Q) de chaque section tissulaire prélevée sur l’ovaire entier, puis à l’aide d’une feuille de calcul, utiliser l’équation ci-dessous pour obtenir la valeur finale de chaque animal répliqué (N)4.
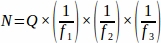 où:
où:
N = Nombre total estimé de follicules dans l’ovaire.
Q = Nombre de follicules primordiaux bruts.
f1 = Intervalle d’échantillonnage. Chaque3ème section a été échantillonnée ainsi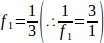 .
.
f2 = Relation entre la base de sondage (zone d’échantillonnage) et le stepper, calculée comme suit : . Étant donné que la zone d’échantillonnage était de 2256 μm2 (47,5 μm x 47,5 μm) et que la zone pas à pas était de 10000 μm2 (100 μm x 100 μm),
suit : . Étant donné que la zone d’échantillonnage était de 2256 μm2 (47,5 μm x 47,5 μm) et que la zone pas à pas était de 10000 μm2 (100 μm x 100 μm),  .
.
f3 = Fraction de la section ovarienne échantillonnée. Étant donné que 10 μm de la section de 20 μm ont été échantillonnés,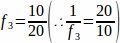 .
.
Par conséquent,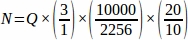 .
.
REMARQUE: Ce protocole décrit comment appliquer ces principes d’analyses thétéologiques à l’aide d’un logiciel de stéréologie largement cité(Table des matériaux); cependant, d’autres logiciels téréologiques sont disponibles. Les principes appliqués lors des analyses thétérologiques des follicules ovariens sont les mêmes, quel que soit le logiciel utilisé pour configurer les paramètres. La stéréologie est plus précise lorsque 100 objets ou plus sont comptés dans un ovaire de souris adulte4, car cela donne un coefficient d’erreur pour l’estimation inférieure à 10%16. Les paramètres d’échantillonnage décrits ici ont été optimisés pour s’assurer qu’au moins 100 objets (c.-à-d. follicules primordiaux, transitoires et primaires) peuvent être comptés dans les ovaires C57BL6J adultes témoins de type sauvage. Une étude pilote peut être menée comprenant une petite taille d’échantillon pour établir les paramètres d’échantillonnage optimaux, tels que l’intervalle et le nombre de sections à analyser et le nombre de dissecteurs optiques dans les sectionséchantillonnées 17.
3. Estimation du nombre de follicules primordiaux par le nombre direct de follicules ovariens
- Placez la lame du microscope solidement sous un microscope optique standard et effectuez des comptages directs pour obtenir le nombre de follicules primordiaux bruts.
- Classer les follicules comme primordiaux si l’ovocyte est clairement visible et est entouré de cellules de granulosa malpighiennes (aplaies), mais pas de cellules de granulosa cubiques (Figure 2D).
REMARQUE : Les follicules primordiaux sont distincts des follicules intermédiaires/transitoires, qui comprennent une combinaison de cellules de granulosa cubiques et malpighiennes(figure 2E)et de follicules primaires, qui sont entourés principalement de cellules de granulosa cubique(figure 2F). Ces classes de follicules doivent être quantifiées séparément. - Assurez-vous que tous les follicules comptés sont sains et ont donc une morphologie normale (Figure 2). Comptez séparément tous les follicules anormaux ou atrétiques, car seuls les follicules sains constituent la réserve ovarienne.
- Classer les follicules comme primordiaux si l’ovocyte est clairement visible et est entouré de cellules de granulosa malpighiennes (aplaies), mais pas de cellules de granulosa cubiques (Figure 2D).
- Vous pouvez également prendre plusieurs photomicrographes de haute puissance (p. ex., 20x) ou cousus de toute la section du tissu ovarien pour effectuer des comptages en ouvrant le ou les fichiers image. Cela peut être fait manuellement ou à l’aide d’un scanner de diapositives automatisé.
- Obtenir la somme du nombre brut de follicules (Q) de chaque section tissulaire prélevée sur l’ovaire entier à l’intervalle prédéterminé. Multipliez ce nombre par l’inverse de la fraction d’échantillonnage pour obtenir la valeur finale pour chaque animal répliqué (N), à l’aide de l’équation ci-dessous.
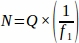 où:
où:
N = Nombre total estimé de follicules dans l’ovaire.
Q = Nombre de follicules bruts (de chaque type individuel, calculé séparément).
f1 = Intervalle d’échantillonnage. Chaque 9e section a été échantillonnée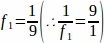 ainsi.
ainsi.
Par conséquent,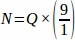 .
.
Résultats
Un modèle bien caractérisé d’épuisement des follicules a été utilisé, dans lequel de jeunes souris femelles adultes ont reçu une dose unique de chimiothérapie au cyclophosphamide, ou un contrôle de véhicule salin (n = 5/groupe) et les deux ovaires ont été récoltés de chaque animal après 48 heures. Un ovaire par animal a été préparé comme décrit à l’étape 1 pour chacune des deux méthodes : stéréologie ou comptage direct. L’ovaire gauche et droit de chaque animal a été assigné au hasard ?...
Discussion
Cet article fournit un protocole étape par étape pour la technique de référence pour énumérer les follicules primordiaux de souris, la stéréologie, et la méthode plus généralement employée de compter direct de follicule. Le traitement de chimiothérapie a été employé pour comparer et contraster les résultats obtenus à partir de ces deux méthodes différentes dans l’ovaire gauche et droit du même animal. Les deux méthodes ont indiqué la variabilité inter-animale élevée dans les nombres primordiau...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été rendu possible grâce au soutien de l’infrastructure opérationnelle du gouvernement de l’État de Victoria et au gouvernement australien NHMRC IRIISS et soutenu par le financement du National Health and Medical Research Council (ALW #1120300) et de l’Australian Research Council (KJH #FT190100265). Les auteurs tiennent à souligner le soutien technique de la plateforme de recherche sur les animaux Monash, de la plateforme d’histologie Monash et de l’installation de micro-imagerie Monash.
matériels
| Name | Company | Catalog Number | Comments |
| 1-Butanol (HPLC) | Fisher Chemical | #A383-1 | |
| Acid alcohol | Amber Scientific | #ACDL | |
| Bouin’s fixative | Sigma-Aldrich | #HT10132 | Picric acid 0.9% (w/v), formaldehyde 9% (v/v), acetic acid 5% (w/v) |
| Cyclophosphamide | Sigma-Aldrich | #C0768-5G | |
| Dibutylphthalate Polystyrene Xylene (DPX) | Sigma-Aldrich | #06522 | |
| Ethanol | Amber Scientific | #ETH | Ethanol 100% |
| Micro Feather opthalmic scalpel with aluminium handle | Designs for Vision | #FEA-745-SR | Feather blade for dissections (seen in Figure 1) |
| Formalin fixative | Australian Biostain | #ANBFC | |
| Glass coverslip | Thermo Scientific | #MENCS22501GP | 22 mm x 50 mm |
| Glycomethacrylate resin RM2165 microtome | Leica Microsystems | #RM2165 | |
| Glycolmethacrylate DPX | *made in house | *Mix 1.5 L Xylene; 800 g polystyrene pellets; 100mL Dibutyl phthalate for 3 weeks | |
| Histolene | Trajan | #11031 | |
| Mayer’s haematoxylin | Amber Scientific | #MH | |
| Olympus BX50 microscope | Olympus | #BX50 | Brightfield microscope fitted with 10x dry & 100x oil immersion objective (numerical aperture 1.3) |
| Olympus immersion oil type-F | Olympus | #IMMOIL-F30CC | |
| Olympus TH4-200 light source | Olympus | #TH4-200 | |
| Paraffin wax | Sigma-Aldrich | #03987 | |
| Periodic acid | Trajan | #PERI1% | Periodic acid 1% |
| Rotary Microtome CUT 4060 | MicroTec | #4060R/F | Used to cut paraffin sections |
| Schiff’s reagent | Trajan | #SCHF | |
| Scott's tap water | Amber Scientific | #SCOT | Potassium carbonate, magnesium sulphate, water |
| StereoInvestigator Stereological System | MBF Bioscience | Includes StereoInvestigator software, multi-control unit, automatic stage and joystick | |
| Superfrost microscope slides | Thermo Scientific | #MENSF41296SP | 1 mm, 72 pcs |
| Technovit 7100 Plastic embedding system | Emgrid Australia | #64709003 | 500 mL/5 x 1 g/40 mL |
| Technovit 3040 yellow | Emgrid Australia | #64708805 | 100 g/80 mL |
Références
- Stringer, J. M., Winship, A., Liew, S. H., Hutt, K. The capacity of oocytes for DNA repair. Cellular and Molecular Life Sciences. 75 (15), 2777-2792 (2018).
- Winship, A. L., Stringer, J. M., Liew, S. H., Hutt, K. J. The importance of DNA repair for maintaining oocyte quality in response to anti-cancer treatments, environmental toxins and maternal ageing. Human Reproduction Update. 24 (2), 119-134 (2018).
- Broer, S. L., Broekmans, F. J., Laven, J. S., Fauser, B. C. Anti-Mullerian hormone: ovarian reserve testing and its potential clinical implications. Human Reproduction Update. 20 (5), 688-701 (2014).
- Myers, M., Britt, K. L., Wreford, N. G., Ebling, F. J., Kerr, J. B. Methods for quantifying follicular numbers within the mouse ovary. Reproduction. 127 (5), 569-580 (2004).
- Boyce, R. W., Dorph-Petersen, K. A., Lyck, L., Gundersen, H. J. Design-based stereology: introduction to basic concepts and practical approaches for estimation of cell number. Toxicologic Pathology. 38 (7), 1011-1025 (2010).
- Ristic, N., et al. Maternal dexamethasone treatment reduces ovarian follicle number in neonatal rat offspring. Journal of Microscopy. 232 (3), 549-557 (2008).
- Soleimani Mehranjani, M., Mansoori, T. Stereological study on the effect of vitamin C in preventing the adverse effects of bisphenol A on rat ovary. International Journal of Reproductive Biomedicine (Yazd). 14 (6), 403-410 (2016).
- Brown, D. L. Bias in image analysis and its solution: unbiased stereology. Journal of Toxicologic Pathology. 30 (3), 183-191 (2017).
- Hasselholt, S., Lykkesfeldt, J., Overgaard Larsen, J. Thick methacrylate sections devoid of lost caps simplify stereological quantifications based on the optical fractionator design. Anatomical Record (Hoboken). 298 (12), 2141-2150 (2015).
- Tilly, J. L. Ovarian follicle counts--not as simple as 1, 2, 3. Reproductive Biology and Endocrinology. 1, 11 (2003).
- Nguyen, Q. N., et al. Loss of PUMA protects the ovarian reserve during DNA-damaging chemotherapy and preserves fertility. Cell Death and Disease. 9 (6), 618 (2018).
- Meirow, D., Assad, G., Dor, J., Rabinovici, J. The GnRH antagonist cetrorelix reduces cyclophosphamide-induced ovarian follicular destruction in mice. Human Reproduction. 19 (6), 1294-1299 (2004).
- Winship, A. L., et al. The PARP inhibitor, olaparib, depletes the ovarian reserve in mice: implications for fertility preservation. Human Reproduction. , (2020).
- Meirow, D., Lewis, H., Nugent, D., Epstein, M. Subclinical depletion of primordial follicular reserve in mice treated with cyclophosphamide: clinical importance and proposed accurate investigative tool. Human Reproduction. 14 (7), 1903-1907 (1999).
- Nguyen, Q. N., et al. Cisplatin- and cyclophosphamide-induced primordial follicle depletion is caused by direct damage to oocytes. Molecular Human Reproduction. , (2019).
- Gundersen, H. J., Jensen, E. B. The efficiency of systematic sampling in stereology and its prediction. Journal of Microscopy. 147, 229-263 (1987).
- Olesen, M. V., Needham, E. K., Pakkenberg, B. The Optical Fractionator Technique to Estimate Cell Numbers in a Rat Model of Electroconvulsive Therapy. Journal of Visualized Experiments. (125), e55737 (2017).
- Findlay, J. K., Hutt, K. J., Hickey, M., Anderson, R. A. How Is the Number of Primordial Follicles in the Ovarian Reserve Established. Biology of Reproduction. 93 (5), 111 (2015).
- Omari, S., et al. Mcl-1 is a key regulator of the ovarian reserve. Cell Death and Disease. 6, 1755 (2015).
- Winship, A. L., Bakai, M., Sarma, U., Liew, S. H., Hutt, K. J. Dacarbazine depletes the ovarian reserve in mice and depletion is enhanced with age. Scientific Reports. 8 (1), 6516 (2018).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. An accurate, simple method for unbiased determination of primordial follicle number in the primate ovary. Biology of Reproduction. 56 (4), 909-915 (1997).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. Morphometric analysis of primordial follicle number in pigtailed monkey ovaries: symmetry and relationship with age. Biology of Reproduction. 61 (2), 553-556 (1999).
- Charleston, J. S., et al. Estimating human ovarian non-growing follicle number: the application of modern stereology techniques to an old problem. Human Reproduction. 22 (8), 2103-2110 (2007).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and nongrowing follicle counts according to the Stages of Reproductive Aging Workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Hansen, K. R., et al. A new model of reproductive aging: the decline in ovarian non-growing follicle number from birth to menopause. Human Reproduction. 23 (3), 699-708 (2008).
- Sonigo, C., et al. High-throughput ovarian follicle counting by an innovative deep learning approach. Scientific Reports. 8 (1), 13499 (2018).
- McKey, J., Cameron, L. A., Lewis, D., Batchvarov, I. S., Capel, B. Combined iDISCO and CUBIC tissue clearing and lightsheet microscopy for in toto analysis of the adult mouse ovarydagger. Biology of Reproduction. 102 (5), 1080-1089 (2020).
- Kagami, K., Shinmyo, Y., Ono, M., Kawasaki, H., Fujiwara, H. Three-dimensional evaluation of murine ovarian follicles using a modified CUBIC tissue clearing method. Reproductive Biology and Endocrinology. 16 (1), 72 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon