JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
성인 마우스 난소의 정확한 여포 열거
요약
여기에서, 우리는 고정 마우스 난소 조직의 정확한 여포 계산을 위한 2개의 다른 기술을 기술하고, 비교하고, 대조합니다.
초록
성적으로 재현된 여성 포유류는 평생 난모세포 공급으로 태어납니다. 미숙하고, 정지성 난모세포는 여성 생식선의 저장 단위인 원시 여포 내에서 발견됩니다. 그(것)들은 비 신재생적입니다, 그러므로 출생시 그들의 수 및 손실의 후속 비율은 주로 여성 비옥한 수명을 지시합니다. 여성과 동물의 원시 여포 수의 정확한 정량화는 난소 보호구역에 대한 의약품과 독성물질의 영향을 결정하는 데 필수적입니다. 또한 기존 및 신흥 불임 보존 기술의 필요성과 성공을 평가하는 데도 필요합니다. 현재 여성의 난소 예비군을 포함하는 원시 여포의 수를 정확하게 측정하는 방법은 존재하지 않는다. 또한, 실험을 위해 큰 동물 또는 멸종 위기에 처한 종에서 난소 조직을 얻는 것은 종종 가능하지 않습니다. 따라서, 마우스는 그러한 연구를 위한 필수적인 모형이 되고, 전체 마우스 난소에 있는 원시 여포 수를 평가하는 기능은 중요한 공구입니다. 그러나 문헌에서 마우스 난소의 절대 여포 숫자에 대한 보고는 매우 가변적이기 때문에 데이터를 비교 및/또는 복제하기가 어렵습니다. 이것은 긴장, 나이, 처리 단, 고용된 계산의 방법에 있는 기술적인 다름을 포함하여 요인의 수 때문입니다. 이 문서에서는 분획기/광학 디스섹터 기술에 의존하는 [1] 입체학: 조직학적 섹션을 준비하고 마우스 난소에서 원시 여포를 계산하기 위한 단계별 교육 가이드를 제공합니다. 및 [2] 직접 카운트 기술. 각 방법의 주요 장점과 단점 중 일부는 현장에서 재현성을 개선하고 연구원이 연구에 가장 적합한 방법을 선택할 수 있도록 강조될 것입니다.
서문
난소의 원시 여포 내에 저장된 미숙하고 메이오티컬하게 체포된 난모세포는 여성 생식선을 위한 저장 장치이며 개인의 평생 난소 보호구역으로 구성됩니다. 원시 여포 수는1세또는 대체로 공기, 식품 및 물2의일부 의약품 및 환경 독성물질을 포함한 외인성 화학 물질에 노출된 후 조기에 고갈될 수 있다. 원시 여포 수가 유한하다는 점을 감안할 때, 난소 안에 존재하는 여포의 양과 질은 주로 여성의 불임과 자손 건강을 결정합니다. 따라서, 여성의 원시 여포 수의 정확한 정량화는 난소 예비군에 외인성 모욕의 오프 타겟 영향을 평가하기 위해 필수적이다.
여성의 경우, 전체 난소의 분석은 일반적으로 불가능하므로 난소 예비군의 비침습적 대리 측정은 임상 환경에서 활용되어야 합니다. 항Mϋllerian 호르몬(AMH)은 가장 널리 사용되는 대리 바이오마커 임상3이다. 혈청 AMH 수준은 종종 고급 모성 나이의 여성에서 측정, 또는 화학 요법과 같은 암 치료 전후. 그러나, AMH는 원시 여포가 아닌 여포를 성장시킴으로써 생성되며, 따라서 혈청 수준은 절대 원시 여포 수에 대해 알리지 않습니다.
설치류와 같은 작은 동물 모델에서난소 여포를 세는 여성의 원시 여포 수를 정확하게 결정하는 방법이 없기 때문에 외인성 모욕이 원시 여포에 미치는 영향을 평가하는 필수적인 연구 도구로 남아 있습니다. 불행하게도 그래도, 설치류 모델의 원시 여포 번호의 문학을 통해 보고서는 매우가변4입니다. 이에 대한 주요 이유는 널리 고용 된 계산 방법의 기술적 차이를보고된다. 주로, 쥐에 있는 원시 여포를 열거하기 위한 문헌에 기술된 2개의 다른 기술이 있습니다. 여기에는 분수기 광학 디스섹터 방법을 사용하는 입체학및 직접 여포 수가 포함됩니다.
입체학은 체계적인 균일 한 무작위 샘플링5를사용하기 때문에 금 본위제로 널리 간주되며, 전체 마우스 또는 쥐 난소4,6,7에서원시 여포 수를 정량화하는 가장 정확한 방법입니다. 입체학은 관심 있는 개체의 3차원 구조를 차지하기 때문에 편견이 없습니다8. 광학 분수/분수기 방법을 사용하여 전체 마우스 난소의 알려진 분수 내에서 두꺼운 조직 섹션(예를 들어, 20 μm)을 사용하여 원시 여포를 정량화하기 위해 3가지 수준의 샘플링이 적용됩니다. 첫째, 샘플링 간격은 무작위 시작(예: 매3rd 섹션)에서 선택됩니다(샘플링 분획 1, f1)4. 그런 다음 이 시점에서 전체 난소를 통해 체계적이고 균일한 방식으로 단조로 섹션을 샘플링합니다. 이어서, 편견없는 카운팅 프레임은 난소 섹션 위에 중첩되고 정의된 무작위 계수 그리드(샘플링 분수 2, f2)8을따라 점진적으로 이동한다. 마지막으로, 단면 두께의 공지된 분획은 광학적으로 샘플링(예를 들어, 10 μm) 및 이 영역 내의 여포(sample 분획 3, f3)4를계산한다. 원시 여포 수는 최종 값을 얻기 위해 이러한 샘플링 분획의 반역으로 곱됩니다. 이 방법은 스테레오소프트웨어가 구동하는 전동 단계가 있는 현미경을 포함한 전문가 교육 및 장비가 필요합니다. 조직은 전문 부인의 고정물로 보존되어야 하며, 글리콜메타크릴레이트 수지에 내장되어 유리 칼로 글리콜메타크릴레이트 수지 마이크로톨메를 사용하여 두꺼운 조직 섹션을 절단할 수 있도록 해야 합니다. 이 방법은 난소와 여포9의3차원 형태 구조를 가장 잘 보존하기 위해 조직 수축 및 변형을 고려하여 설계되었습니다.
직접 여포 카운트는여포(10)를세는 데 가장 자주 사용되는 방법입니다. 일반적인 고정제(즉, 포르말린)를 사용할 수 있으며, 4-6 μm 사이의 두께로 표준 마이크로토메를 사용하여 파라핀 왁스 임베드 및 철저한 직렬 단면을 사용할 수 있습니다. 여포는 정의된 간격으로 전체 조직 섹션에서 체계적으로 계산된 다음 샘플링 간격의 역으로 곱하여 총 여포 추정치를 얻습니다. 이 방법은 빠르고 쉽고 보관된 조직을 사용하여 수행할 수 있으며 표준 조직학 기술을 사용하여 준비할 수 있습니다. 표준 이미징 기능을 갖춘 가벼운 현미경만 필요합니다. 그러나 이러한 장점에도 불구하고 직접 여포 계수는 입체학의 정확성과 엄격한 계수 매개 변수가 부족하여 조사자 편견에 더 취약합니다. 추가적으로, 조직은 처리 도중 수축 및 변형을 겪을 수 있고, 난소의 무결성 그리고 형태를 방해하고 이렇게 여포 분류 및 정량화를 어렵게 만듭니다.
이 문서의 목적은 마우스 난소의 원시 여포 수를 정량적으로 평가하는 두 가지 일반적으로 사용되는 방법을 설명하는 것입니다: 입체학 및 직접 여포 계수. 우리는 이 두 가지 방법에 대한 상세한 프로토콜을 제공하고, 우리의 분야에서 재현성을 향상시키고 연구원이 자신의 연구에 가장 적합한 계수 방법의 정보에 입각한 결정을 내릴 수 있도록하기 위해, 자신의 강점과 약점의 일부를 강조 할 것입니다.
프로토콜
난소는 암컷 C57BL6J 마우스로부터 채취되었다. 모든 동물 절차 와 실험은 동물의 치료 및 사용을위한 NHMRC 호주 관행 규범에 따라 수행되었으며 모나시 동물 연구 플랫폼 동물 윤리위원회의 승인을 받았습니다.
참고: 초보 여포 난모를 고갈하는 것으로 나타난 화학요법 제은입체학 11 및 직접 카운트12,13을 사용하여 동일한 동물의 두 가지 계산 방법을 비교하는 데 사용되었습니다. 여성, 8주된 (젊은 성인) 마우스는 사이클로포스파미드의 75 mg/kg/체급의 단일 내회관 주사 이전에 체중이 감소하거나 식염수 차량 제어(n=5/group)를 측정하였다. 이 복용량은 원시 여포의 대략 50% 고갈을 일으키는 원인이 되기 위하여 보였습니다, 그러나 마우스에 있는 이환율 또는 사망을 일으키는 원인이 되기 위하여 보고되지14. 난소는 치료 후 48시간 후에 수확되었습니다. 각 동물의 난소 1개는 24시간 동안 10%(v/v) 중성 버퍼링 포름틴 용액으로 고정되었으며, 다른 하나는 부인의 용액에 24시간 동안 고정되었다. 조직은 글리콜메타크릴레이트 수지에 내장되어 20 μm에서 직렬로 분리되거나 파라핀에 넣고 5 μm에서 직렬로 단면시켰다. 모든 조직은 주기적인 산 쉬프와 헤마톡시린으로 염색되었다.
1. 조직학적 준비: 고정, 처리, 내장 및 마우스 난소
- 난소 자체를 손상시키거나 자르지 않고 난소와 주변의 모든 지방을 다듬어 마우스 난소를 해부하십시오. 필요한 경우, 이 단계에 대해 해부 현미경 및 미세 블레이드를 사용하십시오(그림1A).
- 조직을 70%에 탄올로 옮기기 전에 부인의 고정(stereology) 또는 24시간 동안 포르말린고정(직접개수)을 포함하는 작은 라벨이 부착된 튜브에 즉시 배치하여 조직을 수정합니다.
참고: 폴릭알 형태는 부인의 고정 난소 조직 내에서 가장 잘 보존되며, 글리콜메타크릴레이트 수지(그림2)에내장되어 있습니다. - 전체 고정 난소를 처리하고 표준 조직학적 프로토콜을 사용하여 직접 카운트에 대한 입체학(보충 파일 1)또는 파라핀 왁스글리콜메타크릴레이트 수지에 포함.
주의: 수지는 독성이 있으므로 모든 조직 처리 단계가 연기 후드로 수행되고 장갑을 착용하십시오. - 유리 나이프(도1D)가장착된 특수 수지 메타크릴레이트 마이크로톨메(도1C)를사용하여 두꺼운 글리콜메타크릴레이트 수지 섹션(예를 들어, 20 μm)을 철저히 절단한다. 스테레오로지용 유리 현미경 슬라이드에 정기적으로 섹션(예:3rd 섹션마다)으로 섹션을 수집합니다.
- 표준 마이크로토메를 사용하여 얇은 파라핀 섹션(예: 4-6 μm)을 자른다. 직접 여포 카운트에 대한 유리 현미경 슬라이드에 정기적으로 간격 (예를 들어, 매 9단 섹션)에서 조직 섹션을 수집합니다.
- 주기적인 산 쉬프와 헤마톡시린(보충 파일 2)로슬라이드를 얼룩.
- 파라핀 섹션에 대한 표준 DPX, 또는 글리콜메타크릴레이트 수지섹션(그림 1E)용두꺼운 DPX가 있는 커버슬립.
주의: 글리콜메타크릴레이트 수지 DPX는 위험하므로 연기 후드에 이 단계를 수행하십시오.
참고: 글리콜메타크릴레이트 수지 DPX는 매우 점성입니다. 유리 커버슬립은 DPX가 균등하고 얇게 분산되도록 주걱으로 눌러 단단히 부착되어야 하며, 커버슬립(도 1F)아래에기포가존재하지 않는다.
2. 광학 분획기사용 원시 여포 수의 스테레오학적 추정
- 컴퓨터, 다중 제어 장치, 카메라 및 입체 설정 내의 광원을 켜고 현미경 목표를 낮은 배율(예: 10x)으로 설정합니다.
- 스테레오로지 소프트웨어를 엽니다.
- 현미경 단계에 첫 번째 슬라이드를 단단히 놓습니다.
- 카메라 설정 패널(보조도 1A)에서노출 미만의 자동 노출을 확인하여 광 노출을 조정합니다. 또는 빛 노출을 수동으로 조정합니다.
- 조이스틱을 사용하여 첫 번째 조직 샘플을 찾고 샘플을 집중시합니다.
- 더 많은 설정(카메라 설정 패널 의 오른쪽 하단에 있음)을 클릭한 다음 화이트 밸런스를 클릭하고 자동(추가 그림 1B)을클릭하여 흰색 균형을 조정합니다. 또는 더 많은 설정 버튼(또는 추가 설정의 영역 선택)에 인접한 화이트 밸런스 버튼을 클릭하여 섹션의 흰색 영역을 선택하여 흰색 균형을 수동으로 설정합니다.
- 프로브 드롭 다운 메뉴로 이동하여 광학 분수기 워크플로우를 클릭합니다. 그런 다음 새 프로젝트 시작을 클릭하고 확인을 클릭합니다.
- 기존 샘플링 구성이 저장된 경우 샘플링 매개 변수에서 예 | 클릭합니다. ... 원하는 샘플링 구성을 선택합니다.
- 그렇지 않은 경우 아니오를 클릭하고 수동으로 직렬 섹션정보(보충 도 1C)를입력하고 2.13 단계에서 프로브 구성을 정의합니다.
- 다음을클릭하고 현미경을 낮은 배율로 설정하고 드롭다운 메뉴에서 10배 배율을 선택합니다.
- 다음을클릭한 다음 전체 난소 섹션을 추적합니다 - 섹션을 클릭하고 마지막에 왼쪽 클릭으로 시작하여 오른쪽 윤곽닫기를 선택하고 선택합니다.
- 다음을클릭하고 현미경을 높은 배율로 설정하고 드롭다운 메뉴에서 100x 오일 배율을 선택합니다.
- 슬라이드의 조직 섹션에 오일 한 방울을 놓고 현미경 목표를 100배율로 이동합니다.
- 라이트 노출(2.4단계)을 조정하고 다음을 클릭합니다.
- 프로브 구성을 정의하기 위해 샘플링 매개 변수를 설정합니다. 여기서, 계수 프레임은 47.5 μm x 47.5 μm(2,256.25 μm2)으로설정되었고, 걸음 길이는 100 μm x 100 μm(10,000 μm 2)(보충도2)로설정되었다. 샘플링 매개 변수가 설정되면 템플릿을 저장하고 후속 분석 세션 동안 2.7단계에서 다시 엽니다.
- 시작 계산(추가 그림 1D)을클릭합니다. 샘플 의 상단에 초점을 맞추고 확인을 클릭하고 계산을 시작합니다.
- 초점 손잡이를 사용하여 10 μm 샘플링 깊이를 이동하고 난모 핵이 초점을 맞춘 원시 여포를 계산합니다. 다음 영역으로 이동하려면 다음 영역을 클릭합니다.
- 난소세포가 편평상피 (평평한) 과립 세포에 둘러싸여 있지만, 어떤 입체 과립 세포(도 2A)에둘러싸여있는 경우 원시로 여포를 분류합니다.
참고: 원시 여포는 중질/과도기 여포와 구별되며, 이는 입체와 편평상피 과립세포(도2B)와1차 여포의 조합을 구성하며, 이는 주로 계류성 과립세포(그림2C)에의해 포위된다. 이러한 여포 클래스는 별도로 정량화되어야 합니다. - 난염 핵이 보이는 여포만 계산합니다. 난소 핵은 카운팅 프레임 내에 나타나거나 카운팅 프레임의 녹색 포함 선을 터치해야한다(보충 도 1E, F).
- 난소 핵이 카운팅프레임(보충 도 1G)외부에 떨어지거나 카운팅 프레임의 적색 배제 라인을 터치하는 경우, 이 여포를 계산하지 마십시오.
- 외인성 화학 물질(예를 들어, 화학요법)에 반응하여 원시 여포 고갈을 평가할 때, 계산된 모든 여포가 건강하고 따라서 정상 형태학이 있는지 확인하십시오(그림2). 비정상 또는 무성 여포를 따로 계산합니다. 종종, 여포 죽음은 화학요법과 같은 모욕에 의해 유도되고, 다폐 여포의 정량화는 건강한 여포와 수폐여포를 구별하기 위하여 별도로 얻어져야 하며, 건강한 여포만이 난소예비15를포함하기 때문에.
- 난소세포가 편평상피 (평평한) 과립 세포에 둘러싸여 있지만, 어떤 입체 과립 세포(도 2A)에둘러싸여있는 경우 원시로 여포를 분류합니다.
- 해당 섹션에서 계산이 완료되면 다음 중 하나를 수행합니다.
- 새 섹션 추가를클릭한 다음 2.3단계로 돌아가 계산에 대한 다음 섹션을 설정합니다.
- 카운트가 완료되어 세션을 종료한 경우를 클릭합니다. 목표를 10배로 되돌리고, 스테레오로지 소프트웨어를 종료하고 광원, 카메라, 다중 제어 장치 및 컴퓨터를 끕니다.
- 전체 난소에서 샘플링된 각 조직 섹션에서 합계 원시 여포 번호(Q)를 얻은 다음 스프레드시트를 사용하여 아래 방정식을 사용하여 각 복제 동물(N)4로부터최종 값을 얻습니다.
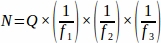 어디:
어디:
N = 난소 내의 총 추정 여포 수입니다.
Q = 원시 원시 여포 수입니다.
f1 = 샘플링 간격. 모든 3rd 섹션은 따라서 샘플링되었다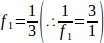 .
.
f2 = 계산 프레임(샘플 영역)과 스테퍼 간의 관계, 로 계산된 . 시료면적은 2256 μm 2(47.5 μm x 47.5 μm)이고 스테퍼 면적은 10000 μm2(100 μm x 100 μm)였다.
계산된 . 시료면적은 2256 μm 2(47.5 μm x 47.5 μm)이고 스테퍼 면적은 10000 μm2(100 μm x 100 μm)였다. 
f3 = 샘플링된 난소 섹션의 분수. 20 μm 단면도의 10 μm을 샘플링했기 때문에,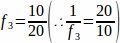 .
.
따라서.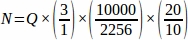
참고: 이 프로토콜은 널리 인용된 입체 소프트웨어(재료 표)를 사용하여 이러한 스테레오학적 분석 원칙을 적용하는 방법을설명합니다. 그러나 다른 스테레오학적 소프트웨어를 사용할 수 있습니다. 난소 여포의 입체 분석 중에 적용 된 원칙은 매개 변수를 설정하는 데 사용되는 소프트웨어에 관계없이 동일합니다. 100개 이상의 물체가 성인 마우스 난소4에계산될 때 가장 정확하며, 이는 10%미만의추정치에 대한 오차 계수를 16% 미만으로 제공한다. 여기에 설명된 샘플링 매개 변수는 최소 약 100개의 개체(즉, 원시, 과도기 및 1차 여포)를 제어 성인 야생형 C57BL6J 난소에서 계산할 수 있도록 최적화되었습니다. 분석할 섹션의 간격 및 수 및 샘플링된섹션(17)내에서 광학 단종의 수와 같은 최적의 샘플링 파라미터를 확립하기 위한 작은 샘플 크기를 포함하는 파일럿 스터디연구가 수행될 수 있다.
3. 직접 난소 여포 수에 의한 원시 여포 수 추정
- 현미경 슬라이드를 표준 광 현미경 아래에 단단히 놓고 직접 카운트를 수행하여 원시 원시 여포 번호를 얻습니다.
- 모낭을 명확하게 볼 수 있고 편평상피 (평평한) 과립 세포로 둘러싸여 있지만, 어떤 입체 과립 세포(도 2D)에의해 포위되는 경우 초보로 여포를 분류합니다.
참고: 원시 여포는 중위/과도기 여포와 구별되며, 이는 입체와 편평상피 과립세포(그림2E)와1차 여포의 조합을 구성하며, 이는 주로 계류성 과립세포(그림2F)에의해 포위된다. 이러한 여포 클래스는 별도로 정량화되어야 합니다. - 계산된 모든 여포가 건강하고 정상적인형태(그림 2)를가지고 있는지 확인합니다. 건강한 여포만이 난소 보호구역을 구성하기 때문에 비정상적 또는 다중 여포를 따로 세어보아 두는 다.
- 모낭을 명확하게 볼 수 있고 편평상피 (평평한) 과립 세포로 둘러싸여 있지만, 어떤 입체 과립 세포(도 2D)에의해 포위되는 경우 초보로 여포를 분류합니다.
- 또는, 이미지 파일을 열어 카운트를 수행하기 위해 전체 난소 조직 섹션의 여러 또는 스티치 고전력(예를 들어, 20x) 광마이크로그래프를 취하십시오. 이 작업은 수동으로 수행하거나 자동화된 슬라이드 스캐너를 사용할 수 있습니다.
- 소정의 간격으로 전체 난소로부터 샘플링된 각 조직 섹션에서 합계 원시 여포 번호(Q)를 가져옵니다. 샘플링 분획의 반역으로 이 숫자를 곱하여 아래 방정식을 사용하여 각 복제 동물(N)에 대한 최종 값을 얻습니다.
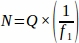 어디:
어디:
N = 난소 내의 총 추정 여포 수입니다.
Q = 원시 여포 수(각 개별 유형의 별도 계산).
f1 = 샘플링 간격. 매9단 섹션은 이렇게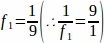 샘플링하였다.
샘플링하였다.
따라서.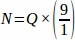
결과
여포 고갈의 잘 특징적인 모형이 이용되었고, 이에 따라 젊은 성인 암컷 마우스는 사이클로포스파미드 화학요법의 단일 용량을 투여하였고, 또는 식염수 차량 제어(n=5/group) 및 두 난소모두 48시간 후에 각 동물로부터 수확하였다. 동물당 난소 1개는 각각의 두 가지 방법에 대해 1단계에서 설명한 대로 제조되었다: 스테레오로지 또는 직접 카운트. 각 동물의 왼쪽과 오른쪽 난소는 각 그룹에 무작위?...
토론
이 문서에서는 마우스 원시 여포, 입체학 및 보다 일반적으로 사용되는 직접 여포 계포 방법을 통합하기 위한 금 표준 기술에 대한 단계별 프로토콜을 제공합니다. 화학요법 치료는 동일한 동물로부터 좌우 난소 내에서 이 두 가지 다른 방법에서 얻은 결과를 비교하고 대조하기 위해 사용되었다. 두 방법 모두 원시 여포 수의 높은 동물 간 가변성을 드러냈습니다. 난소 예비의 중요한 고갈은 입체?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작업은 빅토리아 주 정부 운영 인프라 지원과 호주 정부 NHMRC IRIISS를 통해 가능했으며 국립 보건 의료 연구 위원회 (ALW #1120300)와 호주 연구 위원회 (KJH #FT190100265)의 자금 지원을 통해 지원되었습니다. 저자는 모나시 동물 연구 플랫폼, 모나시 히스토로지 플랫폼 및 모나시 마이크로 이미징 시설의 기술 적 지원을 인정하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1-Butanol (HPLC) | Fisher Chemical | #A383-1 | |
| Acid alcohol | Amber Scientific | #ACDL | |
| Bouin’s fixative | Sigma-Aldrich | #HT10132 | Picric acid 0.9% (w/v), formaldehyde 9% (v/v), acetic acid 5% (w/v) |
| Cyclophosphamide | Sigma-Aldrich | #C0768-5G | |
| Dibutylphthalate Polystyrene Xylene (DPX) | Sigma-Aldrich | #06522 | |
| Ethanol | Amber Scientific | #ETH | Ethanol 100% |
| Micro Feather opthalmic scalpel with aluminium handle | Designs for Vision | #FEA-745-SR | Feather blade for dissections (seen in Figure 1) |
| Formalin fixative | Australian Biostain | #ANBFC | |
| Glass coverslip | Thermo Scientific | #MENCS22501GP | 22 mm x 50 mm |
| Glycomethacrylate resin RM2165 microtome | Leica Microsystems | #RM2165 | |
| Glycolmethacrylate DPX | *made in house | *Mix 1.5 L Xylene; 800 g polystyrene pellets; 100mL Dibutyl phthalate for 3 weeks | |
| Histolene | Trajan | #11031 | |
| Mayer’s haematoxylin | Amber Scientific | #MH | |
| Olympus BX50 microscope | Olympus | #BX50 | Brightfield microscope fitted with 10x dry & 100x oil immersion objective (numerical aperture 1.3) |
| Olympus immersion oil type-F | Olympus | #IMMOIL-F30CC | |
| Olympus TH4-200 light source | Olympus | #TH4-200 | |
| Paraffin wax | Sigma-Aldrich | #03987 | |
| Periodic acid | Trajan | #PERI1% | Periodic acid 1% |
| Rotary Microtome CUT 4060 | MicroTec | #4060R/F | Used to cut paraffin sections |
| Schiff’s reagent | Trajan | #SCHF | |
| Scott's tap water | Amber Scientific | #SCOT | Potassium carbonate, magnesium sulphate, water |
| StereoInvestigator Stereological System | MBF Bioscience | Includes StereoInvestigator software, multi-control unit, automatic stage and joystick | |
| Superfrost microscope slides | Thermo Scientific | #MENSF41296SP | 1 mm, 72 pcs |
| Technovit 7100 Plastic embedding system | Emgrid Australia | #64709003 | 500 mL/5 x 1 g/40 mL |
| Technovit 3040 yellow | Emgrid Australia | #64708805 | 100 g/80 mL |
참고문헌
- Stringer, J. M., Winship, A., Liew, S. H., Hutt, K. The capacity of oocytes for DNA repair. Cellular and Molecular Life Sciences. 75 (15), 2777-2792 (2018).
- Winship, A. L., Stringer, J. M., Liew, S. H., Hutt, K. J. The importance of DNA repair for maintaining oocyte quality in response to anti-cancer treatments, environmental toxins and maternal ageing. Human Reproduction Update. 24 (2), 119-134 (2018).
- Broer, S. L., Broekmans, F. J., Laven, J. S., Fauser, B. C. Anti-Mullerian hormone: ovarian reserve testing and its potential clinical implications. Human Reproduction Update. 20 (5), 688-701 (2014).
- Myers, M., Britt, K. L., Wreford, N. G., Ebling, F. J., Kerr, J. B. Methods for quantifying follicular numbers within the mouse ovary. Reproduction. 127 (5), 569-580 (2004).
- Boyce, R. W., Dorph-Petersen, K. A., Lyck, L., Gundersen, H. J. Design-based stereology: introduction to basic concepts and practical approaches for estimation of cell number. Toxicologic Pathology. 38 (7), 1011-1025 (2010).
- Ristic, N., et al. Maternal dexamethasone treatment reduces ovarian follicle number in neonatal rat offspring. Journal of Microscopy. 232 (3), 549-557 (2008).
- Soleimani Mehranjani, M., Mansoori, T. Stereological study on the effect of vitamin C in preventing the adverse effects of bisphenol A on rat ovary. International Journal of Reproductive Biomedicine (Yazd). 14 (6), 403-410 (2016).
- Brown, D. L. Bias in image analysis and its solution: unbiased stereology. Journal of Toxicologic Pathology. 30 (3), 183-191 (2017).
- Hasselholt, S., Lykkesfeldt, J., Overgaard Larsen, J. Thick methacrylate sections devoid of lost caps simplify stereological quantifications based on the optical fractionator design. Anatomical Record (Hoboken). 298 (12), 2141-2150 (2015).
- Tilly, J. L. Ovarian follicle counts--not as simple as 1, 2, 3. Reproductive Biology and Endocrinology. 1, 11 (2003).
- Nguyen, Q. N., et al. Loss of PUMA protects the ovarian reserve during DNA-damaging chemotherapy and preserves fertility. Cell Death and Disease. 9 (6), 618 (2018).
- Meirow, D., Assad, G., Dor, J., Rabinovici, J. The GnRH antagonist cetrorelix reduces cyclophosphamide-induced ovarian follicular destruction in mice. Human Reproduction. 19 (6), 1294-1299 (2004).
- Winship, A. L., et al. The PARP inhibitor, olaparib, depletes the ovarian reserve in mice: implications for fertility preservation. Human Reproduction. , (2020).
- Meirow, D., Lewis, H., Nugent, D., Epstein, M. Subclinical depletion of primordial follicular reserve in mice treated with cyclophosphamide: clinical importance and proposed accurate investigative tool. Human Reproduction. 14 (7), 1903-1907 (1999).
- Nguyen, Q. N., et al. Cisplatin- and cyclophosphamide-induced primordial follicle depletion is caused by direct damage to oocytes. Molecular Human Reproduction. , (2019).
- Gundersen, H. J., Jensen, E. B. The efficiency of systematic sampling in stereology and its prediction. Journal of Microscopy. 147, 229-263 (1987).
- Olesen, M. V., Needham, E. K., Pakkenberg, B. The Optical Fractionator Technique to Estimate Cell Numbers in a Rat Model of Electroconvulsive Therapy. Journal of Visualized Experiments. (125), e55737 (2017).
- Findlay, J. K., Hutt, K. J., Hickey, M., Anderson, R. A. How Is the Number of Primordial Follicles in the Ovarian Reserve Established. Biology of Reproduction. 93 (5), 111 (2015).
- Omari, S., et al. Mcl-1 is a key regulator of the ovarian reserve. Cell Death and Disease. 6, 1755 (2015).
- Winship, A. L., Bakai, M., Sarma, U., Liew, S. H., Hutt, K. J. Dacarbazine depletes the ovarian reserve in mice and depletion is enhanced with age. Scientific Reports. 8 (1), 6516 (2018).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. An accurate, simple method for unbiased determination of primordial follicle number in the primate ovary. Biology of Reproduction. 56 (4), 909-915 (1997).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. Morphometric analysis of primordial follicle number in pigtailed monkey ovaries: symmetry and relationship with age. Biology of Reproduction. 61 (2), 553-556 (1999).
- Charleston, J. S., et al. Estimating human ovarian non-growing follicle number: the application of modern stereology techniques to an old problem. Human Reproduction. 22 (8), 2103-2110 (2007).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and nongrowing follicle counts according to the Stages of Reproductive Aging Workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Hansen, K. R., et al. A new model of reproductive aging: the decline in ovarian non-growing follicle number from birth to menopause. Human Reproduction. 23 (3), 699-708 (2008).
- Sonigo, C., et al. High-throughput ovarian follicle counting by an innovative deep learning approach. Scientific Reports. 8 (1), 13499 (2018).
- McKey, J., Cameron, L. A., Lewis, D., Batchvarov, I. S., Capel, B. Combined iDISCO and CUBIC tissue clearing and lightsheet microscopy for in toto analysis of the adult mouse ovarydagger. Biology of Reproduction. 102 (5), 1080-1089 (2020).
- Kagami, K., Shinmyo, Y., Ono, M., Kawasaki, H., Fujiwara, H. Three-dimensional evaluation of murine ovarian follicles using a modified CUBIC tissue clearing method. Reproductive Biology and Endocrinology. 16 (1), 72 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유