Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Точное перечисление фолликула в яичниках взрослых мышей
В этой статье
Резюме
Здесь мы описываем, сравниваем и противопоставляем два различных метода точного подсчета фолликулов фиксированных тканей яичников мыши.
Аннотация
Сексуально размножающиеся самки млекопитающих рождаются с их пожизненным запасом яйцеклеток. Незрелые, тихие яйцеклетки находятся в изначальных фолликулах, единице хранения женской зародышевой линии. Они не являются возобновляемыми, поэтому их число при рождении и последующие темпы потерь в значительной степени диктует женскую плодородную продолжительность жизни. Точная количественная оценка количества изначальных фолликулов у женщин и животных имеет важное значение для определения воздействия лекарственных средств и токсикантов на резерв яичников. Необходимо также оценить необходимость и успех существующих и новых методов сохранения фертильности. В настоящее время не существует методов точного измерения количества изначальных фолликулов, включающих резерв яичников у женщин. Кроме того, получение ткани яичников от крупных животных или исчезающих видов для экспериментов часто не представляется возможным. Таким образом, мыши стали важной моделью для таких исследований, и способность оценивать изначальные числа фолликулов в целых яичниках мыши является критическим инструментом. Тем не менее, сообщения об абсолютных числах фолликулов в яичниках мыши в литературе весьма изменчивы, что затрудняет сравнение и/или репликацию данных. Это связано с рядом факторов, включая напряжение, возраст, группы лечения, а также технические различия в методах подсчета занятых. В этой статье мы предоставляем пошаговое учебное руководство по подготовке гистологических разделов и подсчету изначальных фолликулов в яичниках мыши с использованием двух различных методов: стереологии, которая опирается на метод фракционной/оптической препаратора; и метод прямого подсчета. Некоторые из ключевых преимуществ и недостатков каждого метода будут выделены таким образом, чтобы можно было улучшить воспроизводимость в полевых условиях и дать исследователям возможность выбрать наиболее подходящий метод для своих исследований.
Введение
Незрелые, меиотически арестованных яйцеклеток, хранящихся в изначальных фолликулов в яичнике являются единицей хранения для женской зародышевой линии и составляют пожизненный резерв яичников человека. Изначальные номера фолликулов снижаются естественным образомс возрастом 1, или же, может быть преждевременно истощены после воздействия экзогенных химических веществ, в том числе некоторые фармацевтические препараты и экологические токсиканты в воздухе, пище и воде2. Учитывая, что изначальное число фолликулов является конечным, количество и качество фолликулов, присутствующих в яичнике в значительной степени определить женскую плодовитости и здоровья потомства. Таким образом, точная количестве изначальных фолликулов у женщин имеет важное значение для оценки внецелевых воздействий экзогенных оскорблений на резерв яичников.
У женщин анализ всего яичника, как правило, не возможно, поэтому неинвазивные суррогатные меры резерва яичников должны быть использованы в клинических условиях. Анти-Mϋllerian гормона (AMH) является наиболее широко используемым суррогатным биомаркером клинически3. Уровни АМГ сыворотки часто измеряются у женщин преклонного материнского возраста или до и после лечения рака, например, химиотерапии. Тем не менее, AMH производится растущими фолликулами, а не изначальными фолликулами, и, таким образом, уровни сыворотки не сообщают об абсолютном количестве изначальных фолликулов.
При отсутствии методов точного определения количества изначальных фолликулов у женщин на месте, подсчет фолликуловяичников в мелких животных моделях, таких как грызуны, остается важным инструментом исследования для оценки степени, с помощью которой экзогенные оскорбления влияют на изначальные фолликулы и, следовательно, плодовитости. К сожалению, хотя, доклады по всей литературе изначальных фолликулов номера в моделях грызунов являются весьмапеременной 4. Одной из основных причин этого являются широко используемые технические различия в методе подсчета голосов. Преимущественно, Есть два различных методов, описанных в литературе для перечисления изначальных фолликулов у мышей. К ним относятся стереология, которая использует метод оптического препаратора фракциотора, и прямые отсчеты фолликулов.
Стереология широко рассматривается золотой стандарт, как он использует систематические равномернойслучайной выборки 5, что делает его наиболее точным методом количественной изначальной числа фолликула в целом мыши, или крысыяичников 4,6,7. Стереология непредвзята, так как она объясняет трехмерную структуру объекта интереса8. Используя метод оптического рассечения/фракционного метода, три уровня выборки применяются для количественной оценки изначальных фолликулов с использованием толстых секций тканей (например, 20 мкм) в пределах известной доли от общего яичника мыши. Во-первых, выбран интервал отбора проб (например, каждый 3-й раздел) при случайном запуске (выборка фракции 1, f1)4. Разделы затем пробы в систематической, равномерной манере с этого момента через весь яичник. Затем, непредвзятый подсчет кадра накладывается на секцию яичников и постепенно перемещается по определенной, рандомизированной сетке подсчета (выборка фракция 2, f2)8. Наконец, известная доля толщины секции оптически пробы (например, 10 мкм) и фолликулы в этой области учитываются (выборка фракции 3, f3)4. Количество необработанных фолликулов умножается на обратные эти фракции выборки для получения конечного значения. Этот метод требует экспертной подготовки и оборудования, в том числе микроскопа с моторизованной стадией, управляемой стереологическим программным обеспечением. Ткани должны быть сохранены в специализированной фиксатор Буин, и встроенные в гликольметакрилат смолы, чтобы для толстых секций ткани, которые будут сокращены с помощью микротома гликольметакрилат смолы со стеклянным ножом. Этот метод предназначен для учета усадки тканей и деформации, чтобы наилучшим образом сохранить трехмерную морфологическую структуру яичников ифолликулов 9.
Прямой подсчет фолликулов является наиболее часто используемым методом подсчета фолликулов10. Можно использовать более распространенные фиксаторы (т.е. формалин), за которыми следует встраивание парафинового воска и исчерпывающее последовательное сечение с использованием стандартного микротома толщиной от 4 до 6 мкм. Фолликулы систематически подсчитываются во всей секции тканей через определенный интервал, а затем умножаются на обратный интервал выборки для получения общей оценки фолликула. Этот метод быстрый, простой, может быть выполнен с использованием архивных тканей, и подготовлен с использованием стандартных гистологических методов. Для этого требуется только световой микроскоп со стандартными возможностями визуализации. Однако, несмотря на эти преимущества, прямой подсчет фолликулов не хватает точности и строгих параметров подсчета стереологии, что делает его более склонным к следователю предвзятости. Кроме того, ткани могут подвергаться усадки и деформации во время обработки, нарушая целостность и морфологию яичников и тем самым делая классификацию фолликулов и количественной оценки трудно.
Цель этой статьи состоит в том, чтобы описать два широко используемых метода количественной оценки числа изначальных фолликулов в яичниках мыши: стереология и прямой подсчет фолликулов. Мы предоставим подробные протоколы для этих двух методов и подчеркем некоторые из их сильных и слабых сторон, с тем чтобы повысить воспроизводимость в нашей области и позволить исследователям принять обоснованное решение о наиболее подходящем методе подсчета для своих исследований.
протокол
Яичники были собраны у самок мышей C57BL6J. Все процедуры и эксперименты на животных были проведены в соответствии с Австралийским кодексом практики NHMRC по уходу и использованию животных и одобрены Комитетом по этике животных исследовательской платформы Monash Animal.
ПРИМЕЧАНИЕ: Химиотерапевтического агента показано, истощают изначальные фолликулоциты, как это определено спомощью стереологии 11 и прямых кол-во 12,13 был использован в этом докладе для сравнения двух методов подсчета в том же животном. Самки, 8-недельные (молодые взрослые) мыши взвешивались до одной внутриперитонеальной инъекции 75 мг/кг/массы тела циклофосфамида, или солевого управления транспортным средством (n'5/group). Эта доза, как было показано, вызывают приблизительное 50% истощение изначальных фолликулов, но не сообщается, вызывают заболеваемость или смертность умышей 14. Яичники были собраны через 48 часов после лечения. Один яичник от каждого животного был зафиксирован в 10% (v/v) нейтральном буферном растворе формалина в течение 24 часов, а другой зафиксирован в растворе Буина в течение 24 часов. Ткань затем была встроена либо в гликольметакрилат смолы и последовательно раздели на 20 мкм, или в парафин и последовательно раздели на 5 мкм. Все ткани были окрашены периодической кислотой Шифф и гематоксилин.
1. Гистологическая подготовка: фиксация, обработка, встраивание и разделка яичников мыши
- Рассекаете яичники мыши путем обрезки яйцеклетки и всего окружающего жира, не повреждая и не разрезая сам яичник. При необходимости используйте рассечение микроскопа и тонкого лезвия для этого шага(рисунок 1A).
- Исправить ткани немедленно, поместив в небольшой помечены трубки, содержащие либо фиксативной Буин (стереология), или формалин фиксатор (прямые подсчеты) в течение 24 часов(рисунок 1B), прежде чем передавать ткани в 70% этанола.
ПРИМЕЧАНИЕ: Фолликул морфология сохраняется лучше всего в фиксированной ткани яичников Буина, встроенные в глицольметакрилат смолы (Рисунок 2). - Процесс целом фиксированных яичников, а затем вставлять в гликольметакрилат смолы длястереологии( Дополнительный файл 1 ), или парафин воск для прямого подсчета с помощью стандартного гистологического протокола.
ВНИМАНИЕ: Смола является токсичным, поэтому убедитесь, что все шаги обработки тканей выполняются в дым капот и перчатки носят во все времена. - Используйте специализированный микротом из метакрилата смолы(рисунок 1C),оснащенный стекляннымножом (рисунок 1D),чтобы исчерпывающе сократить толстые секции смолы гликольметакрилата (например, 20 мкм). Собирайте секции через регулярный интервал (например, каждый 3-йраздел) на стеклянные слайды микроскопа для стереологии.
- Используйте стандартный микротом для разреза тонких секций парафина (например, 4-6 мкм). Регулярно собирайте секции тканей (например, каждый9-й раздел) на слайде стеклянного микроскопа для прямого подсчета фолликулов.
- Пятно слайды с периодической кислоты Шифф и гематоксилин( Дополнительный файл 2).
- Coverslip со стандартным DPX для парафиновых секций, или толстый DPX для глицольметакрилатных секций смолы(рисунок 1E).
ВНИМАНИЕ: Гликольметакрилат смолы DPX является опасным, так что выполните этот шаг в дым капот.
ПРИМЕЧАНИЕ: Гликольметакрилат смолы DPX является чрезвычайно вязким. Стеклянная обложка должна быть твердо прилипает, нажав его вниз с помощью шпателя, чтобы обеспечить DPX равномерно и тонко рассеяны, и Есть нет пузырьков воздуха присутствует под крышкой (Рисунок 1F).
2. Стереологическая оценка числа изначальных фолликулов с помощью оптического фракционер
- Включите компьютер, блок мультиуго контроля, камеру и источник света в рамках настройки стереологии и установите цель микроскопа до низкого увеличения (например, 10x).
- Откройте программное обеспечение для стереологии.
- Поместите первый слайд надежно на сцене микроскопа.
- Отрегулируйте экспозицию света, проверяя автоматическое воздействие в панели настроек камеры (Дополнительный рисунок 1A). Кроме того, вручную отрегулируйте воздействие света.
- Используйте джойстик, чтобы найти первый образец ткани и привести образец в фокусе.
- Отрегулируйте баланс белого, либо нажав на больше настроек (расположен в правом нижнем углу панели настроек камеры), а затем нажмите Белый баланс и нажмите на автоматический (Дополнительный рисунок 1B). Кроме того, нажмите кнопку «Белый баланс», прилегающую к кнопке «Больше настроек» (или выберите область в большемнаборе настроек), чтобы настроить баланс белого цвета вручную, выбрав белую область в разделе.
- Перейти к зондам падение вниз меню и нажмите на оптический fractionator рабочий процесс. Затем нажмите Кнопку «Начать новый проект» и нажмите OK.
- Если существующая конфигурация выборки сохранена, под параметрами выборки нажмите Да | ... и выберите нужную конфигурацию выборки.
- Если нет, нажмите Нет и вручную введите информацию о разделе(Дополнительный рисунок 1C)и определите конфигурацию зонда на этапе 2.13.
- Нажмите на Следующий, установите микроскоп для низкого увеличения и выбрать 10x увеличение из меню высадки.
- Нажмите на следующий, а затем проследить вокруг всего раздела яичников - начать с левой нажав вокруг раздела и в конце, право нажмите кнопку и выбрать закрыть контур.
- Нажмите на Следующий, установить микроскоп для высокого увеличения и выбрать 100x увеличение масла из меню высадки.
- Поместите каплю масла на секцию ткани на слайде и переместит цель микроскопа к 100-му увеличению.
- Отрегулируйте воздействие света (как в шаге 2.4) и нажмите Далее.
- Настройка параметров выборки для определения конфигурации зонда. Здесь счетная рамка была установлена на 47,5 мкм х 47,5 мкм (2256,25мкм 2),а длина шага была установлена на 100 мкм х 100 мкм (10 000мкм 2)( Дополнительныйрисунок 2). После того, как параметры выборки будут установлены, сохраните шаблон и вновь откройте его во время последующих сеансов анализа на этапе 2.7.
- Нажмите на начало подсчета (Дополнительный рисунок 1D). Сосредоточьтесь на верхней части выборки, нажмите OK и начните подсчет.
- Используйте фокусировку ручки, чтобы двигаться через глубину выборки 10 мкм и подсчитать любые изначальные фолликулы, ядро яйцеклетки которых попадает в фокус. Нажмите далее, чтобы перейти к следующей области.
- Классифицировать фолликулы как изначальные, если яйцеклетка окружена плоскоклеточными (уплощенными) гранулозами, но без кубоидных клеток гранулозы(рисунок 2A).
ПРИМЕЧАНИЕ: Первичные фолликулы отличаются от промежуточных/переходных фолликулов, которые состоят из сочетания кубоидных и плоскоклеточных гранулоз(рисунок 2B),и первичных фолликулов, которые окружены преимущественно кубоидными гранулозными клетками(рисунок 2C). Эти классы фолликулов должны быть количественно определены отдельно. - Только подсчитайте фолликулы, в которых видно ядро яйцеклетки. Ядро яйцеклетки должно появиться в рамке подсчета или касаться зеленых линий включения счетной рамки(Дополнительный рисунок 1E,F).
- Если ядро яйцеклетки падает за пределы счетной рамки(дополнительный рисунок 1G)или касается красных линий исключения из графовой рамы, не посчитайте этот фолликул.
- При оценке истощения изначального фолликула в ответ на экзогенное химическое вещество (например, химиотерапию), убедитесь, что все подсчитанные фолликулы здоровы и, таким образом, имеют нормальнуюморфологию (рисунок 2). Подсчитайте любые ненормальные или атретические фолликулы отдельно. Часто смерть фолликула вызвана оскорблениями, такими как химиотерапия, и количественная оценка атретических фолликулов должна быть получена отдельно, чтобы различать здоровые и атретические фолликулы, так как только здоровые фолликулы составляют резерв яичников15.
- Классифицировать фолликулы как изначальные, если яйцеклетка окружена плоскоклеточными (уплощенными) гранулозами, но без кубоидных клеток гранулозы(рисунок 2A).
- После завершения подсчета на этом разделе, сделать один из следующих:
- Нажмите Добавить новый раздел, а затем вернуться к шагу 2.3, чтобы настроить следующий раздел для подсчета голосов.
- Нажмите, что я закончил подсчет, чтобы закончить сеанс. Верните цель в 10 раз, выйти из стереологического программного обеспечения и выключить источник света, камеру, блок мульти-управления и компьютер.
- Получить сумму сырья фолликула номер (я) из каждой ткани раздел, отобранный из всего яичника, а затем с помощью электронной таблицы, использовать уравнение ниже, чтобы получить окончательное значение от каждого реплицировать животное (N)4.
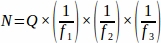 где:
где:
N - Общее предполагаемое количество фолликулов в яичнике.
Сырье из первобытного фолликула кол.
f1 - Интервал выборки. Каждый3-й раздел был отобран таким образом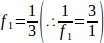 .
.
f2 - Связь между рамкой подсчета (область выборки) и степпером, рассчитанная как . Так как площадь выборки составила 2256мкм 2 (47,5 мкм х 47,5 мкм), а область степпера составила 10000мкм 2 (100 мкм х 100 мкм),
. Так как площадь выборки составила 2256мкм 2 (47,5 мкм х 47,5 мкм), а область степпера составила 10000мкм 2 (100 мкм х 100 мкм),  .
.
f3 - Часть образцов секции яичников. Так как 10 мкм из 20 мкм раздел был отобран,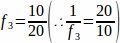 .
.
Таким образом,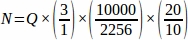 .
.
ПРИМЕЧАНИЕ: В этом протоколе описывается, как применять эти принципы стереологического анализа с использованием широко цитируемого стереологического программногообеспечения (Таблица материалов); однако, другое стереологическое программное обеспечение доступно. Принципы, применяемые при стереологическом анализе фолликулов яичников, одинаковы, независимо от программного обеспечения, используемого для настройки параметров. Стереология является наиболее точным, когда 100 или более объектов учитываются во взросломяичнике мыши 4, так как это дает коэффициент погрешности для оценки ниже 10%16. Параметры выборки, изложенные здесь, были оптимизированы для обеспечения того, чтобы как минимум около 100 объектов (т.е. первичных, переходных и первичных фолликулов) можно было засчитать в контроль взрослых яичников дикого типа C57BL6J. Экспериментальное исследование может быть проведено в том числе небольшой размер выборки для установления оптимальных параметров выборки, таких как интервал и количество разделов, которые будут проанализированы и количество оптических рассечений в отобранныхразделах 17.
3. Оценка числа изначальных фолликулов по прямым подсчетам фолликулов яичников
- Поместите слайд микроскопа надежно под стандартным световым микроскопом и выполните прямые подсчеты, чтобы получить сырое первобытное число фолликула.
- Классифицивные фолликулы как изначальные, если яйцеклетка хорошо видна и окружена плоскоклеточными (уплощенными) гранулоза, но без кубоидных гранулозных клеток(рисунок 2D).
ПРИМЕЧАНИЕ: Первичные фолликулы отличаются от промежуточных/переходных фолликулов, которые состоят из сочетания кубоидных и плоскоклеточных гранулоз(рисунок 2E),и первичных фолликулов, которые окружены преимущественно кубоидными гранулозными клетками(рисунок 2F). Эти классы фолликулов должны быть количественно определены отдельно. - Убедитесь, что все подсчитанные фолликулы здоровы и, таким образом, имеют нормальную морфологию(рисунок 2). Подсчитайте любые ненормальные или атретические фолликулы отдельно, так как только здоровые фолликулы составляют резерв яичников.
- Классифицивные фолликулы как изначальные, если яйцеклетка хорошо видна и окружена плоскоклеточными (уплощенными) гранулоза, но без кубоидных гранулозных клеток(рисунок 2D).
- Кроме того, возьмите несколько, или сшитые высокой мощности (например, 20x) фотомикрографы всего раздела ткани яичников для выполнения рассчитывает, открыв файл изображения (ы). Это можно сделать вручную или с помощью автоматизированного сканера слайдов.
- Получить сумму сырья фолликула номер (я) из каждой части ткани пробы из всего яичника в заданный интервал. Умножьте это число на обратную часть выборки, чтобы получить окончательное значение для каждого реплицировать животное (N), используя уравнение ниже.
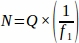 где:
где:
N - Общее предполагаемое количество фолликулов в яичнике.
- Количество необработанных фолликулов (каждого отдельного типа, рассчитанного отдельно).
f1 - Интервал выборки. Каждый9-й раздел был отобран таким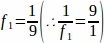 образом.
образом.
Таким образом,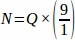 .
.
Результаты
Была использована хорошо охарактеризованная модель истощения фолликула, при которой молодым взрослым самшам вводили разовую дозу циклофосфамидной химиотерапии, или солевой контроль транспортного средства (n'5/group), и оба яичника были собраны с каждого животного после 48 часов. Один яичн...
Обсуждение
В этой статье приводится пошаговой протокол для техники золотого стандарта для перечисления мышей изначальных фолликулов, стереологии и более часто используемого метода прямого подсчета фолликулов. Химиотерапия была использована для сравнения и контраста результаты, полученные из ?...
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Эта работа стала возможной благодаря поддержке оперативной инфраструктуры правительства штата Виктория и австралийского правительства NHMRC IRIISS и при поддержке Национального совета по здравоохранению и медицинским исследованиям (ALW #1120300) и Австралийского исследовательского совета (KJH #FT190100265). Авторы хотели бы отметить техническую поддержку исследовательской платформы Monash Animal Research Platform, платформы Гистологии Монаша и объекта микровизии Монаш.
Материалы
| Name | Company | Catalog Number | Comments |
| 1-Butanol (HPLC) | Fisher Chemical | #A383-1 | |
| Acid alcohol | Amber Scientific | #ACDL | |
| Bouin’s fixative | Sigma-Aldrich | #HT10132 | Picric acid 0.9% (w/v), formaldehyde 9% (v/v), acetic acid 5% (w/v) |
| Cyclophosphamide | Sigma-Aldrich | #C0768-5G | |
| Dibutylphthalate Polystyrene Xylene (DPX) | Sigma-Aldrich | #06522 | |
| Ethanol | Amber Scientific | #ETH | Ethanol 100% |
| Micro Feather opthalmic scalpel with aluminium handle | Designs for Vision | #FEA-745-SR | Feather blade for dissections (seen in Figure 1) |
| Formalin fixative | Australian Biostain | #ANBFC | |
| Glass coverslip | Thermo Scientific | #MENCS22501GP | 22 mm x 50 mm |
| Glycomethacrylate resin RM2165 microtome | Leica Microsystems | #RM2165 | |
| Glycolmethacrylate DPX | *made in house | *Mix 1.5 L Xylene; 800 g polystyrene pellets; 100mL Dibutyl phthalate for 3 weeks | |
| Histolene | Trajan | #11031 | |
| Mayer’s haematoxylin | Amber Scientific | #MH | |
| Olympus BX50 microscope | Olympus | #BX50 | Brightfield microscope fitted with 10x dry & 100x oil immersion objective (numerical aperture 1.3) |
| Olympus immersion oil type-F | Olympus | #IMMOIL-F30CC | |
| Olympus TH4-200 light source | Olympus | #TH4-200 | |
| Paraffin wax | Sigma-Aldrich | #03987 | |
| Periodic acid | Trajan | #PERI1% | Periodic acid 1% |
| Rotary Microtome CUT 4060 | MicroTec | #4060R/F | Used to cut paraffin sections |
| Schiff’s reagent | Trajan | #SCHF | |
| Scott's tap water | Amber Scientific | #SCOT | Potassium carbonate, magnesium sulphate, water |
| StereoInvestigator Stereological System | MBF Bioscience | Includes StereoInvestigator software, multi-control unit, automatic stage and joystick | |
| Superfrost microscope slides | Thermo Scientific | #MENSF41296SP | 1 mm, 72 pcs |
| Technovit 7100 Plastic embedding system | Emgrid Australia | #64709003 | 500 mL/5 x 1 g/40 mL |
| Technovit 3040 yellow | Emgrid Australia | #64708805 | 100 g/80 mL |
Ссылки
- Stringer, J. M., Winship, A., Liew, S. H., Hutt, K. The capacity of oocytes for DNA repair. Cellular and Molecular Life Sciences. 75 (15), 2777-2792 (2018).
- Winship, A. L., Stringer, J. M., Liew, S. H., Hutt, K. J. The importance of DNA repair for maintaining oocyte quality in response to anti-cancer treatments, environmental toxins and maternal ageing. Human Reproduction Update. 24 (2), 119-134 (2018).
- Broer, S. L., Broekmans, F. J., Laven, J. S., Fauser, B. C. Anti-Mullerian hormone: ovarian reserve testing and its potential clinical implications. Human Reproduction Update. 20 (5), 688-701 (2014).
- Myers, M., Britt, K. L., Wreford, N. G., Ebling, F. J., Kerr, J. B. Methods for quantifying follicular numbers within the mouse ovary. Reproduction. 127 (5), 569-580 (2004).
- Boyce, R. W., Dorph-Petersen, K. A., Lyck, L., Gundersen, H. J. Design-based stereology: introduction to basic concepts and practical approaches for estimation of cell number. Toxicologic Pathology. 38 (7), 1011-1025 (2010).
- Ristic, N., et al. Maternal dexamethasone treatment reduces ovarian follicle number in neonatal rat offspring. Journal of Microscopy. 232 (3), 549-557 (2008).
- Soleimani Mehranjani, M., Mansoori, T. Stereological study on the effect of vitamin C in preventing the adverse effects of bisphenol A on rat ovary. International Journal of Reproductive Biomedicine (Yazd). 14 (6), 403-410 (2016).
- Brown, D. L. Bias in image analysis and its solution: unbiased stereology. Journal of Toxicologic Pathology. 30 (3), 183-191 (2017).
- Hasselholt, S., Lykkesfeldt, J., Overgaard Larsen, J. Thick methacrylate sections devoid of lost caps simplify stereological quantifications based on the optical fractionator design. Anatomical Record (Hoboken). 298 (12), 2141-2150 (2015).
- Tilly, J. L. Ovarian follicle counts--not as simple as 1, 2, 3. Reproductive Biology and Endocrinology. 1, 11 (2003).
- Nguyen, Q. N., et al. Loss of PUMA protects the ovarian reserve during DNA-damaging chemotherapy and preserves fertility. Cell Death and Disease. 9 (6), 618 (2018).
- Meirow, D., Assad, G., Dor, J., Rabinovici, J. The GnRH antagonist cetrorelix reduces cyclophosphamide-induced ovarian follicular destruction in mice. Human Reproduction. 19 (6), 1294-1299 (2004).
- Winship, A. L., et al. The PARP inhibitor, olaparib, depletes the ovarian reserve in mice: implications for fertility preservation. Human Reproduction. , (2020).
- Meirow, D., Lewis, H., Nugent, D., Epstein, M. Subclinical depletion of primordial follicular reserve in mice treated with cyclophosphamide: clinical importance and proposed accurate investigative tool. Human Reproduction. 14 (7), 1903-1907 (1999).
- Nguyen, Q. N., et al. Cisplatin- and cyclophosphamide-induced primordial follicle depletion is caused by direct damage to oocytes. Molecular Human Reproduction. , (2019).
- Gundersen, H. J., Jensen, E. B. The efficiency of systematic sampling in stereology and its prediction. Journal of Microscopy. 147, 229-263 (1987).
- Olesen, M. V., Needham, E. K., Pakkenberg, B. The Optical Fractionator Technique to Estimate Cell Numbers in a Rat Model of Electroconvulsive Therapy. Journal of Visualized Experiments. (125), e55737 (2017).
- Findlay, J. K., Hutt, K. J., Hickey, M., Anderson, R. A. How Is the Number of Primordial Follicles in the Ovarian Reserve Established. Biology of Reproduction. 93 (5), 111 (2015).
- Omari, S., et al. Mcl-1 is a key regulator of the ovarian reserve. Cell Death and Disease. 6, 1755 (2015).
- Winship, A. L., Bakai, M., Sarma, U., Liew, S. H., Hutt, K. J. Dacarbazine depletes the ovarian reserve in mice and depletion is enhanced with age. Scientific Reports. 8 (1), 6516 (2018).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. An accurate, simple method for unbiased determination of primordial follicle number in the primate ovary. Biology of Reproduction. 56 (4), 909-915 (1997).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. Morphometric analysis of primordial follicle number in pigtailed monkey ovaries: symmetry and relationship with age. Biology of Reproduction. 61 (2), 553-556 (1999).
- Charleston, J. S., et al. Estimating human ovarian non-growing follicle number: the application of modern stereology techniques to an old problem. Human Reproduction. 22 (8), 2103-2110 (2007).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and nongrowing follicle counts according to the Stages of Reproductive Aging Workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Hansen, K. R., et al. A new model of reproductive aging: the decline in ovarian non-growing follicle number from birth to menopause. Human Reproduction. 23 (3), 699-708 (2008).
- Sonigo, C., et al. High-throughput ovarian follicle counting by an innovative deep learning approach. Scientific Reports. 8 (1), 13499 (2018).
- McKey, J., Cameron, L. A., Lewis, D., Batchvarov, I. S., Capel, B. Combined iDISCO and CUBIC tissue clearing and lightsheet microscopy for in toto analysis of the adult mouse ovarydagger. Biology of Reproduction. 102 (5), 1080-1089 (2020).
- Kagami, K., Shinmyo, Y., Ono, M., Kawasaki, H., Fujiwara, H. Three-dimensional evaluation of murine ovarian follicles using a modified CUBIC tissue clearing method. Reproductive Biology and Endocrinology. 16 (1), 72 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены