È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Enumerazione accurata del follicolo nelle ovaie di topo adulto
In questo articolo
Riepilogo
Qui descriviamo, confrontiamo e confrontiamo due diverse tecniche per un accurato conteggio follicolo dei tessuti ovarico del topo fissi.
Abstract
Mammiferi femminili che si riproducono sessualmente nascono con tutta la loro fornitura di ovociti per tutta la vita. Gli ovociti immaturi e quiescenti si trovano all'interno dei follicoli primordiali, l'unità di stoccaggio della linea germinale femminile. Non sono rinnovabili, quindi il loro numero alla nascita e il conseguente tasso di perdita dettano in gran parte la durata fertile della vita femminile. Una quantificazione accurata del numero primordiale di follicoli nelle donne e negli animali è essenziale per determinare l'impatto di medicinali e sostanze tossiche sulla riserva ovarica. È anche necessario valutare la necessità e il successo delle tecniche di conservazione della fertilità esistenti ed emergenti. Attualmente, non esistono metodi per misurare con precisione il numero di follicoli primordiali che comprendono la riserva ovarica nelle donne. Inoltre, ottenere tessuto ovarico da grandi animali o specie in via di estinzione per la sperimentazione spesso non è fattibile. Pertanto, i topi sono diventati un modello essenziale per tali studi e la capacità di valutare i numeri primordiali dei follicoli nelle ovaie del topo intero è uno strumento critico. Tuttavia, i rapporti sui numeri assoluti dei follicoli nelle ovaie di topo in letteratura sono altamente variabili, rendendo difficile confrontare e / o replicare i dati. Ciò è dovuto a una serie di fattori tra cui tensione, età, gruppi di trattamento, nonché differenze tecniche nei metodi di conteggio impiegati. In questo articolo, forniamo una guida didattica passo-passo per preparare sezioni istologiche e contare follicoli primordiali nelle ovaie di topo usando due metodi diversi: [1] stereologia, che si basa sulla tecnica del frazionamento / dissector ottico; e [2] la tecnica del conteggio diretto. Alcuni dei principali vantaggi e svantaggi di ciascun metodo saranno evidenziati in modo da migliorare la riproducibilità sul campo e consentire ai ricercatori di selezionare il metodo più appropriato per i loro studi.
Introduzione
Gli ovociti immaturi, arrestati meioticamente immagazzinati all'interno di follicoli primordiali nell'ovaio sono l'unità di stoccaggio della linea germinale femminile e comprendono la riserva ovarica a vita di un individuo. Il numero primordiale di follicoli diminuisce naturalmentecon l'età di 1, o in alternativa, può essere prematuramente impoverito a seguito dell'esposizione a sostanze chimiche esogene, tra cui alcuni prodotti farmaceutici e sostanze tossiche ambientali nell'aria, negli alimenti enell'acqua 2. Dato che il numero primordiale del follicolo è finito, la quantità e la qualità dei follicoli presenti all'interno dell'ovaio determinano in gran parte la fertilità femminile e la salute della prole. Pertanto, una quantificazione accurata del numero primordiale di follicoli nelle donne è essenziale per valutare gli impatti fuori bersaglio degli insulti esogeni sulla riserva ovarica.
Nelle donne, l'analisi dell'intera ovaia non è generalmente possibile, quindi le misure surrogate non invasive della riserva ovarica devono essere utilizzate in un ambiente clinico. L'Mϋllerian anti-Mϋllerian (AMH) è il biomarcatore surrogato più utilizzato clinicamente3. I livelli di AMH sierico sono spesso misurati nelle donne in età materna avanzata, o prima e dopo il trattamento del cancro, come la chemioterapia. Tuttavia, l'AMH è prodotto dalla crescita dei follicoli e non dai follicoli primordiali, e quindi, i livelli del siero non informano sul numero primordiale assoluto del follicolo.
Con l'assenza di metodi per determinare con precisione il numero primordiale di follicoli nelle donne in situ, il conteggio dei follicoli ovarico in piccoli modelli animali, come i roditori, rimane uno strumento di ricerca essenziale per valutare il grado in cui gli insulti esogeni hanno un impatto sui follicoli primordiali e quindi sulla fertilità. Sfortunatamente, tuttavia, i rapporti in tutta la letteratura sui numeri primordiali dei follicoli nei modelli di roditori sono altamentevariabili 4. Una delle ragioni principali di ciò sono le differenze tecniche ampiamente riportate nel metodo di conteggio utilizzato. Prevalentemente, ci sono due diverse tecniche descritte nella letteratura per enumerare i follicoli primordiali nei topi. Questi includono la stereologia, che utilizza il metodo del dissector ottico del frazionatore, e il conteggio diretto dei follicoli.
La stereologia è ampiamente considerata il gold standard in quanto utilizza un campionamento casuale uniformesistematico 5, rendendolo il metodo più accurato per quantificare il numero primordiale del follicolo nell'intero topo, o ovaiedi ratto 4,6,7. La stereologia è imparziale, in quanto spiega la struttura tridimensionale dell'oggetto di interesse8. Utilizzando un metodo di dissector/frazionatore ottico, vengono applicati tre livelli di campionamento per quantificare i follicoli primordiali utilizzando sezioni di tessuto spesse (ad esempio, 20 μm) all'interno di una frazione nota dell'ovaio totale del topo. In primo luogo, l'intervallo di campionamento viene scelto (ad esempio, ogni 3rd section) ad un inizio casuale (frazione di campionamento 1, f1)4. Le sezioni vengono quindi campionare in modo sistematico e uniforme da questo punto attraverso l'intera ovaia. Quindi, un sistema di conteggio imparziale viene sovrapposto alla sezione ovarica e progressivamente spostato lungo una griglia di conteggio definita e randomizzata (frazione di campionamento 2, f2)8. Infine, una frazione nota dello spessore della sezione viene campionato otticamente (ad esempio, 10 μm) e vengono conteggiati i follicoli all'interno di quest'area (frazione di campionamento 3, f3)4. Il numero del follicolo grezzo viene moltiplicato per l'inverso di queste frazioni di campionamento per ottenere il valore finale. Questo metodo richiede una formazione e attrezzature esperte, incluso un microscopio con uno stadio motorizzato guidato da software stereologico. I tessuti devono essere conservati in un fixativo di Bouin specializzato e incorporati nella resina glicolemetacrilato per consentire il taglio di sezioni di tessuto spesse utilizzando un microtomo di resina glicolemetacrilato con un coltello di vetro. Questo metodo è progettato per tenere conto del restringimento e della deformazione tissutale, per preservare al meglio la struttura morfologica tridimensionale dell'ovaio e dei follicoli9.
Il conteggio diretto dei follicoli è il metodo più utilizzato per contare ifollicoli 10. Possono essere utilizzati fissivi più comuni (cioè formalina), seguiti da incorporamento di cera di paraffina e sessatura seriale esaustiva utilizzando un microtomo standard con uno spessore compreso tra 4-6 μm. I follicoli vengono sistematicamente conteggiati nell'intera sezione tissutale ad un intervallo definito, e quindi moltiplicati per l'inverso dell'intervallo di campionamento per ottenere la stima totale del follicolo. Questo metodo è rapido, facile, può essere eseguito utilizzando tessuti archiviati e preparato utilizzando tecniche istologiche standard. Richiede solo un microscopio a luce con funzionalità di imaging standard. Tuttavia, nonostante questi vantaggi, il conteggio diretto dei follicoli manca dell'accuratezza e dei rigorosi parametri di conteggio della stereologia, rendendolo più incline ai pregiudizi degli investigatori. Inoltre, i tessuti possono subire restringimento e deformazione durante la lavorazione, interrompendo l'integrità e la morfologia dell'ovaio e rendendo così difficile la classificazione e la quantificazione dei follicoli.
Lo scopo di questo articolo è quello di descrivere due metodi comunemente usati per valutare quantitativamente il numero primordiale di follicoli nelle ovaie del topo: stereologia e conteggio diretto dei follicoli. Forniremo protocolli dettagliati per questi due metodi ed evidenzieremo alcuni dei loro punti di forza e di debolezza, al fine di migliorare la riproducibilità nel nostro campo e consentire ai ricercatori di prendere una decisione informata sul metodo di conteggio più appropriato per i loro studi.
Protocollo
Le ovaie sono state raccolte da topi C57BL6J femminili. Tutte le procedure e gli esperimenti sugli animali sono stati eseguiti in conformità con il Codice di condotta australiano NHMRC per la cura e l'uso degli animali e approvati dal Monash Animal Research Platform Animal Ethics Committee.
NOTA: Un agente chemioterapico ha dimostrato di esaurire gli ovociti follicoli primordiali, come determinato usando lastereologia 11 e il conteggiodiretto 12,13 è stato utilizzato in questo rapporto per confrontare i due metodi di conteggio nello stesso animale. I topi femmine di 8 settimane (giovani adulti) sono stati pesati prima di una singola iniezione intraperitoneale di 75 mg/kg/peso corporeo di ciclofosfamide o controllo del veicolo salino (n=5/gruppo). Questa dose ha dimostrato di causare un impoverimento approssimativo del 50% dei follicoli primordiali, ma non è stato riferito che causi morbilità o mortalità neitopi 14. Le ovaie sono state raccolte 48 ore dopo il trattamento. Un'ovaia di ciascun animale è stata fissata in soluzione di formalina tamponata neutra al 10% (v/v) per 24 ore e l'altra fissata nella soluzione di Bouin per 24 ore. Il tessuto è stato quindi incorporato nella resina glicolemetacrilato e sessato serialmente a 20 μm, oppure in paraffina e sessato serialmente a 5 μm. Tutti i tessuti erano macchiati di acido periodico Schiff ed ematossilina.
1. Preparazione istologica: fissazione, lavorazione, incorporamento e sessatura delle ovaie del topo
- Sezionare le ovaie del topo tagliando l'ovidotto e tutto il grasso circostante, senza danneggiare o tagliare l'ovaio stesso. Se necessario, utilizzare un microscopio sezionato e una lama fine per questo passaggio (Figura 1A).
- Fissare immediatamente i tessuti posizionandoli in un piccolo tubo marcato contenente il fissatore (stereologia) di Bouin o il fissatore formalin (conteggi diretti) per 24 ore(Figura 1B),prima di trasferire i tessuti nel 70% di etanolo.
NOTA: La morfologia follicolare è conservata al meglio all'interno del tessuto ovarico fisso di Bouin, incorporato nella resina glicolemetacrilato (Figura 2). - Elaborare le ovaie fisse intere e quindi incorporare nella resina glicolemetacrilato per la stereologia (File complementare 1), o cera di paraffina per conteggi diretti utilizzando un protocollo istologico standard.
ATTENZIONE: La resina è tossica, quindi assicurati che tutte le fasi di lavorazione dei tessuti vengano eseguite in un cappuccio dei fumi e che i guanti vengano indossati in ogni momento. - Utilizzare un microtome specializzato in metacrilato di resina(Figura 1C)munito di un coltello di vetro(figura 1D)per tagliare in modo esaustivo sezioni di resina glicolemetacrilato spessa (ad esempio, 20 μm). Raccogliere le sezioni a intervalli regolari (ad esempio, ogni 3sezione rd) su vetrini al microscopio per stereologia.
- Utilizzare un microtomo standard per tagliare sezioni di paraffina sottili (ad esempio, 4-6 μm). Raccogliere sezioni di tessuto a intervalli regolari (ad esempio, ogni9 sezione) su un vetrino al microscopio in vetro per il conteggio diretto dei follicoli.
- Macchiare le diapositive con acido periodico Schiff ed ematossilina (File complementare 2).
- Coverslip con DPX standard per sezioni di paraffina o DPX spesso per sezioni di resina glicolemetacrilato (Figura 1E).
ATTENZIONE: La resina glicolemetacrilato DPX è pericolosa, quindi eseguire questo passaggio nella cappa dei fumi.
NOTA: La resina glicolemetacrilato DPX è estremamente viscosa. La coverlip di vetro deve essere aderendo saldamente premendola verso il basso con una spatola per garantire che il DPX sia uniformemente e sottilmente disperso e che non vi siano bolle d'aria presenti sotto il coverslip (Figura 1F).
2. Stima stereologica del numero primordiale del follicolo utilizzando il frazionatore ottico
- Accendere il computer, l'unità multicontrollo, la fotocamera e la sorgente luminosa all'interno della configurazione stereologica e impostare l'obiettivo del microscopio su un ingrandimento basso (ad esempio, 10x).
- Aprire il software di stereologia.
- Mettere la prima diapositiva in modo sicuro sul palco del microscopio.
- Regolare l'esposizione della luce controllando Automatico sotto Esposizione nel pannello Impostazioni fotocamera (Figura complementare 1A). In alternativa, regolare manualmente l'esposizione alla luce.
- Utilizzare il joystick per localizzare il primo campione di tessuto e mettere a fuoco il campione.
- Regolare il bilanciamento del bianco, facendo clic su Altre impostazioni (situato in basso a destra nel pannello Impostazioni fotocamera), quindi fare clic su Bilanciamento del bianco e fare clic su Automatico (Figura complementare 1B). In alternativa, fare clic sul pulsante Bilanciamento bianco adiacente al pulsante Altre impostazioni (o Seleziona area in altre impostazioni) per impostare manualmente il bilanciamento del bianco selezionando un'area bianca nella sezione.
- Passare al menu a discesa Probes e scegliere Workflow frazionatore ottico. Quindi fare clic su Avvia nuovo progetto e quindi su OK.
- Se è stata salvata una configurazione di campionamento esistente, in Parametri campionamento fare clic su Sì | ... e selezionare la configurazione di campionamento desiderata.
- In caso di meno, fare clic su No e immettere manualmente le informazioni sulla sezione seriale ( Figuracomplementare 1C) e definire la configurazione della sonda al passaggio 2.13.
- Fate clic su Avanti (Next),impostate il microscopio su Ingrandimento basso (Low Magnification) e scegliete Ingrandimento 10x dal menu a discesa.
- Fare clic su Avanti, quindi tracciare l'intera sezione ovarica , iniziare facendo clic a sinistra intorno alla sezione e alla fine fare clic con il pulsante destro del mouse e scegliere Chiudi contorno.
- Fate clic su Avanti (Next),impostate il microscopio su Ingrandimento elevato (High Magnification) e scegliete Ingrandimento olio 100x dal menu a discesa.
- Posizionare una goccia di olio sulla sezione tissutale sullo scivolo e spostare l'obiettivo del microscopio a un ingrandimento 100x.
- Regolare l'esposizione alla luce (come nel passaggio 2.4) e fare clic su Avanti.
- Impostate i parametri di campionamento per definire la configurazione del probe. Qui, il telaio di conteggio è stato impostato su 47,5 μm x 47,5 μm (2.256,25 μm2) e la lunghezza del passo è stata impostata su 100 μm x 100 μm (10.000 μm2)(Figura supplementare 2). Una volta stabiliti i parametri di campionamento, salvare il modello e riaprorlo durante le sessioni di analisi successive al passaggio 2.7.
- Fare clic su Inizia conteggio ( Figura complementare 1D). Mettere a fuoco la parte superiore dell'esempio, fare clic su OK e iniziare a contare.
- Utilizzare la manopola di messa a fuoco per muoversi attraverso la profondità di campionamento di 10 μm e contare tutti i follicoli primordiali il cui nucleo di ovocita viene messo a fuoco. Fare clic su Avanti per passare all'area successiva.
- Classificare i follicoli come primordiali se l'ovociti è circondato da cellule granulosa squamose (appiattite), ma nessuna cellule di granulosa cuboidale(Figura 2A).
NOTA: I follicoli primordiali sono distinti dai follicoli intermedi/transitori, che comprendono una combinazione di cellule granulosa cuboidali e squamose (Figura 2B) e follicoli primari, che sono circondati prevalentemente da cellule granulosa cuboidali (Figura 2C). Queste classi follicoli devono essere quantificate separatamente. - Conta solo i follicoli in cui è visibile il nucleo ovocita. Il nucleo di ovocita deve apparire all'interno del quadro di conteggio o toccare le linee di inclusione verde del quadro di conteggio (Figura supplementare 1E,F).
- Se il nucleo di ovocita cade al di fuori del telaio di conteggio (Figura supplementare 1G) o tocca le linee di esclusione rossa del telaio di conteggio, non contare questo follicolo.
- Quando si valuta l'esaurimento primordiale del follicolo in risposta a una sostanza chimica esogena (ad esempio, la chemioterapia), assicurarsi che tutti i follicoli contati siano sani e quindi abbiano una morfologia normale (Figura 2). Contare separatamente eventuali follicoli anomali o atretici. Spesso, la morte follicolare è indotta da insulti come la chemioterapia e la quantificazione dei follicoli atretici dovrebbe essere ottenuta separatamente al fine di distinguere tra follicoli sani e atretici, poiché solo i follicoli sani comprendono la riserva ovarica15.
- Classificare i follicoli come primordiali se l'ovociti è circondato da cellule granulosa squamose (appiattite), ma nessuna cellule di granulosa cuboidale(Figura 2A).
- Una volta completato il conteggio su quella sezione, eseguire una delle operazioni seguenti:
- Fare clic su Aggiungi nuovasezione , quindi tornare al passaggio 2.3 per impostare la sezione successiva per il conteggio.
- Fare clic su Ho finito di contare per terminare la sessione. Riportare l'obiettivo a 10x, uscire dal software di stereologia e spegnere la sorgente luminosa, la fotocamera, l'unità multicontrollo e il computer.
- Ottenere la somma del numero di follicolo grezzo (Q) da ogni sezione di tessuto campionare dall'intera ovaia, quindi utilizzando un foglio di calcolo, utilizzare l'equazione seguente per ottenere il valore finale da ogni animale replicato (N)4.
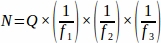 dove:
dove:
N = Numero totale stimato di follicoli all'interno dell'ovaio.
Q = Conteggio primordiale dei follicoli grezzi.
f1 = Intervallo di campionamento. Ogni sezione 3rd è stata campio campionare così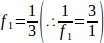 .
.
f2 = Relazione tra il frame di conteggio (area campione) e il stepper, calcolato come . Poiché l'area del campione era di 2256 μm2 (47,5 μm x 47,5 μm) e l'area del stepper era di 10000 μm2 (100 μm x 100 μm),
. Poiché l'area del campione era di 2256 μm2 (47,5 μm x 47,5 μm) e l'area del stepper era di 10000 μm2 (100 μm x 100 μm),  .
.
f3 = Frazione della sezione ovarica campionare. Poiché sono stati campionati 10 μm della sezione di 20 μm,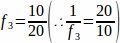 .
.
Pertanto,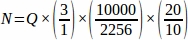 .
.
NOTA: Questo protocollo descrive come applicare questi principi di analisi stereologiche utilizzando un software stereologico ampiamente citato (Table of Materials); tuttavia, sono disponibili altri software stereologici. I principi applicati durante le analisi stereologiche dei follicoli ovarico sono gli stessi, indipendentemente dal software utilizzato per impostare i parametri. La stereologia è più accurata quando 100 o più oggetti sono contati in un'ovaia di topo adulto4, in quanto ciò fornisce un coefficiente di errore per la stima inferiore al 10%16. I parametri di campionamento qui delineati sono stati ottimizzati per garantire che un minimo di circa 100 oggetti (cioè follicoli primordiali, transitori e primari) possano essere conteggiati nelle ovaie di tipo selvatico per adulti di tipo selvatico C57BL6J. È possibile condurre uno studio pilota che includa una piccola dimensione del campione per stabilire i parametri di campionamento ottimali, come l'intervallo e il numero di sezioni da analizzare e il numero di dissettori ottici all'interno delle sezionicampionare 17.
3. Stima del numero primordiale del follicolo per conteggio diretto del follicolo ovarico
- Posizionare il vetrino del microscopio in modo sicuro sotto un microscopio a luce standard ed eseguire conteggi diretti per ottenere il numero di follicolo primordiale grezzo.
- Classificare i follicoli come primordiali se l'ovociti è chiaramente visibile ed è circondato da cellule granulosa squamose (appiattite), ma nessuna cellule granulosa cuboidale(Figura 2D).
NOTA: I follicoli primordiali sono distinti dai follicoli intermedi/transitori, che comprendono una combinazione di cellule granulosa cuboidale e squamosa (Figura 2E) e follicoli primari, che sono circondati prevalentemente da cellule granulosa cuboidali (Figura 2F). Queste classi follicoli devono essere quantificate separatamente. - Assicurarsi che tutti i follicoli contati siano sani e abbiano quindi una morfologia normale (Figura 2). Contare separatamente eventuali follicoli anomali o atretici, poiché solo i follicoli sani comprendono la riserva ovarica.
- Classificare i follicoli come primordiali se l'ovociti è chiaramente visibile ed è circondato da cellule granulosa squamose (appiattite), ma nessuna cellule granulosa cuboidale(Figura 2D).
- In alternativa, prendi fotomicrografi multipli o cuciti ad alta potenza (ad esempio, 20 volte) dell'intera sezione del tessuto ovarico per eseguire conteggi aprendo i file di immagine. Questo può essere fatto manualmente o utilizzando uno scanner di diapositive automatizzato.
- Ottenere il numero di follicolo grezzo (Q) da ogni sezione tissutale campionato dall'intera ovaia all'intervallo predeterminato. Moltiplicare questo numero per l'inverso della frazione di campionamento per ottenere il valore finale per ogni animale replicato (N), usando l'equazione seguente.
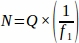 dove:
dove:
N = Numero totale stimato di follicoli all'interno dell'ovaio.
Q = Conteggio follicolo grezzo (di ogni singolo tipo, calcolato separatamente).
f1 = Intervallo di campionamento. Ogni9° sezione è stata campionare così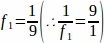 .
.
Pertanto,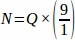 .
.
Risultati
È stato utilizzato un modello ben caratterizzato di esaurimento del follicolo, in base al quale alle giovani topi adulte è stata somministrata una singola dose di chemioterapia ciclofosfamide, o controllo saline del veicolo (n = 5 / gruppo) ed entrambe le ovaie sono state raccolte da ogni animale dopo 48 ore. Un'ovaia per animale è stata preparata come descritto nel passaggio 1 per ciascuno dei due metodi: stereologia o conteggi diretti. L'ovaio sinistro e destro di ogni animale è stato assegnato casualmente a ciascu...
Discussione
Questo articolo fornisce un protocollo passo-passo per la tecnica gold standard per l'enumerazione dei follicoli primordiali del topo, la stereologia e il metodo più comunemente utilizzato per il conteggio diretto dei follicoli. Il trattamento chemioterapico è stato utilizzato per confrontare e confrontare i risultati ottenuti da questi due diversi metodi all'interno dell'ovaio sinistro e destro dello stesso animale. Entrambi i metodi hanno rivelato un'elevata variabilità tra gli animali nei numeri primordiali del fol...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato reso possibile attraverso il supporto alle infrastrutture operative del governo statale vittoriano e l'AUSTRALIAN Government NHMRC IRIISS e supportato dai finanziamenti del National Health and Medical Research Council (ALW #1120300) e dell'Australian Research Council (KJH #FT190100265). Gli autori vorrebbero riconoscere il supporto tecnico della Monash Animal Research Platform, monash Histology Platform e Monash Micro Imaging facility.
Materiali
| Name | Company | Catalog Number | Comments |
| 1-Butanol (HPLC) | Fisher Chemical | #A383-1 | |
| Acid alcohol | Amber Scientific | #ACDL | |
| Bouin’s fixative | Sigma-Aldrich | #HT10132 | Picric acid 0.9% (w/v), formaldehyde 9% (v/v), acetic acid 5% (w/v) |
| Cyclophosphamide | Sigma-Aldrich | #C0768-5G | |
| Dibutylphthalate Polystyrene Xylene (DPX) | Sigma-Aldrich | #06522 | |
| Ethanol | Amber Scientific | #ETH | Ethanol 100% |
| Micro Feather opthalmic scalpel with aluminium handle | Designs for Vision | #FEA-745-SR | Feather blade for dissections (seen in Figure 1) |
| Formalin fixative | Australian Biostain | #ANBFC | |
| Glass coverslip | Thermo Scientific | #MENCS22501GP | 22 mm x 50 mm |
| Glycomethacrylate resin RM2165 microtome | Leica Microsystems | #RM2165 | |
| Glycolmethacrylate DPX | *made in house | *Mix 1.5 L Xylene; 800 g polystyrene pellets; 100mL Dibutyl phthalate for 3 weeks | |
| Histolene | Trajan | #11031 | |
| Mayer’s haematoxylin | Amber Scientific | #MH | |
| Olympus BX50 microscope | Olympus | #BX50 | Brightfield microscope fitted with 10x dry & 100x oil immersion objective (numerical aperture 1.3) |
| Olympus immersion oil type-F | Olympus | #IMMOIL-F30CC | |
| Olympus TH4-200 light source | Olympus | #TH4-200 | |
| Paraffin wax | Sigma-Aldrich | #03987 | |
| Periodic acid | Trajan | #PERI1% | Periodic acid 1% |
| Rotary Microtome CUT 4060 | MicroTec | #4060R/F | Used to cut paraffin sections |
| Schiff’s reagent | Trajan | #SCHF | |
| Scott's tap water | Amber Scientific | #SCOT | Potassium carbonate, magnesium sulphate, water |
| StereoInvestigator Stereological System | MBF Bioscience | Includes StereoInvestigator software, multi-control unit, automatic stage and joystick | |
| Superfrost microscope slides | Thermo Scientific | #MENSF41296SP | 1 mm, 72 pcs |
| Technovit 7100 Plastic embedding system | Emgrid Australia | #64709003 | 500 mL/5 x 1 g/40 mL |
| Technovit 3040 yellow | Emgrid Australia | #64708805 | 100 g/80 mL |
Riferimenti
- Stringer, J. M., Winship, A., Liew, S. H., Hutt, K. The capacity of oocytes for DNA repair. Cellular and Molecular Life Sciences. 75 (15), 2777-2792 (2018).
- Winship, A. L., Stringer, J. M., Liew, S. H., Hutt, K. J. The importance of DNA repair for maintaining oocyte quality in response to anti-cancer treatments, environmental toxins and maternal ageing. Human Reproduction Update. 24 (2), 119-134 (2018).
- Broer, S. L., Broekmans, F. J., Laven, J. S., Fauser, B. C. Anti-Mullerian hormone: ovarian reserve testing and its potential clinical implications. Human Reproduction Update. 20 (5), 688-701 (2014).
- Myers, M., Britt, K. L., Wreford, N. G., Ebling, F. J., Kerr, J. B. Methods for quantifying follicular numbers within the mouse ovary. Reproduction. 127 (5), 569-580 (2004).
- Boyce, R. W., Dorph-Petersen, K. A., Lyck, L., Gundersen, H. J. Design-based stereology: introduction to basic concepts and practical approaches for estimation of cell number. Toxicologic Pathology. 38 (7), 1011-1025 (2010).
- Ristic, N., et al. Maternal dexamethasone treatment reduces ovarian follicle number in neonatal rat offspring. Journal of Microscopy. 232 (3), 549-557 (2008).
- Soleimani Mehranjani, M., Mansoori, T. Stereological study on the effect of vitamin C in preventing the adverse effects of bisphenol A on rat ovary. International Journal of Reproductive Biomedicine (Yazd). 14 (6), 403-410 (2016).
- Brown, D. L. Bias in image analysis and its solution: unbiased stereology. Journal of Toxicologic Pathology. 30 (3), 183-191 (2017).
- Hasselholt, S., Lykkesfeldt, J., Overgaard Larsen, J. Thick methacrylate sections devoid of lost caps simplify stereological quantifications based on the optical fractionator design. Anatomical Record (Hoboken). 298 (12), 2141-2150 (2015).
- Tilly, J. L. Ovarian follicle counts--not as simple as 1, 2, 3. Reproductive Biology and Endocrinology. 1, 11 (2003).
- Nguyen, Q. N., et al. Loss of PUMA protects the ovarian reserve during DNA-damaging chemotherapy and preserves fertility. Cell Death and Disease. 9 (6), 618 (2018).
- Meirow, D., Assad, G., Dor, J., Rabinovici, J. The GnRH antagonist cetrorelix reduces cyclophosphamide-induced ovarian follicular destruction in mice. Human Reproduction. 19 (6), 1294-1299 (2004).
- Winship, A. L., et al. The PARP inhibitor, olaparib, depletes the ovarian reserve in mice: implications for fertility preservation. Human Reproduction. , (2020).
- Meirow, D., Lewis, H., Nugent, D., Epstein, M. Subclinical depletion of primordial follicular reserve in mice treated with cyclophosphamide: clinical importance and proposed accurate investigative tool. Human Reproduction. 14 (7), 1903-1907 (1999).
- Nguyen, Q. N., et al. Cisplatin- and cyclophosphamide-induced primordial follicle depletion is caused by direct damage to oocytes. Molecular Human Reproduction. , (2019).
- Gundersen, H. J., Jensen, E. B. The efficiency of systematic sampling in stereology and its prediction. Journal of Microscopy. 147, 229-263 (1987).
- Olesen, M. V., Needham, E. K., Pakkenberg, B. The Optical Fractionator Technique to Estimate Cell Numbers in a Rat Model of Electroconvulsive Therapy. Journal of Visualized Experiments. (125), e55737 (2017).
- Findlay, J. K., Hutt, K. J., Hickey, M., Anderson, R. A. How Is the Number of Primordial Follicles in the Ovarian Reserve Established. Biology of Reproduction. 93 (5), 111 (2015).
- Omari, S., et al. Mcl-1 is a key regulator of the ovarian reserve. Cell Death and Disease. 6, 1755 (2015).
- Winship, A. L., Bakai, M., Sarma, U., Liew, S. H., Hutt, K. J. Dacarbazine depletes the ovarian reserve in mice and depletion is enhanced with age. Scientific Reports. 8 (1), 6516 (2018).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. An accurate, simple method for unbiased determination of primordial follicle number in the primate ovary. Biology of Reproduction. 56 (4), 909-915 (1997).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. Morphometric analysis of primordial follicle number in pigtailed monkey ovaries: symmetry and relationship with age. Biology of Reproduction. 61 (2), 553-556 (1999).
- Charleston, J. S., et al. Estimating human ovarian non-growing follicle number: the application of modern stereology techniques to an old problem. Human Reproduction. 22 (8), 2103-2110 (2007).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and nongrowing follicle counts according to the Stages of Reproductive Aging Workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Hansen, K. R., et al. A new model of reproductive aging: the decline in ovarian non-growing follicle number from birth to menopause. Human Reproduction. 23 (3), 699-708 (2008).
- Sonigo, C., et al. High-throughput ovarian follicle counting by an innovative deep learning approach. Scientific Reports. 8 (1), 13499 (2018).
- McKey, J., Cameron, L. A., Lewis, D., Batchvarov, I. S., Capel, B. Combined iDISCO and CUBIC tissue clearing and lightsheet microscopy for in toto analysis of the adult mouse ovarydagger. Biology of Reproduction. 102 (5), 1080-1089 (2020).
- Kagami, K., Shinmyo, Y., Ono, M., Kawasaki, H., Fujiwara, H. Three-dimensional evaluation of murine ovarian follicles using a modified CUBIC tissue clearing method. Reproductive Biology and Endocrinology. 16 (1), 72 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon