需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
成人小鼠卵巢中的精确卵泡图解
摘要
在这里,我们描述,比较和对比两种不同的技术,以准确计算固定小鼠卵巢组织的卵泡计数。
摘要
性繁殖的雌性哺乳动物生来就有一生供应的卵母细胞。不成熟、静默的卵母细胞存在于原始卵泡中,这是雌性生殖系的储存单元。它们不可再生,因此它们出生时的数量和随后的丧失率在很大程度上决定了女性的生育寿命。准确量化妇女和动物的原始卵泡数量对于确定药物和毒剂对卵巢保护区的影响至关重要。还需要评估现有和新兴生育保护技术的必要性和成功性。目前,没有方法可以准确测量构成妇女卵巢储备的原始卵泡数量。此外,从大型动物或濒危物种获得卵巢组织进行实验往往不可行。因此,小鼠已成为此类研究的基本模型,评估整个小鼠卵巢原始卵泡数量的能力是一个关键工具。然而,文献中关于小鼠卵巢绝对卵泡数的报告变化很大,因此很难比较和/或复制数据。这是由于许多因素,包括应变,年龄,治疗组,以及技术差异的计数方法使用。在本文中,我们提供分步教学指南,用于准备组发部分和使用两种不同的方法计算小鼠卵巢中的原始卵泡:[1] 立体学,它依赖于分馏器/光学分解技术:和[2]直接计数技术。将突出每种方法的一些关键优点和缺点,以便在该领域提高可重复性,使研究人员能够选择最适合其研究的方法。
引言
储存在卵巢原始卵泡内的不成熟、被肌质逮捕的卵母细胞是雌性生殖系的储存单元,由个体的终身卵巢储备组成。原始毛囊数量随着1岁自然下降,或者,在接触外源性化学物质(包括空气、食物和水中的一些药物和环境毒剂)后,可过早耗尽。鉴于卵泡的原始数量有限,卵巢内卵泡的数量和质量在很大程度上决定了女性的生育能力和后代的健康。因此,准确量化妇女的原始卵泡数量对于评估外源性侮辱对卵巢储备的离目标影响至关重要。
在妇女中,对整个卵巢的分析通常是不可能的,因此卵巢储备的非侵入性代孕措施必须在临床环境中使用。抗Mϋllerian激素(AMH)是临床上应用最广泛的代孕生物标志物3。血清AMH水平通常测量在晚产妇年龄的妇女,或癌症治疗前后,如化疗。然而,AMH是由生长的卵泡而不是原始卵泡产生的,因此,血清水平不会告知绝对原始卵泡数量。
由于缺乏准确确定原位女性卵泡数量的方法,在啮齿动物等小型动物模型 中计算卵巢卵泡仍然是评估外源性侮辱对原始毛囊的影响程度以及生育能力的重要研究工具。然而不幸的是,在整个文献中,关于啮齿动物模型中原始卵泡数量的报道是高度可变的4。其主要原因是广泛报道的计数方法在技术上的差异。在文献中,主要描述了两种不同的技术来列举小鼠的原始卵泡。其中包括立体学,它采用了分馏器光学分解方法,以及直接卵泡计数。
立体学被广泛认为是金本位制,因为它使用系统均匀的随机抽样5,使其成为最准确的方法,量化原始卵泡数在整个小鼠,或大鼠卵巢4,6,7。立体学是公正的,因为它占了利益对象的三维结构。使用光学分解器/分孔器方法,使用三级采样方法,在已知小鼠总卵巢的一小部分内使用厚组织部分(例如 20 μm)对原始卵泡进行量化。首先,随机启动时选择采样间隔(例如,每3 节)(采样分数 1,f1)4。然后,从这一点到整个卵巢,以系统、均匀的方式对部分进行采样。然后,一个不偏不倚的计数框架叠加在卵巢部分,并逐步沿着一个定义的,随机计数网格(采样分数2,f2)8移动。最后,对该区段厚度的已知部分进行光学采样(例如,10μm),并计算该区域内的毛囊(采样分数 3,f3)4。原始毛囊数乘以这些采样分数的反向,以获得最终值。这种方法需要专家培训和设备,包括由固态软件驱动的具有机动阶段的显微镜。组织应保存在专门的Boin的固定剂中,并嵌入甘油甲酸酯树脂中,以便使用玻璃刀切割厚组织部分。这种方法旨在解释组织收缩和变形,以最好地保持卵巢和卵泡9的三维形态结构。
直接卵泡计数是计算卵泡10的最常用的方法。可以使用更常见的固定剂(即形式素),然后是石蜡嵌入和详尽的连续剖面,使用厚度在 4-6 μm 之间的标准微原子。卵泡在定义的间隔内系统地计入整个组织部分,然后乘以采样间隔的反向,以获得毛囊总估计值。这种方法快,简单,可以使用存档组织执行,并使用标准组织学技术准备。它只需要一台具有标准成像能力的光显微镜。然而,尽管有这些优点,直接卵泡计数缺乏立体学的准确性和严格的计数参数,使其更容易受到调查员的偏差。此外,组织在加工过程中可能会发生收缩和变形,破坏卵巢的完整性和形态,从而使卵泡分类和定量变得困难。
本文的目的是描述两种常用的方法,定量评估小鼠卵巢的原始卵泡数量:立体学和直接卵泡计数。我们将为这两种方法提供详细的协议,并突出它们的一些优点和短处,以提高我们领域的可重复性,并使研究人员能够做出最合适的计算方法的知情决定,以供其研究使用。
研究方案
卵巢是从雌性C57BL6J小鼠身上采集的。所有动物程序和实验均按照《NHMRC澳大利亚动物护理和使用业务守则》进行,并经莫纳什动物研究平台动物伦理委员会批准。
注:本报告使用了一种化疗剂,表明其耗尽了原始卵泡卵母细胞,根据确定使用立体学11和直接计数12,13来比较同一动物的两种计数方法。雌性8周大(年轻成人)小鼠在单次肾内注射75毫克/千克/体重的环磷酰胺或盐水车控制(n=5/组)之前称体重。这种剂量已被证明会导致原始卵泡约50%的耗竭,但没有报告导致发病率或死亡率的小鼠14。卵巢在治疗后48小时收获。每只动物的一个卵巢固定在10%(v/v)中性缓冲形式素溶液中24小时,另一个固定在Boin的溶液中24小时。然后,组织被嵌入甘油甲基酸酯树脂中,并以20微米连续分割,或在石蜡中连续分割,在5微米处连续分割。所有组织都沾染了周期性酸希夫和血氧林。
1. 组学准备:固定、处理、嵌入和分割小鼠卵巢
- 通过修剪卵巢和周围所有脂肪来解剖小鼠卵巢,而不会损坏或切割卵巢本身。如有必要,使用解剖显微镜和细刀片进行此步骤(图 1A)。
- 立即修复组织,放入一个小标签管,其中含有Boin的固定(立体学),或形式固定(直接计数)24小时(图1B),然后将组织转移到70%乙醇。
注:卵泡形态在布因的固定卵巢组织内保存得最好,嵌入到甘油甲酸酯树脂中(图2)。 - 处理整个固定卵巢,然后嵌入糖甲基丙烯酸酯树脂用于立体学(补充文件1),或石蜡直接计数使用标准组织学协议。
注意:树脂是有毒的,所以确保所有组织处理步骤都用烟熏罩进行,手套随时佩戴。 - 使用装有玻璃刀(图1D)的专用树脂甲基酸酯微原子(图1C)彻底切割厚糖甲基丙烯酸酯树脂部分(如20微米)。定期将各部分(例如,每3 节)收集到玻璃显微镜幻灯片上,用于立体学。
- 使用标准微原子切割薄石蜡部分(例如,4-6 μm)。定期将组织部分(例如,每9 节 )收集到玻璃显微镜幻灯片上,以进行直接的毛囊计数。
- 用周期性酸希夫和血氧林(补充文件2)染色幻灯片。
- 覆盖唇与标准DPX石蜡部分,或厚DPX甘油甲酸酯树脂部分(图1E)。
注意: 甘油甲酸酯树脂 DPX 是危险的, 所以执行这一步骤在烟雾罩.
注:甘油甲酸酯树脂DPX是非常粘稠的。玻璃盖片必须用铲子将其按下,以确保 DPX 均匀且分散,并且盖片下不存在气泡(图 1F)。
2. 使用光学分馏器对原始卵泡数进行类固理估计
- 打开计算机、多控制单元、相机和立体学设置中的光源,将显微镜目标设置为低倍率(例如,10 倍)。
- 打开立体声软件。
- 将第一张幻灯片安全地放在显微镜舞台上。
- 通过检查相机设置面板中的自动曝光(补充图 1A)来调整光线照射。或者,手动调整光线照射。
- 使用操纵杆定位第一个组织样本,并将样品对焦。
- 通过单击"更多设置"(位于相机设置面板的右下角)来调整白平衡,然后单击"白平衡"并单击"自动"(辅助图 1B)。或者,单击"更多设置"按钮(或"更多设置中的选择区域")旁边的"白平衡"按钮,通过选择该部分上的白色区域手动设置白平衡。
- 转到 探头 下拉菜单,然后单击 光学分数器工作流。然后单击 "开始新项目" 并单击 "确定"。
- 如果已保存现有采样配置,请在 采样参数 下单击 "是 "| ... 并选择所需的采样配置。
- 如果没有,单击 "否" 并手动输入串行部分信息(补充图 1C),并在步骤 2.13 中定义探头配置。
- 单击 "下一步",将显微镜设置为 "低放大", 并从下拉菜单中选择 10 倍 的放大倍数。
- 单击 "下一步",然后跟踪整个卵巢部分 - 从左侧单击该部分开始,到末尾,右键单击并选择 "关闭轮廓"。
- 单击 "下一步",将显微镜设置为 高放大, 并从下拉菜单中选择 100 倍的油放大倍率 。
- 将一滴油放在滑梯上的组织部分,并将显微镜目标移动至 100 倍放大。
- 调整光线照射(如步骤 2.4),然后单击 "下一步"。
- 设置 采样参数 以定义探头配置。在这里,计数框架设置为 47.5 μm x 47.5 μm (2,256.25 μm2),步长设置为 100μm x 100 μm (10,000 μm2)(补充图 2)。建立采样参数后,保存模板,并在后续分析过程中以步骤 2.7 重新打开。
- 点击 开始计数 (补充图1D)。聚焦到示例顶部,单击 "确定" 并开始计数。
- 使用聚焦旋钮穿过 10 μm 采样深度,并计算其卵母细胞核进入焦点的任何原始卵泡。单击 "下一步 "移动到下一个区域。
- 如果卵母细胞被鳞状(扁平)颗粒细胞包围,则将卵泡分类为原始卵泡,但没有阴囊颗粒细胞(图2A)。
注:原始卵泡不同于中叶/过渡卵泡,由胆囊和鳞状粒状细胞(图2B)和原卵泡组成,主要由阴囊状毛囊细胞(图2C)包围。这些卵泡类应单独量化。 - 仅计算卵母细胞核可见的卵泡。卵母细胞核必须出现在计数帧内或触摸计数帧的绿色内含线(补充图1E,F)。
- 如果卵母细胞核落在计数帧(补充图1G)之外或触及计数帧的红色排除线,则不要计算此毛囊。
- 在评估原始卵泡消耗以响应外源性化学物质(如化疗)时,确保所有计算的卵泡都健康,从而具有正常的形态(图 2)。单独计算任何异常或节觉卵泡。通常,卵泡死亡是由化疗等侮辱引起的,为了区分健康和不健康的卵泡,应单独获得对隐性卵泡的定量,因为只有健康的卵泡才包括卵巢储备15。
- 如果卵母细胞被鳞状(扁平)颗粒细胞包围,则将卵泡分类为原始卵泡,但没有阴囊颗粒细胞(图2A)。
- 在该部分完成计数后,进行以下部分之一:
- 单击 "添加新节",然后返回到步骤 2.3 以设置下一节进行计数。
- 单击 "我已完成计数 以结束会话"。将目标返回到 10 倍,退出立体声软件,关闭光源、摄像头、多控制单元和计算机。
- 从从整个卵巢取样的每个组织部分获取总和原始卵泡编号(Q),然后使用电子表格,使用下面的方程从每个复制动物 (N)4中获取最终值。
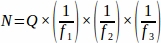 哪里:
哪里:
N = 卵巢内卵泡的总估计数量。
Q= 原始卵泡计数。
f1= 采样间隔。因此,每3节 进行采样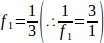 。
。
f2 = 计数帧(示例区域)和步进器之间的关系,按 .由于样本面积为 2256 μm 2(47.5 μm x 47.5 μm),步进区域为 10000 μm2(100μm x 100 μm)。
.由于样本面积为 2256 μm 2(47.5 μm x 47.5 μm),步进区域为 10000 μm2(100μm x 100 μm)。 
f3= 抽样卵巢部分的分数。由于20μm部分的10μm被采样,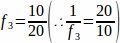 .
.
因此,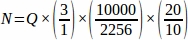 .
.
注:本协议描述了如何使用广泛引用的立体学软件(材料表)应用这些固态分析原理:但是,还有其他的固态软件可用。卵巢卵泡的固态分析中应用的原则是相同的,无论用于设置参数的软件如何。当100个或更多物体计入成年小鼠卵巢4时,立体学是最准确的,因为这给出了一个误差系数,估计低于10%16。此处概述的采样参数已优化,以确保至少 100 个物体(即原始、过渡和原卵泡)可计入控制成人野生型 C57BL6J 卵巢。可以进行试点研究,包括小样本量,以确定最佳采样参数,如要分析的分区的间隔和数量,以及样本第17节内的光学组件数量。
3. 通过直接卵巢卵泡计数估计原始卵泡数
- 将显微镜安全地滑动在标准光显微镜下,并进行直接计数以获取原始卵泡编号。
- 如果卵母细胞清晰可见,并被鳞状(扁平)颗粒细胞包围,但无胆囊颗粒细胞(图2D),则将卵泡分类为原始卵泡。
注:原始卵泡不同于中叶/过渡卵泡,由胆囊和鳞状粒状细胞(图2E)和原卵泡组成,主要由阴囊颗粒细胞(图2F)包围。这些卵泡类应单独量化。 - 确保所有计算的卵泡都健康,从而具有正常的形态(图2)。单独计算任何异常或节觉卵泡,因为只有健康的卵泡构成卵巢储备。
- 如果卵母细胞清晰可见,并被鳞状(扁平)颗粒细胞包围,但无胆囊颗粒细胞(图2D),则将卵泡分类为原始卵泡。
- 或者,通过打开图像文件(s)来获取整个卵巢组织部分的多个或缝合的高功率(例如,20倍)光微镜来执行计数。这可以手动完成,也可以使用自动幻灯片扫描仪。
- 在预定的间隔内从从整个卵巢取样的每个组织部分获取总和原始卵泡编号 (Q)。将此数字乘以采样分数的反向,以便使用以下方程获取每个复制动物 (N) 的最终值。
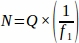 哪里:
哪里:
N = 卵巢内卵泡的总估计数量。
Q = 原始毛囊计数(每个单独类型的,单独计算)。
f1= 采样间隔。因此,每9节 进行采样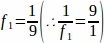 。
。
因此,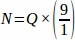 .
.
结果
使用了一种特征良好的卵泡消耗模型,即对年轻的成年雌性小鼠进行单剂量的环磷酰胺化疗,或盐水车辆控制(n=5/组),并在48小时后从每种动物身上采集两个卵巢。每只动物的卵巢是按照第1步为两种方法中描述的那样准备的:立体学或直接计数。每个动物的左右卵巢被随机分配给每组。这些数据表明,使用立体学时,在化疗后可以检测到小鼠原始卵泡的显著消耗(387±11个卵泡),而对照(1043±1...
讨论
本文为列举小鼠原始毛囊、立体学的金本位技术以及更常用的直接毛囊计数方法提供了分步协议。化疗用于比较和对比从同一动物的左右卵巢内这两种不同方法获得的结果。这两种方法都揭示了原始毛囊数量的高动物间变异性。使用立体学记录了卵巢储备的显著消耗,但直接计数未能检测到化疗与控制后原始卵泡数量显著减少。
值得注意的是,即使在近亲繁殖的老鼠,如C57BL...
披露声明
作者没有什么可透露的。
致谢
这项工作是通过维多利亚州政府业务基础设施支助和澳大利亚政府NHMRC IRIISS实现的,并得到国家卫生和医学研究理事会(ALW #1120300)和澳大利亚研究理事会(KJH #FT190100265)的资助。作者希望感谢莫纳什动物研究平台、莫纳什组织学平台和莫纳什微成像设施的技术支持。
材料
| Name | Company | Catalog Number | Comments |
| 1-Butanol (HPLC) | Fisher Chemical | #A383-1 | |
| Acid alcohol | Amber Scientific | #ACDL | |
| Bouin’s fixative | Sigma-Aldrich | #HT10132 | Picric acid 0.9% (w/v), formaldehyde 9% (v/v), acetic acid 5% (w/v) |
| Cyclophosphamide | Sigma-Aldrich | #C0768-5G | |
| Dibutylphthalate Polystyrene Xylene (DPX) | Sigma-Aldrich | #06522 | |
| Ethanol | Amber Scientific | #ETH | Ethanol 100% |
| Micro Feather opthalmic scalpel with aluminium handle | Designs for Vision | #FEA-745-SR | Feather blade for dissections (seen in Figure 1) |
| Formalin fixative | Australian Biostain | #ANBFC | |
| Glass coverslip | Thermo Scientific | #MENCS22501GP | 22 mm x 50 mm |
| Glycomethacrylate resin RM2165 microtome | Leica Microsystems | #RM2165 | |
| Glycolmethacrylate DPX | *made in house | *Mix 1.5 L Xylene; 800 g polystyrene pellets; 100mL Dibutyl phthalate for 3 weeks | |
| Histolene | Trajan | #11031 | |
| Mayer’s haematoxylin | Amber Scientific | #MH | |
| Olympus BX50 microscope | Olympus | #BX50 | Brightfield microscope fitted with 10x dry & 100x oil immersion objective (numerical aperture 1.3) |
| Olympus immersion oil type-F | Olympus | #IMMOIL-F30CC | |
| Olympus TH4-200 light source | Olympus | #TH4-200 | |
| Paraffin wax | Sigma-Aldrich | #03987 | |
| Periodic acid | Trajan | #PERI1% | Periodic acid 1% |
| Rotary Microtome CUT 4060 | MicroTec | #4060R/F | Used to cut paraffin sections |
| Schiff’s reagent | Trajan | #SCHF | |
| Scott's tap water | Amber Scientific | #SCOT | Potassium carbonate, magnesium sulphate, water |
| StereoInvestigator Stereological System | MBF Bioscience | Includes StereoInvestigator software, multi-control unit, automatic stage and joystick | |
| Superfrost microscope slides | Thermo Scientific | #MENSF41296SP | 1 mm, 72 pcs |
| Technovit 7100 Plastic embedding system | Emgrid Australia | #64709003 | 500 mL/5 x 1 g/40 mL |
| Technovit 3040 yellow | Emgrid Australia | #64708805 | 100 g/80 mL |
参考文献
- Stringer, J. M., Winship, A., Liew, S. H., Hutt, K. The capacity of oocytes for DNA repair. Cellular and Molecular Life Sciences. 75 (15), 2777-2792 (2018).
- Winship, A. L., Stringer, J. M., Liew, S. H., Hutt, K. J. The importance of DNA repair for maintaining oocyte quality in response to anti-cancer treatments, environmental toxins and maternal ageing. Human Reproduction Update. 24 (2), 119-134 (2018).
- Broer, S. L., Broekmans, F. J., Laven, J. S., Fauser, B. C. Anti-Mullerian hormone: ovarian reserve testing and its potential clinical implications. Human Reproduction Update. 20 (5), 688-701 (2014).
- Myers, M., Britt, K. L., Wreford, N. G., Ebling, F. J., Kerr, J. B. Methods for quantifying follicular numbers within the mouse ovary. Reproduction. 127 (5), 569-580 (2004).
- Boyce, R. W., Dorph-Petersen, K. A., Lyck, L., Gundersen, H. J. Design-based stereology: introduction to basic concepts and practical approaches for estimation of cell number. Toxicologic Pathology. 38 (7), 1011-1025 (2010).
- Ristic, N., et al. Maternal dexamethasone treatment reduces ovarian follicle number in neonatal rat offspring. Journal of Microscopy. 232 (3), 549-557 (2008).
- Soleimani Mehranjani, M., Mansoori, T. Stereological study on the effect of vitamin C in preventing the adverse effects of bisphenol A on rat ovary. International Journal of Reproductive Biomedicine (Yazd). 14 (6), 403-410 (2016).
- Brown, D. L. Bias in image analysis and its solution: unbiased stereology. Journal of Toxicologic Pathology. 30 (3), 183-191 (2017).
- Hasselholt, S., Lykkesfeldt, J., Overgaard Larsen, J. Thick methacrylate sections devoid of lost caps simplify stereological quantifications based on the optical fractionator design. Anatomical Record (Hoboken). 298 (12), 2141-2150 (2015).
- Tilly, J. L. Ovarian follicle counts--not as simple as 1, 2, 3. Reproductive Biology and Endocrinology. 1, 11 (2003).
- Nguyen, Q. N., et al. Loss of PUMA protects the ovarian reserve during DNA-damaging chemotherapy and preserves fertility. Cell Death and Disease. 9 (6), 618 (2018).
- Meirow, D., Assad, G., Dor, J., Rabinovici, J. The GnRH antagonist cetrorelix reduces cyclophosphamide-induced ovarian follicular destruction in mice. Human Reproduction. 19 (6), 1294-1299 (2004).
- Winship, A. L., et al. The PARP inhibitor, olaparib, depletes the ovarian reserve in mice: implications for fertility preservation. Human Reproduction. , (2020).
- Meirow, D., Lewis, H., Nugent, D., Epstein, M. Subclinical depletion of primordial follicular reserve in mice treated with cyclophosphamide: clinical importance and proposed accurate investigative tool. Human Reproduction. 14 (7), 1903-1907 (1999).
- Nguyen, Q. N., et al. Cisplatin- and cyclophosphamide-induced primordial follicle depletion is caused by direct damage to oocytes. Molecular Human Reproduction. , (2019).
- Gundersen, H. J., Jensen, E. B. The efficiency of systematic sampling in stereology and its prediction. Journal of Microscopy. 147, 229-263 (1987).
- Olesen, M. V., Needham, E. K., Pakkenberg, B. The Optical Fractionator Technique to Estimate Cell Numbers in a Rat Model of Electroconvulsive Therapy. Journal of Visualized Experiments. (125), e55737 (2017).
- Findlay, J. K., Hutt, K. J., Hickey, M., Anderson, R. A. How Is the Number of Primordial Follicles in the Ovarian Reserve Established. Biology of Reproduction. 93 (5), 111 (2015).
- Omari, S., et al. Mcl-1 is a key regulator of the ovarian reserve. Cell Death and Disease. 6, 1755 (2015).
- Winship, A. L., Bakai, M., Sarma, U., Liew, S. H., Hutt, K. J. Dacarbazine depletes the ovarian reserve in mice and depletion is enhanced with age. Scientific Reports. 8 (1), 6516 (2018).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. An accurate, simple method for unbiased determination of primordial follicle number in the primate ovary. Biology of Reproduction. 56 (4), 909-915 (1997).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. Morphometric analysis of primordial follicle number in pigtailed monkey ovaries: symmetry and relationship with age. Biology of Reproduction. 61 (2), 553-556 (1999).
- Charleston, J. S., et al. Estimating human ovarian non-growing follicle number: the application of modern stereology techniques to an old problem. Human Reproduction. 22 (8), 2103-2110 (2007).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and nongrowing follicle counts according to the Stages of Reproductive Aging Workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Hansen, K. R., et al. A new model of reproductive aging: the decline in ovarian non-growing follicle number from birth to menopause. Human Reproduction. 23 (3), 699-708 (2008).
- Sonigo, C., et al. High-throughput ovarian follicle counting by an innovative deep learning approach. Scientific Reports. 8 (1), 13499 (2018).
- McKey, J., Cameron, L. A., Lewis, D., Batchvarov, I. S., Capel, B. Combined iDISCO and CUBIC tissue clearing and lightsheet microscopy for in toto analysis of the adult mouse ovarydagger. Biology of Reproduction. 102 (5), 1080-1089 (2020).
- Kagami, K., Shinmyo, Y., Ono, M., Kawasaki, H., Fujiwara, H. Three-dimensional evaluation of murine ovarian follicles using a modified CUBIC tissue clearing method. Reproductive Biology and Endocrinology. 16 (1), 72 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。