このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
成人マウス卵巣における正確な卵胞列挙体
要約
ここでは、固定マウス卵巣組織の正確な卵胞数を計算するための2つの異なる技術について説明し、比較し、対比する。
要約
性的に再生する女性の哺乳類は、卵母細胞の生涯供給で生まれます。未熟な静止卵母細胞は、原始卵胞、女性生殖細胞の貯蔵単位内で発見される。彼らは再生不可能であるため、出生時の数とその後の損失率は、主に女性の肥沃な寿命を決定します。女性および動物における原始卵数の正確な定量は、卵巣予備軍に対する医薬品および毒性物質の影響を決定するために不可欠である。また、既存および新興の不妊治療保存技術の必要性と成功を評価する必要があります。現在、女性における卵巣予備を含む原胞の数を正確に測定する方法は存在しない。さらに、実験のために大型動物や絶滅危惧種から卵巣組織を得ることは、しばしば実現不可能である。このように、マウスはこのような研究に不可欠なモデルとなっており、マウスの卵巣全体で原胞数を評価する能力は重要なツールです。しかし、文献中のマウス卵巣の絶対卵胞数の報告は非常に変動するため、データの比較や複製が困難です。これは、株、年齢、治療群、および採用されたカウント方法の技術的な違いを含む多くの要因によるものです。本稿では、分数/光学解離技術に依存する[1]ステレロジーという2つの異なる方法を用いて、組織学的セクションを準備し、マウス卵巣の原始卵胞を数えるステップバイステップの指導ガイドを提供します。そして[2]直接カウント技術。各方法の主な利点と欠点のいくつかは、現場で再現性を向上させ、研究者が研究に最も適した方法を選択できるように強調されます。
概要
卵巣の原始卵胞内に貯蔵された未熟で、機始的に逮捕された卵母細胞は、女性生殖細胞系列の貯蔵単位であり、個人の生涯卵巣予備軍を構成する。原胞の数は、1歳とともに自然に減少し、あるいはあるいは、空気中のいくつかの医薬品および環境毒性物質を含む外因性化学物質への暴露後に早期に枯渇する可能性がある2。原始卵胞数が有限であることを考えると、卵巣内に存在する卵胞の量と質は、主に女性の生殖能力と子孫の健康を決定する。したがって、女性における原始卵胞数の正確な定量化は、卵巣予備軍に対する外因性侮辱のオフターゲットの影響を評価するために不可欠である。
女性では、卵巣全体の分析は一般的に不可能であり、したがって卵巣予備の非侵襲的代理手段は臨床現場で利用されなければならない。抗Mϋllerianホルモン(AMH)は、臨床的に最も広く使用されている代理バイオマーカーです。血清AMHレベルは、多くの場合、進行した母親の年齢の女性、または化学療法などの癌治療の前後に測定されます。しかし、AMHは原始卵胞ではなく卵胞を成長させることによって産生され、したがって、血清レベルは絶対的な原始卵胞数では知らない。
げっ歯類などの小動物モデルの卵巣卵胞を数える その場の女性の原始卵胞数を正確に決定する方法がないため、外因性の侮辱が原始卵胞に与える程度を評価し、生殖能力を評価するために不可欠な研究ツールであり続ける。残念ながら、げっ歯類モデルにおける原始卵胞数の文献全体の報告は非常に可変的です 4.この主な理由は、採用されたカウント方法の技術的な違いが広く報告されている。主に、マウスの原胞を列挙するための文献に記載されている2つの異なる技術がある。これらには、分数光学解質法を採用するステレロジー、および直接卵胞数が含まれる。
ステレロジーは、体系的な均一なランダムサンプリング5を使用し、マウス全体で原始卵数を定量する最も正確な方法、またはラット卵巣4、6、7を使用するため、金本位制と広く考えられている。ステレロジーは、対象物8の立体構造を占めているため、公平である。光学脱離/分化法を用いて、3段階のサンプリングを適用して、マウス総卵巣の既知の分数内で厚い組織切片(例えば20μm)を使用して原胞を定量化する。まず、サンプリング間隔がランダムな開始(サンプリング分1、f1)4で選択されます(例えば、3番目のセクションごと)。その後、セクションは、この時点から卵巣全体を通して体系的で均一な方法でサンプリングされる。次に、バイアスされない計数フレームが卵巣セクションの上に重ね合わされ、定義されたランダム化されたカウントグリッド(サンプリング分数2、f2)8に沿って徐々に移動する。最後に、断面厚さの既知の分率は光学的にサンプリングされ(例えば、10μm)、この領域内の卵胞は計数される(サンプリング分画3、f3)4。生の卵胞数は、最終的な値を得るために、これらのサンプリング分数の逆数で乗算されます。この方法では、ステレオロジーソフトウェアによって駆動される電動ステージを備えた顕微鏡を含む専門家の訓練と機器が必要です。組織は特殊なブインの固定液に保存し、グリコールメタクリレート樹脂に埋め込まれ、ガラスナイフを用いたグリコールメタクリレート樹脂ミクロトームを使用して厚い組織切片を切断できるようにする必要があります。この方法は、組織の収縮および変形を考慮して設計されており、卵巣および卵胞9の三次元形態構造を最もよく保存する。
直接卵胞カウントは、卵胞10を数える最も頻繁に使用される方法です。より一般的な固定剤(すなわち、ホルマリン)を使用することができ、その後に4〜6μmの厚さの標準ミクロトームを使用してパラフィンワックス埋め込みおよび網羅的なシリアル切除が行われる。卵胞は、定義された間隔で組織セクション全体で体系的にカウントされ、次にサンプリング間隔の逆数を掛けて全卵胞の推定値を得る。この方法は、迅速かつ容易に、アーカイブされた組織を使用して行うことができる、および標準的な組織学的手法を使用して調製される。それは標準的なイメージ投射機能の軽い顕微鏡だけ要求する。しかし、これらの利点にもかかわらず、直接卵胞カウントはステレロジーの精度と厳格なカウントパラメータを欠いているため、研究者の偏見が強くなります。さらに、組織は処理中に収縮および変形を受け、卵巣の完全性および形態を破壊し、卵胞の分類および定量化を困難にする。
この記事の目的は、マウス卵巣の原始卵胞数を定量的に評価するために一般的に使用される2つの方法を説明することです: 生殖器と直接卵胞の数え。我々は、これらの2つの方法の詳細なプロトコルを提供し、我々の分野で再現性を高め、研究者が彼らの研究のための最も適切なカウント方法の情報に基づいた決定を行うことを可能にするために、それらの長所と短所のいくつかを強調する。
プロトコル
卵巣は雌のC57BL6Jマウスから採取した。すべての動物の手順と実験は、動物のケアと使用のためのNHMRCオーストラリアの行動規範に従って行われ、モナッシュ動物研究プラットフォーム動物倫理委員会によって承認されました。
注:原始卵胞卵母細胞を枯渇させることが示された化学療法剤は、ステテロロジー11および直接カウント12、13を使用して決定されたように、同じ動物の2つの計数方法を比較するためにこの報告書で使用された。雌の8週齢(若年成人)マウスは、シクロホスファミド(n=5/群)の75mg/kg/体重の腹腔内注射の前に体重を量った。この用量は、原胞のおよそ50%の枯渇を引き起こすことが示されているが、マウス14において罹患率または死亡率を引き起こすことは報告されていない。卵巣は治療後48時間後に収穫された。各動物からの1つの卵巣は、24時間、24時間、もう一方はブインの溶液中に24時間、中性緩衝ホルマリン溶液に10%(v/v)で固定された。その後、組織をグリコールメタクリレート樹脂に包埋し、20μmで連続的に切断するか、またはパラフィンで5μmで連続的に切り離した。全ての組織を周期酸シフおよびヘマトキシリンで染色した。
1. 組織学的準備:マウス卵巣の固定、処理、埋め込み、切除
- 卵巣自体を損傷または切断することなく、卵管および周囲のすべての脂肪をトリミングすることによってマウス卵巣を解剖する。必要に応じて、このステップに解剖顕微鏡と細かい刃を使用します(図1A)。
- 70%エタノールに組織を移す前に、24時間(図1B)のブイン固定(ステテロロジー)、またはホルマリン固定剤(直接カウント)のいずれかを含む小さなラベル付きチューブに入れることで、組織を直ちに固定化します。
注:卵胞形態は、ブアンの固定卵巣組織内で最もよく保存され、グリコールメタクリレート樹脂に埋め込まれています(図2)。 - 全体の固定卵巣を処理し、ステテロ学のためのグリコールメタクリレート樹脂に埋め込む (補助ファイル 1), またはパラフィンワックス直接カウント用標準組織学的プロトコルを使用します。
注意:樹脂は有毒であるため、すべての組織処理手順がヒュームフードで実行され、手袋が常に着用されていることを確認してください。 - ガラスナイフ(図1D)を取り付けた特殊樹脂メタクリル酸ミクロトーム(図1C)を使用して、厚いグリコールメタクリレート樹脂切片(例えば、20μm)を徹底的に切断します。滅菌のためにガラス顕微鏡スライドに一定の間隔(例えば、3番目のセクションごと)でセクションを収集します。
- 標準的なミクロトームを使用して、薄いパラフィンセクション(例えば、4〜6 μm)を切断してください。直接卵胞数のためにガラス顕微鏡スライドに一定の間隔(例えば、9番目 のセクションごと)で組織切片を収集します。
- 周期酸シッフおよびヘマトキシリン(補足ファイル2)でスライドを染色する。
- パラフィン切片用の標準DPX、グリコールメタクリレート樹脂切片用の厚いDPXを含むカバースリップ(図1E)。
注意:グリコールメタクリル樹脂DPXは危険であるため、フームフードにこのステップを実行します。
注:グリコールメタクリレート樹脂DPXは非常に粘性です。ガラスカバースリップは、DPXが均等かつ薄く分散され、カバースリップの下に気泡がないことを確認するために、スパチュラで押し下げてしっかりと接着する必要があります(図1F)。
2. 光学分光器を用いた原始卵数の立体的推定
- コンピュータ、マルチコントロールユニット、カメラ、およびステローロジー内の光源をオンにし、顕微鏡の目的を低倍率(例えば、10倍)に設定します。
- ステオロジーソフトウェアを開きます。
- 最初のスライドを顕微鏡のステージにしっかりと置きます。
- カメラ設定パネル (補足図 1A)の[露出]の下の[自動]をオンにして、光の露出を調整します。または、光の露出を手動で調整します。
- ジョイスティックを使用して最初の組織サンプルを見つけ、サンプルを焦点にします。
- [カメラ設定] パネルの右下にある[その他の設定]をクリックしてホワイトバランスを調整し、[ホワイトバランス] をクリックして [自動] をクリックします (補足図 1B)。または、[その他の設定]ボタン (または [その他の設定] の領域を選択) の横にある[ホワイト バランス] ボタンをクリックして、セクションの白い領域を選択してホワイト バランスを手動で設定します。
- [プローブ] ドロップダウン メニューに移動し、[光学分数のワークフロー] をクリックします。次に、[新しいプロジェクトの開始] をクリックし、[OK]をクリックします。
- 既存のサンプリング構成が保存されている場合は、[ サンプリング パラメータ] で [ はい ] をクリック| .. をクリックし、目的のサンプリング構成を選択します。
- ない場合は、[ いいえ ]をクリックし、シリアルセクション情報(補足図1C)を手動で入力し、ステップ2.13でプローブ構成を定義します。
- [次へ]をクリックし、顕微鏡を低倍率に設定し、ドロップダウンメニューから10倍の倍率を選択します。
- [次へ] をクリックし、卵巣セクション全体をトレースします - セクションの周りを左クリックして開始し、最後に[輪郭を閉じる]を選択します。
- [次へ]をクリックし、顕微鏡を「高倍率」に設定し、ドロップダウンメニューから100倍のオイル倍率を選択します。
- スライド上の組織部に油を一滴置き、顕微鏡の目的を100倍の倍率に移動します。
- ライト露出を調整し(手順 2.4)、[ 次へ]をクリックします。
- サンプリング パラメータを設定して、プローブの構成を定義します。ここで、計数フレームを47.5 μm x 47.5 μm(2,256.25 μm2)に設定し、ステップ長を100 μm x 100 μm(10,000 μm2)に設定した(補足図2)。サンプリング パラメータが確立されたら、テンプレートを保存し、ステップ 2.7 で以降の分析セッション中に再度開きます。
- [カウント開始] をクリックします (補助図 1D)。サンプルの先頭にフォーカスし、[OK]をクリックしてカウントを開始します。
- 焦点を合わせるノブを使用して、10 μmのサンプリング深度を移動し、卵母細胞核が焦点を合わせる原胞を数えます。[ 次へ ] をクリックして次の領域に移動します。
- 卵母細胞が扁平上皮(平坦化)顆粒球細胞に囲まれている場合、卵胞を原始子として分類するが、立方腺細胞はない(図2A)。
注意:原始卵胞は、立方体および扁平上皮顆粒細胞(図2B)と主に立方体顆粒細胞に囲まれた原発卵胞の組み合わせからなる中間/移行卵胞とは異なる(図2C)。これらの卵胞クラスは別々に定量化する必要があります。 - 卵母細胞の核が見える卵胞のみを数えます。卵母細胞核は、計数フレーム内に現れるか、または計数フレームの緑色の包含線に触れている必要があります(補助図1E、F)。
- 卵母細胞核が計数フレーム(補助図1G)の外に落ちる場合、またはカウントフレームの赤い除外線に触れた場合は、この卵胞をカウントしないでください。
- 外因性の化学物質(例えば、化学療法)に応答して原始卵胞の枯渇を評価する場合、数えられるすべての卵胞が健康であり、したがって正常な形態を有していることを確認する(図2)。異常な卵胞や食痛卵胞を別々に数えます。しばしば、卵胞死は化学療法などの侮辱によって誘発され、そして、健康な卵胞と不死菌の卵胞を区別するために、卵胞の定量は、卵巣予備軍15を含むだけであるように、別々に得られるべきである。
- 卵母細胞が扁平上皮(平坦化)顆粒球細胞に囲まれている場合、卵胞を原始子として分類するが、立方腺細胞はない(図2A)。
- そのセクションでカウントが完了したら、次のいずれかの操作を行います。
- [ 新しいセクションの追加] をクリックし、手順 2.3 に戻って次のセクションをカウントするように設定します。
- [ カウントが終了しました ] をクリックしてセッションを終了します。目的を10倍に戻し、ステロジーソフトウェアを終了し、光源、カメラ、マルチコントロールユニット、コンピュータをオフにします。
- 卵巣全体からサンプリングした各組織セクションから生卵数(Q)の合計を求め、次にスプレッドシートを使用して、以下の式を用いて各複製動物(N)4から最終的な値を得る。
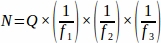 どこ:
どこ:
N = 卵巣内の卵胞の総推定数。
Q = 原始毛の数。
f1 = サンプリング間隔。3番目のセクションはすべて、このようにサンプリングされました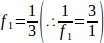 。
。
f2 = カウントフレーム (サンプル領域) とステッパーの関係を、 として計算 します。サンプル面積は2256μm2(47.5 μm x 47.5 μm)で、ステッパー面積は10000 μm2(100 μm x 100 μm)
します。サンプル面積は2256μm2(47.5 μm x 47.5 μm)で、ステッパー面積は10000 μm2(100 μm x 100 μm)  であった。
であった。
f3 = サンプリングされた卵巣セクションの画分。20μmのセクションの10μmをサンプリングしたので、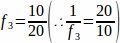 .
.
したがって、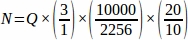 .
.
注:このプロトコルは、広く引用されたステロジーソフトウェア(資料文献)を使用して、これらの原理の立体分析を適用する方法を説明しています。ただし、他のステレオロジーソフトウェアも利用できます。卵巣卵胞の立体的分析中に適用される原理は、パラメータを設定するために使用されるソフトウェアに関係なく、同じです。ステレロジーは、10%以下の推定値の誤差係数を与えるため、100個以上の物体が成体マウス卵巣4に数えられると最も正確である。ここで概説するサンプリングパラメータは、約100個の物体(すなわち、原始、過渡期および原発性卵胞)を制御成人型C57BL6J卵巣で数えられるように最適化されている。試験的研究は、分析する区間およびセクション数、およびサンプリングされたセクション17内の光学崩壊セクタの数などの最適なサンプリングパラメータを確立するための小さなサンプルサイズを含めて実施することができる。
3. 直接卵巣卵胞数による原始卵胞数の推定
- 顕微鏡スライドを標準的な軽顕微鏡の下にしっかりと置き、直接カウントを行い、生の原始卵胞数を得る。
- 卵母細胞がはっきりと見え、扁平上皮(平坦化された)顆粒球細胞に囲まれている場合、卵胞を原始子として分類するが、立方体顆粒球細胞はない(図2D)。
注意:原始卵胞は、立方体および扁平上皮顆粒細胞(図2E)と主に立方体顆粒細胞に囲まれた原発卵胞の組み合わせからなる中間/移行卵胞とは異なる(図2F)。これらの卵胞クラスは別々に定量化する必要があります。 - カウントされたすべての卵胞が正常であり、したがって正常な形態を有することを確認する(図2)。健康な卵胞だけが卵巣予備軍を構成するので、異常な卵胞または食前包を別々に数える。
- 卵母細胞がはっきりと見え、扁平上皮(平坦化された)顆粒球細胞に囲まれている場合、卵胞を原始子として分類するが、立方体顆粒球細胞はない(図2D)。
- あるいは、複数の、または、画像ファイルを開くことによってカウントを実行するために、卵巣組織セクション全体の高出力(例えば、20倍)のマイクロ顕微鏡写真を取る。これは手動で行うか、自動スライドスキャナーを使用して行うことができます。
- 所定の間隔で卵巣全体からサンプリングした各組織部分から生卵数(Q)の合計を求める。この数値にサンプリング分数の逆数を掛けて、以下の式を使用して各複製動物(N)の最終値を求めます。
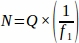 どこ:
どこ:
N = 卵巣内の卵胞の総推定数。
Q = 生の卵胞数(個々のタイプの、別々に計算)。
f1 = サンプリング間隔。9番目のセクションごとにサンプリングされた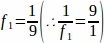 .
.
したがって、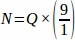 .
.
結果
卵胞枯渇の特徴のあるモデルが使用され、若年成人雌マウスにシクロホスファミド化学療法の単回投与、または生理的車両制御(n=5/群)を投与し、両方の卵巣を48時間後に各動物から採取した。動物ごとに1つの卵巣を、ステテロロジーまたは直接カウントの2つの方法のそれぞれについてステップ1で説明したように調製した。各動物からの左右の卵巣を各群にランダムに割り当てた。これらの?...
ディスカッション
この記事では、マウスの原始卵胞、ステテロロジー、および直接卵胞の数え方がより一般的に採用される方法を列挙するためのゴールドスタンダード技術のステップバイステッププロトコルを提供します。化学療法治療は、同じ動物から左右の卵巣内のこれら2つの異なる方法から得られた結果を比較対照するために使用した。どちらの方法も、原始卵胞数における高い動物間変動性を明らか...
開示事項
著者らは開示するものは何もない。
謝辞
この作業は、ビクトリア州政府の運用インフラ支援とオーストラリア政府NHMRC IRIISSを通じて可能となり、国民保健医療研究評議会(ALW#1120300)とオーストラリア研究評議会(KJH#FT190100265)からの資金提供によって支援されました。著者らは、モナッシュ動物研究プラットフォーム、モナッシュ菌学プラットフォーム、モナッシュマイクロイメージング施設の技術サポートを認めたい。
資料
| Name | Company | Catalog Number | Comments |
| 1-Butanol (HPLC) | Fisher Chemical | #A383-1 | |
| Acid alcohol | Amber Scientific | #ACDL | |
| Bouin’s fixative | Sigma-Aldrich | #HT10132 | Picric acid 0.9% (w/v), formaldehyde 9% (v/v), acetic acid 5% (w/v) |
| Cyclophosphamide | Sigma-Aldrich | #C0768-5G | |
| Dibutylphthalate Polystyrene Xylene (DPX) | Sigma-Aldrich | #06522 | |
| Ethanol | Amber Scientific | #ETH | Ethanol 100% |
| Micro Feather opthalmic scalpel with aluminium handle | Designs for Vision | #FEA-745-SR | Feather blade for dissections (seen in Figure 1) |
| Formalin fixative | Australian Biostain | #ANBFC | |
| Glass coverslip | Thermo Scientific | #MENCS22501GP | 22 mm x 50 mm |
| Glycomethacrylate resin RM2165 microtome | Leica Microsystems | #RM2165 | |
| Glycolmethacrylate DPX | *made in house | *Mix 1.5 L Xylene; 800 g polystyrene pellets; 100mL Dibutyl phthalate for 3 weeks | |
| Histolene | Trajan | #11031 | |
| Mayer’s haematoxylin | Amber Scientific | #MH | |
| Olympus BX50 microscope | Olympus | #BX50 | Brightfield microscope fitted with 10x dry & 100x oil immersion objective (numerical aperture 1.3) |
| Olympus immersion oil type-F | Olympus | #IMMOIL-F30CC | |
| Olympus TH4-200 light source | Olympus | #TH4-200 | |
| Paraffin wax | Sigma-Aldrich | #03987 | |
| Periodic acid | Trajan | #PERI1% | Periodic acid 1% |
| Rotary Microtome CUT 4060 | MicroTec | #4060R/F | Used to cut paraffin sections |
| Schiff’s reagent | Trajan | #SCHF | |
| Scott's tap water | Amber Scientific | #SCOT | Potassium carbonate, magnesium sulphate, water |
| StereoInvestigator Stereological System | MBF Bioscience | Includes StereoInvestigator software, multi-control unit, automatic stage and joystick | |
| Superfrost microscope slides | Thermo Scientific | #MENSF41296SP | 1 mm, 72 pcs |
| Technovit 7100 Plastic embedding system | Emgrid Australia | #64709003 | 500 mL/5 x 1 g/40 mL |
| Technovit 3040 yellow | Emgrid Australia | #64708805 | 100 g/80 mL |
参考文献
- Stringer, J. M., Winship, A., Liew, S. H., Hutt, K. The capacity of oocytes for DNA repair. Cellular and Molecular Life Sciences. 75 (15), 2777-2792 (2018).
- Winship, A. L., Stringer, J. M., Liew, S. H., Hutt, K. J. The importance of DNA repair for maintaining oocyte quality in response to anti-cancer treatments, environmental toxins and maternal ageing. Human Reproduction Update. 24 (2), 119-134 (2018).
- Broer, S. L., Broekmans, F. J., Laven, J. S., Fauser, B. C. Anti-Mullerian hormone: ovarian reserve testing and its potential clinical implications. Human Reproduction Update. 20 (5), 688-701 (2014).
- Myers, M., Britt, K. L., Wreford, N. G., Ebling, F. J., Kerr, J. B. Methods for quantifying follicular numbers within the mouse ovary. Reproduction. 127 (5), 569-580 (2004).
- Boyce, R. W., Dorph-Petersen, K. A., Lyck, L., Gundersen, H. J. Design-based stereology: introduction to basic concepts and practical approaches for estimation of cell number. Toxicologic Pathology. 38 (7), 1011-1025 (2010).
- Ristic, N., et al. Maternal dexamethasone treatment reduces ovarian follicle number in neonatal rat offspring. Journal of Microscopy. 232 (3), 549-557 (2008).
- Soleimani Mehranjani, M., Mansoori, T. Stereological study on the effect of vitamin C in preventing the adverse effects of bisphenol A on rat ovary. International Journal of Reproductive Biomedicine (Yazd). 14 (6), 403-410 (2016).
- Brown, D. L. Bias in image analysis and its solution: unbiased stereology. Journal of Toxicologic Pathology. 30 (3), 183-191 (2017).
- Hasselholt, S., Lykkesfeldt, J., Overgaard Larsen, J. Thick methacrylate sections devoid of lost caps simplify stereological quantifications based on the optical fractionator design. Anatomical Record (Hoboken). 298 (12), 2141-2150 (2015).
- Tilly, J. L. Ovarian follicle counts--not as simple as 1, 2, 3. Reproductive Biology and Endocrinology. 1, 11 (2003).
- Nguyen, Q. N., et al. Loss of PUMA protects the ovarian reserve during DNA-damaging chemotherapy and preserves fertility. Cell Death and Disease. 9 (6), 618 (2018).
- Meirow, D., Assad, G., Dor, J., Rabinovici, J. The GnRH antagonist cetrorelix reduces cyclophosphamide-induced ovarian follicular destruction in mice. Human Reproduction. 19 (6), 1294-1299 (2004).
- Winship, A. L., et al. The PARP inhibitor, olaparib, depletes the ovarian reserve in mice: implications for fertility preservation. Human Reproduction. , (2020).
- Meirow, D., Lewis, H., Nugent, D., Epstein, M. Subclinical depletion of primordial follicular reserve in mice treated with cyclophosphamide: clinical importance and proposed accurate investigative tool. Human Reproduction. 14 (7), 1903-1907 (1999).
- Nguyen, Q. N., et al. Cisplatin- and cyclophosphamide-induced primordial follicle depletion is caused by direct damage to oocytes. Molecular Human Reproduction. , (2019).
- Gundersen, H. J., Jensen, E. B. The efficiency of systematic sampling in stereology and its prediction. Journal of Microscopy. 147, 229-263 (1987).
- Olesen, M. V., Needham, E. K., Pakkenberg, B. The Optical Fractionator Technique to Estimate Cell Numbers in a Rat Model of Electroconvulsive Therapy. Journal of Visualized Experiments. (125), e55737 (2017).
- Findlay, J. K., Hutt, K. J., Hickey, M., Anderson, R. A. How Is the Number of Primordial Follicles in the Ovarian Reserve Established. Biology of Reproduction. 93 (5), 111 (2015).
- Omari, S., et al. Mcl-1 is a key regulator of the ovarian reserve. Cell Death and Disease. 6, 1755 (2015).
- Winship, A. L., Bakai, M., Sarma, U., Liew, S. H., Hutt, K. J. Dacarbazine depletes the ovarian reserve in mice and depletion is enhanced with age. Scientific Reports. 8 (1), 6516 (2018).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. An accurate, simple method for unbiased determination of primordial follicle number in the primate ovary. Biology of Reproduction. 56 (4), 909-915 (1997).
- Miller, P. B., Charleston, J. S., Battaglia, D. E., Klein, N. A., Soules, M. R. Morphometric analysis of primordial follicle number in pigtailed monkey ovaries: symmetry and relationship with age. Biology of Reproduction. 61 (2), 553-556 (1999).
- Charleston, J. S., et al. Estimating human ovarian non-growing follicle number: the application of modern stereology techniques to an old problem. Human Reproduction. 22 (8), 2103-2110 (2007).
- Hansen, K. R., Craig, L. B., Zavy, M. T., Klein, N. A., Soules, M. R. Ovarian primordial and nongrowing follicle counts according to the Stages of Reproductive Aging Workshop (STRAW) staging system. Menopause. 19 (2), 164-171 (2012).
- Hansen, K. R., et al. A new model of reproductive aging: the decline in ovarian non-growing follicle number from birth to menopause. Human Reproduction. 23 (3), 699-708 (2008).
- Sonigo, C., et al. High-throughput ovarian follicle counting by an innovative deep learning approach. Scientific Reports. 8 (1), 13499 (2018).
- McKey, J., Cameron, L. A., Lewis, D., Batchvarov, I. S., Capel, B. Combined iDISCO and CUBIC tissue clearing and lightsheet microscopy for in toto analysis of the adult mouse ovarydagger. Biology of Reproduction. 102 (5), 1080-1089 (2020).
- Kagami, K., Shinmyo, Y., Ono, M., Kawasaki, H., Fujiwara, H. Three-dimensional evaluation of murine ovarian follicles using a modified CUBIC tissue clearing method. Reproductive Biology and Endocrinology. 16 (1), 72 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved