A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חקר חילוף החומרים של אנרגיה מיטוכונדריאלית של כדוריות מיקרוטיסו תלת-ממדיות בודדות באמצעות ניתוח שטף חוץ-תאי
In This Article
Erratum Notice
Summary
פרוטוקולים אלה יסייעו למשתמשים לחקור את חילוף החומרים של אנרגיה מיטוכונדריאלית בספרואידים שמקורם בתאי סרטן תלת-ממדיים באמצעות ניתוח שטף חוץ-תאי של סוסון ים.
Abstract
אגרגטים תאיים תלת-ממדיים (3D), המכונים ספרואידים, הפכו בשנים האחרונות לחזית תרבית התאים במבחנה . בניגוד לתאי התרבות כחד-שכבתיים דו-ממדיים חד-תאיים (תרבית דו-ממדית), תרבית תאים כדורית מקדמת, מווסתת ותומכת בארכיטקטורה תאית פיזיולוגית ובמאפיינים הקיימים ב-vivo, כולל ביטוי של חלבוני מטריצה חוץ-תאית, איתות תאים, ביטוי גנים, ייצור חלבונים, התמיינות והתפשטות. חשיבותה של תרבית תלת-ממדית הוכרה בתחומי מחקר רבים, כולל אונקולוגיה, סוכרת, ביולוגיה של תאי גזע והנדסת רקמות. בעשור האחרון פותחו שיטות משופרות לייצור ספרואידים ולהערכת תפקודם המטבולי וגורלם.
מנתחי שטף חוץ-תאי (XF) שימשו כדי לחקור את תפקוד המיטוכונדריה במיקרוטיסים תלת-ממדיים כגון ספרואידים באמצעות צלחת לכידת איים XF24 או מיקרו-פלטה ספרואידית XFe96. עם זאת, פרוטוקולים ברורים ואופטימיזציה של בדיקת חילוף החומרים של אנרגיה מיטוכונדריאלית בספרואידים באמצעות טכנולוגיית XF לא תוארו בפירוט. מאמר זה מספק פרוטוקולים מפורטים לבדיקת חילוף החומרים של אנרגיה מיטוכונדריאלית בספרואידים תלת-ממדיים בודדים באמצעות מיקרו-פלטות ספרואידיות עם מנתח XF XFe96. באמצעות קווי תאים סרטניים שונים, טכנולוגיית XF מוכחת כמי שמסוגלת להבחין בין נשימה תאית בספרואידים תלת-ממדיים בגדלים שונים לא רק בגדלים שונים, אלא גם בנפחים שונים, מספרי תאים, תכולת DNA וסוגים שונים.
ריכוזי התרכובת האופטימליים של אוליגומיצין, BAM15, רוטנון ואנטימיצין A משמשים לבדיקת פרמטרים ספציפיים של חילוף חומרים של אנרגיה מיטוכונדריאלית בספרואידים תלת-ממדיים. מאמר זה דן גם בשיטות לנרמול נתונים המתקבלים מספרואידים ומתייחס לשיקולים רבים שיש לקחת בחשבון בעת חקירת חילוף החומרים של הספרואידים באמצעות טכנולוגיית XF. פרוטוקול זה יסייע להניע מחקר במודלים מתקדמים של ספרואידים במבחנה .
Introduction
ההתקדמות במודלים חוץ גופיים במחקר הביולוגי התקדמה במהירות במהלך 20 השנים האחרונות. מודלים כאלה כוללים כיום אופנות של איברים על שבב, אורגנואידים וספרואידים תלת-ממדיים של מיקרוטיסואה, שכולם הפכו למוקד נפוץ לשיפור התרגום בין מחקרי in vitro ו-in vivo. השימוש במודלים מתקדמים במבחנה, במיוחד ספרואידים, משתרע על פני מספר תחומי מחקר, כולל הנדסת רקמות, מחקר בתאי גזע, סרטן וביולוגיה של מחלות 1,2,3,4,5,6,7, ובדיקות בטיחות, כולל טוקסיקולוגיה גנטית 8,9,10, טוקסיקולוגיה של ננו-חומרים11, 12,13,14, ובדיקות בטיחות ויעילות של תרופות 8,15,16,17,18,19.
מורפולוגיה תקינה של תאים היא קריטית לפנוטיפ ולפעילות ביולוגית. גידול תאים לכדי ספרואידים תלת-ממדיים של מיקרוטיסואה מאפשר לתאים לאמץ מורפולוגיה, פונקציה פנוטיפית וארכיטקטורה, הדומים יותר לאלה שנצפו in vivo אך קשים ללכידה באמצעות טכניקות קלאסיות של תרביות תאים חד-שכבתיות יותר. הן in vivo והן in vitro, תפקוד התאים מושפע ישירות מהמיקרו-סביבה התאית, שאינה מוגבלת לתקשורת תאית ותכנות (למשל, תצורות צומת תאים-תאים, הזדמנויות ליצור נישות תאים); חשיפת תאים להורמונים ולגורמי גדילה בסביבות המיידיות (למשל, חשיפה לציטוקין תאי כחלק מתגובה דלקתית); הרכב של מטריצות פיזיקליות וכימיות (למשל, האם תאים גדלים בפלסטיק בתרבית רקמה נוקשה או בסביבת רקמה אלסטית); והכי חשוב, כיצד חילוף החומרים התאי מושפע מתזונה וגישה לחמצן, כמו גם מעיבוד של תוצרי פסולת מטבולית כגון חומצה לקטית.
ניתוח שטף מטבולי הוא דרך רבת עוצמה לבחון את חילוף החומרים התאי בתוך מערכות מוגדרות במבחנה . באופן ספציפי, טכנולוגיית XF מאפשרת ניתוח של שינויים חיים בזמן אמת בביו-אנרגיה תאית של תאים ורקמות שלמים. בהתחשב בכך שאירועים מטבוליים תוך-תאיים רבים מתרחשים בסדר גודל של שניות עד דקות, גישות תפקודיות בזמן אמת הן בעלות חשיבות עליונה להבנת שינויים בזמן אמת בשטף המטבולי התאי בתאים שלמים וברקמות במבחנה.
מאמר זה מספק פרוטוקולים לטיפוח קווי תאים שמקורם בסרטן A549 (אדנוקרצינומה של הריאות), HepG2/C3A (קרצינומה הפטוצלולרית), MCF-7 (אדנוקרצינומה של השד) ו-SK-OV-3 (אדנוקרצינומה שחלתית) כמו במודלים ספרואידיים תלת-ממדיים במבחנה תוך שימוש בגישות של צבירה כפויה (איור 1). הוא גם (i) מתאר בפירוט כיצד לחקור את חילוף החומרים של אנרגיה מיטוכונדריאלית של כדוריות תלת-ממדיות בודדות באמצעות מנתח Agilent XFe96 XF, (ii) מדגיש דרכים לייעל את מבחני ה-XF באמצעות ספרואידים תלת-ממדיים בודדים, ו-(iii) דן בשיקולים חשובים ובמגבלות של בדיקת חילוף החומרים הספרואידי התלת-ממדי באמצעות גישה זו. והכי חשוב, מאמר זה מתאר כיצד נאספים מערכי נתונים המאפשרים חישוב של קצב צריכת החמצן (OCR) כדי לקבוע זרחון חמצוני ובכך את תפקוד המיטוכונדריה בספרואידים תאיים. למרות שלא נותח עבור פרוטוקול זה, קצב ההחמצה החוץ-תאית (ECAR) הוא פרמטר נוסף הנמדד לצד נתוני OCR בניסויי XF. עם זאת, ECAR מתפרש לעתים קרובות בצורה גרועה או שגויה ממערכי נתונים של XF. אנו מספקים פרשנות לגבי המגבלות של חישוב ECAR בעקבות גישות בסיסיות של יצרן הטכנולוגיה.
Access restricted. Please log in or start a trial to view this content.
Protocol
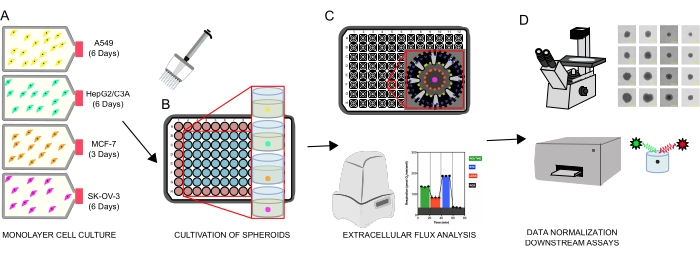
איור 1: זרימת עבודה גרפית ליצירת ספרואידים תאיים, ניתוח שטף חוץ-תאי ובדיקות במורד הזרם. ארבעה קווי תאים סרטניים עברו תרבית סלקטיבית כחד-שכבתיים (A), נותקו מצלוחיות תרביות רקמה, ונזרעו לתוך מיקרו-פלטות חיבור אולטרה-נמוכות בעלות 96 בארות ליצירת ספרואידים (B). קרצינומה של ריאה A549, קרצינומה בכבד HepG2/C3A, אדנוקרצינומה שחלתית SK-OV-3 ותאי קרצינומה של השד MCF-7 נזרעו ב-1 × 103-8 × 103 תאים/באר וגדלו עד 7 ימים כדי ליצור ספרואידים בודדים ולייעל את צפיפות הזריעה הספרואידית ואת זמן הטיפוח על ידי תצפית רציפה ומדידות פלנימטריות. לאחר שנוצרו, ספרואידים בודדים נשטפו לתוך מדיום XF ללא סרום ונזרעו בקפידה לתוך מיקרו-לוחות בדיקה ספרואידיים, מצומדים מראש עם פולי-D-ליזין (C). הספרואידים היו נתונים לניתוח שטף חוץ-תאי באמצעות מנתח XFe96 תוך שימוש במספר פרוטוקולים כדי לטפל ב: (1) גודל ספרואידי אופטימלי לתגובת נשימה מיטוכונדריאלית בסיסית; (2) טיטרציה אופטימלית של מעכבי נשימה מיטוכונדריאליים; (3) אופטימיזציה של מיקום הספרואידים בתוך בארות מיקרו-פלטה. (D) ניתוחים לאחר XF, מיקרוסקופיית ניגודיות פאזה וכימות DNA ספרואידי שימשו לנורמליזציה של נתונים ולבדיקות אחרות במבחנה במורד הזרם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
1. טיפוח קווי תאים סרטניים כספרואידים תלת-ממדיים במבחנה
| קו סלולרי | תיאור | מדיום תרבותי | מקור |
| A549 | קו תאי קרצינומה של הריאות | RPMI 1640 | אוסף אירופי של תרביות תאים מאומתות (ECACC) |
| נתרן פירובט (1 מ"מ) | |||
| פניצילין- סטרפטומיצין - (100 U/mL - 100 מ"ג/מ"ל) | |||
| 10 % (v/v) FBS | |||
| HepG2/C3A | קו תאי קרצינומה בכבד, נגזרת קלונלית של קו תאי ההורה HepG2 | DMEM | אוסף תרביות רקמה אמריקאי (ATCC) |
| פניצילין- סטרפטומיצין - (100 U/mL - 100 מ"ג/מ"ל) | |||
| 10 % (v/v) FBS | |||
| MCF7 | קו תאי אדנוקרצינומה של השד | RPMI 1640 | אוסף אירופי של תרביות תאים מאומתות (ECACC) |
| נתרן פירובט (1 מ"מ) | |||
| פניצילין- סטרפטומיצין - (100 U/mL - 100 מ"ג/מ"ל) | |||
| 10 % (v/v) FBS | |||
| SK-OV-3 | קו תאי אדנוקרצינומה שחלתית | RPMI 1640 | אוסף אירופי של תרביות תאים מאומתות (ECACC) |
| נתרן פירובט (1 מ"מ) | |||
| פניצילין- סטרפטומיצין - (100 U/mL - 100 מ"ג/מ"ל) | |||
| 10 % (v/v) FBS | |||
| רכיב | מדיום בדיקת RPMI (נפח סופי של 50 מ"ל) | ||
| מדיום בסיס | סוסון ים אג'ילנט XF RPMI, pH 7.4 | ||
| גלוקוז (1 M ציר סטרילי) | 11 mM (תמיסת מלאי של 0.55 מ"ל) | ||
| L-גלוטמין (200 mM מלאי סטרילי) | 2 mM (0.5 מ"ל של תמיסת מלאי) | ||
| נתרן פירובט (ציר סטרילי של 100 mM) | 1 mM (0.5 מ"ל של תמיסת מלאי) |
טבלה 1: מדיה של קווי תאים סרטניים והרכבי מדיה XF.
- תרבית את כל קווי התאים באמצעות טכניקת תרבית רקמה אספטית סטנדרטית ואישר שהם נקיים ממיקופלסמה באמצעות ערכת בדיקה מתאימה.
- תרבית את קווי התאים בבקבוקי תרבית רקמה T75 או שווה ערך, באמצעות המדיום המומלץ (טבלה 1). תרבית את קווי התא למפגש של 65-80% והעברתם באופן קבוע עד למקסימום של 25 מעברים.
- יש לשטוף פעמיים את צלוחיות תרבית התאים במי מלח (DBPS) שעברו DBPS של דולבקו.
- נתקו את התאים מהצלליות עם 3 מ"ל של מגיב הדיסוציאציה של התא (ראו טבלת החומרים) למשך 5 דקות בטמפרטורה של 37 מעלות צלזיוס ואישרו את הניתוק על ידי מיקרוסקופיה.
- שאפו בעדינות את תרחיף התא המנותק כדי להבטיח תרחיף חד-תאי ולהשבית את ריאגנט הדיסוציאציה של התא עם 7 מ"ל של מדיום תרבית רקמה שלם.
- לאסוף את התאים על ידי צנטריפוגה ב 300 × g במשך 5 דקות, להשליך את supernatant, ולהחיות את התאים בתווך שלם.
- ספרו את התאים באמצעות המוציטומטר או מונה תאים אוטומטי והצמידו את צפיפות התאים הרצויה לזריעה.
הערה: כדי לזרוע צלחת שלמה של 96 בארות ב-100 μL/well ב-4 ×-103 תאים/באר, התאים צריכים להיות מחוברים ל-4 ×-104 תאים/מ"ל בנפח מומלץ של 12 מ"ל. - נקו את תרחיף התא למאגר סטרילי ופיצו 100 μL של תרחיף התא לכל באר של מיקרו-לוחית דוחה תאים באמצעות פיפטטור רב-ערוצי.
הערה: יש לזרוע רק את 60 הבארות הפנימיות של מיקרו-לוחית ואת השאר למלא ב-DPBS. פעולה זו תיצור מחסום אידוי, תבטיח הומוגניות כדורית על פני הצלחת ותמזער את השפעות קצה הצלחת. - מיקרו-לוחות ספרואידים של צנטריפוגה ב-300 × גרם במשך 15 דקות כדי לאלץ את התאים לאגרגטים רופפים.
- הדגירה של הצלחות בטמפרטורה של 37 מעלות צלזיוס, 5% CO2 למשך 3 ימים לפחות כדי להבטיח היווצרות כדורית.
- בצע מיקרוסקופיה של ניגודיות פאזה תוך שימוש בשיטות מעבדה סטנדרטיות כדי לעקוב אחר צמיחתם של ספרואידים. מלאו את מדיום תרביות התאים כל 3 ימים או פעמיים בשבוע על ידי ביצוע חילופי חצי נפח בינוניים.
2. בדיקת חילוף חומרים של אנרגיה מיטוכונדריאלית של כדוריות בודדות באמצעות טכנולוגיית שטף חוץ-תאי (XF)
- הכנת בדיקה (יום אחד לפני כן)
- בדוק את הכדאיות הספרואידית באמצעות מיקרוסקופ אור הפוך עם ניגודיות פאזה בהגדלה של פי 4 כדי להבטיח מבנה ספרואידי שלם, מורפולוגיה ואחידות כוללת בין הדגימות.
- הוסיפו לחות למחסנית החיישן.
- Aliquot ~ 20 מ"ל של calibrant לתוך צינור חרוטי.
- מניחים את הצינור החרוטי המכיל את הקליברנט באינקובטור שאינו CO2 37 °C למשך הלילה.
- הסר את התוכן מתוך ערכת הבדיקה.
- הסר את מחסנית החיישן מלוח השירות והנח אותה במהופך על משטח העבודה שליד לוח השירות.
- Pipette 200 μL של ddH2O סטרילי לתוך כל באר של לוחית השירות של מחסנית החיישן באמצעות פיפטה P300 רב-ערוצית.
- הניחו את מחסנית החיישן על גבי לוחית השירות.
- בדקו שמפלס המים בכל באר גבוה מספיק כדי להטביע את בדיקות החיישן.
- העבר את מחסנית החיישן המורכבת לחממה שאינה CO2 37 °C והשאר אותה למשך הלילה.
הערה: ניתן לבצע שלב זה 12-72 שעות לפני תחילת הבדיקה.
- מעיל כדורי בדיקה מיקרו-לוחית
- באמצעות טכניקות אספטיות, הוסיפו 30 μL/באר של תמיסת Poly-D-Lysine סטרילית (0.1 מ"ג/מ"ל) למיקרו-פלטה הספרואידית והדגמו אותה למשך 30 דקות בטמפרטורת החדר.
- שאפו את התמיסה מכל באר של המיקרו-פלטה הספרואידית, הפכו את הצלחת והקשו אותה בחוזקה על נייר טישו כדי להסיר כל תמיסה שיורית.
- שטפו את הצלחת פעמיים עם 200 μL/באר של ddH2O סטרילי.
- לאחר הכביסה הסופית, הפכו את המיקרו-פלטה והקשו אותה בחוזקה על נייר טישו כדי להסיר את שאריות המים.
- אפשרו לצלחת להתייבש באוויר למשך 30 דקות לפני השימוש או האחסון שלה ב-4 מעלות צלזיוס לשימוש עתידי.
הערה: יש לצפות את המיקרו-פלטה של הבדיקה הספרואידית בדבק מולקולרי כדי להבטיח שהספרואידים מקובעים בתחתית המיקרו-פלטה. ללא דבק מולקולרי, ספרואידים יכולים להתנתק ולהפריע לתוצאות הבדיקה. דבקים מולקולריים אחרים יכולים לשמש גם כחלופה לפולי-D-ליזין עבור לוחות מקדימים. ניתן לאחסן צלחות מוכנות מראש בטמפרטורה של 4 מעלות צלזיוס, אך יש להשאירן לשיווי משקל לטמפרטורת החדר לפני תחילת הבדיקה.
- הכן XF Assay בינוני
- הכן מדיום XF RPMI, כמפורט בטבלה 1, ומסנן סטרילי עם מסנן מזרק 0.22 מיקרומטר
- הכנת בדיקה (שעה אחת לפני הבדיקה)
- יש להמתין מראש את המבחן הנוסף של XF RPMI בינוני ל-37 מעלות צלזיוס.
- לפני המלחמה את המיקרו-פלטה של בדיקת הספרואידים המצופה באינקובטור שאינו CO2 37 °C או באמבטיה יבשה.
- הכן את מחסנית החיישן.
- הוציאו את הצינור החרוטי המכיל את הקליברנט ואת מחסנית החיישן מחממת האוויר.
- הסר את מחסנית החיישן מלוח השירות והנח אותה במהופך על משטח העבודה.
- באמצעות פיפטה רב-ערוצית P300, שאפו את המים מלוח השירות והשליכו אותם.
- יוצקים את תמיסת הקליברנט למאגר ריאגנטים סטרילי ומוסיפים 200 μL/באר של הקליברנט המתוכנן מראש ללוח השירות באמצעות פיפטה רב-ערוצית P300.
- הרימו את מחסנית החיישן והניחו אותה בחזרה על גבי לוח השירות, מה שמבטיח שהחיישנים שקועים היטב בקליברנט.
- העבר את מחסנית החיישן המורכבת בחזרה לחממה שאינה CO2 37 °C עד שיהיה מוכן לטעון את פתרונות הזרקת היציאה.
- לשטוף את הספרואידים עם מדיום הבדיקה.
- הסר את צלחת תרבית הספרואידים מחממת 37 °C, 5% CO2 והתבונן בספרואידים מתחת למיקרוסקופ כדי להבטיח את שלמותם לפני שלבי העברת הספרואידים.
- טען את כל הבארות של הלוח הספרואידי עם 180 μL / באר של מדיום בדיקה מוכן מראש, כולל כל בארות תיקון רקע.
- ממלאים חלקית צלחת פטרי 7 ס"מ ב-3 מ"ל של מדיום הבדיקה.
- באמצעות פיפטה רב-ערוצית עמוסה בקצות פיפטה רחבים, מעבירים את הספרואידים מצלחת התרבית בת 96 הבארות לכלי פטרי בקוטר 7 ס"מ על ידי הצבת הפיפטטור בנפח שאיפה של 10-50 מיקרול'.
- כדוריות זרעים לתוך מיקרו-לוחית הבדיקה הספרואידית המצופה מראש.
- באמצעות מיקרוסקופ דיסקציה ומנגנון תיבת אור, מעבירים את הספרואידים מצלחת פטרי למיקרו-לוחית הבדיקה הספרואידית כמפורט להלן.
- הגדר את הנפח של פיפטטור בעל ערוץ יחיד המצויד בקצה פיפטה רחב ל-20 μL ושאף בזהירות ספרואיד יחיד. מניחים את הקצה ישירות במרכז כל באר של מיקרו-לוחית הבדיקה הספרואידית ומאפשרים לכוח הכבידה להכניס ספרואיד יחיד למרכז כל באר, כלומר, אל תגרשו שום מדיום מקצה הפיפטה ותאפשרו לפעולה נימית למשוך את הספרואיד מקצה הפיפטה. כדי לאשר את האלוטציה, ניתן לטפטף את תכולת הפיפטטור בחזרה לתוך צלחת פטרי 7 ס"מ מתחת למיקרוסקופ.
הערה: אלוטציה של ספרואיד יחיד לוקחת בדרך כלל 15-30 שניות בהתאם לגודל/צפיפות הספרואידים. במהלך תקופה זו, אין להסיר את הצינור. כל בארות תיקון רקע צריכות להיות נקיות מספרואידים ולהכיל רק מדיום בדיקה. תחת המיקרוסקופ, לאשר את המיקום של כל ספרואיד. כל ספרואיד צריך להיות ממוקם באופן אידיאלי במרכז כל באר. - לאחר שכל הספרואידים הועברו למיקרו-לוחית הבדיקה של הספרואידים, העבירו את הצלחת לחממה שאינה CO2 בטמפרטורה של 37 מעלות צלזיוס למשך שעה לפחות 1 שעות לפני הבדיקה.
- הגדר את הנפח של פיפטטור בעל ערוץ יחיד המצויד בקצה פיפטה רחב ל-20 μL ושאף בזהירות ספרואיד יחיד. מניחים את הקצה ישירות במרכז כל באר של מיקרו-לוחית הבדיקה הספרואידית ומאפשרים לכוח הכבידה להכניס ספרואיד יחיד למרכז כל באר, כלומר, אל תגרשו שום מדיום מקצה הפיפטה ותאפשרו לפעולה נימית למשוך את הספרואיד מקצה הפיפטה. כדי לאשר את האלוטציה, ניתן לטפטף את תכולת הפיפטטור בחזרה לתוך צלחת פטרי 7 ס"מ מתחת למיקרוסקופ.
- באמצעות מיקרוסקופ דיסקציה ומנגנון תיבת אור, מעבירים את הספרואידים מצלחת פטרי למיקרו-לוחית הבדיקה הספרואידית כמפורט להלן.
3. הכנה וטעינה של תרכובות למחסנית החיישן למבחני XF
| אסטרטגיית הזרקה | מתחם (יציאה) | נפח התחלתי של מיקרו-וול XFe96 (μL) | ריכוז באר סופית רצויה | נפח יציאה (μL) | נפח מיקרווול XFe96 סופי לאחר ההזרקה (μL) | ריכוז מלאי עבודה |
| 1 | אוליגומיצין (אנ') | 180 | 3 מ"ג/מ"ל | 20 | 200 | 30 מיקרוגרם/מ"ל |
| רוטנונה (ב) | 200 | 2 מיקרומטר | 20 | 220 | 22 מיקרומטר | |
| אנטימיצין A (B) | 200 | 2 מיקרומטר | 20 | 220 | 22 מיקרומטר | |
| 2 | BAM15 (A) | 180 | 5 מיקרומטר | 20 | 200 | 50 מיקרומטר |
| רוטנונה (ב) | 200 | 2 מיקרומטר | 20 | 220 | 22 מיקרומטר | |
| אנטימיצין A (B) | 200 | 2 מיקרומטר | 20 | 220 | 22 מיקרומטר |
טבלה 2: ריכוזי תרכובות מיטוכונדריאליות לבדיקת חילוף החומרים של אנרגיה מיטוכונדריאלית של ספרואידים תלת-ממדיים בודדים באמצעות מנתח XFe96.
- הכן ריכוזי מלאי עבודה של כל תרכובת כפי שצוין בטבלה 2 באמצעות מדיום בדיקת XF RPMI מלא, מוכן מראש.
- כוון את לוחית המחסנית (המוצמדת ללוח השירות) מבחינת עמודה, 1-12 משמאל לימין.
- אם אתה משתמש במדריך טעינה, הנח אותו על גבי לוחית המחסנית בהתאם להליך הטעינה היטב, לדוגמה, אם נטען תחילה יציאה A, ודא ש- A גלוי בפינה השמאלית העליונה של המדריך.
- העבר את פתרון העבודה של כל תרכובת למאגר מתאים, ובאמצעות פיפטה רב-ערוצית מכוילת P100, מחלק 20 μL לכל היציאות המתאימות. יש לחזור על הפעולה עבור כל תרכובת לתוך היציאות הנותרות.
הערה: אם לא נעשה שימוש ביציאות כלשהן בלוח מחסנית החיישן, ניתן להשאיר אותן ריקות או מלאות במדיום בדיקה. אם נעשה שימוש רק בבחירה של אות יציאה מסוימת, ודא שהיציאות האחרות המתאימות לאות זו נטענות במדיום בדיקה; אחרת, אוויר יוזרק לתוך הבאר, תוך פגיעה בתוצאות בארות אלה. - לאחר טעינת היציאה, הסר את מדריכי טעינת הצלחת (אם נעשה בהם שימוש) והכן את המנתח לטעינת מחסנית החיישן.
הערה: אם הבדיקה אינה מופעלת מיד לאחר טעינת היציאות, הנח את המכסה בחזרה על מחסנית החיישן והחזיר את הצלחת לחממת האוויר של 37 °C עד שיהיה מוכן לטעינה למכונה.
4. תכנון בדיקה, אסטרטגיות הזרקה ורכישת נתונים
- הפעלת הבדיקה
- הפעל את המנתח והתחבר לבקר (מחשב).
הערה: ניתן לאמת זאת על-ידי מצב חיבור המכשיר בחלונית הווידג'טים של תוכנת Wave Controller. - נווט אל דף התבניות בתוכנת WAVE, מצא את קובץ תבנית הבדיקה של הניסוי ולחץ פעמיים כדי לפתוח אותו.
הערה: אם תבנית הבדיקה אינה מופיעה בתצוגה תבניות , ייבא את קובץ התבנית לתיקיית התבנית מכונן רשת משותף או מכונן הבזק מסוג USB. - כדי להתחיל את הבדיקה, לחץ על הכרטיסיה הפעל Assay .
הערה: אם הגדרות הקבוצה הוקצו כהלכה בתוך מפת הלוח, הבדיקה תהיה מוכנה להפעלה כפי שמצוין על ידי הסימון הירוק בצד ימין של הדף. בשלב זה, ניתן להזין כל מידע נוסף בדף סיכום הבדיקה או בדף שנותר ריק; המשך לשלב הבא. בשל החדירה המאוחרת של אפננים מיטוכונדריאליים בספרואידים תלת-ממדיים של מיקרוטיסואה (איור 2), השתמש במידע פרוטוקול המדידה המתואר בטבלה 3.
- הפעל את המנתח והתחבר לבקר (מחשב).
| תקופת המדידה | מספר הזרקה ויציאה | פרטי המדידה | משך התקופה (h:min:s) |
| כיול | לא ישים | מנתחי XF מבצעים תמיד כיול זה כדי לוודא שהמדידות מדויקות | 00:20:00 (זה ממוצע ויכול להשתנות בין מכונות) |
| שוויון נפש | לא ישים | שיווי משקל מתרחש לאחר כיול והוא מומלץ. | 00:10:00 |
| בזלת | לא ישים | מחזורים = 5 | 00:30:00 |
| מיקס = 3:00 | |||
| המתן = 0:00 | |||
| מידה = 3:00 | |||
| אוליגומיצין / BAM15 | הזרקה 1 (יציאה A) | מחזורים = 10 | 01:00:00 |
| מיקס = 3:00 | |||
| המתן = 0:00 | |||
| מידה = 3:00 | |||
| רוטנון + אנטימיצין A | הזרקה 2 (יציאה B) | מחזורים = 10 | 01:00:00 |
| מיקס = 3:00 | |||
| המתן = 0:00 | |||
| מידה = 3:00 | |||
| סה"כ זמן: | 03:00:00 | ||
טבלה 3: הגדרת פרוטוקול לבדיקת חילוף חומרים של אנרגיה מיטוכונדריאלית של ספרואידים תלת-ממדיים בודדים באמצעות מנתח XFe96.
- לחץ על התחל הפעל כדי להעלות את תיבת הדו-שיח שמירת מיקום .
- הזן את מיקום השמירה של קובץ התוצאה, והנח את מחסנית החיישן המורכבת על המגש התרמי המופיע מהדלת בצד המנתח. המתן עד שהמגש התרמי ייפתח באופן אוטומטי והמסך יציג את הודעת לוח השירות של Load Calibrant . לפני ביצוע ההנחיות על המסך, ודא i) התאמה נכונה של מחסנית החיישן בלוח השירות, ii) המכסה מוסר ממחסנית החיישן, ו- iii) כיוון נכון של מחסנית החיישן בלוח השירות.
- בצע את הפקודות שעל המסך כדי להפעיל כיול מחסנית חיישן.
הערה: הזמן שלוקח להשלים את הכיול הוא בערך 10-20 דקות (לבדיקות ב-37 מעלות צלזיוס). - לאחר כיול מחסנית החיישן, טען את המיקרו-פלטה הספרואידית לתוך המנתח על-ידי ביצוע ההוראות שעל המסך בבקר הגלים כדי להתחיל את שלב שיווי המשקל של 12 דקות.
הערה: תיבות ירוקות עם קרציות לבנות מציינות כיול 'טוב' עבור באר זו. אם בארות כלשהן לא יצליחו לספק כיול 'טוב', הן יסומנו בקופסה אדומה ובצלב לבן. יש לציין בארות כאלה ולהחריג אותן מכל ניתוח לאחר השלמת הבדיקה באמצעות כרטיסיית בדיקת השינוי . - המתן עד שהמנתח יתחיל באופן אוטומטי לרכוש מדידות בסיסיות לאחר שהמכונה השלימה את שלב שיווי המשקל (כמתואר בפרוטוקול המכשיר).
- כדי להשלים את הניסוי, בצע את הפקודות שעל המסך בבקר WAVE.
הערה: לאחר שהמיקרו-פלטה הספרואידית הוסרה מהמנתח, השליכו את מחסנית החיישן והניחו בצד את הלוחית הספרואידית לניתוח נוסף במידת הצורך (למשל, כימות דנ"א דו-גדילי (ds). אם המיקרו-פלטה אינה נדרשת לניתוח נוסף, ניתן להשליך אותה יחד עם מחסנית החיישן. - המתן עד שתיבת הדו-שיח של הבדיקה תופיע ותציג את התוצאות או חזור לתצוגת התבניות .
5. אסטרטגיות לנורמליזציה וניתוח נתונים - נורמליזציה לאחר הבדיקה ומבחנים במורד הזרם (שלבים אופציונליים)
- נורמליזציה של נתונים
- כדי לנרמל את נתוני הספרואידים, עיין בסדרת הפרוטוקולים הרלוונטיים לאסטרטגיות נורמליזציה של נתונים לחישוב הגודל והנפח של הספרואידים ולכימות dsDNA במבחנים ספרואידיים. אלה נכללו כקבצים משלימים; ראה קובץ משלים 1 וקובץ משלים 2.
- ניתוח נתונים
- כדי לייצא נתונים לאחד ממחוללי הניתוח האוטומטיים, בצע את פקודות ייצוא הנתונים בבקר WAVE ובחר את מחולל הייצוא התואם לסוג הבדיקה. לחלופין, ייצא את קובץ הנתונים והעלה אותו לניתוח סוסון ים.
הערה: החיסרון של מחוללי דוחות וניתוח סוסון ים הוא שניתוח נתונים מוגבל לאופן שבו מתוכנן מבחן ה- XF ואינו מאפשר לקחת ממוצעים על פני מחזורי מדידה. ייצוא ידני של מערכי נתונים מתוכנת המכשיר מאפשר העדפת משתמש בהקשר זה. בהתחשב בכך שאסטרטגיית ההזרקה להערכת נשימה מיטוכונדריאלית של ספרואידים תלת-ממדיים תהיה ככל הנראה שונה מזו של בדיקת 'MitoStress' טיפוסית, פותחו סדרה של תבניות גיליון אלקטרוני כדי לסייע בניתוח מערכי נתונים אלה, ספציפיים לתרביות תאים תלת-ממדיות, ויסופקו על פי בקשה. קבצי תבניות נתונים אלה יספקו נתונים על הפרמטרים הנשימתיים המיטוכונדריאליים העיקריים המפורטים והמוסברים באיור 2. - כדי לנתח את הנתונים, ייצא את הנתונים כדוח גיליון אלקטרוני מתוכנת בקר WAVE והשתמש בתבנית גיליון אלקטרוני עצמאית לניתוח.
- כדי לייצא נתונים לאחד ממחוללי הניתוח האוטומטיים, בצע את פקודות ייצוא הנתונים בבקר WAVE ובחר את מחולל הייצוא התואם לסוג הבדיקה. לחלופין, ייצא את קובץ הנתונים והעלה אותו לניתוח סוסון ים.
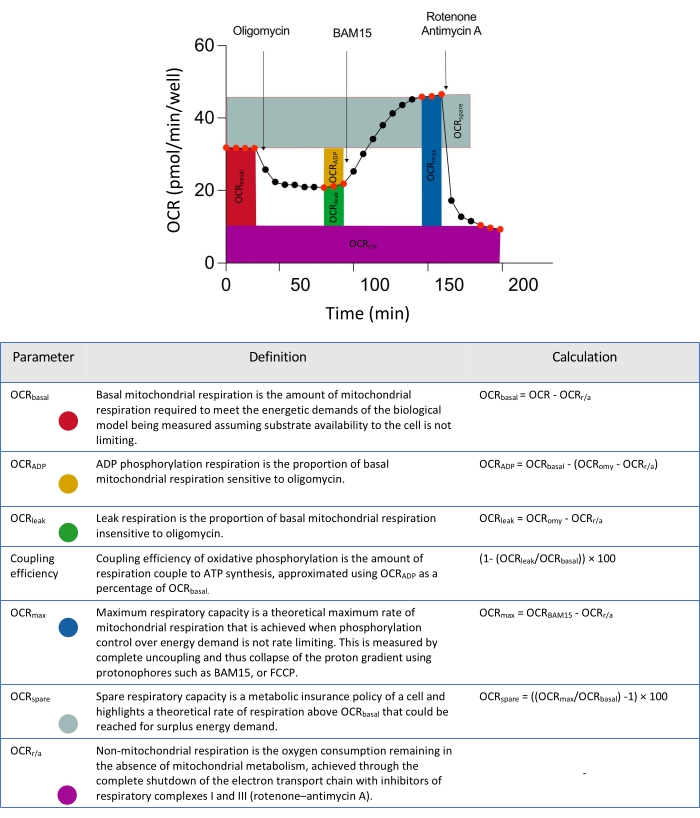
איור 2: מתארים סכמטיים לפרמטרים הנגזרים מניתוח נתוני שטף חוץ-תאי. קיצור: OCR = שיעור צריכת חמצן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
כדי להשיג ספרואידים קומפקטיים מעוצבים היטב, כל קו תאים הותאם בנפרד לצפיפות הזריעה ולמשך הטיפוח (איור 3). קווי תאים A549, HepG2/C3A ו-SK-OV-3 יצרו בתחילה אגרגטים רופפים שלא התקדמו לכדורואידים עגולים עם היקפים מוגדרים בבירור עד לאחר 7 ימים בתרבית. לעומת זאת, תאי MCF-7 יכולים ליצור ספרואידי...
Access restricted. Please log in or start a trial to view this content.
Discussion
ממצאים ותפוקות עיקריים
מאמר זה מספק פרוטוקול מפורט לבדיקת חילוף החומרים של אנרגיה מיטוכונדריאלית של ספרואידים תלת-ממדיים בודדים באמצעות סדרה של קווי תאים שמקורם בסרטן עם מנתח XFe96 XF. שיטה מפותחת ומתוארת לטיפוח מהיר של A549, HepG2/C3A, MCF7 ו-SK-OV-3 כדוריים תאיים באמצעות טכנולוגיות דוחות תא...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגודי עניינים להצהיר עליהם.
Acknowledgements
N.J.C נתמך על ידי פרס מקרה BBSRC MIBTP עם Sygnature Discovery Ltd (BB/M01116X/1, 1940003)
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| A549 | ECACC | #86012804 | Lung carcinoma cell line |
| Agilent Seahorse XF RPMI Medium, pH 7.4 | Agilent Technologies Inc. | 103576-100 | XF assay medium with 1 mM HEPES, without phenol red, sodium bicarbonate, glucose, L-glutamine, and sodium pyruvate |
| Agilent Seahorse XFe96 Extracellular Flux Analyzer | Agilent Technologies Inc. | - | Instrument for measuring rates of spheroid oxygen uptake in single spheroids |
| Antimycin A | Merck Life Science | A8674 | Mitochondrial respiratory complex III inhibitor |
| BAM15 | TOCRIS bio-techne | 5737 | Mitochondrial protnophore uncoupler |
| Black-walled microplate | Greiner Bio-One | 655076 | For fluorescence-based assays |
| CELLSTAR cell-repellent surface 96 U well microplates | Greiner Bio-One | 650970 | Microplates for generating spheroids |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | Assay for the determination of cell viability in 3D microtissue spheroids |
| Cultrex Poly-D-Lysine | R&D Systems a biotechne brand | 3439-100-01 | Molecular cell adhesive for coating XFe96 spheroid microplates to facillitate attachment of spheroids |
| D-(+)-Glucose | Merck Life Sciences | G8270 | Supplement for cell culture growth and XF assay medium |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | 11885084 | Culture medium for HepG2/C3A spheroids |
| EVOS XL Core Imaging System | Thermo Fisher Scientific | AMEX1000 | Phase-contrast imaging microscope |
| EZ-PCR Mycoplasma test kit | Biological Industries | 20-700-20 | Mycoplasma screening in cell cultures |
| FIJI Is Just Image J | Analysis of collated images | ||
| Foetal bovine serum | Merck Life Science | F7524 | Supplement for cell culture medium |
| HepG2/C3A | ATCC | #CRL-10741 | Hepatic carcinoma cell line, a clonal derivative of the parent HepG2 cell line |
| Lactate-Glo | Promega | J5021 | Assay for measurement of lactate within spheorid culture medium |
| L-glutamine (200 mM solution) | Merk Life Sciences | G7513 | Supplement for cell culture growth and XF assay medium |
| M50 Stereo microscope | Leica Microsytems | LEICAM50 | Stereo dissection micrscope; used for spheorid handling |
| MCF-7 | ECACC | #86012803 | Breast adenocarcinoma cell line |
| Oligomycin from Streptomyces diastatochromogenes | Merck Life Science | O4876 | ATP Synthase Inhibitor |
| Penicilin-Streptomycin | Gibco | 15140122 | Antibiotics added to cell culture medium |
| Quant-iT PicoGreen dsDNA Assay Kit | Initrogen | P7589 | Analysis of dsDNA in spehroids |
| Rotenone | Merck Life Science | R8875 | Mitochondrial Respiratory Complex I Inhibitor |
| RPMI 1640 | Gibco | 21875091 | Culture medium for A549, MCF7, and SK-OV-3 spheroids |
| Seahorse Analytics | Agilent Technologies Inc. | Build 421 | https://seahorseanalytics.agilent.com |
| Seahorse XFe96 Spheroid FluxPak | Agilent Technologies Inc. | 102905-100 | Each Seahorse XFe96 Spheroid FluxPak contains: 6 Seahorse XFe96 Spheroid Microplates (102978-100), 6 XFe96 sensor cartridges, and 1 bottle of Seahorse XF Calibrant Solution 500 mL (100840-000) |
| Serological pipette: 5, 10, and 25 mL | Greiner Bio-One | 606107; 607107; 760107 | Consumables for cell culture |
| SK-OV-3 | ECACC | #HTB-77 | Ovarian adenocarcinoma cell line |
| Sodium pyruvate (100 mM solution) | Merck Life Science | S8636 | Supplement for cell culture growth and XF assay medium |
| T75 cm2 cell culture flask | Greiner Bio-One | 658175 | Tissue culture treated flasks for maintaining cell cultures |
| TrypLExpress | Gibco | 12604-021 | Cell dissociation reagent |
| Wave controller software | Agilent Technologies Inc. | - | |
| Wide orifice tip | STARLAB International GmbH | E1011-8400 | Pipette tips with wide opening for spheroid handling |
References
- Correa de Sampaio, P., et al. A heterogeneous in vitro three dimensional model of tumour-stroma interactions regulating sprouting angiogenesis. PLoS One. 7 (2), 30753(2012).
- Amann, A., et al. Development of an innovative 3D cell culture system to study tumour-stroma interactions in non-small cell lung cancer cells. PLoS One. 9 (3), 92511(2014).
- Russell, S., Wojtkowiak, J., Neilson, A., Gillies, R. J. Metabolic profiling of healthy and cancerous tissues in 2D and 3D. Scientific Reports. 7 (1), 15285(2017).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: a systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103(2016).
- Song, Y., et al. Patient-derived multicellular tumor spheroids towards optimized treatment for patients with hepatocellular carcinoma. Journal of Experimental and Clinica Cancer Research. 37 (1), 109(2018).
- Courau, T., et al. Cocultures of human colorectal tumor spheroids with immune cells reveal the therapeutic potential of MICA/B and NKG2A targeting for cancer treatment. Journal for ImmunoTherapy of Cancer. 7 (1), 74(2019).
- Ivanova, E., et al. Use of ex vivo patient-derived tumor organotypic spheroids to identify combination therapies for HER2 mutant non-small cell lung cancer. Clinical Cancer Research. 26 (10), 2393-2403 (2020).
- Mandon, M., Huet, S., Dubreil, E., Fessard, V., Le Hegarat, L. Three-dimensional HepaRG spheroids as a liver model to study human genotoxicity in vitro with the single cell gel electrophoresis assay. Scientific Reports. 9 (1), 10548(2019).
- Stampar, M., et al. Hepatocellular carcinoma (HepG2/C3A) cell-based 3D model for genotoxicity testing of chemicals. Science of the Total Environment. 755, 143255(2020).
- Coltman, N. J., et al. Application of HepG2/C3A liver spheroids as a model system for genotoxicity studies. Toxicology Letters. 345, 34-45 (2021).
- Tchoryk, A., et al. Penetration and uptake of nanoparticles in 3D tumor spheroids. Bioconjugate Chemistry. 30 (5), 1371-1384 (2019).
- Leite, P. E. C., et al. Suitability of 3D human brain spheroid models to distinguish toxic effects of gold and poly-lactic acid nanoparticles to assess biocompatibility for brain drug delivery. Partical Fibre Toxicology. 16 (1), 22(2019).
- Elje, E., et al. Hepato(Geno)toxicity assessment of nanoparticles in a HepG2 liver spheroid model. Nanomaterials. 10 (3), 545(2020).
- Conway, G. E., et al. Adaptation of the in vitro micronucleus assay for genotoxicity testing using 3D liver models supporting longer-term exposure durations. Mutagenesis. 35 (4), 319-330 (2020).
- Wang, Z., et al. HepaRG culture in tethered spheroids as an in vitro three-dimensional model for drug safety screening. Journal of Applied Toxicology. 35 (8), 909-917 (2015).
- Proctor, W. R., et al. Utility of spherical human liver microtissues for prediction of clinical drug-induced liver injury. Archives of Toxicology. 91 (8), 2849-2863 (2017).
- Basharat, A., Rollison, H. E., Williams, D. P., Ivanov, D. P. HepG2 (C3A) spheroids show higher sensitivity compared to HepaRG spheroids for drug-induced liver injury (DILI). Toxicology and Applied Pharmacology. 408, 115279(2020).
- Benning, L., Peintner, A., Finkenzeller, G., Peintner, L. Automated spheroid generation, drug application and efficacy screening using a deep learning classification: a feasibility study. Scientific Reports. 10 (1), 11071(2020).
- Mittler, F., et al. High-content monitoring of drug effects in a 3D spheroid model. Frontiers in Oncology. 7, 293(2017).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. The Biochemical Journal. 435 (2), 297-312 (2011).
- Benz, R., McLaughlin, S. The molecular mechanism of action of the proton ionophore FCCP (carbonylcyanide p-trifluoromethoxyphenylhydrazone). Biophysical Journal. 41 (3), 381-398 (1983).
- Kasianowicz, J., Benz, R., McLaughlin, S. The kinetic mechanism by which CCCP (carbonyl cyanide m-chlorophenylhydrazone) transports protons across membranes. The Journal of Membrane Biology. 82 (2), 179-190 (1984).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2013).
- Mitchell, P. Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism. Nature. 191, 144-148 (1961).
- Alexopoulos, S. J., et al. Mitochondrial uncoupler BAM15 reverses diet-induced obesity and insulin resistance in mice. Nature Communications. 11 (1), 2397(2020).
- Chen, S. -Y., et al. Mitochondrial uncoupler SHC517 reverses obesity in mice without affecting food intake. Metabolism - Clinical and Experimental. 117, 154724(2021).
- Goedeke, L., Shulman, G. I. Therapeutic potential of mitochondrial uncouplers for the treatment of metabolic associated fatty liver disease and NASH. Molecular Metabolism. 46, 101178(2021).
- Hill, B. G., et al. Integration of cellular bioenergetics with mitochondrial quality control and autophagy. Biological chemistry. 393 (12), 1485-1512 (2012).
- Demine, S., Renard, P., Arnould, T. Mitochondrial uncoupling: a key controller of biological processes in physiology and diseases. Cells. 8 (8), 795(2019).
- Wang, J., et al. Uncoupling effect of F16 is responsible for its mitochondrial toxicity and anticancer activity. Toxicological Sciences. 161 (2), 431-442 (2018).
- Tretter, L., Chinopoulos, C., Adam-Vizi, V. Plasma membrane depolarization and disturbed Na+ homeostasis induced by the protonophore carbonyl cyanide-p-trifluoromethoxyphenyl-hydrazon in isolated nerve terminals. Molecular Pharmacology. 53 (4), 734-741 (1998).
- Connop, B. P., Thies, R. L., Beyreuther, K., Ida, N., Reiner, P. B. Novel effects of FCCP [carbonyl cyanide p-(trifluoromethoxy) phenylhydrazone] on amyloid precursor protein processing. Journal of neurochemistry. 72 (4), 1457-1465 (1999).
- Stöckl, P., et al. Partial uncoupling of oxidative phosphorylation induces premature senescence in human fibroblasts and yeast mother cells. Free Radical Biology and Medicine. 43 (6), 947-958 (2007).
- Firsov, A. M., et al. Protonophoric action of BAM15 on planar bilayers, liposomes, mitochondria, bacteria and neurons. Bioelectrochemistry. 137, 107673(2021).
- Dranka, B. P., Hill, B. G., Darley-Usmar, V. M. Mitochondrial reserve capacity in endothelial cells: The impact of nitric oxide and reactive oxygen species. Free Radical Biology and Medicine. 48 (7), 905-914 (2010).
- Eilenberger, C., Rothbauer, M., Ehmoser, E. K., Ertl, P., Kupcu, S. Effect of spheroidal age on sorafenib diffusivity and toxicity in a 3D HepG2 spheroid model. Scientific Reports. 9 (1), 4863(2019).
- vanden Brand, D., Veelken, C., Massuger, L., Brock, R. Penetration in 3D tumor spheroids and explants: Adding a further dimension to the structure-activity relationship of cell-penetrating peptides. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1860 (6), 1342-1349 (2018).
- Niora, M., et al. Head-to-head comparison of the penetration efficiency of lipid-based nanoparticles into tumor spheroids. ACS Omega. 5 (33), 21162-21171 (2020).
- Millard, M., et al. Drug delivery to solid tumors: the predictive value of the multicellular tumor spheroid model for nanomedicine screening. International Journal of Nanomedicine. 12, 7993-8007 (2017).
- Ruas, J. S., et al. Underestimation of the maximal capacity of the mitochondrial electron transport system in oligomycin-treated cells. PLoS One. 11 (3), 0150967(2016).
- Benton, G., DeGray, G., Kleinman, H. K., George, J., Arnaoutova, I. In vitro microtumors provide a physiologically predictive tool for breast cancer therapeutic screening. PLoS One. 10 (4), 0123312(2015).
- Hirpara, J., et al. Metabolic reprogramming of oncogene-addicted cancer cells to OXPHOS as a mechanism of drug resistance. Redox Biology. 25, 101076(2019).
- Ware, M. J., et al. Generation of homogenous three-dimensional pancreatic cancer cell spheroids using an improved hanging drop technique. Tissue Engineering. Part C, Methods. 22 (4), 312-321 (2016).
- Song, Y., et al. TGF-β-independent CTGF induction regulates cell adhesion mediated drug resistance by increasing collagen I in HCC. Oncotarget. 8 (13), 21650-21662 (2017).
- Wrzesinski, K., et al. HepG2/C3A 3D spheroids exhibit stable physiological functionality for at least 24 days after recovering from trypsinisation. Toxicology Research. 2 (3), 163-172 (2013).
- Gaskell, H., et al. Characterization of a functional C3A liver spheroid model. Toxicology Research. 5 (4), 1053-1065 (2016).
- Takahashi, Y., et al. 3D spheroid cultures improve the metabolic gene expression profiles of HepaRG cells. Bioscience Reports. 35 (3), 00208(2015).
- Hendriks, D. F. G., Puigvert, L. F., Messner, S., Mortiz, W., Ingelman-Sundberg, M. Hepatic 3D spheroid models for the detection and study of compounds with cholestatic liability. Scientific Reports. 6, 35434(2016).
- Leung, B. M., Lesher-Perez, S. C., Matsuoka, T., Moraes, C., Takayama, S. Media additives to promote spheroid circularity and compactness in hanging drop platform. Biomaterials Science. 3 (2), 336-344 (2015).
- Cavo, M., et al. A synergic approach to enhance long-term culture and manipulation of MiaPaCa-2 pancreatic cancer spheroids. Scientific Reports. 10 (1), 10192(2020).
- Carlsson, J., Yuhas, J. M. Liquid-overlay culture of cellular spheroids. Recent Results in Cancer Research. 95, 1-23 (1984).
- Costa, E. C., Gaspar, V. M., Coutinho, P., Correia, I. J. Optimization of liquid overlay technique to formulate heterogenic 3D co-cultures models. Biotechnology and Bioengineering. 111 (8), 1672-1685 (2014).
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Zhang, X. D., et al. The use of strictly standardized mean difference for hit selection in primary RNA interference high-throughput screening experiments. Journal of Biomolecular Screening. 12 (4), 497-509 (2007).
- Yepez, V. A., et al. OCR-Stats: Robust estimation and statistical testing of mitochondrial respiration activities using Seahorse XF Analyzer. PLoS One. 13 (7), 0199938(2018).
- Silva, L. P., et al. Measurement of DNA concentration as a normalization strategy for metabolomic data from adherent cell lines. Analytical Chemistry. 85 (20), 9536-9542 (2013).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Exploring Mitochondrial Energy Metabolism of Single 3D Microtissue Spheroids using Extracellular Flux Analysis
Posted by JoVE Editors on 3/11/2022. Citeable Link.
An erratum was issued for: Exploring Mitochondrial Energy Metabolism of Single 3D Microtissue Spheroids using Extracellular Flux Analysis. The Representative Results section was updated.
Figure 5 was updated from:
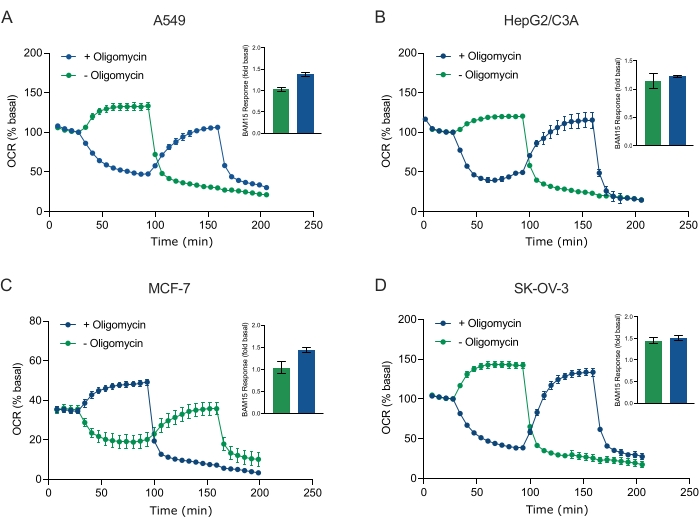
Figure 5: Single or sequential injection of mitochondrial respiratory compounds. Cancer-cell-derived spheroids of MCF-7, HEPG2/C3A, SK-OV-3, and A549 were placed into wells of an XFe96 spheroid microplate in XF RPMI and probed for OCR using the Agilent Seahorse XFe96 analyzer. OCR was measured 5x, after which 2 µg/mL oligomycin (injection Port A: green trace) or 5 µM BAM15 (injection Port A: blue trace or injection port B: green trace) to inhibit the mitochondrial ATP synthase and determine maximal respiratory capacity, respectively. Kinetic OCR data are expressed as % basal (A-D). Maximal respiratory capacity (OCRmax) was calculated as a factor of basal OCR by the equation: OCRmax = OCRBAM15 / OCRbasal. OCRmax was obtained from OCR averages across measurement cycles 8-10 post BAM15 injection with (green bars) and without (blue bars) oligomycin. Data are averages ± SEM from 3-8 individual well replicates across the spheroid assay microplate. Abbreviations: OCR = oxygen consumption rate. Please click here to view a larger version of this figure.
to:
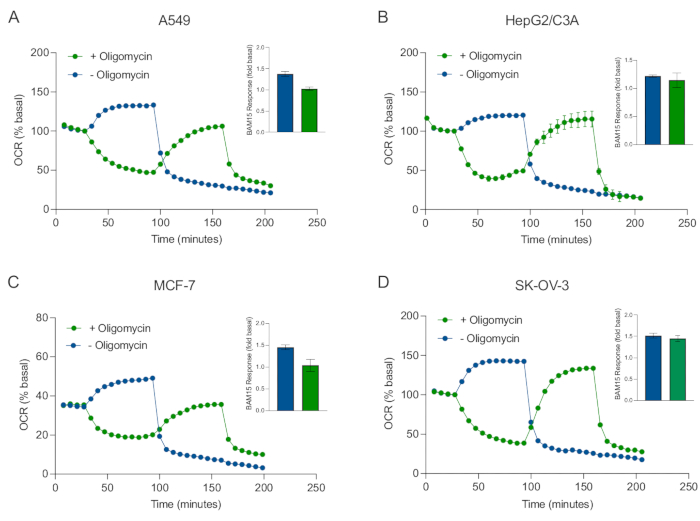
Figure 5: Single or sequential injection of mitochondrial respiratory compounds. Cancer-cell-derived spheroids of MCF-7, HEPG2/C3A, SK-OV-3, and A549 were placed into wells of an XFe96 spheroid microplate in XF RPMI and probed for OCR using the Agilent Seahorse XFe96 analyzer. OCR was measured 5x, after which 2 µg/mL oligomycin (injection Port A: green trace) or 5 µM BAM15 (injection Port A: blue trace or injection port B: green trace) to inhibit the mitochondrial ATP synthase and determine maximal respiratory capacity, respectively. Kinetic OCR data are expressed as % basal (A-D). Maximal respiratory capacity (OCRmax) was calculated as a factor of basal OCR by the equation: OCRmax = OCRBAM15 / OCRbasal. OCRmax was obtained from OCR averages across measurement cycles 8-10 post BAM15 injection with (green bars) and without (blue bars) oligomycin. Data are averages ± SEM from 3-8 individual well replicates across the spheroid assay microplate. Abbreviations: OCR = oxygen consumption rate. Please click here to view a larger version of this figure.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved