A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אינטובציה אנדוטרכאלית באמצעות אנדוסקופ אינטובציה גמיש כמודל סטנדרטי לניהול בטוח של דרכי הנשימה בחזירים
In This Article
Erratum Notice
Summary
השימוש בחזירים במחקר גדל בשנים האחרונות. עם זאת, חזירים מאופיינים באנטומיה קשה של דרכי הנשימה. על ידי הדגמה כיצד לבצע אינטובציה אנדוטרכאלית מונחית אנדוסקופית, הפרוטוקול הנוכחי נועד להגביר עוד יותר את הבטיחות של חיות מעבדה כדי למנוע סבל של בעלי חיים ומוות מיותר.
Abstract
אינטובציה אנדוטרכאלית היא לעתים קרובות דרישה בסיסית למחקר תרגומי במודלים חזיריים עבור התערבויות שונות הדורשות נתיב אוויר מאובטח או לחצי אוורור גבוהים. אינטובציה אנדוטרכאלית היא מיומנות מאתגרת, הדורשת מספר מינימלי של אינטובציות אנדוטרכאליות מוצלחות כדי להשיג שיעור הצלחה גבוה בתנאים אופטימליים, אשר לעתים קרובות בלתי ניתן להשגה עבור חוקרים שאינם מרדימים. בשל האנטומיה הספציפית של דרכי הנשימה החזיריות, בדרך כלל ניתן להניח נתיב אוויר קשה. חוסר האפשרות ליצור נתיב אוויר בטוח עלול לגרום לפציעה, תופעות לוואי או מוות של חיית המעבדה. באמצעות גישת הערכה פרוספקטיבית, אקראית ומבוקרת, הוכח כי אינטובציה אנדוטרכאלית בסיוע סיבים אופטיים אורכת זמן רב יותר, אך יש לה שיעור הצלחה גבוה יותר במעבר ראשון מאשר אינטובציה קונבנציונלית מבלי לגרום לירידות רלוונטיות קלינית בריווי חמצן. מודל זה מציג משטר סטנדרטי לאינטובציה אנדוטרכאלית מונחית אנדוסקופית, המספקת נתיב אוויר מאובטח, במיוחד עבור חוקרים שאינם מנוסים בטכניקה של אינטובציה אנדוטרכאלית באמצעות לרינגוסקופיה ישירה. הליך זה צפוי למזער את סבלם של בעלי חיים ואובדן מיותר של בעלי חיים.
Introduction
אינטובציה אנדוטרכאלית היא לעתים קרובות דרישה בסיסית למחקר תרגומי במודלים חזיריים עבור התערבויות שונות הדורשות נתיב אוויר מאובטח או לחצי אוורור גבוהים (כגון אוורור במהלך החייאה לב-ריאה1 או תסמונת מצוקה נשימתית חריפה2) או דורשות שזרימת הדם במוח לא תיפגע באמצעות דחיסה פנימית על ידי מכשירי דרכי נשימה סופרגלוטיים3 אשר מופצים מדי פעם כחלופות בהקשר של נתיב אוויר קשה צפוי בחזירים4,5.,
בעוד פיזיולוגיית הריאות של חזירים מראה תכונות דומות לזו של בני אדם6, אבטחת נתיב האוויר היא לפעמים קשה יותר באופן משמעותי7 בשל הבדלים ספציפיים באנטומיה orotracheal חזיר. לחוטם של חזיר יש פתח צר עם לשון גדולה מאוד, הגרון נייד מאוד, והאפיגלוטיס גדול יחסית, עם קצה חופשי המשתרע עד החיך הרך. באופן קאודלי, הגרון יוצר זווית אטומה עם קנה הנשימה. הסחוסים האריטנואידים גדולים8. החלק הצר ביותר של נתיב האוויר נמצא ברמה תת-גלוטית9, בדומה לאנטומיה של דרכי הנשימה של ילדיםבני 10. מכיוון שהגרון בחזירים נייד מאוד, קיים סיכון שקצה הצינור האנדוטרכאלי יעבור דרך מיתרי הקול, אך הגרון יזוז רק באופן קאודלי עד כמה סנטימטרים, מה שעלול להיחשב בטעות לאינטובציהנכונה 8,11. בנוסף, אינטובציה של הוושט היא סיכון נפוץ כאשר מתמודדים עם ניהול דרכי נשימה חזיריות12.
שיעורי אינטובציות אנדוטרכאליות קשות או בלתי אפשריות עם השפעה שלילית מקבילה על הניסוי או תמותה מוקדמת לא תועדו באופן שיטתי, אך פורסמו מספר דיווחי מקרה13,14. בבני אדם, קיימת אפשרות להשתמש באנדוסקופ אינטובציה גמיש בהקשר של אינטובציה קונבנציונלית קשה באופן בלתי צפוי15. אינטובציות שווא שונות מקדימות לעתים קרובות אמצעי זה. ניסיונות אינטובציה חוזרים ונשנים אלה קשורים לתופעות לוואי בבני אדם16,17, במיוחד סיבוכים בדרכי הנשימה 18. אירועים כאלה מזיקים בחיות ניסוי, שכן במקרה הפשוט ביותר הם מייצגים משתנה מבלבל בניסוי; במקרה הגרוע ביותר, הם יכולים להוביל לאובדן מיותר של החיה.
המחקר הנוכחי פיתח מודל המבוסס על הקווים המנחים לניהול דרכי נשימה קשות צפויות בבני אדם 15,19,20,21,22,23,24. בעבר, טכניקה דומה תוארה ללימוד אינטובציה של סיבים אופטיים במחקרים בבני אדם25,26. הפרוטוקול המוצג בדו"ח זה נועד לספק מודל אינטובציה סטנדרטי וקל להסתגלות המאפשר גם למומחים שאינם בדרכי הנשימה לבצע אינטובציה אנדוטרכאלית מוצלחת ובטוחה בחזירים.
Protocol
הניסויים בפרוטוקול זה אושרו על ידי הוועדה הממלכתית והמוסדית לטיפול בבעלי חיים (Landesuntersuchungsamt Rheinland-Pfalz, קובלנץ, גרמניה; אישור מס' G20-1-135). הניסויים נערכו בהתאם להנחיות ARRIVE. בסך הכל, 10 חזירים זכרים מורדמים (Sus scrofa domestica) עם משקל ממוצע של 30 ק"ג ± 2 ק"ג וגיל 12-16 שבועות שימשו במחקר הנוכחי.
1. הכנת בעלי חיים
- שמרו על סביבה נורמלית עבור בעלי החיים כדי למזער את הלחץ. הימנעו ממזון 6 שעות לפני הניסוי המתוכנן כדי להפחית את הסיכון לשאיפה, אך אפשרו גישה למים.
- הרגיעו את החזירים בזריקה משולבת של מידזולם (0.5 מ"ג/ק"ג) ואזפרון (2-3 מ"ג/ק"ג) (ראו טבלת חומרים) בשריר הגלוטאלי או בצוואר באמצעות מחט (20 גרם) להזרקה תוך שרירית. השאירו את בעלי החיים ללא הפרעה עד שההרגעה נכנסת (15-20 דקות).
הערה: בהתאם לתקנות לאומיות, מתן חומרי הרגעה עשוי להיות כפוף לבדיקה ועשוי לדרוש או לא לדרוש פיקוח של וטרינר מיומן. יש להתייעץ עם הרשויות המקומיות לפני תכנון הניסויים. - להעביר את בעלי החיים המורדמים מהאורוות למעבדה. זמן ההובלה לא יעלה על זמן הרגעה מספיק (כאן, 30-60 דקות). ודא שימור חום מספיק, כך החיה לא מקבל היפותרמי (כלומר, מתחת 38 ° C), כגון על ידי כיסוי הגוף עם שמיכה בהתאם לטמפרטורה בחוץ.
- באמצעות חיישן (ראה טבלת חומרים) המוצמד לאוזן או לזנב, נטר את ריווי החמצן ההיקפי (SpO2).
- יש לחטא את העור בחומר חיטוי (אלכוהולי) לפני החדרת צינורית וריד היקפית (22 גרם) לווריד האוזן. רססו את האזור, נגבו פעם אחת, ואז רססו שוב, והניחו לחומר החיטוי להתייבש. הדקו את צינורית האוזן בעזרת פלסטר (ראו טבלת חומרים).
2. הרדמה ואוורור מכני
- ניהול שיכוך כאבים באמצעות הזרקה תוך ורידית של 4 מיקרוגרם / ק"ג פנטניל. יש להשרות הרדמה עם הזרקה תוך ורידית של 3 מ"ג/ק"ג פרופופול (ראה טבלת חומרים).
הערה: בשל יישום הבולוס, התרופה מציפה במהירות לתוך התא הפעיל, מתן התחלה מהירה של הרדמה עמוקה. - הניחו את החזיר על אלונקה במצב שכיבה וקיבעו אותו בתחבושות. יש למרוח מרפה שרירים באמצעות הזרקה תוך ורידית של 0.5 מ"ג/ק"ג אטרקוריום (ראו טבלת חומרים).
- התחילו מיד באוורור לא פולשני באמצעות מסכת אוורור לכלב (ראו טבלת חומרים) או דגמים דומים. כדי להבטיח התאמה הדוקה של המסכה, הניחו את ההבלטה האזנית ואת האגודלים של שתי הידיים על גבי המסכה תוך ביצוע דחיפת לסת עם האצבעות הנותרות.
הערה: פרמטרי אוורור: FiO 2 (מקטע חמצן השראתי) = 100%, לחץ שיא השראתי = <20 ס"מ ג' 2 0, קצב נשימה= 18-20 נשימות לדקה, PEEP (לחץ חיובי בסוף התוקף) = 5 ס"מ ג'2 0. - שמור על הרדמה באמצעות עירוי מתמשך של 0.1-0.2 מ"ג / ק"ג / שעה של פנטניל ו 8-12 מ"ג / ק"ג / שעה של פרופופול. התחילו להחדיר 5 מ"ל/ק"ג/שעה של תמיסת אלקטרוליטים מאוזנת (ראו טבלת חומרים) ברציפות. כל הזמן לשמור על עומק מספיק של הרדמה.
הערה: פרמטרים חלופיים לכך הם היעדר תנועה, היעדר מאמצי נשימה משלו לאחר אינטובציה, והיעדר עלייה פתאומית בקצב הלב. במידת האפשר, הימנעו מהרפיית שרירים קבועה כדי לאפשר תגובות מוטוריות כסימן לעומק לא מספיק של הרדמה.
3. אינטובציה אנדוטרכאלית
- יש עוזר לעמוד בצד שמאל של הראש. בקש מידו השמאלית של העוזר לפתוח את הפה ולצבוט את הלשון החוצה ולהשאיר עם דחיסה. בקש מהעוזר ללחוץ כלפי מטה על השפה העליונה הימנית עם האצבע המורה הימנית כדי לספק פתיחת פה טובה יותר.
- בצע laryngoscopy ישיר. לשם כך, הכנס את הלרינגוסקופ (ראה טבלת חומרים) לצד ימין של הפה ודחוף אותו קדימה תוך דחיפת הלשון שמאלה. מקדמים את קצה הלרינגוסקופ עד שהוא נח בוקולה האפיגלוטית.
הערה: האפיגלוטיס בדרך כלל מטשטש את הגלוטיס על ידי היצמדות לחיך הרך. - דוחפים בזהירות את האפיגלוטיס הצידה בעזרת חוט מנחה צינור (ראו טבלת חומרים) בתנועת גריפה עדינה משקע הפיריפורם הימני שמאלה לאורך החיך הרך.
- העבר את ידית הלרינגוסקופ לעוזר כדי לתקן אותו במצב הנוכחי.
- עכשיו, קח את אנדוסקופ אינטובציה גמיש שעליו כבר הותקן צינור אנדוטרכאלי וזה מחובר לצג וידאו. הכנס את האנדוסקופ דרך הפה וקדם אותו על בסיס הלשון עד גלוטיס הוא דמיין.
הערה: כדי למנוע ערפול של המצלמה, מומלץ להשתמש מראש בחומרים מונעי ערפל (ראה טבלת חומרים). - מקדמים את האנדוסקופ בין רצועות הקול לתוך קנה הנשימה. לאשר את האנטומיה של קנה הנשימה על ידי זיהוי חזותי של טבעות סחוס ואת pars membranacea. מקדמים את האנדוסקופ עד שהוא נח מעל הקרינה. נסו לא לגעת ברירית הרגישה עם קצה האנדוסקופ כדי למנוע נפיחות ודימום.
- תוך שמירה על מיקום האנדוסקופ, מקדמים את הצינור האנדוטרכאלי עד שהוא הופך גלוי בתמונת המצלמה.
הערה: אם לא ניתן לקדם את הצינור האנדוטרכאלי דרך המישור הגלוטי, קיימת אפשרות שהוא נתפס בסחוס האריטנואידי. במקרה זה, יש למשוך את הצינור האנדוטרכאלי 1 ס"מ ולסובב אותו ב -90 מעלות לפני שהוא מתקדם שוב בעדינות. במידת הצורך, תמרון זה יכול לחזור על עצמו. קליברים דומים של אינטובציה גמישה, אנדוסקופ וצינור אנדוטרכאלי יכולים למזער את הסיכון להתרחשות בעיה זו. אם לא ניתן לקדם את הצינור האנדוטרכאלי למרות תמרון זה, סביר להניח שלא ניתן לעבור את הצרות התת-גלוטית - החלק הצר ביותר של הגרון החזירי. במקרה זה, יש לבחור גודל צינור אנדוטרכאלי קטן יותר. צינורות אנדוטרכאליים רגילים הזמינים מסחרית בגדלים 6.5 ס"מ או 7.0 ס"מ ID, אמורים להיות מסוגלים לעבור את הגלוטיס כל עוד אין הפרעות אנטומיות. דרישות גודל הצינור האנדוטרכאלי משתנות בהתאם לגודל החזרזיר ולגזע. - משוך את אנדוסקופ האינטובציה הגמיש תוך שמירה על מיקום הצינור האנדוטרכאלי.
- באמצעות מזרק 10 מ"ל, לנפח את השרוול עם 10 מ"ל של אוויר. שלוט בלחץ השרוול באמצעות מנהל שרוול (ערך יעד: 30 cmH2O, ראה טבלת חומרים).
- ודא את המיקום הנכון של הצינור האנדוטרכאלי ואוורור נאות על ידי נשיפה תקופתית וסדירה של פחמן דו חמצני באמצעות קפנוגרפיה24 ואוורור דו צדדי באמצעות auscultation15.
- התחל אוורור מכני לאחר חיבור הצינור עם מאוורר (PEEP = 5 cmH 2 O, קצב נשימה = משתנה כדי להשיג CO 2 של <6 kPa, בדרך כלל 30-50 דקות−1, FiO 2 = 0.4, I:E (יחס השראה לתפוגה) = 1:2, נפח גאות = 6-8 מ"ל / ק"ג).
- להרחיב את הניטור (למשל, קביעת מדידת לחץ דם תוך עורקי, התקנת קטטר ורידי מרכזי או עורקי ריאה27) או להמשיך בהתערבות.
הערה: בהתאם לשאלת הניסויים הנוספים, הגדר ערכי גבול עבור הפרמטרים החיוניים ואפשרויות ההתערבות וקבע את הניטור בהתאם בפרוטוקול המחקר.
תוצאות
אינטובציה אנדוטרכאלית בוצעה על 10 חזירים זכרים (בגילאי 12-16 שבועות, משקל 30 ק"ג ± 3 ק"ג) במסגרת מחקר פרוספקטיבית, אקראית ומבוקרת. החזירים חולקו באופן אקראי לשתי קבוצות: הקבוצה השנייה עברה אינטובציה לרינגוסקופית קונבנציונלית (קבוצת CI), והקבוצה השנייה קיבלה אינטובציה בסיוע אנדוסקופ אינטובצ...
Discussion
במחקרים קודמים, קבוצת המחקר שלנו כבר תיארה פרטים ספציפיים לגבי היתרונות התרגומי של מודל חזירי 2,27,32,33. באופן כללי, הפחתת רמת הלחץ של בעל החיים וכאב מיותר צריכה להיות חלק בלתי נפרד מכל פרוטוקול מחקר והיא בעלת חשיבות עליונ?...
Disclosures
אנדוסקופ האינטובציה הגמיש ואביזריו, סופקו ללא תנאי על ידי היצרן למטרות מחקר בלבד. המחברים מצהירים כי אין עוד ניגודי עניינים כספיים או אחרים.
Acknowledgements
המחברים רוצים להודות לדאגמר דירבונסקיס על התמיכה הטכנית המצוינת שלה.
Materials
| Name | Company | Catalog Number | Comments |
| Ambu aScope Regular | Ambu GmbH, Medizinprodukte, Bad Nauheim, Germany | Disposable fiber optic outer diameter 5 mm | |
| Ambu aView Monitor | Ambu GmbH, Medizinprodukte, Bad Nauheim, Germany | monitor | |
| Atracurium Hikma 50 mg/5mL | Hikma Pharma GmbH, Martinsried | atracurium | |
| Azaperone (Stresnil) 40mg/mL | Lilly Deutschland GmbH, Bad Homburg, Germany | azaperone | |
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy, AB Helsingborg, Schweden | 3-way-stopcock | |
| BD Microlance 3 20 G | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | cannula | |
| Curafix i.v. classics | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Cannula retention dressing | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| IBM SPSS Statistics for Windows, Version 20 | IBM SPSS Statistics for Windows, Version 20.0. Armonk, NY: IBM Corp.) | Statistical software | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland, GmbH | perfusor line | |
| Intrafix Primeline | B. Braun Melsungen AG, Melsungen, Germany | Infusion line | |
| JOZA Einmal Nitril Untersuchungshandschuhe | JOZA, München, Germany | disposable gloves | |
| Laryngoscope, 45.48.50, KL 2000 | Medicon | Laryngoscope handle | |
| Littmann Classic III Stethoscope | 3M Deutschland GmbH, Neuss, Germany | stethoscope | |
| Luer Lock | B.Braun Melsungen AG, Germany | ||
| Maimed Vlieskompresse | Maimed GmbH, Neuenkirchen, Germany | Fleece compress to fix the tongue | |
| Masimo LNCS Adtx SpO2 sensor | Masimo Corporation Irvine, Ca 92618 USA | saturation clip for the tail | |
| Masimo LNCS TC-I SpO2 ear clip sensor | Masimo Corporation Irvine, Ca 92618 USA | Saturation clip for the ear | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Midazolam 15 mg/3 mL | Hameln Pharma GmbH, Hameln, Germany | midazolam | |
| Midmark Canine Mask Small Plastic with Diaphragm FRSCM-0005 | Midmark Corp., Dayton, Ohio, USA | dog ventilation mask | |
| Octeniderm farblos | Schülke & Mayr GmbH, Nordenstedt, Germany | Alcoholic disinfectant | |
| Original Perfusor syringe 50 mL | B.Braun Melsungen AG, Germany | perfusor syringe | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| Propofol 2% 20 mg/mL (50 mL flasks) | Fresenius, Kabi Deutschland, GmbH | propofol | |
| RÜSCH Führungsstab für Endotrachealtubus (ID 5.6 mm) | Teleflex Medical Sdn. Bhd, Malaysia | PVC coated tube guiding wire | |
| Rüschelit Super Safety Clear >ID 6/6.5 /7.0 mm | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Stainless Macintosh Größe 4 | Welch Allyn69604 | blade for laryngoscope | |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | Balanced electrolyte solution | |
| Ultrastop Antibeschlagmittel bottle with dropper 25 mL | Sigmapharm Arzneimittel GmbH, Wien, Austria | Antifog agent | |
| Vasofix Safety 22 G-16 G | B.Braun Melsungen AG, Germany | venous catheter | |
| VBM Cuff Manometer | VBM Medizintechnik GmbH, Sulz a.N., Germany | cuff pressure gauge | |
| Zelette | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Tissue swab |
References
- Kleinman, M. E., Oh, W., Stonestreet, B. S. Comparison of intravenous and endotracheal epinephrine during cardiopulmonary resuscitation in newborn piglets. Critical Care Medicine. 27 (12), 2748-2754 (1999).
- Rissel, R., et al. Bronchoalveolar lavage and oleic acid-injection in pigs as a double-hit model for acute respiratory distress syndrome (ARDS). Journal of Visualized Experiments. (159), e61358 (2020).
- Segal, N., et al. Impairment of carotid artery blood flow by supraglottic airway use in a swine model of cardiac arrest. Resuscitation. 83 (8), 1025-1030 (2012).
- Goldmann, K., Kalinowski, M., Kraft, S. Airway management under general anaesthesia in pigs using the LMA-ProSeal: A pilot study. Veterinary Anaesthesia and Analgesia. 32 (5), 308-313 (2005).
- Wemyss-Holden, S. A., Porter, K. J., Baxter, P., Rudkin, G. E., Maddern, G. J. The laryngeal mask airway in experimental pig anaesthesia. Lab Animal. 33 (1), 30-34 (1999).
- Kobayashi, E., Hishikawa, S., Teratani, T., Lefor, A. T. The pig as a model for translational research: overview of porcine animal models at Jichi Medical University. Transplantation Research. 1 (1), 8 (2012).
- Judge, E. P., et al. Anatomy and bronchoscopy of the porcine lung. A model for translational respiratory medicine. American Journal of Respiratory Cell and Molecular Biology. 51 (3), 334-343 (2014).
- Dondelinger, R. F., et al. Relevant radiological anatomy of the pig as a training model in interventional radiology. European Radiology. 8 (7), 1254-1273 (1998).
- Nickel, R., Schummer, A., Seiferle, E. . Lehrbuch der Anatomie der Haustiere, Band I: Bewegungsapparat. , (2003).
- Wani, T. M., Rafiq, M., Akhter, N., AlGhamdi, F. S., Tobias, J. D. Upper airway in infants-A computed tomography-based analysis. Paediatric Anaesthesia. 27 (5), 501-505 (2017).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Ettrup, K. S., et al. Basic surgical techniques in the Göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. Journal of Visualized Experiments. (52), e2652 (2011).
- Steinbacher, R., von Ritgen, S., Moens, Y. P. S. Laryngeal perforation during a standard intubation procedure in a pig. Laboratory Animals. 46 (3), 261-263 (2012).
- Iliff-Sizemore, S. A., Chrisp, C. E., Rush, H. G. Peritracheolaryngeal abscess: An iatrogenic complication of endotracheal intubation in swine. Laboratory Animal Science. 39 (5), 455-458 (1989).
- Piepho, T., et al. S1 guidelines on airway management. Der Anaesthesist. 64 (11), 859-873 (2015).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesthesia & Analgesia. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Annals of Emergency Medicine. 60 (6), 749-754 (2012).
- Martin, L. D., Mhyre, J. M., Shanks, A. M., Tremper, K. K., Kheterpal, S. 3,423 emergency tracheal intubations at a university hospital: airway outcomes and complications. Anesthesiology. 114 (1), 42-48 (2011).
- Ahmad, I., et al. Difficult Airway Society guidelines for awake tracheal intubation (ATI) in adults. Anaesthesia. 75 (4), 509-528 (2020).
- Frerk, C., et al. Difficult Airway Society 2015 guidelines for management of unanticipated difficult intubation in adults. British Journal of Anaesthesia. 115 (6), 827-848 (2015).
- Cook, T. M., et al. Consensus guidelines for managing the airway in patients with COVID-19: Guidelines from the Difficult Airway Society, the Association of Anaesthetists the Intensive Care Society, the Faculty of Intensive Care Medicine and the Royal College of Anaesthetists. Anaesthesia. 75 (6), 785-799 (2020).
- Kornas, R. L., Owyang, C. G., Sakles, J. C., Foley, L. J., Mosier, J. M. Evaluation and management of the physiologically difficult airway: Consensus recommendations from Society for Airway Management. Anesthesia & Analgesia. 132 (2), 395-405 (2021).
- Higgs, A., et al. Guidelines for the management of tracheal intubation in critically ill adults. British Journal of Anaesthesia. 120 (2), 323-352 (2018).
- Apfelbaum, J. L., et al. American Society of Anesthesiologists Practice Guidelines for Management of the Difficult Airway. Anesthesiology. 136 (1), 31-81 (2022).
- Doyle, D. J. GlideScope-assisted fiberoptic intubation: A new airway teaching method. Anesthesiology. 101 (5), 1252 (2004).
- Lenhardt, R., et al. Is video laryngoscope-assisted flexible tracheoscope intubation feasible for patients with predicted difficult airway? A prospective, randomized clinical trial. Anesthesia & Analgesia. 118 (6), 1259-1265 (2014).
- Ruemmler, R., Ziebart, A., Garcia-Bardon, A., Kamuf, J., Hartmann, E. K. Standardized model of ventricular fibrillation and advanced cardiac life support in swine. Journal of Visualized Experiments. (155), e60707 (2020).
- Dodge, Y. Kolmogorov-Smirnov Test. The Concise Encyclopedia of Statistics. , 283-287 (2008).
- Ross, A., Willson, V. L. Independent Samples T-test. Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , 13-16 (2017).
- Mann, H. B., Whitney, D. R. On a test of whether one of two random variables is stochastically larger than the other. The Annals of Mathematical Statistics. 18 (1), 50-60 (1947).
- Spearman, C. The proof and measurement of association between two things. American Journal of Psychology. 100 (3-4), 441-471 (1987).
- Ziebart, A., et al. Standardized hemorrhagic shock induction guided by cerebral oximetry and extended hemodynamic monitoring in pigs. Journal of Visualized Experiments. (147), e59332 (2019).
- Kamuf, J., et al. Oleic acid-injection in pigs as a model for acute respiratory distress syndrome. Journal of Visualized Experiments. (140), e57783 (2018).
- Kurita, T., Kawashima, S., Morita, K., Nakajima, Y. Assessment of the benefits of head-up preoxygenation using near-infrared spectroscopy with pulse oximetry in a swine model. Journal of Clinical Monitoring and Computing. 35 (1), 155-163 (2021).
- Ruemmler, R., Ziebart, A., Ott, T., Dirvonskis, D., Hartmann, E. K. Flexible fibreoptic intubation in swine - Improvement for resident training and animal safety alike. BMC Anesthesiology. 20 (1), 206 (2020).
- Cook, J. A., Ramsay, C. R., Fayers, P. Using the literature to quantify the learning curve: A case study. International Journal of Technology Assessment in Health Care. 23 (2), 255-260 (2007).
- Buis, M. L., Maissan, I. M., Hoeks, S. E., Klimek, M., Stolker, R. J. Defining the learning curve for endotracheal intubation using direct laryngoscopy: A systematic review. Resuscitation. 99, 63-71 (2016).
- Knapp, S., et al. The assessment of four different methods to verify tracheal tube placement in the critical care setting. Anesthesia & Analgesia. 88 (4), 766-770 (1999).
- Schmidt, R. F. . Physiologie des Menschen. 31, (2010).
- Eberlein, C. M., Luther, I. S., Carpenter, T. A., Ramirez, L. D. First-pass success intubations using video laryngoscopy versus direct laryngoscopy: A retrospective prehospital ambulance service study. Air Medical Journal. 38 (5), 356-358 (2019).
- Lohse, J., Noppens, R. Awake video laryngoscopy - An alternative to awake fiberoptic intubation. Anasthesiologie, Intensivmedizin, Notfallmedizin, Schmerztherapie. 51 (11-12), 656-663 (2016).
- Johnson, C., Roberts, J. T. Clinical competence in the performance of fiberoptic laryngoscopy and endotracheal intubation: A study of resident instruction. Journal of Clinical Anesthesia. 1 (5), 344-349 (1989).
- Geovanini, G. R., Pinna, F. R., Prado, F. A., Tamaki, W. T., Marques, E. Standardization of anesthesia in swine for experimental cardiovascular surgeries. Revista Brasileira de Anestesiologia. 58 (4), 363-370 (2008).
Erratum
Formal Correction: Erratum: Endotracheal Intubation Using a Flexible Intubation Endoscope As a Standardized Model for Safe Airway Management in Swine
Posted by JoVE Editors on 4/03/2023. Citeable Link.
An erratum was issued for: Endotracheal Intubation Using a Flexible Intubation Endoscope As a Standardized Model for Safe Airway Management in Swine. The Protocol, Representative Results, and Discussion sections were updated.
In the Protocol, step 1.5 was updated from:
Disinfect the skin with a disinfectant (alcoholic) before inserting a peripheral vein cannula (22 G) into an ear vein. Spray the area, wipe once, then spray again, and allow the disinfectant to dry.
to:
Disinfect the skin with a disinfectant (alcoholic) before inserting a peripheral vein cannula (22 G) into an ear vein. Spray the area, wipe once, then spray again, and allow the disinfectant to dry. Secure the ear cannula with a band-aid (See Table of Materials).
In the Protocol, step 3.7 was updated from:
While maintaining the position of the endoscope, advance the endotracheal tube until it becomes visible in the camera image.
NOTE: If the endotracheal tube cannot be advanced through the glottic plane, there is a possibility that it has become caught on the arytenoid cartilage. In this case, the endotracheal tube must be withdrawn 1 cm and rotated by 90° before gently advancing again. If necessary, this maneuver can be repeated. Similar calibers of flexible intubation endoscope and endotracheal tube can minimize the risk of this issue occurring. If the endotracheal tube cannot be advanced despite this maneuver, it is likely that the subglottic narrowness-the narrowest part of the porcine larynx-cannot be passed. In this case, a smaller endotracheal tube size needs to be selected. Regular commercially available endotracheal tubes in sizes 6.5 cm or 7.0 cm ID should be able to pass the glottis as long as no anatomic abnormalities are present.
to:
While maintaining the position of the endoscope, advance the endotracheal tube until it becomes visible in the camera image.
NOTE: If the endotracheal tube cannot be advanced through the glottic plane, there is a possibility that it has become caught on the arytenoid cartilage. In this case, the endotracheal tube must be withdrawn 1 cm and rotated by 90° before gently advancing again. If necessary, this maneuver can be repeated. Similar calibers of flexible intubation endoscope and endotracheal tube can minimize the risk of this issue occurring. If the endotracheal tube cannot be advanced despite this maneuver, it is likely that the subglottic narrowness-the narrowest part of the porcine larynx-cannot be passed. In this case, a smaller endotracheal tube size needs to be selected. Regular commercially available endotracheal tubes in sizes 6.5 cm or 7.0 cm ID should be able to pass the glottis as long as no anatomic abnormalities are present. Endotracheal tube size requirements vary depending on the piglet size and breed.
In the Representative Results, the sixth paragraph was updated from:
Statistical analyses were performed using commercially available software (see Table of Materials). Normal distribution was examined using the Kolmogorov-Smirnoff test28. If a normal distribution was determined, group differences were analyzed using t-tests of independent samples29 or the Mann-Whitney U test30 for the non-parametric version. Data are presented as mean (± standard deviation). Correlations of ordinal-scale data were examined using Spearman's correlation coefficient31. A significance level of p < 0.05 was assumed.
to:
Statistical analyses were performed using commercially available software (see Table of Materials). Normal distribution was examined using the Kolmogorov-Smirnoff test28. If a normal distribution was determined, group differences were analyzed using t-tests of independent samples29 or the Mann-Whitney U test30 for the non-parametric version. Data are presented as mean (± standard deviation). Correlations of ordinal-scale data were examined using Spearman's correlation coefficient31. A significance level of p < 0.05 was assumed. All tests were performed with exploratory intention; therefore p-values are descriptive. Nevertheless, p < 0.05 was accepted as indicative of statistical significance.
In the Representative Results, the legend for figure 1 was updated from:
Figure 1: Number of intubation attempts in group comparison. For the group that was intubated using a flexible intubation endoscope, every intubation attempt was successful; in the group that was conventionally intubated, it took an average of 1.4 attempts before the endotracheal tube could be placed correctly. Error bars show the standard deviation. Please click here to view a larger version of this figure.
to:
Figure 1: Number of intubation attempts in group comparison. For the group that was intubated using a flexible intubation endoscope, every intubation attempt was successful; in the group that was conventionally intubated, it took an average of 1.4 attempts before the endotracheal tube could be placed correctly. Error bars show the standard deviation. n = 5 (for each group). Please click here to view a larger version of this figure.
In the Representative Results, figure 2 was updated from:
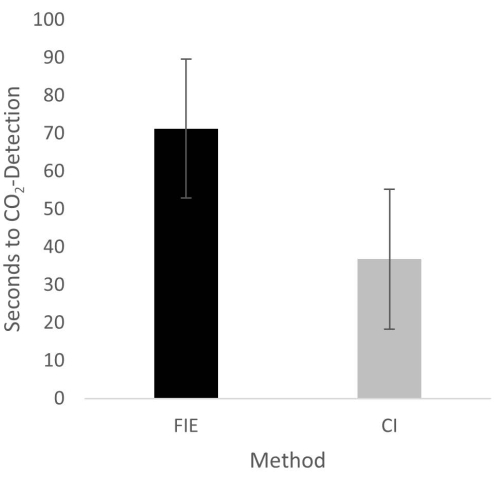
Figure 2: Time until CO2 detection in group comparison. For the group that was intubated using a flexible intubation endoscope, it took significantly longer until end-tidal CO2 could be detected, depicted as mean and standard deviation. Please click here to view a larger version of this figure.
to:
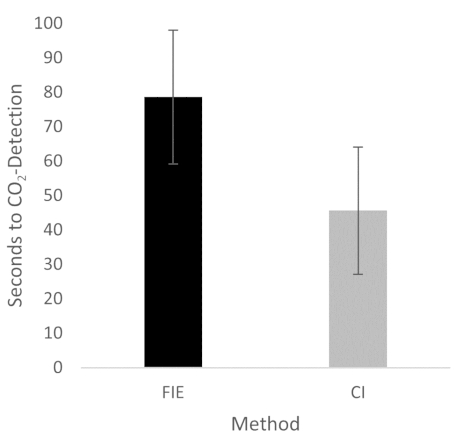
Figure 2: Time until CO2 detection in group comparison. For the group that was intubated using a flexible intubation endoscope, it took significantly longer until end-tidal CO2 could be detected, depicted as mean and standard deviation. n = 5 (for each group). Please click here to view a larger version of this figure.
In the Discussion, the fifth paragraph was updated from:
The increased duration had no clinical significance in this cohort. At no time was the termination criterion-a saturation of less than 93%-reached. This is shown in the results because a procedure change was unnecessary at any time. Prior adequate mask ventilation is a critical step to allow sufficient time for fiberoptic endotracheal tube placement to avoid rapid desaturation34. These results are consistent with previous studies comparing conventional intubation and endoscopically assisted intubations with inexperienced providers35.
to:
The increased duration had no clinical significance in this cohort. At no time was the termination criterion-a saturation of less than 93%-reached. This is shown in the results because a procedure change was unnecessary at any time. Prior adequate mask ventilation is a critical step to allow sufficient time for fiberoptic endotracheal tube placement to avoid rapid desaturation34. These results are consistent with previous studies comparing conventional intubation and endoscopically assisted intubations with inexperienced providers35. We attribute the prolonged duration of fiberoptic intubation to the fact that one must first reorient again after insertion, whereas with conventional intubation, one retains a view of the glottis. It is also important to avoid contact with the mucosa with the flexible intubation endoscope during advancement. This requires occasional corrective maneuvers. Last but not least, after successful placement, retraction of the relatively long endoscope is required, which increases the time to CO2 detection slightly.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved