Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Intubation endotrachéale utilisant un endoscope d’intubation flexible comme modèle normalisé pour la gestion sécuritaire des voies respiratoires chez les porcs
Dans cet article
Erratum Notice
Résumé
L’utilisation de porcs dans la recherche a augmenté ces dernières années. Néanmoins, les porcs sont caractérisés par une anatomie difficile des voies respiratoires. En démontrant comment effectuer une intubation endotrachéale guidée par endoscopie, le présent protocole vise à accroître davantage la sécurité des animaux de laboratoire afin d’éviter la souffrance animale et la mort inutile.
Résumé
L’intubation endotrachéale est souvent une exigence de base pour la recherche translationnelle dans des modèles porcins pour diverses interventions qui nécessitent une voie respiratoire sécurisée ou des pressions de ventilation élevées. L’intubation endotrachéale est une compétence difficile, nécessitant un nombre minimum d’intubations endotrachéales réussies pour atteindre un taux de réussite élevé dans des conditions optimales, ce qui est souvent irréalisable pour les chercheurs non anesthésiologistes. En raison de l’anatomie spécifique des voies respiratoires porcines, on peut généralement supposer une voie respiratoire difficile. L’impossibilité d’établir une voie aérienne sûre peut entraîner des blessures, des événements indésirables ou la mort de l’animal de laboratoire. En utilisant une approche d’évaluation prospective, randomisée et contrôlée, il a été démontré que l’intubation endotrachéale assistée par fibre optique prend plus de temps, mais a un taux de réussite de premier passage plus élevé que l’intubation conventionnelle sans provoquer de baisses cliniquement pertinentes de la saturation en oxygène. Ce modèle présente un schéma posologique normalisé pour l’intubation endotrachéale guidée par endoscopie, fournissant une voie respiratoire sécurisée, en particulier pour les chercheurs qui sont inexpérimentés dans la technique d’intubation endotrachéale par laryngoscopie directe. Cette procédure devrait réduire au minimum la souffrance animale et les pertes inutiles d’animaux.
Introduction
L’intubation endotrachéale est souvent une exigence de base pour la recherche translationnelle dans des modèles porcins pour diverses interventions qui nécessitent des voies respiratoires sécurisées ou des pressions de ventilation élevées (comme la ventilation pendant la réanimation cardiorespiratoire1 ou le syndrome de détresse respiratoire aiguë2) ou qui exigent que le flux sanguin cérébral ne soit pas compromis par la compression interne par des dispositifs des voies respiratoires supraglottiques3 , qui sont parfois multipliés comme solutions de remplacement dans le contexte d’une difficulté anticipée des voies respiratoires chez les porcs 4,5.
Alors que la physiologie pulmonaire des porcs présente des caractéristiques similaires à celles des humains6, la sécurisation des voies respiratoires est parfois beaucoup plus difficile7 en raison de différences spécifiques dans l’anatomie orotrachéale porcine. Le museau d’un porc a une ouverture étroite avec une très grande langue, le larynx est extrêmement mobile et l’épiglotte est relativement grande, avec une extrémité libre qui s’étend jusqu’au palais mou. Caudally, le larynx forme un angle obtus avec la trachée. Les cartilages aryténoïdes sont gros8. La partie la plus étroite des voies respiratoires se trouve au niveau sous-glottique9, comparable à l’anatomie des voies respiratoires des enfants10. Comme le larynx chez le porc est très mobile, il y a un risque que l’extrémité du tube endotrachéal passe par les cordes vocales mais que le larynx ne soit déplacé caudale que de plusieurs centimètres maximum, ce qui peut être confondu avec une intubation correcte 8,11. De plus, l’intubation œsophagienne est un risque courant lorsqu’il s’agit de la gestion des voies respiratoires porcines12.
Les taux d’intubations endotrachéales difficiles ou impossibles avec un impact négatif correspondant sur l’expérience ou une mortalité précoce n’ont pas été systématiquement enregistrés, mais plusieurs rapports de cas ont été publiés13,14. Chez l’homme, il est possible d’utiliser un endoscope d’intubation flexible dans le contexte d’une intubation conventionnelle étonnamment difficile15. Diverses fausses intubations précèdent souvent cette mesure. Ces tentatives d’intubation répétées sont associées à des événements indésirables chez l’homme16,17, en particulier des complications des voies respiratoires 18. De tels événements sont délétères chez les animaux d’essai puisque, dans le cas le plus simple, ils représentent une variable de confusion dans l’expérience; Dans le pire des cas, ils peuvent entraîner la perte inutile de l’animal.
La présente étude a développé un modèle basé sur les lignes directrices pour la gestion difficile des voies respiratoires chez les humains 15,19,20,21,22,23,24. Auparavant, une technique similaire a été décrite pour l’apprentissage de l’intubation par fibre optique dans des études humaines25,26. Le protocole présenté dans ce rapport vise à fournir un modèle d’intubation normalisé et facile à adapter qui permet également aux non-spécialistes des voies respiratoires d’effectuer une intubation endotrachéale réussie et sûre chez les porcs.
Protocole
Les expériences de ce protocole ont été approuvées par le Comité national et institutionnel pour la protection des animaux (Landesuntersuchungsamt Rheinland-Pfalz, Coblence, Allemagne; approbation n° G20-1-135). Les expériences ont été menées conformément aux directives ARRIVE. Dans l’ensemble, 10 porcs mâles anesthésiés (Sus scrofa domestica) pesant en moyenne 30 kg ± 2 kg et âgés de 12 à 16 semaines ont été utilisés pour la présente étude.
1. Préparation des animaux
- Maintenez un environnement normal pour les animaux afin de minimiser le stress. Retenir la nourriture 6 h avant l’expérience prévue pour réduire le risque d’aspiration, mais permettre l’accès à l’eau.
- Sédater les porcs avec une injection combinée de midazolam (0,5 mg/kg) et d’azapérone (2-3 mg/kg) (voir le tableau des matières) dans le muscle fessier ou le cou avec une aiguille (20 g) pour injection intramusculaire. Laissez les animaux tranquilles jusqu’à ce que la sédation s’installe (15-20 min).
NOTE: Selon les réglementations nationales, l’administration d’agents sédatifs peut faire l’objet d’un examen minutieux et peut ou non nécessiter la supervision d’un vétérinaire qualifié. Consultez les autorités locales avant de planifier les expériences. - Transporter les animaux sous sédation des écuries au laboratoire. Le temps de transport ne doit pas dépasser le temps de sédation adéquat (ici, 30-60 min). Assurez-vous d’une rétention suffisante de la chaleur pour que l’animal ne devienne pas hypothermique (c.-à-d. en dessous de 38 °C), par exemple en recouvrant le corps d’une couverture en fonction de la température extérieure.
- À l’aide d’un capteur (voir le tableau des matériaux) fixé à l’oreille ou à la queue, surveillez la saturation périphérique en oxygène (SpO2).
- Désinfecter la peau avec un désinfectant (alcoolique) avant d’insérer une canule veineuse périphérique (22 G) dans une veine auriculaire. Vaporisez la zone, essuyez une fois, puis vaporisez à nouveau, et laissez le désinfectant sécher. Fixez la canule auriculaire avec un pansement (voir le tableau des matériaux).
2. Anesthésie et ventilation mécanique
- Administrer l’analgésie par injection intraveineuse de 4 μg/kg de fentanyl. Induire l’anesthésie par injection intraveineuse de 3 mg/kg de propofol (voir le tableau des matières).
REMARQUE: En raison de l’application du bolus, le médicament inonde rapidement le compartiment actif, fournissant un début rapide d’anesthésie profonde. - Placez le porc sur une civière en décubitus dorsal et fixez-le avec des bandages. Appliquer un relaxant musculaire par injection intraveineuse de 0,5 mg/kg d’atracurium (voir le tableau des matières).
- Commencez instantanément une ventilation non invasive à l’aide d’un masque de ventilation pour chien (voir le tableau des matériaux) ou de modèles similaires. Pour assurer un ajustement serré du masque, placez l’éminence thénar et les pouces des deux mains sur le masque tout en effectuant une poussée de la mâchoire avec les doigts restants.
NOTE: Paramètres de ventilation: FiO 2 (fraction inspiratoire d’oxygène) = 100%, pression inspiratoire de pointe = <20 cmH 2 0, fréquence respiratoire = 18-20 respirations / min, PEP (pression expiratoire positive) = 5 cmH2 0. - Maintenir l’anesthésie par perfusion continue de 0,1-0,2 mg/kg/h de fentanyl et de 8-12 mg/kg/h de propofol. Commencer à perfuser avec 5 mL/kg/h de solution électrolytique équilibrée (voir le tableau des matières) en continu. Maintenez constamment une profondeur d’anesthésie adéquate.
REMARQUE: Les paramètres de substitution pour cela sont l’absence de mouvement, le manque d’efforts respiratoires propres après l’intubation et l’absence d’une augmentation soudaine de la fréquence cardiaque. Si possible, évitez la relaxation musculaire permanente pour permettre des réactions motrices comme un signe de profondeur insuffisante de l’anesthésie.
3. Intubation endotrachéale
- Demandez à un assistant de se tenir sur le côté gauche de la tête. Demandez à la main gauche de l’assistant d’ouvrir la bouche et de pincer la langue vers l’extérieur et de la laisser avec une compresse. Demandez à l’assistant d’appuyer sur la lèvre supérieure droite avec l’index droit pour offrir une meilleure ouverture de la bouche.
- Effectuer une laryngoscopie directe. Pour ce faire, insérez le laryngoscope (voir Tableau des matériaux) dans le côté droit de la bouche et poussez-le vers l’avant tout en poussant la langue vers la gauche. Avancez la pointe du laryngoscope jusqu’à ce qu’elle repose dans la vallecule épiglotte.
REMARQUE: L’épiglotte obscurcit généralement la glotte en collant au palais mou. - Écartez délicatement l’épiglotte à l’aide d’un fil de guidage tubulaire (voir Tableau des matériaux) en effectuant un léger mouvement d’écoulement de l’évidement piriforme droit vers la gauche le long du palais mou.
- Passez la poignée du laryngoscope à l’assistant pour le fixer dans la position actuelle.
- Maintenant, prenez l’endoscope à intubation flexible sur lequel un tube endotrachéal a déjà été monté et qui est connecté à un moniteur vidéo. Insérez l’endoscope par voie orale et avancez-le sur la base de la langue jusqu’à ce que la glotte soit visualisée.
REMARQUE : Pour éviter la formation de buée de la caméra, l’application préalable d’agents antibuée (voir le tableau des matériaux) est recommandée. - Faire avancer l’endoscope entre les ligaments vocaux dans la trachée. Confirmer l’anatomie de la trachée en identifiant visuellement les anneaux cartilagineux et la pars membranacea. Faites avancer l’endoscope jusqu’à ce qu’il repose au-dessus de la carène. Essayez de ne pas toucher la muqueuse sensible avec l’extrémité de l’endoscope pour éviter l’enflure et les saignements.
- Tout en maintenant la position de l’endoscope, avancez le tube endotrachéal jusqu’à ce qu’il devienne visible sur l’image de la caméra.
REMARQUE: Si le tube endotrachéal ne peut pas être avancé à travers le plan glottique, il est possible qu’il se soit pris sur le cartilage aryténoïde. Dans ce cas, le tube endotrachéal doit être retiré de 1 cm et tourné de 90° avant d’avancer doucement à nouveau. Si nécessaire, cette manœuvre peut être répétée. Des calibres similaires d’endoscope à intubation flexible et de tube endotrachéal peuvent minimiser le risque que ce problème se produise. Si le tube endotrachéal ne peut pas être avancé malgré cette manœuvre, il est probable que l’étroitesse sous-glottique - la partie la plus étroite du larynx porcin - ne puisse pas être dépassée. Dans ce cas, une taille de tube endotrachéal plus petite doit être sélectionnée. Les tubes endotrachéaux réguliers disponibles dans le commerce dans des tailles 6,5 cm ou 7,0 cm ID devraient pouvoir passer la glotte tant qu’aucune anomalie anatomique n’est présente. Les exigences en matière de taille de sonde endotrachéale varient en fonction de la taille et de la race du porcelet. - Retirer l’endoscope d’intubation flexible tout en maintenant la position du tube endotrachéal.
- À l’aide d’une seringue de 10 mL, gonfler le brassard avec 10 mL d’air. Contrôlez la pression du brassard avec un gestionnaire de brassard (valeur cible : 30cmH2O, voir tableau des matériaux).
- Confirmer la mise en place correcte de la sonde endotrachéale et une ventilation adéquate par une expiration périodique et régulière du dioxyde de carbone par capnographie24 et une ventilation double face par auscultation15.
- Commencer la ventilation mécanique après avoir connecté le tube à un ventilateur (PEP = 5cmH2O, fréquence respiratoire = variable pour obtenir un CO 2 en fin de marée de <6 kPa, généralement 30-50 min−1, FiO 2 = 0,4, I:E (rapport inspiration/péripération) = 1:2, volume courant = 6-8 mL/kg).
- Élargir la surveillance (p. ex., établissement d’une mesure intra-artérielle de la pression artérielle, installation d’un cathéter artériel veineux ou pulmonaire central27) ou poursuivre l’intervention.
NOTE: En fonction de la question des expériences ultérieures, définir des valeurs limites pour les paramètres vitaux et les options d’intervention et établir la surveillance en conséquence dans le protocole d’étude.
Résultats
L’intubation endotrachéale a été réalisée sur 10 porcs mâles (âgés de 12 à 16 semaines, poids 30 kg ± 3 kg) dans le cadre d’une étude prospective, randomisée et contrôlée. Les porcs ont été randomisés en deux groupes : l’un était intubé par laryngoscopie conventionnelle (groupe IC) et l’autre groupe était intubé assisté par un endoscope à intubation flexible tel que décrit dans le protocole (groupe FIE). L’affectation de groupe a été faite en tirant des enveloppes scellées. L...
Discussion
Dans des études antérieures, notre groupe de recherche a déjà décrit des détails spécifiques concernant les avantages translationnels du modèle porcin 2,27,32,33. En règle générale, la réduction du niveau de stress de l’animal et de la douleur inutile devrait faire partie intégrante de tout protocole d’étude et est primordiale pour générer des données reproductibles de mani...
Déclarations de divulgation
L’endoscope à intubation flexible et ses accessoires ont été fournis sans condition par le fabricant à des fins de recherche uniquement. Les auteurs ne déclarent plus de conflits d’intérêts financiers ou autres.
Remerciements
Les auteurs tiennent à remercier Dagmar Dirvonskis pour son excellent soutien technique.
matériels
| Name | Company | Catalog Number | Comments |
| Ambu aScope Regular | Ambu GmbH, Medizinprodukte, Bad Nauheim, Germany | Disposable fiber optic outer diameter 5 mm | |
| Ambu aView Monitor | Ambu GmbH, Medizinprodukte, Bad Nauheim, Germany | monitor | |
| Atracurium Hikma 50 mg/5mL | Hikma Pharma GmbH, Martinsried | atracurium | |
| Azaperone (Stresnil) 40mg/mL | Lilly Deutschland GmbH, Bad Homburg, Germany | azaperone | |
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy, AB Helsingborg, Schweden | 3-way-stopcock | |
| BD Microlance 3 20 G | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | cannula | |
| Curafix i.v. classics | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Cannula retention dressing | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| IBM SPSS Statistics for Windows, Version 20 | IBM SPSS Statistics for Windows, Version 20.0. Armonk, NY: IBM Corp.) | Statistical software | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland, GmbH | perfusor line | |
| Intrafix Primeline | B. Braun Melsungen AG, Melsungen, Germany | Infusion line | |
| JOZA Einmal Nitril Untersuchungshandschuhe | JOZA, München, Germany | disposable gloves | |
| Laryngoscope, 45.48.50, KL 2000 | Medicon | Laryngoscope handle | |
| Littmann Classic III Stethoscope | 3M Deutschland GmbH, Neuss, Germany | stethoscope | |
| Luer Lock | B.Braun Melsungen AG, Germany | ||
| Maimed Vlieskompresse | Maimed GmbH, Neuenkirchen, Germany | Fleece compress to fix the tongue | |
| Masimo LNCS Adtx SpO2 sensor | Masimo Corporation Irvine, Ca 92618 USA | saturation clip for the tail | |
| Masimo LNCS TC-I SpO2 ear clip sensor | Masimo Corporation Irvine, Ca 92618 USA | Saturation clip for the ear | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Midazolam 15 mg/3 mL | Hameln Pharma GmbH, Hameln, Germany | midazolam | |
| Midmark Canine Mask Small Plastic with Diaphragm FRSCM-0005 | Midmark Corp., Dayton, Ohio, USA | dog ventilation mask | |
| Octeniderm farblos | Schülke & Mayr GmbH, Nordenstedt, Germany | Alcoholic disinfectant | |
| Original Perfusor syringe 50 mL | B.Braun Melsungen AG, Germany | perfusor syringe | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| Propofol 2% 20 mg/mL (50 mL flasks) | Fresenius, Kabi Deutschland, GmbH | propofol | |
| RÜSCH Führungsstab für Endotrachealtubus (ID 5.6 mm) | Teleflex Medical Sdn. Bhd, Malaysia | PVC coated tube guiding wire | |
| Rüschelit Super Safety Clear >ID 6/6.5 /7.0 mm | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Stainless Macintosh Größe 4 | Welch Allyn69604 | blade for laryngoscope | |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | Balanced electrolyte solution | |
| Ultrastop Antibeschlagmittel bottle with dropper 25 mL | Sigmapharm Arzneimittel GmbH, Wien, Austria | Antifog agent | |
| Vasofix Safety 22 G-16 G | B.Braun Melsungen AG, Germany | venous catheter | |
| VBM Cuff Manometer | VBM Medizintechnik GmbH, Sulz a.N., Germany | cuff pressure gauge | |
| Zelette | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Tissue swab |
Références
- Kleinman, M. E., Oh, W., Stonestreet, B. S. Comparison of intravenous and endotracheal epinephrine during cardiopulmonary resuscitation in newborn piglets. Critical Care Medicine. 27 (12), 2748-2754 (1999).
- Rissel, R., et al. Bronchoalveolar lavage and oleic acid-injection in pigs as a double-hit model for acute respiratory distress syndrome (ARDS). Journal of Visualized Experiments. (159), e61358 (2020).
- Segal, N., et al. Impairment of carotid artery blood flow by supraglottic airway use in a swine model of cardiac arrest. Resuscitation. 83 (8), 1025-1030 (2012).
- Goldmann, K., Kalinowski, M., Kraft, S. Airway management under general anaesthesia in pigs using the LMA-ProSeal: A pilot study. Veterinary Anaesthesia and Analgesia. 32 (5), 308-313 (2005).
- Wemyss-Holden, S. A., Porter, K. J., Baxter, P., Rudkin, G. E., Maddern, G. J. The laryngeal mask airway in experimental pig anaesthesia. Lab Animal. 33 (1), 30-34 (1999).
- Kobayashi, E., Hishikawa, S., Teratani, T., Lefor, A. T. The pig as a model for translational research: overview of porcine animal models at Jichi Medical University. Transplantation Research. 1 (1), 8 (2012).
- Judge, E. P., et al. Anatomy and bronchoscopy of the porcine lung. A model for translational respiratory medicine. American Journal of Respiratory Cell and Molecular Biology. 51 (3), 334-343 (2014).
- Dondelinger, R. F., et al. Relevant radiological anatomy of the pig as a training model in interventional radiology. European Radiology. 8 (7), 1254-1273 (1998).
- Nickel, R., Schummer, A., Seiferle, E. . Lehrbuch der Anatomie der Haustiere, Band I: Bewegungsapparat. , (2003).
- Wani, T. M., Rafiq, M., Akhter, N., AlGhamdi, F. S., Tobias, J. D. Upper airway in infants-A computed tomography-based analysis. Paediatric Anaesthesia. 27 (5), 501-505 (2017).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Ettrup, K. S., et al. Basic surgical techniques in the Göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. Journal of Visualized Experiments. (52), e2652 (2011).
- Steinbacher, R., von Ritgen, S., Moens, Y. P. S. Laryngeal perforation during a standard intubation procedure in a pig. Laboratory Animals. 46 (3), 261-263 (2012).
- Iliff-Sizemore, S. A., Chrisp, C. E., Rush, H. G. Peritracheolaryngeal abscess: An iatrogenic complication of endotracheal intubation in swine. Laboratory Animal Science. 39 (5), 455-458 (1989).
- Piepho, T., et al. S1 guidelines on airway management. Der Anaesthesist. 64 (11), 859-873 (2015).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesthesia & Analgesia. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Annals of Emergency Medicine. 60 (6), 749-754 (2012).
- Martin, L. D., Mhyre, J. M., Shanks, A. M., Tremper, K. K., Kheterpal, S. 3,423 emergency tracheal intubations at a university hospital: airway outcomes and complications. Anesthesiology. 114 (1), 42-48 (2011).
- Ahmad, I., et al. Difficult Airway Society guidelines for awake tracheal intubation (ATI) in adults. Anaesthesia. 75 (4), 509-528 (2020).
- Frerk, C., et al. Difficult Airway Society 2015 guidelines for management of unanticipated difficult intubation in adults. British Journal of Anaesthesia. 115 (6), 827-848 (2015).
- Cook, T. M., et al. Consensus guidelines for managing the airway in patients with COVID-19: Guidelines from the Difficult Airway Society, the Association of Anaesthetists the Intensive Care Society, the Faculty of Intensive Care Medicine and the Royal College of Anaesthetists. Anaesthesia. 75 (6), 785-799 (2020).
- Kornas, R. L., Owyang, C. G., Sakles, J. C., Foley, L. J., Mosier, J. M. Evaluation and management of the physiologically difficult airway: Consensus recommendations from Society for Airway Management. Anesthesia & Analgesia. 132 (2), 395-405 (2021).
- Higgs, A., et al. Guidelines for the management of tracheal intubation in critically ill adults. British Journal of Anaesthesia. 120 (2), 323-352 (2018).
- Apfelbaum, J. L., et al. American Society of Anesthesiologists Practice Guidelines for Management of the Difficult Airway. Anesthesiology. 136 (1), 31-81 (2022).
- Doyle, D. J. GlideScope-assisted fiberoptic intubation: A new airway teaching method. Anesthesiology. 101 (5), 1252 (2004).
- Lenhardt, R., et al. Is video laryngoscope-assisted flexible tracheoscope intubation feasible for patients with predicted difficult airway? A prospective, randomized clinical trial. Anesthesia & Analgesia. 118 (6), 1259-1265 (2014).
- Ruemmler, R., Ziebart, A., Garcia-Bardon, A., Kamuf, J., Hartmann, E. K. Standardized model of ventricular fibrillation and advanced cardiac life support in swine. Journal of Visualized Experiments. (155), e60707 (2020).
- Dodge, Y. Kolmogorov-Smirnov Test. The Concise Encyclopedia of Statistics. , 283-287 (2008).
- Ross, A., Willson, V. L. Independent Samples T-test. Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , 13-16 (2017).
- Mann, H. B., Whitney, D. R. On a test of whether one of two random variables is stochastically larger than the other. The Annals of Mathematical Statistics. 18 (1), 50-60 (1947).
- Spearman, C. The proof and measurement of association between two things. American Journal of Psychology. 100 (3-4), 441-471 (1987).
- Ziebart, A., et al. Standardized hemorrhagic shock induction guided by cerebral oximetry and extended hemodynamic monitoring in pigs. Journal of Visualized Experiments. (147), e59332 (2019).
- Kamuf, J., et al. Oleic acid-injection in pigs as a model for acute respiratory distress syndrome. Journal of Visualized Experiments. (140), e57783 (2018).
- Kurita, T., Kawashima, S., Morita, K., Nakajima, Y. Assessment of the benefits of head-up preoxygenation using near-infrared spectroscopy with pulse oximetry in a swine model. Journal of Clinical Monitoring and Computing. 35 (1), 155-163 (2021).
- Ruemmler, R., Ziebart, A., Ott, T., Dirvonskis, D., Hartmann, E. K. Flexible fibreoptic intubation in swine - Improvement for resident training and animal safety alike. BMC Anesthesiology. 20 (1), 206 (2020).
- Cook, J. A., Ramsay, C. R., Fayers, P. Using the literature to quantify the learning curve: A case study. International Journal of Technology Assessment in Health Care. 23 (2), 255-260 (2007).
- Buis, M. L., Maissan, I. M., Hoeks, S. E., Klimek, M., Stolker, R. J. Defining the learning curve for endotracheal intubation using direct laryngoscopy: A systematic review. Resuscitation. 99, 63-71 (2016).
- Knapp, S., et al. The assessment of four different methods to verify tracheal tube placement in the critical care setting. Anesthesia & Analgesia. 88 (4), 766-770 (1999).
- Schmidt, R. F. . Physiologie des Menschen. 31, (2010).
- Eberlein, C. M., Luther, I. S., Carpenter, T. A., Ramirez, L. D. First-pass success intubations using video laryngoscopy versus direct laryngoscopy: A retrospective prehospital ambulance service study. Air Medical Journal. 38 (5), 356-358 (2019).
- Lohse, J., Noppens, R. Awake video laryngoscopy - An alternative to awake fiberoptic intubation. Anasthesiologie, Intensivmedizin, Notfallmedizin, Schmerztherapie. 51 (11-12), 656-663 (2016).
- Johnson, C., Roberts, J. T. Clinical competence in the performance of fiberoptic laryngoscopy and endotracheal intubation: A study of resident instruction. Journal of Clinical Anesthesia. 1 (5), 344-349 (1989).
- Geovanini, G. R., Pinna, F. R., Prado, F. A., Tamaki, W. T., Marques, E. Standardization of anesthesia in swine for experimental cardiovascular surgeries. Revista Brasileira de Anestesiologia. 58 (4), 363-370 (2008).
Erratum
Formal Correction: Erratum: Endotracheal Intubation Using a Flexible Intubation Endoscope As a Standardized Model for Safe Airway Management in Swine
Posted by JoVE Editors on 4/03/2023. Citeable Link.
An erratum was issued for: Endotracheal Intubation Using a Flexible Intubation Endoscope As a Standardized Model for Safe Airway Management in Swine. The Protocol, Representative Results, and Discussion sections were updated.
In the Protocol, step 1.5 was updated from:
Disinfect the skin with a disinfectant (alcoholic) before inserting a peripheral vein cannula (22 G) into an ear vein. Spray the area, wipe once, then spray again, and allow the disinfectant to dry.
to:
Disinfect the skin with a disinfectant (alcoholic) before inserting a peripheral vein cannula (22 G) into an ear vein. Spray the area, wipe once, then spray again, and allow the disinfectant to dry. Secure the ear cannula with a band-aid (See Table of Materials).
In the Protocol, step 3.7 was updated from:
While maintaining the position of the endoscope, advance the endotracheal tube until it becomes visible in the camera image.
NOTE: If the endotracheal tube cannot be advanced through the glottic plane, there is a possibility that it has become caught on the arytenoid cartilage. In this case, the endotracheal tube must be withdrawn 1 cm and rotated by 90° before gently advancing again. If necessary, this maneuver can be repeated. Similar calibers of flexible intubation endoscope and endotracheal tube can minimize the risk of this issue occurring. If the endotracheal tube cannot be advanced despite this maneuver, it is likely that the subglottic narrowness-the narrowest part of the porcine larynx-cannot be passed. In this case, a smaller endotracheal tube size needs to be selected. Regular commercially available endotracheal tubes in sizes 6.5 cm or 7.0 cm ID should be able to pass the glottis as long as no anatomic abnormalities are present.
to:
While maintaining the position of the endoscope, advance the endotracheal tube until it becomes visible in the camera image.
NOTE: If the endotracheal tube cannot be advanced through the glottic plane, there is a possibility that it has become caught on the arytenoid cartilage. In this case, the endotracheal tube must be withdrawn 1 cm and rotated by 90° before gently advancing again. If necessary, this maneuver can be repeated. Similar calibers of flexible intubation endoscope and endotracheal tube can minimize the risk of this issue occurring. If the endotracheal tube cannot be advanced despite this maneuver, it is likely that the subglottic narrowness-the narrowest part of the porcine larynx-cannot be passed. In this case, a smaller endotracheal tube size needs to be selected. Regular commercially available endotracheal tubes in sizes 6.5 cm or 7.0 cm ID should be able to pass the glottis as long as no anatomic abnormalities are present. Endotracheal tube size requirements vary depending on the piglet size and breed.
In the Representative Results, the sixth paragraph was updated from:
Statistical analyses were performed using commercially available software (see Table of Materials). Normal distribution was examined using the Kolmogorov-Smirnoff test28. If a normal distribution was determined, group differences were analyzed using t-tests of independent samples29 or the Mann-Whitney U test30 for the non-parametric version. Data are presented as mean (± standard deviation). Correlations of ordinal-scale data were examined using Spearman's correlation coefficient31. A significance level of p < 0.05 was assumed.
to:
Statistical analyses were performed using commercially available software (see Table of Materials). Normal distribution was examined using the Kolmogorov-Smirnoff test28. If a normal distribution was determined, group differences were analyzed using t-tests of independent samples29 or the Mann-Whitney U test30 for the non-parametric version. Data are presented as mean (± standard deviation). Correlations of ordinal-scale data were examined using Spearman's correlation coefficient31. A significance level of p < 0.05 was assumed. All tests were performed with exploratory intention; therefore p-values are descriptive. Nevertheless, p < 0.05 was accepted as indicative of statistical significance.
In the Representative Results, the legend for figure 1 was updated from:
Figure 1: Number of intubation attempts in group comparison. For the group that was intubated using a flexible intubation endoscope, every intubation attempt was successful; in the group that was conventionally intubated, it took an average of 1.4 attempts before the endotracheal tube could be placed correctly. Error bars show the standard deviation. Please click here to view a larger version of this figure.
to:
Figure 1: Number of intubation attempts in group comparison. For the group that was intubated using a flexible intubation endoscope, every intubation attempt was successful; in the group that was conventionally intubated, it took an average of 1.4 attempts before the endotracheal tube could be placed correctly. Error bars show the standard deviation. n = 5 (for each group). Please click here to view a larger version of this figure.
In the Representative Results, figure 2 was updated from:
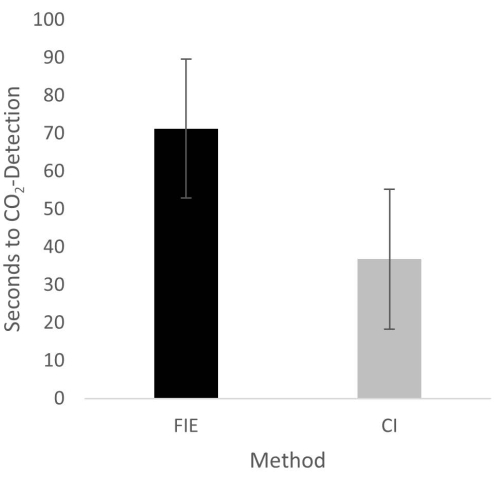
Figure 2: Time until CO2 detection in group comparison. For the group that was intubated using a flexible intubation endoscope, it took significantly longer until end-tidal CO2 could be detected, depicted as mean and standard deviation. Please click here to view a larger version of this figure.
to:
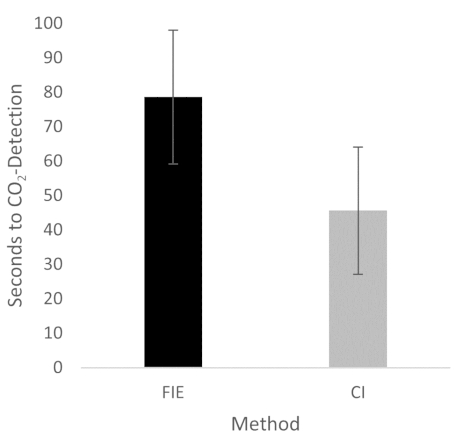
Figure 2: Time until CO2 detection in group comparison. For the group that was intubated using a flexible intubation endoscope, it took significantly longer until end-tidal CO2 could be detected, depicted as mean and standard deviation. n = 5 (for each group). Please click here to view a larger version of this figure.
In the Discussion, the fifth paragraph was updated from:
The increased duration had no clinical significance in this cohort. At no time was the termination criterion-a saturation of less than 93%-reached. This is shown in the results because a procedure change was unnecessary at any time. Prior adequate mask ventilation is a critical step to allow sufficient time for fiberoptic endotracheal tube placement to avoid rapid desaturation34. These results are consistent with previous studies comparing conventional intubation and endoscopically assisted intubations with inexperienced providers35.
to:
The increased duration had no clinical significance in this cohort. At no time was the termination criterion-a saturation of less than 93%-reached. This is shown in the results because a procedure change was unnecessary at any time. Prior adequate mask ventilation is a critical step to allow sufficient time for fiberoptic endotracheal tube placement to avoid rapid desaturation34. These results are consistent with previous studies comparing conventional intubation and endoscopically assisted intubations with inexperienced providers35. We attribute the prolonged duration of fiberoptic intubation to the fact that one must first reorient again after insertion, whereas with conventional intubation, one retains a view of the glottis. It is also important to avoid contact with the mucosa with the flexible intubation endoscope during advancement. This requires occasional corrective maneuvers. Last but not least, after successful placement, retraction of the relatively long endoscope is required, which increases the time to CO2 detection slightly.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon