Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Эндотрахеальная интубация с использованием гибкого интубационного эндоскопа в качестве стандартизированной модели безопасного управления дыхательными путями у свиней
В этой статье
Erratum Notice
Резюме
Использование свиней в исследованиях в последние годы возросло. Тем не менее, свиньи характеризуются сложной анатомией дыхательных путей. Демонстрируя, как выполнять эндоскопическую интубацию под эндоскопическим контролем, настоящий протокол направлен на дальнейшее повышение безопасности лабораторных животных, чтобы избежать страданий животных и ненужной смерти.
Аннотация
Эндотрахеальная интубация часто является основным требованием для трансляционных исследований на моделях свиней для различных вмешательств, требующих защищенных дыхательных путей или высокого вентиляционного давления. Эндотрахеальная интубация является сложным навыком, требующим минимального количества успешных эндотрахеальных интубаций для достижения высокого уровня успеха в оптимальных условиях, что часто недостижимо для исследователей, не являющихся анестезиологами. Из-за специфической анатомии дыхательных путей свиней обычно можно предположить затрудненные дыхательные пути. Невозможность установить безопасные дыхательные пути может привести к травме, нежелательным явлениям или смерти лабораторного животного. Используя проспективный, рандомизированный, контролируемый подход к оценке, было показано, что эндотрахеальная интубация с помощью волоконно-оптического волокна занимает больше времени, но имеет более высокий уровень успеха первого прохождения, чем обычная интубация, не вызывая клинически значимого падения насыщения кислородом. Эта модель представляет собой стандартизированный режим эндоскопической эндотрахеальной интубации, обеспечивающий безопасность дыхательных путей, особенно для исследователей, не имеющих опыта в технике эндотрахеальной интубации с помощью прямой ларингоскопии. Ожидается, что эта процедура сведет к минимуму страдания животных и ненужные потери животных.
Введение
Эндотрахеальная интубация часто является основным требованием для трансляционных исследований на моделях свиней для различных вмешательств, которые требуют защищенных дыхательных путей или высокого вентиляционного давления (например, вентиляции во время сердечно-легочной реанимации1 или острого респираторного дистресс-синдрома2) или требуют, чтобы мозговой кровоток не нарушался из-за внутреннего сжатия супраглоттическими дыхательными путями3 , которые иногда размножают в качестве альтернативы в контексте ожидаемого затрудненного проходимого дыхательного пути у свиней 4,5.
В то время как физиология легких свиней имеет сходные черты с человеческими6, обеспечение безопасности дыхательных путей иногда значительно сложнее7 из-за специфических различий в анатомии оротрахеи свиней. Морда свиньи имеет узкое отверстие с очень большим языком, гортань чрезвычайно подвижна, а надгортанник относительно большой, со свободным концом, который простирается до мягкого неба. Каудально гортань образует тупой угол с трахеей. Черпаловидные хрящи крупные8. Самая узкая часть дыхательных путей находится на подсвязочном уровне9, что сопоставимо с анатомией дыхательных путей детей10. Поскольку гортань у свиней очень подвижна, существует риск того, что конец эндотрахеальной трубки пройдет через голосовые связки, но гортань будет смещена каудально только на несколько сантиметров, что может быть ошибочно принято за правильную интубацию 8,11. Кроме того, интубация пищевода является распространенным риском при управлении дыхательными путямисвиней 12.
Частота сложных или невозможных эндотрахеальных интубаций с соответствующим негативным влиянием на эксперимент или ранней смертностью систематически не регистрировалась, но было опубликовано несколько сообщений о случаях13,14. У людей существует возможность использования гибкого интубационного эндоскопа в контексте неожиданно сложной обычной интубации15. Этой мере часто предшествуют различные ложные интубации. Эти повторные попытки интубации связаны с нежелательными явлениями у людей16,17, особенно осложнениями дыхательных путей 18. Такие события вредны для подопытных животных, поскольку в простейшем случае они представляют собой искажающую переменную в эксперименте; В худшем случае они могут привести к ненужной потере животного.
В настоящем исследовании разработана модель, основанная на рекомендациях по ожидаемому затрудненному управлению дыхательными путями у людей 15,19,20,21,22,23,24. Ранее аналогичная методика была описана для обучения волоконно-оптической интубации в исследованиях на людях25,26. Протокол, представленный в этом отчете, направлен на предоставление стандартизированной и легко адаптируемой модели интубации, которая также позволяет специалистам, не занимающимся дыхательными путями, выполнять успешную и безопасную эндотрахеальную интубацию у свиней.
протокол
Эксперименты в этом протоколе были одобрены Государственным и институциональным комитетом по уходу за животными (Landesuntersuchungsamt Rheinland-Pfalz, Кобленц, Германия; номер одобрения G20-1-135). Эксперименты проводились в соответствии с рекомендациями ARRIVE. В целом, для настоящего исследования были использованы 10 анестезированных свиней-самцов (Sus scrofa domestica) со средним весом 30 кг ± 2 кг и возрастом 12-16 недель.
1. Подготовка животных
- Поддерживайте нормальную среду для животных, чтобы свести к минимуму стресс. Воздержитесь от еды за 6 часов до запланированного эксперимента, чтобы снизить риск аспирации, но обеспечьте доступ к воде.
- Успокаивают свиней комбинированным введением мидазолама (0,5 мг/кг) и азаперона (2-3 мг/кг) (см. Таблицу материалов) в ягодичную мышцу или шею иглой (20 г) для внутримышечного введения. Оставьте животных нетронутыми до наступления седативного эффекта (15-20 минут).
ПРИМЕЧАНИЕ: В зависимости от национальных правил, введение седативных средств может подвергаться тщательной проверке и может требовать или не требовать наблюдения обученного ветеринара. Проконсультируйтесь с местными властями, прежде чем планировать эксперименты. - Транспортировка успокоенных животных из конюшни в лабораторию. Время транспортировки не должно превышать достаточного времени седации (в данном случае 30-60 минут). Обеспечьте достаточное удержание тепла, чтобы животное не переохладилось (т. е. ниже 38 °C), например, накрыв тело одеялом в зависимости от температуры наружного воздуха.
- С помощью датчика (см. Таблицу материалов), прикрепленного к уху или хвосту, контролируют периферическое насыщение кислородом (SpO2).
- Продезинфицируйте кожу дезинфицирующим средством (спиртовым) перед введением канюли периферической вены (22 г) в ушную вену. Распылите область, протрите один раз, затем снова распылите и дайте дезинфицирующему средству высохнуть. Закрепите ушную канюлю пластырем (см. Таблицу материалов).
2. Анестезия и искусственная вентиляция легких
- Вводят анальгезию путем внутривенной инъекции 4 мкг / кг фентанила. Индуцируют анестезию внутривенной инъекцией 3 мг/кг пропофола (см. Таблицу материалов).
ПРИМЕЧАНИЕ: За счет болюсного введения препарат быстро проникает в активный компартмент, обеспечивая быстрое наступление глубокой анестезии. - Положите поросенка на носилки в положении лежа на спине и зафиксируйте бинтами. Применяют миорелаксант путем внутривенной инъекции 0,5 мг/кг атракурия (см. Таблицу материалов).
- Мгновенно запустите неинвазивную вентиляцию легких с помощью маски для вентиляции собак (см. Таблицу материалов) или аналогичных моделей. Чтобы обеспечить плотное прилегание маски, поместите возвышение тенара и большие пальцы обеих рук поверх маски, выполняя толчок челюстью оставшимися пальцами.
ПРИМЕЧАНИЕ: Параметры вентиляции: FiO 2 (доля кислорода на вдохе) = 100%, пиковое давление на вдохе = <20 см H 2 0, частота дыхания= 18-20 вдохов / мин, PEEP (положительное давление в конце выдоха) = 5 см H2 0. - Поддерживайте анестезию путем непрерывной инфузии 0,1-0,2 мг/кг/ч фентанила и 8-12 мг/кг/ч пропофола. Начните непрерывную инфузию 5 мл / кг / ч сбалансированного раствора электролита (см. Таблицу материалов). Постоянно поддерживайте достаточную глубину анестезии.
ПРИМЕЧАНИЕ: Суррогатными параметрами для этого являются отсутствие движения, отсутствие собственных дыхательных усилий после интубации и отсутствие внезапного увеличения частоты сердечных сокращений. По возможности избегайте постоянной мышечной релаксации, чтобы вызвать двигательные реакции как признак недостаточной глубины анестезии.
3. Эндотрахеальная интубация
- Попросите помощника встать на левую сторону головы. Попросите помощника левой рукой открыть рот и зажать язык наружу и оставить компресс. Попросите помощника надавить на правую верхнюю губу указательным пальцем правой руки, чтобы обеспечить лучшее открытие рта.
- Проведите прямую ларингоскопию. Для этого нужно ввести ларингоскоп (см. Таблицу материалов) в правую сторону рта и выдвинуть его вперед, одновременно отодвигая язык влево. Продвигайте кончик ларингоскопа до тех пор, пока он не упрется в эпиглоттическую валлекулу.
ПРИМЕЧАНИЕ: Надгортанник обычно скрывает голосовую щель, прилипая к мягкому небу. - Осторожно отодвиньте надгортанник в сторону с помощью трубчатой направляющей проволоки (см. Таблицу материалов) легким зачерпывающим движением от правого грушевидного углубления к левому вдоль мягкого неба.
- Передайте рукоятку ларингоскопа помощнику, чтобы зафиксировать его в текущем положении.
- Теперь возьмем гибкий интубационный эндоскоп, на который уже установлена эндотрахеальная трубка и который подключен к видеомонитору. Вставьте эндоскоп перорально и продвигайте его по основанию языка до тех пор, пока голосовая щель не будет визуализирована.
ПРИМЕЧАНИЕ: Во избежание запотевания камеры рекомендуется предварительное нанесение средств против запотевания (см. Таблицу материалов). - Продвиньте эндоскоп между голосовыми связками в трахею. Подтвердите анатомию трахеи, визуально определив хрящевые кольца и pars membranacea. Продвигайте эндоскоп до тех пор, пока он не окажется над килем. Старайтесь не прикасаться к чувствительной слизистой наконечником эндоскопа, чтобы избежать отека и кровотечения.
- Сохраняя положение эндоскопа, продвигайте эндотрахеальную трубку до тех пор, пока она не станет видна на изображении камеры.
ПРИМЕЧАНИЕ: Если эндотрахеальная трубка не может быть продвинута через плоскость глотты, существует вероятность того, что она зацепилась за черпаловидный хрящ. В этом случае эндотрахеальная трубка должна быть удалена на 1 см и повернута на 90°, прежде чем снова осторожно продвинуться. При необходимости этот маневр можно повторить. Аналогичные калибры гибкого интубационного эндоскопа и эндотрахеальной трубки могут свести к минимуму риск возникновения этой проблемы. Если эндотрахеальная трубка не может быть продвинута, несмотря на этот маневр, вполне вероятно, что подсвязочная узость - самая узкая часть свиной гортани - не может быть пройдена. В этом случае необходимо выбрать эндотрахеальную трубку меньшего размера. Обычные коммерчески доступные эндотрахеальные трубки размером 6,5 см или 7,0 см должны иметь возможность проходить голосовую щель до тех пор, пока нет анатомических аномалий. Требования к размеру эндотрахеальной трубки варьируются в зависимости от размера и породы поросят. - Извлеките гибкий интубационный эндоскоп, сохраняя при этом положение эндотрахеальной трубки.
- Используя шприц объемом 10 мл, надуйте манжету 10 мл воздуха. Контролируйте давление манжеты с помощью менеджера манжеты (целевое значение: 30 смН2О, см. Таблицу материалов).
- Подтвердите правильное размещение эндотрахеальной трубки и адекватную вентиляцию путем периодического и регулярного выдоха углекислого газа с помощью капнографии24 и двусторонней вентиляции с помощью аускультации15.
- Начинайте искусственную вентиляцию легких после подключения трубки к аппарату ИВЛ (PEEP = 5смH2O, частота дыхания = переменная для достижения CO 2 в конце выдоха <6 кПа, обычно 30-50 мин-1, FiO 2 = 0,4, I:E (отношение вдоха к выдоху) = 1:2, дыхательный объем = 6-8 мл/кг).
- Расширьте мониторинг (например, установка внутриартериального давления, установка центрального венозного или легочного артериального катетера27) или продолжайте вмешательство.
ПРИМЕЧАНИЕ: В зависимости от вопроса о дальнейших экспериментах определите предельные значения жизненно важных параметров и вариантов вмешательства и установите соответствующий мониторинг в протоколе исследования.
Результаты
Эндотрахеальная интубация проводилась 10 свиньям-самцам (возраст 12-16 недель, вес 30 кг ± 3 кг) в проспективном рандомизированном контролируемом исследовании. Свиньи были рандомизированы на две группы: одна была интубирована традиционно ларингоскопически (группа КИ), а другая группа была ?...
Обсуждение
В предыдущих исследованиях наша исследовательская группа уже описывала конкретные детали, касающиеся трансляционных преимуществ моделисвиней 2,27,32,33. Как правило, снижение уровня стресса животного и ненужной боли д...
Раскрытие информации
Гибкий интубационный эндоскоп и его аксессуары были безоговорочно предоставлены производителем только в исследовательских целях. Авторы заявляют об отсутствии дальнейших финансовых или иных конфликтов интересов.
Благодарности
Авторы благодарят Дагмар Дирвонскис за отличную техническую поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| Ambu aScope Regular | Ambu GmbH, Medizinprodukte, Bad Nauheim, Germany | Disposable fiber optic outer diameter 5 mm | |
| Ambu aView Monitor | Ambu GmbH, Medizinprodukte, Bad Nauheim, Germany | monitor | |
| Atracurium Hikma 50 mg/5mL | Hikma Pharma GmbH, Martinsried | atracurium | |
| Azaperone (Stresnil) 40mg/mL | Lilly Deutschland GmbH, Bad Homburg, Germany | azaperone | |
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy, AB Helsingborg, Schweden | 3-way-stopcock | |
| BD Microlance 3 20 G | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | cannula | |
| Curafix i.v. classics | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Cannula retention dressing | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| IBM SPSS Statistics for Windows, Version 20 | IBM SPSS Statistics for Windows, Version 20.0. Armonk, NY: IBM Corp.) | Statistical software | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland, GmbH | perfusor line | |
| Intrafix Primeline | B. Braun Melsungen AG, Melsungen, Germany | Infusion line | |
| JOZA Einmal Nitril Untersuchungshandschuhe | JOZA, München, Germany | disposable gloves | |
| Laryngoscope, 45.48.50, KL 2000 | Medicon | Laryngoscope handle | |
| Littmann Classic III Stethoscope | 3M Deutschland GmbH, Neuss, Germany | stethoscope | |
| Luer Lock | B.Braun Melsungen AG, Germany | ||
| Maimed Vlieskompresse | Maimed GmbH, Neuenkirchen, Germany | Fleece compress to fix the tongue | |
| Masimo LNCS Adtx SpO2 sensor | Masimo Corporation Irvine, Ca 92618 USA | saturation clip for the tail | |
| Masimo LNCS TC-I SpO2 ear clip sensor | Masimo Corporation Irvine, Ca 92618 USA | Saturation clip for the ear | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Midazolam 15 mg/3 mL | Hameln Pharma GmbH, Hameln, Germany | midazolam | |
| Midmark Canine Mask Small Plastic with Diaphragm FRSCM-0005 | Midmark Corp., Dayton, Ohio, USA | dog ventilation mask | |
| Octeniderm farblos | Schülke & Mayr GmbH, Nordenstedt, Germany | Alcoholic disinfectant | |
| Original Perfusor syringe 50 mL | B.Braun Melsungen AG, Germany | perfusor syringe | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| Propofol 2% 20 mg/mL (50 mL flasks) | Fresenius, Kabi Deutschland, GmbH | propofol | |
| RÜSCH Führungsstab für Endotrachealtubus (ID 5.6 mm) | Teleflex Medical Sdn. Bhd, Malaysia | PVC coated tube guiding wire | |
| Rüschelit Super Safety Clear >ID 6/6.5 /7.0 mm | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Stainless Macintosh Größe 4 | Welch Allyn69604 | blade for laryngoscope | |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | Balanced electrolyte solution | |
| Ultrastop Antibeschlagmittel bottle with dropper 25 mL | Sigmapharm Arzneimittel GmbH, Wien, Austria | Antifog agent | |
| Vasofix Safety 22 G-16 G | B.Braun Melsungen AG, Germany | venous catheter | |
| VBM Cuff Manometer | VBM Medizintechnik GmbH, Sulz a.N., Germany | cuff pressure gauge | |
| Zelette | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Tissue swab |
Ссылки
- Kleinman, M. E., Oh, W., Stonestreet, B. S. Comparison of intravenous and endotracheal epinephrine during cardiopulmonary resuscitation in newborn piglets. Critical Care Medicine. 27 (12), 2748-2754 (1999).
- Rissel, R., et al. Bronchoalveolar lavage and oleic acid-injection in pigs as a double-hit model for acute respiratory distress syndrome (ARDS). Journal of Visualized Experiments. (159), e61358 (2020).
- Segal, N., et al. Impairment of carotid artery blood flow by supraglottic airway use in a swine model of cardiac arrest. Resuscitation. 83 (8), 1025-1030 (2012).
- Goldmann, K., Kalinowski, M., Kraft, S. Airway management under general anaesthesia in pigs using the LMA-ProSeal: A pilot study. Veterinary Anaesthesia and Analgesia. 32 (5), 308-313 (2005).
- Wemyss-Holden, S. A., Porter, K. J., Baxter, P., Rudkin, G. E., Maddern, G. J. The laryngeal mask airway in experimental pig anaesthesia. Lab Animal. 33 (1), 30-34 (1999).
- Kobayashi, E., Hishikawa, S., Teratani, T., Lefor, A. T. The pig as a model for translational research: overview of porcine animal models at Jichi Medical University. Transplantation Research. 1 (1), 8 (2012).
- Judge, E. P., et al. Anatomy and bronchoscopy of the porcine lung. A model for translational respiratory medicine. American Journal of Respiratory Cell and Molecular Biology. 51 (3), 334-343 (2014).
- Dondelinger, R. F., et al. Relevant radiological anatomy of the pig as a training model in interventional radiology. European Radiology. 8 (7), 1254-1273 (1998).
- Nickel, R., Schummer, A., Seiferle, E. . Lehrbuch der Anatomie der Haustiere, Band I: Bewegungsapparat. , (2003).
- Wani, T. M., Rafiq, M., Akhter, N., AlGhamdi, F. S., Tobias, J. D. Upper airway in infants-A computed tomography-based analysis. Paediatric Anaesthesia. 27 (5), 501-505 (2017).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Ettrup, K. S., et al. Basic surgical techniques in the Göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. Journal of Visualized Experiments. (52), e2652 (2011).
- Steinbacher, R., von Ritgen, S., Moens, Y. P. S. Laryngeal perforation during a standard intubation procedure in a pig. Laboratory Animals. 46 (3), 261-263 (2012).
- Iliff-Sizemore, S. A., Chrisp, C. E., Rush, H. G. Peritracheolaryngeal abscess: An iatrogenic complication of endotracheal intubation in swine. Laboratory Animal Science. 39 (5), 455-458 (1989).
- Piepho, T., et al. S1 guidelines on airway management. Der Anaesthesist. 64 (11), 859-873 (2015).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesthesia & Analgesia. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Annals of Emergency Medicine. 60 (6), 749-754 (2012).
- Martin, L. D., Mhyre, J. M., Shanks, A. M., Tremper, K. K., Kheterpal, S. 3,423 emergency tracheal intubations at a university hospital: airway outcomes and complications. Anesthesiology. 114 (1), 42-48 (2011).
- Ahmad, I., et al. Difficult Airway Society guidelines for awake tracheal intubation (ATI) in adults. Anaesthesia. 75 (4), 509-528 (2020).
- Frerk, C., et al. Difficult Airway Society 2015 guidelines for management of unanticipated difficult intubation in adults. British Journal of Anaesthesia. 115 (6), 827-848 (2015).
- Cook, T. M., et al. Consensus guidelines for managing the airway in patients with COVID-19: Guidelines from the Difficult Airway Society, the Association of Anaesthetists the Intensive Care Society, the Faculty of Intensive Care Medicine and the Royal College of Anaesthetists. Anaesthesia. 75 (6), 785-799 (2020).
- Kornas, R. L., Owyang, C. G., Sakles, J. C., Foley, L. J., Mosier, J. M. Evaluation and management of the physiologically difficult airway: Consensus recommendations from Society for Airway Management. Anesthesia & Analgesia. 132 (2), 395-405 (2021).
- Higgs, A., et al. Guidelines for the management of tracheal intubation in critically ill adults. British Journal of Anaesthesia. 120 (2), 323-352 (2018).
- Apfelbaum, J. L., et al. American Society of Anesthesiologists Practice Guidelines for Management of the Difficult Airway. Anesthesiology. 136 (1), 31-81 (2022).
- Doyle, D. J. GlideScope-assisted fiberoptic intubation: A new airway teaching method. Anesthesiology. 101 (5), 1252 (2004).
- Lenhardt, R., et al. Is video laryngoscope-assisted flexible tracheoscope intubation feasible for patients with predicted difficult airway? A prospective, randomized clinical trial. Anesthesia & Analgesia. 118 (6), 1259-1265 (2014).
- Ruemmler, R., Ziebart, A., Garcia-Bardon, A., Kamuf, J., Hartmann, E. K. Standardized model of ventricular fibrillation and advanced cardiac life support in swine. Journal of Visualized Experiments. (155), e60707 (2020).
- Dodge, Y. Kolmogorov-Smirnov Test. The Concise Encyclopedia of Statistics. , 283-287 (2008).
- Ross, A., Willson, V. L. Independent Samples T-test. Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , 13-16 (2017).
- Mann, H. B., Whitney, D. R. On a test of whether one of two random variables is stochastically larger than the other. The Annals of Mathematical Statistics. 18 (1), 50-60 (1947).
- Spearman, C. The proof and measurement of association between two things. American Journal of Psychology. 100 (3-4), 441-471 (1987).
- Ziebart, A., et al. Standardized hemorrhagic shock induction guided by cerebral oximetry and extended hemodynamic monitoring in pigs. Journal of Visualized Experiments. (147), e59332 (2019).
- Kamuf, J., et al. Oleic acid-injection in pigs as a model for acute respiratory distress syndrome. Journal of Visualized Experiments. (140), e57783 (2018).
- Kurita, T., Kawashima, S., Morita, K., Nakajima, Y. Assessment of the benefits of head-up preoxygenation using near-infrared spectroscopy with pulse oximetry in a swine model. Journal of Clinical Monitoring and Computing. 35 (1), 155-163 (2021).
- Ruemmler, R., Ziebart, A., Ott, T., Dirvonskis, D., Hartmann, E. K. Flexible fibreoptic intubation in swine - Improvement for resident training and animal safety alike. BMC Anesthesiology. 20 (1), 206 (2020).
- Cook, J. A., Ramsay, C. R., Fayers, P. Using the literature to quantify the learning curve: A case study. International Journal of Technology Assessment in Health Care. 23 (2), 255-260 (2007).
- Buis, M. L., Maissan, I. M., Hoeks, S. E., Klimek, M., Stolker, R. J. Defining the learning curve for endotracheal intubation using direct laryngoscopy: A systematic review. Resuscitation. 99, 63-71 (2016).
- Knapp, S., et al. The assessment of four different methods to verify tracheal tube placement in the critical care setting. Anesthesia & Analgesia. 88 (4), 766-770 (1999).
- Schmidt, R. F. . Physiologie des Menschen. 31, (2010).
- Eberlein, C. M., Luther, I. S., Carpenter, T. A., Ramirez, L. D. First-pass success intubations using video laryngoscopy versus direct laryngoscopy: A retrospective prehospital ambulance service study. Air Medical Journal. 38 (5), 356-358 (2019).
- Lohse, J., Noppens, R. Awake video laryngoscopy - An alternative to awake fiberoptic intubation. Anasthesiologie, Intensivmedizin, Notfallmedizin, Schmerztherapie. 51 (11-12), 656-663 (2016).
- Johnson, C., Roberts, J. T. Clinical competence in the performance of fiberoptic laryngoscopy and endotracheal intubation: A study of resident instruction. Journal of Clinical Anesthesia. 1 (5), 344-349 (1989).
- Geovanini, G. R., Pinna, F. R., Prado, F. A., Tamaki, W. T., Marques, E. Standardization of anesthesia in swine for experimental cardiovascular surgeries. Revista Brasileira de Anestesiologia. 58 (4), 363-370 (2008).
Erratum
Formal Correction: Erratum: Endotracheal Intubation Using a Flexible Intubation Endoscope As a Standardized Model for Safe Airway Management in Swine
Posted by JoVE Editors on 4/03/2023. Citeable Link.
An erratum was issued for: Endotracheal Intubation Using a Flexible Intubation Endoscope As a Standardized Model for Safe Airway Management in Swine. The Protocol, Representative Results, and Discussion sections were updated.
In the Protocol, step 1.5 was updated from:
Disinfect the skin with a disinfectant (alcoholic) before inserting a peripheral vein cannula (22 G) into an ear vein. Spray the area, wipe once, then spray again, and allow the disinfectant to dry.
to:
Disinfect the skin with a disinfectant (alcoholic) before inserting a peripheral vein cannula (22 G) into an ear vein. Spray the area, wipe once, then spray again, and allow the disinfectant to dry. Secure the ear cannula with a band-aid (See Table of Materials).
In the Protocol, step 3.7 was updated from:
While maintaining the position of the endoscope, advance the endotracheal tube until it becomes visible in the camera image.
NOTE: If the endotracheal tube cannot be advanced through the glottic plane, there is a possibility that it has become caught on the arytenoid cartilage. In this case, the endotracheal tube must be withdrawn 1 cm and rotated by 90° before gently advancing again. If necessary, this maneuver can be repeated. Similar calibers of flexible intubation endoscope and endotracheal tube can minimize the risk of this issue occurring. If the endotracheal tube cannot be advanced despite this maneuver, it is likely that the subglottic narrowness-the narrowest part of the porcine larynx-cannot be passed. In this case, a smaller endotracheal tube size needs to be selected. Regular commercially available endotracheal tubes in sizes 6.5 cm or 7.0 cm ID should be able to pass the glottis as long as no anatomic abnormalities are present.
to:
While maintaining the position of the endoscope, advance the endotracheal tube until it becomes visible in the camera image.
NOTE: If the endotracheal tube cannot be advanced through the glottic plane, there is a possibility that it has become caught on the arytenoid cartilage. In this case, the endotracheal tube must be withdrawn 1 cm and rotated by 90° before gently advancing again. If necessary, this maneuver can be repeated. Similar calibers of flexible intubation endoscope and endotracheal tube can minimize the risk of this issue occurring. If the endotracheal tube cannot be advanced despite this maneuver, it is likely that the subglottic narrowness-the narrowest part of the porcine larynx-cannot be passed. In this case, a smaller endotracheal tube size needs to be selected. Regular commercially available endotracheal tubes in sizes 6.5 cm or 7.0 cm ID should be able to pass the glottis as long as no anatomic abnormalities are present. Endotracheal tube size requirements vary depending on the piglet size and breed.
In the Representative Results, the sixth paragraph was updated from:
Statistical analyses were performed using commercially available software (see Table of Materials). Normal distribution was examined using the Kolmogorov-Smirnoff test28. If a normal distribution was determined, group differences were analyzed using t-tests of independent samples29 or the Mann-Whitney U test30 for the non-parametric version. Data are presented as mean (± standard deviation). Correlations of ordinal-scale data were examined using Spearman's correlation coefficient31. A significance level of p < 0.05 was assumed.
to:
Statistical analyses were performed using commercially available software (see Table of Materials). Normal distribution was examined using the Kolmogorov-Smirnoff test28. If a normal distribution was determined, group differences were analyzed using t-tests of independent samples29 or the Mann-Whitney U test30 for the non-parametric version. Data are presented as mean (± standard deviation). Correlations of ordinal-scale data were examined using Spearman's correlation coefficient31. A significance level of p < 0.05 was assumed. All tests were performed with exploratory intention; therefore p-values are descriptive. Nevertheless, p < 0.05 was accepted as indicative of statistical significance.
In the Representative Results, the legend for figure 1 was updated from:
Figure 1: Number of intubation attempts in group comparison. For the group that was intubated using a flexible intubation endoscope, every intubation attempt was successful; in the group that was conventionally intubated, it took an average of 1.4 attempts before the endotracheal tube could be placed correctly. Error bars show the standard deviation. Please click here to view a larger version of this figure.
to:
Figure 1: Number of intubation attempts in group comparison. For the group that was intubated using a flexible intubation endoscope, every intubation attempt was successful; in the group that was conventionally intubated, it took an average of 1.4 attempts before the endotracheal tube could be placed correctly. Error bars show the standard deviation. n = 5 (for each group). Please click here to view a larger version of this figure.
In the Representative Results, figure 2 was updated from:
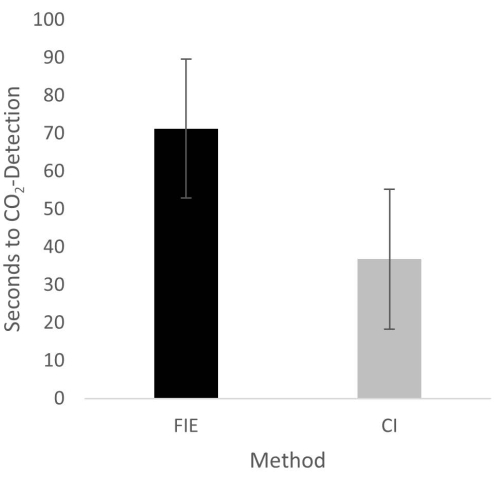
Figure 2: Time until CO2 detection in group comparison. For the group that was intubated using a flexible intubation endoscope, it took significantly longer until end-tidal CO2 could be detected, depicted as mean and standard deviation. Please click here to view a larger version of this figure.
to:
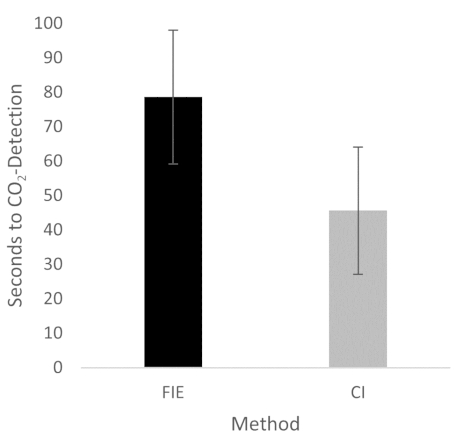
Figure 2: Time until CO2 detection in group comparison. For the group that was intubated using a flexible intubation endoscope, it took significantly longer until end-tidal CO2 could be detected, depicted as mean and standard deviation. n = 5 (for each group). Please click here to view a larger version of this figure.
In the Discussion, the fifth paragraph was updated from:
The increased duration had no clinical significance in this cohort. At no time was the termination criterion-a saturation of less than 93%-reached. This is shown in the results because a procedure change was unnecessary at any time. Prior adequate mask ventilation is a critical step to allow sufficient time for fiberoptic endotracheal tube placement to avoid rapid desaturation34. These results are consistent with previous studies comparing conventional intubation and endoscopically assisted intubations with inexperienced providers35.
to:
The increased duration had no clinical significance in this cohort. At no time was the termination criterion-a saturation of less than 93%-reached. This is shown in the results because a procedure change was unnecessary at any time. Prior adequate mask ventilation is a critical step to allow sufficient time for fiberoptic endotracheal tube placement to avoid rapid desaturation34. These results are consistent with previous studies comparing conventional intubation and endoscopically assisted intubations with inexperienced providers35. We attribute the prolonged duration of fiberoptic intubation to the fact that one must first reorient again after insertion, whereas with conventional intubation, one retains a view of the glottis. It is also important to avoid contact with the mucosa with the flexible intubation endoscope during advancement. This requires occasional corrective maneuvers. Last but not least, after successful placement, retraction of the relatively long endoscope is required, which increases the time to CO2 detection slightly.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены