Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Endotracheale Intubation mit einem flexiblen Intubationsendoskop als standardisiertes Modell für ein sicheres Atemwegsmanagement bei Schweinen
In diesem Artikel
Erratum Notice
Zusammenfassung
Der Einsatz von Schweinen in der Forschung hat in den letzten Jahren zugenommen. Dennoch zeichnen sich Schweine durch eine schwierige Atemwegsanatomie aus. Durch die Demonstration der Durchführung einer endoskopisch gesteuerten endotrachealen Intubation zielt das vorliegende Protokoll darauf ab, die Sicherheit von Labortieren weiter zu erhöhen, um Tierleid und unnötigen Tod zu vermeiden.
Zusammenfassung
Die endotracheale Intubation ist oft eine Grundvoraussetzung für die translationale Forschung in schweinen Modellen für verschiedene Eingriffe, die einen gesicherten Atemweg oder hohe Beatmungsdrücke erfordern. Die endotracheale Intubation ist eine anspruchsvolle Fähigkeit, die eine minimale Anzahl erfolgreicher endotrachealer Intubationen erfordert, um unter optimalen Bedingungen eine hohe Erfolgsrate zu erzielen, die für Nicht-Anästhesiologieforscher oft unerreichbar ist. Aufgrund der spezifischen Anatomie der porcinen Atemwege kann in der Regel von einem schwierigen Atemweg ausgegangen werden. Die Unmöglichkeit, einen sicheren Atemweg herzustellen, kann zu Verletzungen, unerwünschten Ereignissen oder zum Tod des Labortiers führen. Unter Verwendung eines prospektiven, randomisierten, kontrollierten Bewertungsansatzes konnte gezeigt werden, dass die faseroptische endotracheale Intubation länger dauert, aber eine höhere First-Pass-Erfolgsrate aufweist als die konventionelle Intubation, ohne klinisch relevante Abfalle der Sauerstoffsättigung zu verursachen. Dieses Modell stellt ein standardisiertes Schema für die endoskopisch gesteuerte endotracheale Intubation dar, das einen gesicherten Atemweg bietet, insbesondere für Forscher, die mit der Technik der endotrachealen Intubation durch direkte Laryngoskopie unerfahren sind. Dieses Verfahren soll Tierleid und unnötige Tierverluste minimieren.
Einleitung
Die endotracheale Intubation ist oft eine Grundvoraussetzung für die translationale Forschung in Schweinemodellen für verschiedene Interventionen, die einen gesicherten Atemweg oder einen hohen Beatmungsdruck erfordern (wie z.B. Beatmung während der Herz-Lungen-Wiederbelebung1 oder akutes Atemnotsyndrom2) oder erfordern, dass der zerebrale Blutfluss nicht durch interne Kompression durch supraglottische Atemwegsgeräte beeinträchtigt wird3 , die gelegentlich als Alternativen im Zusammenhang mit einer zu erwartenden schwierigen Atemwegserkrankung bei Schweinen vermehrt werden 4,5.
Während die Lungenphysiologie von Schweinen ähnliche Merkmale aufweist wie beim Menschen6, ist die Sicherung der Atemwege aufgrund spezifischer Unterschiede in der orotrachealen Anatomie des Schweins manchmal deutlich schwieriger7. Die Schnauze eines Schweins hat eine schmale Öffnung mit einer sehr großen Zunge, der Kehlkopf ist extrem beweglich und die Epiglottis ist relativ groß, mit einem freien Ende, das sich bis zum weichen Gaumen erstreckt. Kaudal bildet der Kehlkopf mit der Luftröhre einen stumpfen Winkel. Die Arytenoidknorpel sind groß8. Der engste Teil der Atemwege befindet sich auf der subglottischen Ebene9, vergleichbar mit der Atemwegsanatomie von Kindern10. Da der Kehlkopf bei Schweinen sehr beweglich ist, besteht die Gefahr, dass das Ende des Endotrachealtubus durch die Stimmbänder verläuft, der Kehlkopf jedoch nur kaudal um bis zu mehreren Zentimeter verschoben wird, was mit einer korrekten Intubation verwechselt werden kann 8,11. Darüber hinaus ist die Intubation der Speiseröhre ein häufiges Risiko beim Umgang mit dem Atemwegsmanagement von Schweinen12.
Die Raten schwieriger oder unmöglicher endotrachealer Intubationen mit entsprechenden negativen Auswirkungen auf das Experiment oder die frühe Mortalität wurden nicht systematisch erfasst, aber es wurden mehrere Fallberichte veröffentlicht13,14. Beim Menschen besteht die Möglichkeit, ein flexibles Intubationsendoskop im Rahmen einer unerwartet schwierigen konventionellen Intubationeinzusetzen 15. Dieser Maßnahme gehen oft verschiedene falsche Intubationen voraus. Diese wiederholten Intubationsversuche sind mit unerwünschten Ereignissen beim Menschen verbunden16,17, insbesondere mit Atemwegskomplikationen 18. Solche Ereignisse sind bei Versuchstieren schädlich, da sie im einfachsten Fall eine Störvariable im Experiment darstellen; Im schlimmsten Fall können sie zum unnötigen Verlust des Tieres führen.
In der vorliegenden Studie wurde ein Modell entwickelt, das auf den Leitlinien für das erwartete schwierige Atemwegsmanagement beim Menschen 15,19,20,21,22,23,24 basiert. Zuvor wurde eine ähnliche Technik zum Erlernen der faseroptischen Intubation in Studien am Menschen beschrieben25,26. Das in diesem Bericht vorgestellte Protokoll zielt darauf ab, ein standardisiertes und einfach anzupassendes Intubationsmodell bereitzustellen, das es auch Nicht-Atemwegsspezialisten ermöglicht, eine erfolgreiche und sichere endotracheale Intubation bei Schweinen durchzuführen.
Protokoll
Die Versuche in diesem Protokoll wurden vom Landesuntersuchungsamt Rheinland-Pfalz (Koblenz, Deutschland; Zulassungs-Nr. G20-1-135) genehmigt. Die Experimente wurden nach den ARRIVE-Richtlinien durchgeführt. Insgesamt wurden 10 anästhesierte männliche Schweine (Sus scrofa domestica) mit einem Durchschnittsgewicht von 30 kg ± 2 kg und einem Alter von 12-16 Wochen für die vorliegende Studie verwendet.
1. Tierische Vorbereitung
- Sorgen Sie für eine normale Umgebung für die Tiere, um Stress zu minimieren. Halten Sie die Nahrung 6 Stunden vor dem geplanten Experiment zurück, um das Aspirationsrisiko zu verringern, aber erlauben Sie den Zugang zu Wasser.
- Die Schweine werden mit einer kombinierten Injektion von Midazolam (0,5 mg/kg) und Azaperon (2-3 mg/kg) (siehe Materialtabelle) in den Gesäßmuskel oder Hals mit einer Nadel (20 g) zur intramuskulären Injektion beruhigt. Lassen Sie die Tiere ungestört, bis die Sedierung einsetzt (15-20 min).
HINWEIS: Abhängig von den nationalen Vorschriften kann die Verabreichung von Betäubungsmitteln einer Prüfung unterzogen werden und die Aufsicht eines ausgebildeten Tierarztes erfordern oder nicht. Konsultieren Sie die örtlichen Behörden, bevor Sie die Experimente planen. - Transportieren Sie die sedierten Tiere von den Ställen ins Labor. Die Transportzeit darf eine angemessene Sedierungszeit (hier 30-60 min) nicht überschreiten. Sorgen Sie für eine ausreichende Wärmespeicherung, damit das Tier nicht unterkühlt (d. h. unter 38 °C), z. B. indem Sie den Körper je nach Außentemperatur mit einer Decke abdecken.
- Überwachen Sie mit einem Sensor (siehe Materialtabelle), der am Ohr oder am Schwanz befestigt ist, die periphere Sauerstoffsättigung (SpO2).
- Desinfizieren Sie die Haut mit einem Desinfektionsmittel (alkoholisch), bevor Sie eine periphere Venenkanüle (22 G) in eine Ohrvene einführen. Sprühen Sie den Bereich ein, wischen Sie ihn einmal ab, sprühen Sie dann erneut und lassen Sie das Desinfektionsmittel trocknen. Befestigen Sie die Ohrkanüle mit einem Pflaster (siehe Materialtabelle).
2. Anästhesie und mechanische Beatmung
- Verabreichen Sie Analgesie durch eine intravenöse Injektion von 4 μg/kg Fentanyl. Induzieren Sie eine Anästhesie mit einer intravenösen Injektion von 3 mg/kg Propofol (siehe Materialtabelle).
HINWEIS: Aufgrund der Bolusanwendung strömt das Medikament schnell in das aktive Kompartiment und sorgt für einen schnellen Beginn der tiefen Anästhesie. - Legen Sie das Schwein auf eine Trage in Rückenlage und fixieren Sie es mit Bandagen. Tragen Sie Muskelrelaxans durch eine intravenöse Injektion von 0,5 mg/kg Atracurium auf (siehe Materialtabelle).
- Starten Sie sofort die nichtinvasive Beatmung über eine Hundebeatmungsmaske (siehe Materialtabelle) oder ähnliche Modelle. Um einen festen Sitz der Maske zu gewährleisten, legen Sie die Eminenz und die Daumen beider Hände auf die Maske, während Sie mit den verbleibenden Fingern einen Kieferstoß ausführen.
HINWEIS: Beatmungsparameter: FiO 2 (inspiratorischer Sauerstoffanteil) = 100%, maximaler inspiratorischer Druck = <20 cmH 2 0,Atemfrequenz = 18-20 Atemzüge/min, PEEP (positiver endexspiratorischer Druck) = 5 cmH2 0. - Aufrechterhaltung der Anästhesie durch kontinuierliche Infusion von 0,1-0,2 mg/kg/h Fentanyl und 8-12 mg/kg/h Propofol. Beginnen Sie mit der kontinuierlichen Infusion von 5 ml/kg/h ausgewogener Elektrolytlösung (siehe Materialtabelle). Halten Sie ständig eine ausreichende Anästhesietiefe aufrecht.
HINWEIS: Surrogatparameter dafür sind das Fehlen von Bewegung, das Fehlen eigener Atemanstrengungen nach der Intubation und das Fehlen eines plötzlichen Anstiegs der Herzfrequenz. Vermeiden Sie nach Möglichkeit eine dauerhafte Muskelentspannung, um motorische Reaktionen als Zeichen einer unzureichenden Anästhesietiefe zu ermöglichen.
3. Endotracheale Intubation
- Lassen Sie einen Assistenten auf der linken Seite des Kopfes stehen. Lassen Sie die linke Hand des Assistenten den Mund öffnen und kneifen Sie die Zunge nach außen und lassen Sie sie mit einer Kompresse zurück. Bitten Sie den Assistenten, mit dem rechten Zeigefinger auf die rechte Oberlippe zu drücken, um eine bessere Mundöffnung zu erzielen.
- Führen Sie eine direkte Laryngoskopie durch. Führen Sie dazu das Laryngoskop (siehe Materialtabelle) in die rechte Mundseite ein und schieben Sie es nach vorne, während Sie die Zunge nach links schieben. Schieben Sie die Spitze des Laryngoskops vor, bis es in der epiglottischen Vallecula ruht.
HINWEIS: Die Epiglottis verdeckt normalerweise die Stimmritze, indem sie am weichen Gaumen klebt. - Schieben Sie den Kehldeckel vorsichtig mit einem Rohrführungsdraht (siehe Materialtabelle) mit einer sanften Schöpfbewegung von der rechten piriformen Aussparung nach links entlang des weichen Gaumens beiseite.
- Geben Sie den Griff des Laryngoskops an den Assistenten weiter, um es in der aktuellen Position zu fixieren.
- Nehmen Sie nun das flexible Intubationsendoskop, auf dem bereits ein Endotrachealtubus montiert ist und das mit einem Videomonitor verbunden ist. Führen Sie das Endoskop oral ein und schieben Sie es über den Zungengrund, bis die Stimmritze sichtbar wird.
HINWEIS: Um ein Beschlagen der Kamera zu vermeiden, wird die vorherige Anwendung von Antibeschlagmitteln (siehe Materialtabelle) empfohlen. - Schieben Sie das Endoskop zwischen den Stimmbändern in die Luftröhre vor. Bestätigen Sie die Anatomie der Luftröhre, indem Sie die Knorpelringe und die Pars membranacea visuell identifizieren. Schieben Sie das Endoskop vor, bis es über der Carina aufliegt. Versuchen Sie, die empfindliche Schleimhaut nicht mit der Spitze des Endoskops zu berühren, um Schwellungen und Blutungen zu vermeiden.
- Während Sie die Position des Endoskops beibehalten, schieben Sie den Endotrachealtubus vor, bis er im Kamerabild sichtbar wird.
HINWEIS: Wenn der Endotrachealtubus nicht durch die Stimmritzenebene vorgeschoben werden kann, besteht die Möglichkeit, dass er sich am Arytenoidknorpel verfangen hat. In diesem Fall muss der Endotrachealtubus 1 cm zurückgezogen und um 90° gedreht werden, bevor er wieder sanft vorgeschoben wird. Bei Bedarf kann dieses Manöver wiederholt werden. Ähnliche Kaliber des flexiblen Intubationsendoskops und des Endotrachealtubus können das Risiko des Auftretens dieses Problems minimieren. Wenn der Endotrachealtubus trotz dieses Manövers nicht vorgeschoben werden kann, ist es wahrscheinlich, dass die subglottische Enge - der engste Teil des Schweinekehlkopfes - nicht passiert werden kann. In diesem Fall muss eine kleinere Endotrachealtubusgröße gewählt werden. Reguläre handelsübliche Endotrachealtuben in den Größen 6,5 cm oder 7,0 cm ID sollten die Stimmritze passieren können, solange keine anatomischen Anomalien vorliegen. Die Anforderungen an die Größe des Endotrachealtubus variieren je nach Ferkelgröße und Rasse. - Ziehen Sie das flexible Intubationsendoskop heraus und behalten Sie dabei die Position des Endotrachealtubus bei.
- Blasen Sie die Manschette mit einer 10-ml-Spritze mit 10 ml Luft auf. Kontrollieren Sie den Manschettendruck mit einem Manschettenmanager (Zielwert: 30 cmH2O, siehe Materialtabelle).
- Bestätigen Sie die korrekte Platzierung des Endotrachealtubus und eine ausreichende Belüftung durch periodisches und regelmäßiges Ausatmen von Kohlendioxid mittels Kapnographie24 und beidseitige Belüftung durch Auskultation15.
- Beginnen Sie mit der mechanischen Beatmung, nachdem Sie den Schlauch mit einem Beatmungsgerät verbunden haben (PEEP = 5 cmH 2 O, Atemfrequenz = variabel, um ein endtidales CO 2 von <6 kPa zu erreichen, normalerweise 30-50 min−1, FiO 2 = 0,4, I:E (Verhältnis von Inspiration zu Exspiration) = 1:2, Atemzugvolumen = 6-8 ml/kg).
- Erweitern Sie die Überwachung (z. B. die Einrichtung einer intraarteriellen Blutdruckmessung, die Installation eines zentralvenösen oder pulmonalen arteriellen Katheters27) oder setzen Sie den Eingriff fort.
HINWEIS: Legen Sie je nach Fragestellung der weiteren Experimente Grenzwerte für die Vitalparameter und Interventionsmöglichkeiten fest und legen Sie das Monitoring entsprechend im Studienprotokoll fest.
Ergebnisse
Die endotracheale Intubation wurde an 10 männlichen Schweinen (Alter 12-16 Wochen, Gewicht 30 kg ± 3 kg) in einer prospektiven, randomisierten, kontrollierten Studie durchgeführt. Die Schweine wurden randomisiert in zwei Gruppen eingeteilt: eine wurde konventionell larynoskopisch intubiert (CI-Gruppe) und die andere Gruppe wurde mit Hilfe eines flexiblen Intubationsendoskops intubiert, wie im Protokoll beschrieben (FIE-Gruppe). Die Gruppenzuordnung erfolgte durch Ziehen versiegelter Umschläge. Der Ermittler ...
Diskussion
In früheren Studien hat unsere Forschungsgruppe bereits spezifische Details zu den translationalen Vorteilen des porcinen Modells 2,27,32,33 beschrieben. Im Allgemeinen sollte die Reduzierung des Stressniveaus des Tieres und unnötiger Schmerzen ein integraler Bestandteil jedes Studienprotokolls sein und ist von größter Bedeutung, um zuverlässig reproduzierbare Daten zu generieren. Daher is...
Offenlegungen
Das flexible Intubationsendoskop und sein Zubehör wurden vom Hersteller vorbehaltlos nur zu Forschungszwecken zur Verfügung gestellt. Die Autoren erklären keine weiteren finanziellen oder sonstigen Interessenkonflikte.
Danksagungen
Die Autoren bedanken sich bei Dagmar Dirvonskis für die hervorragende technische Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Ambu aScope Regular | Ambu GmbH, Medizinprodukte, Bad Nauheim, Germany | Disposable fiber optic outer diameter 5 mm | |
| Ambu aView Monitor | Ambu GmbH, Medizinprodukte, Bad Nauheim, Germany | monitor | |
| Atracurium Hikma 50 mg/5mL | Hikma Pharma GmbH, Martinsried | atracurium | |
| Azaperone (Stresnil) 40mg/mL | Lilly Deutschland GmbH, Bad Homburg, Germany | azaperone | |
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy, AB Helsingborg, Schweden | 3-way-stopcock | |
| BD Microlance 3 20 G | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | cannula | |
| Curafix i.v. classics | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Cannula retention dressing | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| IBM SPSS Statistics for Windows, Version 20 | IBM SPSS Statistics for Windows, Version 20.0. Armonk, NY: IBM Corp.) | Statistical software | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland, GmbH | perfusor line | |
| Intrafix Primeline | B. Braun Melsungen AG, Melsungen, Germany | Infusion line | |
| JOZA Einmal Nitril Untersuchungshandschuhe | JOZA, München, Germany | disposable gloves | |
| Laryngoscope, 45.48.50, KL 2000 | Medicon | Laryngoscope handle | |
| Littmann Classic III Stethoscope | 3M Deutschland GmbH, Neuss, Germany | stethoscope | |
| Luer Lock | B.Braun Melsungen AG, Germany | ||
| Maimed Vlieskompresse | Maimed GmbH, Neuenkirchen, Germany | Fleece compress to fix the tongue | |
| Masimo LNCS Adtx SpO2 sensor | Masimo Corporation Irvine, Ca 92618 USA | saturation clip for the tail | |
| Masimo LNCS TC-I SpO2 ear clip sensor | Masimo Corporation Irvine, Ca 92618 USA | Saturation clip for the ear | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Midazolam 15 mg/3 mL | Hameln Pharma GmbH, Hameln, Germany | midazolam | |
| Midmark Canine Mask Small Plastic with Diaphragm FRSCM-0005 | Midmark Corp., Dayton, Ohio, USA | dog ventilation mask | |
| Octeniderm farblos | Schülke & Mayr GmbH, Nordenstedt, Germany | Alcoholic disinfectant | |
| Original Perfusor syringe 50 mL | B.Braun Melsungen AG, Germany | perfusor syringe | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| Propofol 2% 20 mg/mL (50 mL flasks) | Fresenius, Kabi Deutschland, GmbH | propofol | |
| RÜSCH Führungsstab für Endotrachealtubus (ID 5.6 mm) | Teleflex Medical Sdn. Bhd, Malaysia | PVC coated tube guiding wire | |
| Rüschelit Super Safety Clear >ID 6/6.5 /7.0 mm | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Stainless Macintosh Größe 4 | Welch Allyn69604 | blade for laryngoscope | |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | Balanced electrolyte solution | |
| Ultrastop Antibeschlagmittel bottle with dropper 25 mL | Sigmapharm Arzneimittel GmbH, Wien, Austria | Antifog agent | |
| Vasofix Safety 22 G-16 G | B.Braun Melsungen AG, Germany | venous catheter | |
| VBM Cuff Manometer | VBM Medizintechnik GmbH, Sulz a.N., Germany | cuff pressure gauge | |
| Zelette | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Tissue swab |
Referenzen
- Kleinman, M. E., Oh, W., Stonestreet, B. S. Comparison of intravenous and endotracheal epinephrine during cardiopulmonary resuscitation in newborn piglets. Critical Care Medicine. 27 (12), 2748-2754 (1999).
- Rissel, R., et al. Bronchoalveolar lavage and oleic acid-injection in pigs as a double-hit model for acute respiratory distress syndrome (ARDS). Journal of Visualized Experiments. (159), e61358 (2020).
- Segal, N., et al. Impairment of carotid artery blood flow by supraglottic airway use in a swine model of cardiac arrest. Resuscitation. 83 (8), 1025-1030 (2012).
- Goldmann, K., Kalinowski, M., Kraft, S. Airway management under general anaesthesia in pigs using the LMA-ProSeal: A pilot study. Veterinary Anaesthesia and Analgesia. 32 (5), 308-313 (2005).
- Wemyss-Holden, S. A., Porter, K. J., Baxter, P., Rudkin, G. E., Maddern, G. J. The laryngeal mask airway in experimental pig anaesthesia. Lab Animal. 33 (1), 30-34 (1999).
- Kobayashi, E., Hishikawa, S., Teratani, T., Lefor, A. T. The pig as a model for translational research: overview of porcine animal models at Jichi Medical University. Transplantation Research. 1 (1), 8 (2012).
- Judge, E. P., et al. Anatomy and bronchoscopy of the porcine lung. A model for translational respiratory medicine. American Journal of Respiratory Cell and Molecular Biology. 51 (3), 334-343 (2014).
- Dondelinger, R. F., et al. Relevant radiological anatomy of the pig as a training model in interventional radiology. European Radiology. 8 (7), 1254-1273 (1998).
- Nickel, R., Schummer, A., Seiferle, E. . Lehrbuch der Anatomie der Haustiere, Band I: Bewegungsapparat. , (2003).
- Wani, T. M., Rafiq, M., Akhter, N., AlGhamdi, F. S., Tobias, J. D. Upper airway in infants-A computed tomography-based analysis. Paediatric Anaesthesia. 27 (5), 501-505 (2017).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Ettrup, K. S., et al. Basic surgical techniques in the Göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. Journal of Visualized Experiments. (52), e2652 (2011).
- Steinbacher, R., von Ritgen, S., Moens, Y. P. S. Laryngeal perforation during a standard intubation procedure in a pig. Laboratory Animals. 46 (3), 261-263 (2012).
- Iliff-Sizemore, S. A., Chrisp, C. E., Rush, H. G. Peritracheolaryngeal abscess: An iatrogenic complication of endotracheal intubation in swine. Laboratory Animal Science. 39 (5), 455-458 (1989).
- Piepho, T., et al. S1 guidelines on airway management. Der Anaesthesist. 64 (11), 859-873 (2015).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesthesia & Analgesia. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Annals of Emergency Medicine. 60 (6), 749-754 (2012).
- Martin, L. D., Mhyre, J. M., Shanks, A. M., Tremper, K. K., Kheterpal, S. 3,423 emergency tracheal intubations at a university hospital: airway outcomes and complications. Anesthesiology. 114 (1), 42-48 (2011).
- Ahmad, I., et al. Difficult Airway Society guidelines for awake tracheal intubation (ATI) in adults. Anaesthesia. 75 (4), 509-528 (2020).
- Frerk, C., et al. Difficult Airway Society 2015 guidelines for management of unanticipated difficult intubation in adults. British Journal of Anaesthesia. 115 (6), 827-848 (2015).
- Cook, T. M., et al. Consensus guidelines for managing the airway in patients with COVID-19: Guidelines from the Difficult Airway Society, the Association of Anaesthetists the Intensive Care Society, the Faculty of Intensive Care Medicine and the Royal College of Anaesthetists. Anaesthesia. 75 (6), 785-799 (2020).
- Kornas, R. L., Owyang, C. G., Sakles, J. C., Foley, L. J., Mosier, J. M. Evaluation and management of the physiologically difficult airway: Consensus recommendations from Society for Airway Management. Anesthesia & Analgesia. 132 (2), 395-405 (2021).
- Higgs, A., et al. Guidelines for the management of tracheal intubation in critically ill adults. British Journal of Anaesthesia. 120 (2), 323-352 (2018).
- Apfelbaum, J. L., et al. American Society of Anesthesiologists Practice Guidelines for Management of the Difficult Airway. Anesthesiology. 136 (1), 31-81 (2022).
- Doyle, D. J. GlideScope-assisted fiberoptic intubation: A new airway teaching method. Anesthesiology. 101 (5), 1252 (2004).
- Lenhardt, R., et al. Is video laryngoscope-assisted flexible tracheoscope intubation feasible for patients with predicted difficult airway? A prospective, randomized clinical trial. Anesthesia & Analgesia. 118 (6), 1259-1265 (2014).
- Ruemmler, R., Ziebart, A., Garcia-Bardon, A., Kamuf, J., Hartmann, E. K. Standardized model of ventricular fibrillation and advanced cardiac life support in swine. Journal of Visualized Experiments. (155), e60707 (2020).
- Dodge, Y. Kolmogorov-Smirnov Test. The Concise Encyclopedia of Statistics. , 283-287 (2008).
- Ross, A., Willson, V. L. Independent Samples T-test. Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , 13-16 (2017).
- Mann, H. B., Whitney, D. R. On a test of whether one of two random variables is stochastically larger than the other. The Annals of Mathematical Statistics. 18 (1), 50-60 (1947).
- Spearman, C. The proof and measurement of association between two things. American Journal of Psychology. 100 (3-4), 441-471 (1987).
- Ziebart, A., et al. Standardized hemorrhagic shock induction guided by cerebral oximetry and extended hemodynamic monitoring in pigs. Journal of Visualized Experiments. (147), e59332 (2019).
- Kamuf, J., et al. Oleic acid-injection in pigs as a model for acute respiratory distress syndrome. Journal of Visualized Experiments. (140), e57783 (2018).
- Kurita, T., Kawashima, S., Morita, K., Nakajima, Y. Assessment of the benefits of head-up preoxygenation using near-infrared spectroscopy with pulse oximetry in a swine model. Journal of Clinical Monitoring and Computing. 35 (1), 155-163 (2021).
- Ruemmler, R., Ziebart, A., Ott, T., Dirvonskis, D., Hartmann, E. K. Flexible fibreoptic intubation in swine - Improvement for resident training and animal safety alike. BMC Anesthesiology. 20 (1), 206 (2020).
- Cook, J. A., Ramsay, C. R., Fayers, P. Using the literature to quantify the learning curve: A case study. International Journal of Technology Assessment in Health Care. 23 (2), 255-260 (2007).
- Buis, M. L., Maissan, I. M., Hoeks, S. E., Klimek, M., Stolker, R. J. Defining the learning curve for endotracheal intubation using direct laryngoscopy: A systematic review. Resuscitation. 99, 63-71 (2016).
- Knapp, S., et al. The assessment of four different methods to verify tracheal tube placement in the critical care setting. Anesthesia & Analgesia. 88 (4), 766-770 (1999).
- Schmidt, R. F. . Physiologie des Menschen. 31, (2010).
- Eberlein, C. M., Luther, I. S., Carpenter, T. A., Ramirez, L. D. First-pass success intubations using video laryngoscopy versus direct laryngoscopy: A retrospective prehospital ambulance service study. Air Medical Journal. 38 (5), 356-358 (2019).
- Lohse, J., Noppens, R. Awake video laryngoscopy - An alternative to awake fiberoptic intubation. Anasthesiologie, Intensivmedizin, Notfallmedizin, Schmerztherapie. 51 (11-12), 656-663 (2016).
- Johnson, C., Roberts, J. T. Clinical competence in the performance of fiberoptic laryngoscopy and endotracheal intubation: A study of resident instruction. Journal of Clinical Anesthesia. 1 (5), 344-349 (1989).
- Geovanini, G. R., Pinna, F. R., Prado, F. A., Tamaki, W. T., Marques, E. Standardization of anesthesia in swine for experimental cardiovascular surgeries. Revista Brasileira de Anestesiologia. 58 (4), 363-370 (2008).
Erratum
Formal Correction: Erratum: Endotracheal Intubation Using a Flexible Intubation Endoscope As a Standardized Model for Safe Airway Management in Swine
Posted by JoVE Editors on 4/03/2023. Citeable Link.
An erratum was issued for: Endotracheal Intubation Using a Flexible Intubation Endoscope As a Standardized Model for Safe Airway Management in Swine. The Protocol, Representative Results, and Discussion sections were updated.
In the Protocol, step 1.5 was updated from:
Disinfect the skin with a disinfectant (alcoholic) before inserting a peripheral vein cannula (22 G) into an ear vein. Spray the area, wipe once, then spray again, and allow the disinfectant to dry.
to:
Disinfect the skin with a disinfectant (alcoholic) before inserting a peripheral vein cannula (22 G) into an ear vein. Spray the area, wipe once, then spray again, and allow the disinfectant to dry. Secure the ear cannula with a band-aid (See Table of Materials).
In the Protocol, step 3.7 was updated from:
While maintaining the position of the endoscope, advance the endotracheal tube until it becomes visible in the camera image.
NOTE: If the endotracheal tube cannot be advanced through the glottic plane, there is a possibility that it has become caught on the arytenoid cartilage. In this case, the endotracheal tube must be withdrawn 1 cm and rotated by 90° before gently advancing again. If necessary, this maneuver can be repeated. Similar calibers of flexible intubation endoscope and endotracheal tube can minimize the risk of this issue occurring. If the endotracheal tube cannot be advanced despite this maneuver, it is likely that the subglottic narrowness-the narrowest part of the porcine larynx-cannot be passed. In this case, a smaller endotracheal tube size needs to be selected. Regular commercially available endotracheal tubes in sizes 6.5 cm or 7.0 cm ID should be able to pass the glottis as long as no anatomic abnormalities are present.
to:
While maintaining the position of the endoscope, advance the endotracheal tube until it becomes visible in the camera image.
NOTE: If the endotracheal tube cannot be advanced through the glottic plane, there is a possibility that it has become caught on the arytenoid cartilage. In this case, the endotracheal tube must be withdrawn 1 cm and rotated by 90° before gently advancing again. If necessary, this maneuver can be repeated. Similar calibers of flexible intubation endoscope and endotracheal tube can minimize the risk of this issue occurring. If the endotracheal tube cannot be advanced despite this maneuver, it is likely that the subglottic narrowness-the narrowest part of the porcine larynx-cannot be passed. In this case, a smaller endotracheal tube size needs to be selected. Regular commercially available endotracheal tubes in sizes 6.5 cm or 7.0 cm ID should be able to pass the glottis as long as no anatomic abnormalities are present. Endotracheal tube size requirements vary depending on the piglet size and breed.
In the Representative Results, the sixth paragraph was updated from:
Statistical analyses were performed using commercially available software (see Table of Materials). Normal distribution was examined using the Kolmogorov-Smirnoff test28. If a normal distribution was determined, group differences were analyzed using t-tests of independent samples29 or the Mann-Whitney U test30 for the non-parametric version. Data are presented as mean (± standard deviation). Correlations of ordinal-scale data were examined using Spearman's correlation coefficient31. A significance level of p < 0.05 was assumed.
to:
Statistical analyses were performed using commercially available software (see Table of Materials). Normal distribution was examined using the Kolmogorov-Smirnoff test28. If a normal distribution was determined, group differences were analyzed using t-tests of independent samples29 or the Mann-Whitney U test30 for the non-parametric version. Data are presented as mean (± standard deviation). Correlations of ordinal-scale data were examined using Spearman's correlation coefficient31. A significance level of p < 0.05 was assumed. All tests were performed with exploratory intention; therefore p-values are descriptive. Nevertheless, p < 0.05 was accepted as indicative of statistical significance.
In the Representative Results, the legend for figure 1 was updated from:
Figure 1: Number of intubation attempts in group comparison. For the group that was intubated using a flexible intubation endoscope, every intubation attempt was successful; in the group that was conventionally intubated, it took an average of 1.4 attempts before the endotracheal tube could be placed correctly. Error bars show the standard deviation. Please click here to view a larger version of this figure.
to:
Figure 1: Number of intubation attempts in group comparison. For the group that was intubated using a flexible intubation endoscope, every intubation attempt was successful; in the group that was conventionally intubated, it took an average of 1.4 attempts before the endotracheal tube could be placed correctly. Error bars show the standard deviation. n = 5 (for each group). Please click here to view a larger version of this figure.
In the Representative Results, figure 2 was updated from:
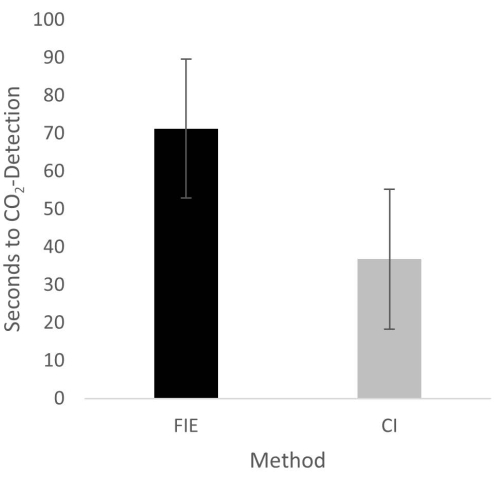
Figure 2: Time until CO2 detection in group comparison. For the group that was intubated using a flexible intubation endoscope, it took significantly longer until end-tidal CO2 could be detected, depicted as mean and standard deviation. Please click here to view a larger version of this figure.
to:
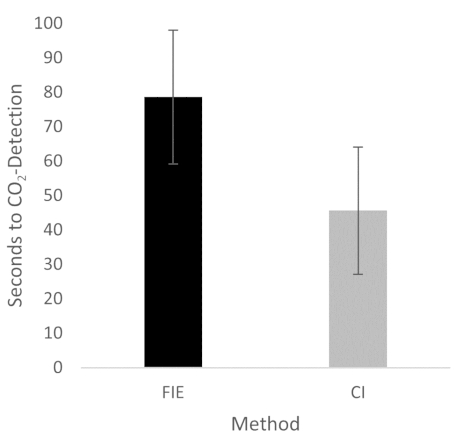
Figure 2: Time until CO2 detection in group comparison. For the group that was intubated using a flexible intubation endoscope, it took significantly longer until end-tidal CO2 could be detected, depicted as mean and standard deviation. n = 5 (for each group). Please click here to view a larger version of this figure.
In the Discussion, the fifth paragraph was updated from:
The increased duration had no clinical significance in this cohort. At no time was the termination criterion-a saturation of less than 93%-reached. This is shown in the results because a procedure change was unnecessary at any time. Prior adequate mask ventilation is a critical step to allow sufficient time for fiberoptic endotracheal tube placement to avoid rapid desaturation34. These results are consistent with previous studies comparing conventional intubation and endoscopically assisted intubations with inexperienced providers35.
to:
The increased duration had no clinical significance in this cohort. At no time was the termination criterion-a saturation of less than 93%-reached. This is shown in the results because a procedure change was unnecessary at any time. Prior adequate mask ventilation is a critical step to allow sufficient time for fiberoptic endotracheal tube placement to avoid rapid desaturation34. These results are consistent with previous studies comparing conventional intubation and endoscopically assisted intubations with inexperienced providers35. We attribute the prolonged duration of fiberoptic intubation to the fact that one must first reorient again after insertion, whereas with conventional intubation, one retains a view of the glottis. It is also important to avoid contact with the mucosa with the flexible intubation endoscope during advancement. This requires occasional corrective maneuvers. Last but not least, after successful placement, retraction of the relatively long endoscope is required, which increases the time to CO2 detection slightly.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten