È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Intubazione endotracheale utilizzando un endoscopio per intubazione flessibile come modello standardizzato per la gestione sicura delle vie aeree nei suini
In questo articolo
Erratum Notice
Riepilogo
L'uso dei maiali nella ricerca è aumentato negli ultimi anni. Tuttavia, i maiali sono caratterizzati da una difficile anatomia delle vie aeree. Dimostrando come eseguire l'intubazione endotracheale guidata endoscopicamente, il presente protocollo mira ad aumentare ulteriormente la sicurezza degli animali da laboratorio per evitare sofferenze e morti inutili.
Abstract
L'intubazione endotracheale è spesso un requisito fondamentale per la ricerca traslazionale nei modelli suini per vari interventi che richiedono una via aerea sicura o alte pressioni di ventilazione. L'intubazione endotracheale è un'abilità impegnativa, che richiede un numero minimo di intubazioni endotracheali di successo per ottenere un alto tasso di successo in condizioni ottimali, che è spesso irraggiungibile per i ricercatori non anestesiologici. A causa della specifica anatomia delle vie aeree suine, di solito si può presumere una via aerea difficile. L'impossibilità di stabilire una via aerea sicura può causare lesioni, eventi avversi o morte dell'animale da laboratorio. Utilizzando un approccio di valutazione prospettica, randomizzato e controllato, è stato dimostrato che l'intubazione endotracheale assistita da fibre ottiche richiede più tempo ma ha un tasso di successo di primo passaggio più elevato rispetto all'intubazione convenzionale senza causare cali clinicamente rilevanti nella saturazione di ossigeno. Questo modello presenta un regime standardizzato per l'intubazione endotracheale guidata endoscopicamente, fornendo una via aerea sicura, in particolare per i ricercatori che sono inesperti nella tecnica dell'intubazione endotracheale tramite laringoscopia diretta. Questa procedura dovrebbe ridurre al minimo la sofferenza degli animali e le perdite inutili degli animali.
Introduzione
L'intubazione endotracheale è spesso un requisito fondamentale per la ricerca traslazionale in modelli suini per vari interventi che richiedono una via aerea sicura o alte pressioni di ventilazione (come la ventilazione durante la rianimazione cardiopolmonare1 o la sindrome da distress respiratorio acuto2) o richiedono che il flusso sanguigno cerebrale non sia compromesso dalla compressione interna da parte di dispositivi delle vie aeree sopraglottiche3 , che sono occasionalmente propagate come alternative nel contesto di una prevista difficoltà delle vie aeree nei suini 4,5.
Mentre la fisiologia polmonare dei suini mostra caratteristiche simili a quella degli esseri umani6, la protezione delle vie aeree è a volte significativamente più difficile7 a causa di differenze specifiche nell'anatomia orotracheale suina. Il muso di un maiale ha un'apertura stretta con una lingua molto grande, la laringe è estremamente mobile e l'epiglottide è relativamente grande, con un'estremità libera che si estende fino al palato molle. Caudalmente, la laringe forma un angolo ottuso con la trachea. Le cartilagini aritenoidi sono grandi8. La parte più stretta delle vie aeree è al livello sottoglottico9, paragonabile all'anatomia delle vie aeree dei bambini10. Poiché la laringe nei suini è molto mobile, c'è il rischio che l'estremità del tubo endotracheale passi attraverso le corde vocali, ma la laringe sarà spostata caudalmente solo fino a diversi centimetri, che può essere scambiata per una corretta intubazione 8,11. Inoltre, l'intubazione esofagea è un rischio comune quando si tratta di gestione delle vie aeree suine12.
I tassi di intubazioni endotracheali difficili o impossibili con un corrispondente impatto negativo sull'esperimento o mortalità precoce non sono stati sistematicamente registrati, ma sono stati pubblicati diversi casi clinici13,14. Nell'uomo, esiste la possibilità di utilizzare un endoscopio per intubazione flessibile nel contesto di un'intubazione convenzionale inaspettatamente difficile15. Varie false intubazioni spesso precedono questa misura. Questi ripetuti tentativi di intubazione sono associati a eventi avversi nell'uomo 16,17, in particolare complicanze delle vie aeree18. Tali eventi sono deleteri negli animali da esperimento poiché, nel caso più semplice, rappresentano una variabile confondente nell'esperimento; Nel peggiore dei casi, possono portare alla perdita inutile dell'animale.
Il presente studio ha sviluppato un modello basato sulle linee guida per la gestione delle vie aeree difficili previste nell'uomo 15,19,20,21,22,23,24. In precedenza, una tecnica simile è stata descritta per l'apprendimento dell'intubazione a fibre ottiche negli studi sull'uomo25,26. Il protocollo presentato in questo rapporto mira a fornire un modello di intubazione standardizzato e facile da adattare che consenta anche agli specialisti non delle vie aeree di eseguire con successo e sicura l'intubazione endotracheale nei suini.
Protocollo
Gli esperimenti di questo protocollo sono stati approvati dal Comitato statale e istituzionale per la cura degli animali (Landesuntersuchungsamt Rheinland-Pfalz, Coblenza, Germania; approvazione n. G20-1-135). Gli esperimenti sono stati condotti seguendo le linee guida ARRIVE. Complessivamente, per il presente studio sono stati utilizzati 10 suini maschi anestetizzati (Sus scrofa domestica) con un peso medio di 30 kg ± 2 kg e 12-16 settimane di età.
1. Preparazione degli animali
- Mantenere un ambiente normale per gli animali per ridurre al minimo lo stress. Trattenere il cibo 6 ore prima dell'esperimento programmato per ridurre il rischio di aspirazione, ma consentire l'accesso all'acqua.
- Sedare i suini con un'iniezione combinata di midazolam (0,5 mg/kg) e azaperone (2-3 mg/kg) (vedere tabella dei materiali) nel muscolo gluteo o nel collo con un ago (20 G) per iniezione intramuscolare. Lasciare gli animali indisturbati fino all'inizio della sedazione (15-20 min).
NOTA: A seconda delle normative nazionali, la somministrazione di agenti sedativi può essere soggetta a controllo e può richiedere o meno la supervisione di un veterinario addestrato. Consultare le autorità locali prima di pianificare gli esperimenti. - Trasportare gli animali sedati dalle stalle al laboratorio. Il tempo di trasporto non deve superare un tempo di sedazione adeguato (qui, 30-60 min). Garantire una sufficiente ritenzione di calore in modo che l'animale non diventi ipotermico (cioè al di sotto di 38 °C), ad esempio coprendo il corpo con una coperta a seconda della temperatura esterna.
- Utilizzando un sensore (vedi Tabella dei materiali) agganciato all'orecchio o alla coda, monitorare la saturazione periferica di ossigeno (SpO2).
- Disinfettare la pelle con un disinfettante (alcolico) prima di inserire una cannula venosa periferica (22 G) in una vena dell'orecchio. Spruzzare l'area, pulire una volta, quindi spruzzare di nuovo e lasciare asciugare il disinfettante. Fissare la cannula auricolare con un cerotto (vedi tabella dei materiali).
2. Anestesia e ventilazione meccanica
- Somministrare l'analgesia attraverso un'iniezione endovenosa di 4 μg/kg di fentanil. Indurre l'anestesia con un'iniezione endovenosa di 3 mg/kg di propofol (vedere Tabella dei materiali).
NOTA: A causa dell'applicazione del bolo, il farmaco si riversa rapidamente nel compartimento attivo, fornendo un rapido inizio dell'anestesia profonda. - Metti il maiale su una barella in posizione supina e fissalo con bende. Applicare il miorilassante attraverso un'iniezione endovenosa di 0,5 mg/kg di atracurio (vedere Tabella dei materiali).
- Avviare istantaneamente la ventilazione non invasiva tramite una maschera di ventilazione per cani (vedi Tabella dei materiali) o modelli simili. Per garantire una vestibilità aderente della maschera, posizionare l'eminenza thenar e i pollici di entrambe le mani sulla parte superiore della maschera mentre si esegue la spinta della mascella con le dita rimanenti.
NOTA: Parametri di ventilazione: FiO 2 (frazione inspiratoria di ossigeno) = 100%, pressione inspiratoria di picco = <20 cmH 2 0,frequenza respiratoria = 18-20 respiri / min, PEEP (pressione positiva di fine espirazione) = 5 cmH2 0. - Mantenere l'anestesia attraverso l'infusione continua di 0,1-0,2 mg/kg/h di fentanil e 8-12 mg/kg/h di propofol. Iniziare a infondere con 5 ml/kg/h di soluzione elettrolitica bilanciata (vedere Tabella dei materiali) continuamente. Mantenere costantemente un'adeguata profondità di anestesia.
NOTA: I parametri surrogati per questo sono l'assenza di movimento, la mancanza di sforzi respiratori propri dopo l'intubazione e l'assenza di un improvviso aumento della frequenza cardiaca. Se possibile, evitare il rilassamento muscolare permanente per consentire reazioni motorie come segno di insufficiente profondità dell'anestesia.
3. Intubazione endotracheale
- Chiedi a un assistente di stare sul lato sinistro della testa. Chiedi alla mano sinistra dell'assistente di aprire la bocca e pizzicare la lingua verso l'esterno e sinistra con un impacco. Chiedi all'assistente di premere verso il basso sul labbro superiore destro con l'indice destro per fornire una migliore apertura della bocca.
- Eseguire laringoscopia diretta. Per fare ciò, inserire il laringoscopio (vedi Tabella dei materiali) nella parte destra della bocca e spingerlo in avanti mentre si spinge la lingua verso sinistra. Avanzare la punta del laringoscopio fino a quando non si appoggia nella vallecula epiglotica.
NOTA: L'epiglottide di solito oscura la glottide attaccandosi al palato molle. - Spingere con cautela l'epiglottide da parte con un filo guida del tubo (vedi Tabella dei materiali) con un leggero movimento di scooping dalla rientranza piriforme destra a sinistra lungo il palato molle.
- Passare la maniglia del laringoscopio all'assistente per fissarlo nella posizione corrente.
- Ora, prendi l'endoscopio flessibile per intubazione su cui è già stato montato un tubo endotracheale e che è collegato a un monitor video. Inserire l'endoscopio per via orale e farlo avanzare sulla base della lingua fino a visualizzare la glottide.
NOTA: Per evitare l'appannamento della fotocamera, si raccomanda l'applicazione preventiva di agenti antiappannamento (vedere la tabella dei materiali). - Far avanzare l'endoscopio tra i legamenti vocali nella trachea. Confermare l'anatomia della trachea identificando visivamente gli anelli cartilaginei e la pars membranacea. Avanzare l'endoscopio fino a quando non si appoggia sopra la carena. Cerca di non toccare la mucosa sensibile con la punta dell'endoscopio per evitare gonfiore e sanguinamento.
- Mantenendo la posizione dell'endoscopio, far avanzare il tubo endotracheale fino a quando non diventa visibile nell'immagine della fotocamera.
NOTA: Se il tubo endotracheale non può essere avanzato attraverso il piano glottico, esiste la possibilità che sia rimasto intrappolato sulla cartilagine aritenoide. In questo caso, il tubo endotracheale deve essere ritirato di 1 cm e ruotato di 90° prima di avanzare di nuovo delicatamente. Se necessario, questa manovra può essere ripetuta. Calibri simili di endoscopio flessibile per intubazione e tubo endotracheale possono ridurre al minimo il rischio che si verifichi questo problema. Se il tubo endotracheale non può essere avanzato nonostante questa manovra, è probabile che la ristrettezza sottoglottica - la parte più stretta della laringe suina - non possa essere superata. In questo caso, è necessario selezionare una dimensione del tubo endotracheale più piccola. I normali tubi endotracheali disponibili in commercio nelle dimensioni 6,5 cm o 7,0 cm ID dovrebbero essere in grado di passare la glottide finché non sono presenti anomalie anatomiche. I requisiti di dimensione del tubo endotracheale variano a seconda delle dimensioni e della razza dei suinetti. - Prelevare l'endoscopio flessibile per intubazione mantenendo la posizione del tubo endotracheale.
- Utilizzando una siringa da 10 ml, gonfiare il bracciale con 10 ml di aria. Controllare la pressione del bracciale con un gestore del bracciale (valore target: 30 cmH2O, vedi tabella dei materiali).
- Confermare il corretto posizionamento del tubo endotracheale e un'adeguata ventilazione mediante espirazione periodica e regolare di anidride carbonica tramite capnografia24 e ventilazione bifacciale tramite auscultazione15.
- Avviare la ventilazione meccanica dopo aver collegato il tubo con un ventilatore (PEEP = 5 cmH 2 O, frequenza respiratoria = variabile per ottenere un CO2 corrente di fine marea di <6 kPa, di solito 30-50 min−1, FiO 2 = 0,4, I:E (rapporto inspirazione/espirazione) = 1:2, volume corrente = 6-8 ml/kg).
- Espandere il monitoraggio (ad esempio, l'istituzione di una misurazione della pressione arteriosa intra-arteriosa, l'installazione di un catetere arterioso venoso o polmonare centrale27) o continuare con l'intervento.
NOTA: A seconda della domanda degli ulteriori esperimenti, definire i valori limite per i parametri vitali e le opzioni di intervento e stabilire il monitoraggio di conseguenza nel protocollo di studio.
Risultati
L'intubazione endotracheale è stata eseguita su 10 suini maschi (età 12-16 settimane, peso 30 kg ± 3 kg) in un ambiente di studio prospettico, randomizzato e controllato. I suini sono stati randomizzati in due gruppi: uno era convenzionalmente laringoscopicamente intubato (gruppo CI) e l'altro gruppo è stato intubato assistito tramite un endoscopio di intubazione flessibile come descritto nel protocollo (gruppo FIE). L'assegnazione del gruppo è stata effettuata tirando buste sigillate. L'investigatore è st...
Discussione
In studi precedenti, il nostro gruppo di ricerca ha già descritto dettagli specifici riguardanti i benefici traslazionali del modello suino 2,27,32,33. In generale, ridurre il livello di stress dell'animale e il dolore inutile dovrebbe essere parte integrante di qualsiasi protocollo di studio ed è fondamentale per generare dati riproducibili in modo affidabile. Pertanto, l'intubazione endosco...
Divulgazioni
L'endoscopio flessibile per intubazione e i suoi accessori sono stati forniti incondizionatamente dal produttore solo a scopo di ricerca. Gli autori non dichiarano ulteriori conflitti di interesse finanziari o di altro tipo.
Riconoscimenti
Gli autori vogliono ringraziare Dagmar Dirvonskis per il suo eccellente supporto tecnico.
Materiali
| Name | Company | Catalog Number | Comments |
| Ambu aScope Regular | Ambu GmbH, Medizinprodukte, Bad Nauheim, Germany | Disposable fiber optic outer diameter 5 mm | |
| Ambu aView Monitor | Ambu GmbH, Medizinprodukte, Bad Nauheim, Germany | monitor | |
| Atracurium Hikma 50 mg/5mL | Hikma Pharma GmbH, Martinsried | atracurium | |
| Azaperone (Stresnil) 40mg/mL | Lilly Deutschland GmbH, Bad Homburg, Germany | azaperone | |
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy, AB Helsingborg, Schweden | 3-way-stopcock | |
| BD Microlance 3 20 G | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | cannula | |
| Curafix i.v. classics | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Cannula retention dressing | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| IBM SPSS Statistics for Windows, Version 20 | IBM SPSS Statistics for Windows, Version 20.0. Armonk, NY: IBM Corp.) | Statistical software | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland, GmbH | perfusor line | |
| Intrafix Primeline | B. Braun Melsungen AG, Melsungen, Germany | Infusion line | |
| JOZA Einmal Nitril Untersuchungshandschuhe | JOZA, München, Germany | disposable gloves | |
| Laryngoscope, 45.48.50, KL 2000 | Medicon | Laryngoscope handle | |
| Littmann Classic III Stethoscope | 3M Deutschland GmbH, Neuss, Germany | stethoscope | |
| Luer Lock | B.Braun Melsungen AG, Germany | ||
| Maimed Vlieskompresse | Maimed GmbH, Neuenkirchen, Germany | Fleece compress to fix the tongue | |
| Masimo LNCS Adtx SpO2 sensor | Masimo Corporation Irvine, Ca 92618 USA | saturation clip for the tail | |
| Masimo LNCS TC-I SpO2 ear clip sensor | Masimo Corporation Irvine, Ca 92618 USA | Saturation clip for the ear | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Midazolam 15 mg/3 mL | Hameln Pharma GmbH, Hameln, Germany | midazolam | |
| Midmark Canine Mask Small Plastic with Diaphragm FRSCM-0005 | Midmark Corp., Dayton, Ohio, USA | dog ventilation mask | |
| Octeniderm farblos | Schülke & Mayr GmbH, Nordenstedt, Germany | Alcoholic disinfectant | |
| Original Perfusor syringe 50 mL | B.Braun Melsungen AG, Germany | perfusor syringe | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| Propofol 2% 20 mg/mL (50 mL flasks) | Fresenius, Kabi Deutschland, GmbH | propofol | |
| RÜSCH Führungsstab für Endotrachealtubus (ID 5.6 mm) | Teleflex Medical Sdn. Bhd, Malaysia | PVC coated tube guiding wire | |
| Rüschelit Super Safety Clear >ID 6/6.5 /7.0 mm | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Stainless Macintosh Größe 4 | Welch Allyn69604 | blade for laryngoscope | |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | Balanced electrolyte solution | |
| Ultrastop Antibeschlagmittel bottle with dropper 25 mL | Sigmapharm Arzneimittel GmbH, Wien, Austria | Antifog agent | |
| Vasofix Safety 22 G-16 G | B.Braun Melsungen AG, Germany | venous catheter | |
| VBM Cuff Manometer | VBM Medizintechnik GmbH, Sulz a.N., Germany | cuff pressure gauge | |
| Zelette | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Tissue swab |
Riferimenti
- Kleinman, M. E., Oh, W., Stonestreet, B. S. Comparison of intravenous and endotracheal epinephrine during cardiopulmonary resuscitation in newborn piglets. Critical Care Medicine. 27 (12), 2748-2754 (1999).
- Rissel, R., et al. Bronchoalveolar lavage and oleic acid-injection in pigs as a double-hit model for acute respiratory distress syndrome (ARDS). Journal of Visualized Experiments. (159), e61358 (2020).
- Segal, N., et al. Impairment of carotid artery blood flow by supraglottic airway use in a swine model of cardiac arrest. Resuscitation. 83 (8), 1025-1030 (2012).
- Goldmann, K., Kalinowski, M., Kraft, S. Airway management under general anaesthesia in pigs using the LMA-ProSeal: A pilot study. Veterinary Anaesthesia and Analgesia. 32 (5), 308-313 (2005).
- Wemyss-Holden, S. A., Porter, K. J., Baxter, P., Rudkin, G. E., Maddern, G. J. The laryngeal mask airway in experimental pig anaesthesia. Lab Animal. 33 (1), 30-34 (1999).
- Kobayashi, E., Hishikawa, S., Teratani, T., Lefor, A. T. The pig as a model for translational research: overview of porcine animal models at Jichi Medical University. Transplantation Research. 1 (1), 8 (2012).
- Judge, E. P., et al. Anatomy and bronchoscopy of the porcine lung. A model for translational respiratory medicine. American Journal of Respiratory Cell and Molecular Biology. 51 (3), 334-343 (2014).
- Dondelinger, R. F., et al. Relevant radiological anatomy of the pig as a training model in interventional radiology. European Radiology. 8 (7), 1254-1273 (1998).
- Nickel, R., Schummer, A., Seiferle, E. . Lehrbuch der Anatomie der Haustiere, Band I: Bewegungsapparat. , (2003).
- Wani, T. M., Rafiq, M., Akhter, N., AlGhamdi, F. S., Tobias, J. D. Upper airway in infants-A computed tomography-based analysis. Paediatric Anaesthesia. 27 (5), 501-505 (2017).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Ettrup, K. S., et al. Basic surgical techniques in the Göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. Journal of Visualized Experiments. (52), e2652 (2011).
- Steinbacher, R., von Ritgen, S., Moens, Y. P. S. Laryngeal perforation during a standard intubation procedure in a pig. Laboratory Animals. 46 (3), 261-263 (2012).
- Iliff-Sizemore, S. A., Chrisp, C. E., Rush, H. G. Peritracheolaryngeal abscess: An iatrogenic complication of endotracheal intubation in swine. Laboratory Animal Science. 39 (5), 455-458 (1989).
- Piepho, T., et al. S1 guidelines on airway management. Der Anaesthesist. 64 (11), 859-873 (2015).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesthesia & Analgesia. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Annals of Emergency Medicine. 60 (6), 749-754 (2012).
- Martin, L. D., Mhyre, J. M., Shanks, A. M., Tremper, K. K., Kheterpal, S. 3,423 emergency tracheal intubations at a university hospital: airway outcomes and complications. Anesthesiology. 114 (1), 42-48 (2011).
- Ahmad, I., et al. Difficult Airway Society guidelines for awake tracheal intubation (ATI) in adults. Anaesthesia. 75 (4), 509-528 (2020).
- Frerk, C., et al. Difficult Airway Society 2015 guidelines for management of unanticipated difficult intubation in adults. British Journal of Anaesthesia. 115 (6), 827-848 (2015).
- Cook, T. M., et al. Consensus guidelines for managing the airway in patients with COVID-19: Guidelines from the Difficult Airway Society, the Association of Anaesthetists the Intensive Care Society, the Faculty of Intensive Care Medicine and the Royal College of Anaesthetists. Anaesthesia. 75 (6), 785-799 (2020).
- Kornas, R. L., Owyang, C. G., Sakles, J. C., Foley, L. J., Mosier, J. M. Evaluation and management of the physiologically difficult airway: Consensus recommendations from Society for Airway Management. Anesthesia & Analgesia. 132 (2), 395-405 (2021).
- Higgs, A., et al. Guidelines for the management of tracheal intubation in critically ill adults. British Journal of Anaesthesia. 120 (2), 323-352 (2018).
- Apfelbaum, J. L., et al. American Society of Anesthesiologists Practice Guidelines for Management of the Difficult Airway. Anesthesiology. 136 (1), 31-81 (2022).
- Doyle, D. J. GlideScope-assisted fiberoptic intubation: A new airway teaching method. Anesthesiology. 101 (5), 1252 (2004).
- Lenhardt, R., et al. Is video laryngoscope-assisted flexible tracheoscope intubation feasible for patients with predicted difficult airway? A prospective, randomized clinical trial. Anesthesia & Analgesia. 118 (6), 1259-1265 (2014).
- Ruemmler, R., Ziebart, A., Garcia-Bardon, A., Kamuf, J., Hartmann, E. K. Standardized model of ventricular fibrillation and advanced cardiac life support in swine. Journal of Visualized Experiments. (155), e60707 (2020).
- Dodge, Y. Kolmogorov-Smirnov Test. The Concise Encyclopedia of Statistics. , 283-287 (2008).
- Ross, A., Willson, V. L. Independent Samples T-test. Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , 13-16 (2017).
- Mann, H. B., Whitney, D. R. On a test of whether one of two random variables is stochastically larger than the other. The Annals of Mathematical Statistics. 18 (1), 50-60 (1947).
- Spearman, C. The proof and measurement of association between two things. American Journal of Psychology. 100 (3-4), 441-471 (1987).
- Ziebart, A., et al. Standardized hemorrhagic shock induction guided by cerebral oximetry and extended hemodynamic monitoring in pigs. Journal of Visualized Experiments. (147), e59332 (2019).
- Kamuf, J., et al. Oleic acid-injection in pigs as a model for acute respiratory distress syndrome. Journal of Visualized Experiments. (140), e57783 (2018).
- Kurita, T., Kawashima, S., Morita, K., Nakajima, Y. Assessment of the benefits of head-up preoxygenation using near-infrared spectroscopy with pulse oximetry in a swine model. Journal of Clinical Monitoring and Computing. 35 (1), 155-163 (2021).
- Ruemmler, R., Ziebart, A., Ott, T., Dirvonskis, D., Hartmann, E. K. Flexible fibreoptic intubation in swine - Improvement for resident training and animal safety alike. BMC Anesthesiology. 20 (1), 206 (2020).
- Cook, J. A., Ramsay, C. R., Fayers, P. Using the literature to quantify the learning curve: A case study. International Journal of Technology Assessment in Health Care. 23 (2), 255-260 (2007).
- Buis, M. L., Maissan, I. M., Hoeks, S. E., Klimek, M., Stolker, R. J. Defining the learning curve for endotracheal intubation using direct laryngoscopy: A systematic review. Resuscitation. 99, 63-71 (2016).
- Knapp, S., et al. The assessment of four different methods to verify tracheal tube placement in the critical care setting. Anesthesia & Analgesia. 88 (4), 766-770 (1999).
- Schmidt, R. F. . Physiologie des Menschen. 31, (2010).
- Eberlein, C. M., Luther, I. S., Carpenter, T. A., Ramirez, L. D. First-pass success intubations using video laryngoscopy versus direct laryngoscopy: A retrospective prehospital ambulance service study. Air Medical Journal. 38 (5), 356-358 (2019).
- Lohse, J., Noppens, R. Awake video laryngoscopy - An alternative to awake fiberoptic intubation. Anasthesiologie, Intensivmedizin, Notfallmedizin, Schmerztherapie. 51 (11-12), 656-663 (2016).
- Johnson, C., Roberts, J. T. Clinical competence in the performance of fiberoptic laryngoscopy and endotracheal intubation: A study of resident instruction. Journal of Clinical Anesthesia. 1 (5), 344-349 (1989).
- Geovanini, G. R., Pinna, F. R., Prado, F. A., Tamaki, W. T., Marques, E. Standardization of anesthesia in swine for experimental cardiovascular surgeries. Revista Brasileira de Anestesiologia. 58 (4), 363-370 (2008).
Erratum
Formal Correction: Erratum: Endotracheal Intubation Using a Flexible Intubation Endoscope As a Standardized Model for Safe Airway Management in Swine
Posted by JoVE Editors on 4/03/2023. Citeable Link.
An erratum was issued for: Endotracheal Intubation Using a Flexible Intubation Endoscope As a Standardized Model for Safe Airway Management in Swine. The Protocol, Representative Results, and Discussion sections were updated.
In the Protocol, step 1.5 was updated from:
Disinfect the skin with a disinfectant (alcoholic) before inserting a peripheral vein cannula (22 G) into an ear vein. Spray the area, wipe once, then spray again, and allow the disinfectant to dry.
to:
Disinfect the skin with a disinfectant (alcoholic) before inserting a peripheral vein cannula (22 G) into an ear vein. Spray the area, wipe once, then spray again, and allow the disinfectant to dry. Secure the ear cannula with a band-aid (See Table of Materials).
In the Protocol, step 3.7 was updated from:
While maintaining the position of the endoscope, advance the endotracheal tube until it becomes visible in the camera image.
NOTE: If the endotracheal tube cannot be advanced through the glottic plane, there is a possibility that it has become caught on the arytenoid cartilage. In this case, the endotracheal tube must be withdrawn 1 cm and rotated by 90° before gently advancing again. If necessary, this maneuver can be repeated. Similar calibers of flexible intubation endoscope and endotracheal tube can minimize the risk of this issue occurring. If the endotracheal tube cannot be advanced despite this maneuver, it is likely that the subglottic narrowness-the narrowest part of the porcine larynx-cannot be passed. In this case, a smaller endotracheal tube size needs to be selected. Regular commercially available endotracheal tubes in sizes 6.5 cm or 7.0 cm ID should be able to pass the glottis as long as no anatomic abnormalities are present.
to:
While maintaining the position of the endoscope, advance the endotracheal tube until it becomes visible in the camera image.
NOTE: If the endotracheal tube cannot be advanced through the glottic plane, there is a possibility that it has become caught on the arytenoid cartilage. In this case, the endotracheal tube must be withdrawn 1 cm and rotated by 90° before gently advancing again. If necessary, this maneuver can be repeated. Similar calibers of flexible intubation endoscope and endotracheal tube can minimize the risk of this issue occurring. If the endotracheal tube cannot be advanced despite this maneuver, it is likely that the subglottic narrowness-the narrowest part of the porcine larynx-cannot be passed. In this case, a smaller endotracheal tube size needs to be selected. Regular commercially available endotracheal tubes in sizes 6.5 cm or 7.0 cm ID should be able to pass the glottis as long as no anatomic abnormalities are present. Endotracheal tube size requirements vary depending on the piglet size and breed.
In the Representative Results, the sixth paragraph was updated from:
Statistical analyses were performed using commercially available software (see Table of Materials). Normal distribution was examined using the Kolmogorov-Smirnoff test28. If a normal distribution was determined, group differences were analyzed using t-tests of independent samples29 or the Mann-Whitney U test30 for the non-parametric version. Data are presented as mean (± standard deviation). Correlations of ordinal-scale data were examined using Spearman's correlation coefficient31. A significance level of p < 0.05 was assumed.
to:
Statistical analyses were performed using commercially available software (see Table of Materials). Normal distribution was examined using the Kolmogorov-Smirnoff test28. If a normal distribution was determined, group differences were analyzed using t-tests of independent samples29 or the Mann-Whitney U test30 for the non-parametric version. Data are presented as mean (± standard deviation). Correlations of ordinal-scale data were examined using Spearman's correlation coefficient31. A significance level of p < 0.05 was assumed. All tests were performed with exploratory intention; therefore p-values are descriptive. Nevertheless, p < 0.05 was accepted as indicative of statistical significance.
In the Representative Results, the legend for figure 1 was updated from:
Figure 1: Number of intubation attempts in group comparison. For the group that was intubated using a flexible intubation endoscope, every intubation attempt was successful; in the group that was conventionally intubated, it took an average of 1.4 attempts before the endotracheal tube could be placed correctly. Error bars show the standard deviation. Please click here to view a larger version of this figure.
to:
Figure 1: Number of intubation attempts in group comparison. For the group that was intubated using a flexible intubation endoscope, every intubation attempt was successful; in the group that was conventionally intubated, it took an average of 1.4 attempts before the endotracheal tube could be placed correctly. Error bars show the standard deviation. n = 5 (for each group). Please click here to view a larger version of this figure.
In the Representative Results, figure 2 was updated from:
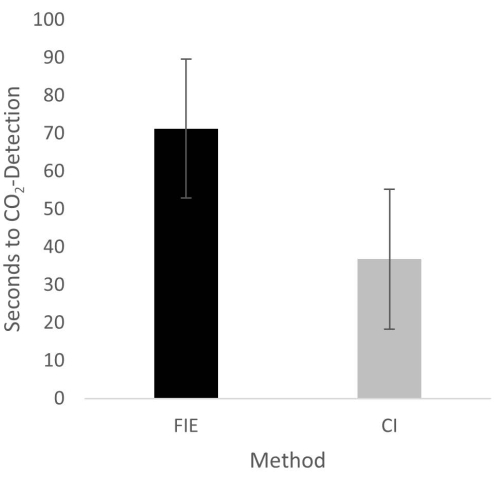
Figure 2: Time until CO2 detection in group comparison. For the group that was intubated using a flexible intubation endoscope, it took significantly longer until end-tidal CO2 could be detected, depicted as mean and standard deviation. Please click here to view a larger version of this figure.
to:
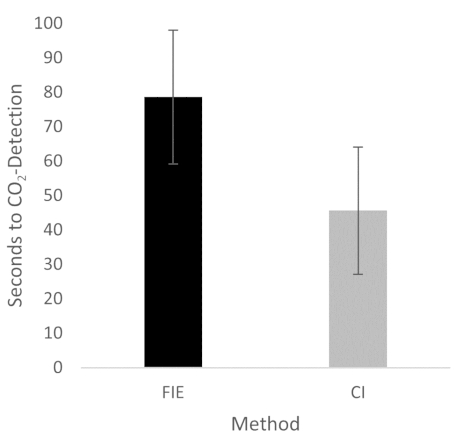
Figure 2: Time until CO2 detection in group comparison. For the group that was intubated using a flexible intubation endoscope, it took significantly longer until end-tidal CO2 could be detected, depicted as mean and standard deviation. n = 5 (for each group). Please click here to view a larger version of this figure.
In the Discussion, the fifth paragraph was updated from:
The increased duration had no clinical significance in this cohort. At no time was the termination criterion-a saturation of less than 93%-reached. This is shown in the results because a procedure change was unnecessary at any time. Prior adequate mask ventilation is a critical step to allow sufficient time for fiberoptic endotracheal tube placement to avoid rapid desaturation34. These results are consistent with previous studies comparing conventional intubation and endoscopically assisted intubations with inexperienced providers35.
to:
The increased duration had no clinical significance in this cohort. At no time was the termination criterion-a saturation of less than 93%-reached. This is shown in the results because a procedure change was unnecessary at any time. Prior adequate mask ventilation is a critical step to allow sufficient time for fiberoptic endotracheal tube placement to avoid rapid desaturation34. These results are consistent with previous studies comparing conventional intubation and endoscopically assisted intubations with inexperienced providers35. We attribute the prolonged duration of fiberoptic intubation to the fact that one must first reorient again after insertion, whereas with conventional intubation, one retains a view of the glottis. It is also important to avoid contact with the mucosa with the flexible intubation endoscope during advancement. This requires occasional corrective maneuvers. Last but not least, after successful placement, retraction of the relatively long endoscope is required, which increases the time to CO2 detection slightly.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon