このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ブタの安全な気道管理のための標準化モデルとしての柔軟な挿管内内視鏡を使用した気管内挿管
Erratum Notice
要約
研究における豚の使用は近年増加しています。それにもかかわらず、ブタは困難な気道解剖学的構造を特徴としています。内視鏡ガイド下気管内挿管を行う方法を実証することにより、本プロトコルは、実験動物の安全性をさらに高め、動物の苦痛や不必要な死を回避することを目的としています。
要約
気管内挿管は、安全な気道または高い換気圧を必要とするさまざまな介入のためのブタモデルにおけるトランスレーショナル研究の基本的な要件であることがよくあります。気管内挿管は困難なスキルであり、最適な条件下で高い成功率を達成するためには、気管内挿管の成功回数を最小限に抑える必要がありますが、これは非麻酔学の研究者にとっては達成できないことがよくあります。特定のブタ気道解剖学的構造のために、困難な気道が通常想定され得る。安全な気道を確立することが不可能であると、実験動物の怪我、有害事象、または死亡につながる可能性があります。前向き無作為化制御評価アプローチを使用すると、光ファイバー支援気管内挿管には時間がかかりますが、臨床的に関連する酸素飽和度の低下を引き起こすことなく、従来の挿管よりも初回通過成功率が高いことが示されています。このモデルは、内視鏡ガイド気管内挿管の標準化されたレジメンを提示し、特に直接喉頭鏡 検査による 気管内挿管の技術に不慣れな研究者に安全な気道を提供します。この手順は、動物の苦しみと不必要な動物の損失を最小限に抑えることが期待されています。
概要
気管内挿管は、気道の確保または高い換気圧(心肺蘇生法中の換気1や急性呼吸窮迫症候群2など)を必要とするさまざまな介入、または声門上気道装置による内部圧迫によって脳血流が損なわれないことを必要とするさまざまな介入のためのブタモデルにおけるトランスレーショナル研究の基本的な要件であることがよくあります3これは、ブタ4,5で予想される困難な気道の文脈で代替として時折伝播されます。
ブタの肺生理機能はヒトと同様の特徴を示していますが6、ブタの口腔気管解剖学的構造の特定の違いにより、気道の確保が著しく困難な場合があります7。ブタの鼻は非常に大きな舌を有する狭い開口部を有し、喉頭は非常に可動性であり、そして喉頭蓋は比較的大きく、軟口蓋まで伸びる自由端を有する。尾側では、喉頭は気管と鈍角を形成します。披裂軟骨は大きい 8.気道の最も狭い部分は声門下レベル9であり、子供の気道解剖学的構造に匹敵します10。ブタの喉頭は非常に可動性であるため、気管内チューブの端が声帯を通過するリスクがありますが、喉頭は最大数センチメートルしか尾側に変位せず、正しい挿管と間違われる可能性があります8,11。さらに、食道挿管は、ブタの気道管理を扱う際の一般的なリスクです12。
実験または早期死亡率に対応する悪影響を伴う困難または不可能な気管内挿管の割合は体系的に記録されていませんが、いくつかの症例報告が発表されています13,14。ヒトにおいて、予想外に困難な従来の挿管15の状況において可撓性挿管内視鏡を使用する可能性がある。さまざまな誤った挿管がこの措置に先行することがよくあります。これらの反復挿管の試みは、ヒトにおける有害事象と関連している16、17、特に気道合併症18。このようなイベントは、最も単純なケースでは実験の交絡変数を表すため、試験動物では有害です。最悪の場合、それらは動物の不必要な損失につながる可能性があります。
本研究では、ヒトにおいて予想される困難な気道管理のガイドラインに基づいてモデルを開発しました15、19、20、21、22、23、24。以前、同様の技術が人間の研究で光ファイバー挿管を学習するために説明されています25,26。このレポートで提示されたプロトコルは、標準化された適応が容易な挿管モデルを提供することを目的としており、気道以外の専門家がブタの気管内挿管を成功裏に安全に実行できるようにします。
プロトコル
このプロトコルの実験は、州および施設の動物管理委員会(ドイツ、コブレンツ、ラインラントプファルツ、承認番号G20-1-135)によって承認されました。実験はARRIVEガイドラインに従って実施した。全体として、平均体重30 kg±2 kg、12〜16週齢の麻酔をかけた雄豚10頭(Sus scrofa domestic a)が本研究に使用されました。
1.動物の準備
- ストレスを最小限に抑えるために、動物が通常の環境を維持します。誤嚥のリスクを下げるために、予定された実験の6時間前に食物を差し控えますが、水へのアクセスを許可します。
- ミダゾラム(0.5 mg / kg)とアザペロン(2-3 mg / kg)の併用注射( 材料表を参照)でブタを鎮静させ、筋肉内注射用の針(20 G)で臀筋または首に注射します。.鎮静が始まるまで(15〜20分)、動物を邪魔しないでください。
注:国の規制によっては、鎮静剤の投与が精査の対象となる場合があり、訓練を受けた獣医師の監督が必要な場合と不要な場合があります。実験を計画する前に、地方自治体に相談してください。 - 鎮静動物を厩舎から実験室に輸送します。輸送時間は適切な鎮静時間(ここでは30〜60分)を超えてはなりません。外気温に応じて毛布で体を覆うなど、動物が低体温(38°C未満)にならないように十分な保温を確保してください。
- 耳または尾にクリップされたセンサー( 材料の表を参照)を使用して、末梢酸素飽和度(SpO2)を監視します。
- 末梢静脈カニューレ(22 G)を耳の静脈に挿入する前に、消毒剤(アルコール性)で皮膚を消毒します。その領域にスプレーし、一度拭いてからもう一度スプレーし、消毒剤を乾燥させます。耳カニューレをバンドエイドで固定します(材料の表を参照)。
2.麻酔と機械的換気
- 4μg/ kgのフェンタニルの静脈内注射を通じて鎮痛を投与します。.3 mg / kgのプロポフォールを静脈内注射して麻酔を誘発します( 材料の表を参照)。
注:ボーラスの適用により、薬物はすぐに活性コンパートメントに溢れ込み、深部麻酔の迅速な開始を提供します。 - 豚を仰臥位の担架に置き、包帯で固定します。アトラクリウム0.5 mg / kgの静脈内注射を通じて筋弛緩剤を適用します( 材料の表を参照)。.
- 犬の換気マスク(材料の表を参照)または同様のモデルを介して、非侵襲的換気を即座に開始します。マスクをしっかりとフィットさせるには、残りの指で顎を突き刺しながら、テナールの隆起と両手の親指をマスクの上に置きます。
注:換気パラメータ:FiO 2(吸気圧分率)= 100%、ピーク吸気圧= <20 cmH 2 0、呼吸数=18-20呼吸/分、PEEP(呼気終末陽圧)= 5 cmH2 0。 - 0.1〜0.2 mg / kg / hのフェンタニルと8〜12 mg / kg / hのプロポフォールの連続注入により麻酔を維持します。.5 mL / kg / hのバランスの取れた電解質溶液( 材料の表を参照)を継続的に注入し始めます。常に適切な麻酔深度を維持します。
注:このための代理パラメータは、動きの欠如、挿管後の自身の呼吸努力の欠如、および心拍数の突然の増加の欠如です。可能であれば、麻酔の深さが不十分な兆候として運動反応を可能にするために、恒久的な筋肉の弛緩を避けてください。
3.気管内挿管
- アシスタントを頭の左側に立たせます。アシスタントの左手で口を開け、舌を外側につまんで左に湿布します。アシスタントに、右人差し指で右上唇を押し下げて、口の開口部を改善するように依頼します。
- 直接喉頭鏡検査を行います。これを行うには、喉頭鏡( 材料の表を参照)を口の右側に挿入し、舌を左に押しながら前方に押します。喉頭鏡の先端を喉頭蓋弁に収まるまで進めます。
注:喉頭蓋は通常、軟口蓋に付着することによって声門を覆い隠します。 - チューブガイドワイヤー( 材料の表を参照)で喉頭蓋を慎重に脇に押し、軟口蓋に沿って右の梨状くぼみから左に穏やかですくい取ります。
- 喉頭鏡のハンドルをアシスタントに渡して、現在の位置に固定します。
- 次に、気管内チューブがすでに取り付けられ、ビデオモニターに接続されている柔軟な挿管内視鏡を取ります。内視鏡を経口的に挿入し、声門が視覚化されるまで舌の付け根の上に進めます。
注意: カメラの曇りを防ぐために、防曇剤( 材料の表を参照)を事前に塗布することをお勧めします。 - 声靭帯の間の内視鏡を気管に進めます。軟骨リングと膜性を視覚的に識別することにより、気管の解剖学的構造を確認します。内視鏡がカリナの上に載るまで進めます。腫れや出血を避けるために、内視鏡の先端で敏感な粘膜に触れないようにしてください。
- 内視鏡の位置を維持しながら、カメラ画像で見えるようになるまで気管内チューブを進めます。
注:気管内チューブが声門面を通って前進できない場合は、披裂軟骨に引っかかっている可能性があります。この場合、気管内チューブを1cm引き出し、90°回転させてから、再びゆっくりと前進させる必要があります。必要に応じて、この操作を繰り返すことができます。柔軟な挿管内視鏡と気管内チューブの同様の口径は、この問題が発生するリスクを最小限に抑えることができます。この操作にもかかわらず気管内チューブを進めることができない場合、ブタの喉頭の最も狭い部分である声門下狭窄を通過できない可能性があります。この場合、より小さな気管内チューブサイズを選択する必要があります。サイズ6.5cmまたは7.0cmのIDの通常の市販の気管内チューブは、解剖学的異常がない限り、声門を通過できるはずです。気管内チューブのサイズ要件は、子豚のサイズと品種によって異なります。 - 気管内チューブの位置を維持しながら、柔軟な挿管内視鏡を引き出します。
- 10 mLシリンジを使用して、10 mLの空気でカフを膨らませます。カフマネージャーでカフ圧力を制御します(目標値:30 cmH2O、 材料表を参照)。
- カプノグラフィ24による二酸化炭素の定期的かつ定期的な呼気と聴診15による両面換気により、気管内チューブの正しい配置と適切な換気を確認します。
- チューブを人工呼吸器に接続した後、機械的換気を開始します(PEEP = 5 cmH 2 O、呼吸数=可変で、潮汐末CO 2<6 kPa、通常30〜50分-1、FiO 2 = 0.4、I:E(吸気と呼気の比率)= 1:2、一回換気量= 6-8 mL / kg)。
- モニタリングを拡大するか(例えば、動脈内血圧測定値の確立、中心静脈または肺動脈カテーテル27の設置)、または介入を継続する。
注:さらなる実験の問題に応じて、バイタルパラメータと介入オプションの限界値を定義し、それに応じてモニタリングを確立します 研究プロトコルで。
結果
気管内挿管は、前向き無作為化対照研究設定で、10頭の雄豚(12〜16週齢、体重30 kg±3 kg)で実施されました。.ブタは2つのグループに無作為化されました:1つは従来の喉頭鏡下で挿管され(CIグループ)、もう1つのグループはプロトコルに記載されているように柔軟な挿管内視鏡 を介して 挿管支援されました(FIEグループ)。グループの割り当ては、封印された封筒を引っ張ることによって行?...
ディスカッション
これまでの研究では、ブタモデル2,27,32,33の翻訳上の利点に関する具体的な詳細をすでに説明しています。一般に、動物のストレスレベルと不必要な痛みを減らすことは、あらゆる研究プロトコルの不可欠な部分であるべきであり、確実に再現可能なデータを生成するために最も重要です。したが...
開示事項
柔軟な挿管内視鏡とその付属品は、研究目的でのみメーカーから無条件に提供されています。著者らは、これ以上の金銭的またはその他の利益相反を宣言しません。
謝辞
著者は、ダグマー・ディルボンスキーの優れた技術サポートに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Ambu aScope Regular | Ambu GmbH, Medizinprodukte, Bad Nauheim, Germany | Disposable fiber optic outer diameter 5 mm | |
| Ambu aView Monitor | Ambu GmbH, Medizinprodukte, Bad Nauheim, Germany | monitor | |
| Atracurium Hikma 50 mg/5mL | Hikma Pharma GmbH, Martinsried | atracurium | |
| Azaperone (Stresnil) 40mg/mL | Lilly Deutschland GmbH, Bad Homburg, Germany | azaperone | |
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy, AB Helsingborg, Schweden | 3-way-stopcock | |
| BD Microlance 3 20 G | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | cannula | |
| Curafix i.v. classics | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Cannula retention dressing | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| IBM SPSS Statistics for Windows, Version 20 | IBM SPSS Statistics for Windows, Version 20.0. Armonk, NY: IBM Corp.) | Statistical software | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland, GmbH | perfusor line | |
| Intrafix Primeline | B. Braun Melsungen AG, Melsungen, Germany | Infusion line | |
| JOZA Einmal Nitril Untersuchungshandschuhe | JOZA, München, Germany | disposable gloves | |
| Laryngoscope, 45.48.50, KL 2000 | Medicon | Laryngoscope handle | |
| Littmann Classic III Stethoscope | 3M Deutschland GmbH, Neuss, Germany | stethoscope | |
| Luer Lock | B.Braun Melsungen AG, Germany | ||
| Maimed Vlieskompresse | Maimed GmbH, Neuenkirchen, Germany | Fleece compress to fix the tongue | |
| Masimo LNCS Adtx SpO2 sensor | Masimo Corporation Irvine, Ca 92618 USA | saturation clip for the tail | |
| Masimo LNCS TC-I SpO2 ear clip sensor | Masimo Corporation Irvine, Ca 92618 USA | Saturation clip for the ear | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Midazolam 15 mg/3 mL | Hameln Pharma GmbH, Hameln, Germany | midazolam | |
| Midmark Canine Mask Small Plastic with Diaphragm FRSCM-0005 | Midmark Corp., Dayton, Ohio, USA | dog ventilation mask | |
| Octeniderm farblos | Schülke & Mayr GmbH, Nordenstedt, Germany | Alcoholic disinfectant | |
| Original Perfusor syringe 50 mL | B.Braun Melsungen AG, Germany | perfusor syringe | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| Propofol 2% 20 mg/mL (50 mL flasks) | Fresenius, Kabi Deutschland, GmbH | propofol | |
| RÜSCH Führungsstab für Endotrachealtubus (ID 5.6 mm) | Teleflex Medical Sdn. Bhd, Malaysia | PVC coated tube guiding wire | |
| Rüschelit Super Safety Clear >ID 6/6.5 /7.0 mm | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Stainless Macintosh Größe 4 | Welch Allyn69604 | blade for laryngoscope | |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | Balanced electrolyte solution | |
| Ultrastop Antibeschlagmittel bottle with dropper 25 mL | Sigmapharm Arzneimittel GmbH, Wien, Austria | Antifog agent | |
| Vasofix Safety 22 G-16 G | B.Braun Melsungen AG, Germany | venous catheter | |
| VBM Cuff Manometer | VBM Medizintechnik GmbH, Sulz a.N., Germany | cuff pressure gauge | |
| Zelette | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Tissue swab |
参考文献
- Kleinman, M. E., Oh, W., Stonestreet, B. S. Comparison of intravenous and endotracheal epinephrine during cardiopulmonary resuscitation in newborn piglets. Critical Care Medicine. 27 (12), 2748-2754 (1999).
- Rissel, R., et al. Bronchoalveolar lavage and oleic acid-injection in pigs as a double-hit model for acute respiratory distress syndrome (ARDS). Journal of Visualized Experiments. (159), e61358 (2020).
- Segal, N., et al. Impairment of carotid artery blood flow by supraglottic airway use in a swine model of cardiac arrest. Resuscitation. 83 (8), 1025-1030 (2012).
- Goldmann, K., Kalinowski, M., Kraft, S. Airway management under general anaesthesia in pigs using the LMA-ProSeal: A pilot study. Veterinary Anaesthesia and Analgesia. 32 (5), 308-313 (2005).
- Wemyss-Holden, S. A., Porter, K. J., Baxter, P., Rudkin, G. E., Maddern, G. J. The laryngeal mask airway in experimental pig anaesthesia. Lab Animal. 33 (1), 30-34 (1999).
- Kobayashi, E., Hishikawa, S., Teratani, T., Lefor, A. T. The pig as a model for translational research: overview of porcine animal models at Jichi Medical University. Transplantation Research. 1 (1), 8 (2012).
- Judge, E. P., et al. Anatomy and bronchoscopy of the porcine lung. A model for translational respiratory medicine. American Journal of Respiratory Cell and Molecular Biology. 51 (3), 334-343 (2014).
- Dondelinger, R. F., et al. Relevant radiological anatomy of the pig as a training model in interventional radiology. European Radiology. 8 (7), 1254-1273 (1998).
- Nickel, R., Schummer, A., Seiferle, E. . Lehrbuch der Anatomie der Haustiere, Band I: Bewegungsapparat. , (2003).
- Wani, T. M., Rafiq, M., Akhter, N., AlGhamdi, F. S., Tobias, J. D. Upper airway in infants-A computed tomography-based analysis. Paediatric Anaesthesia. 27 (5), 501-505 (2017).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Ettrup, K. S., et al. Basic surgical techniques in the Göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. Journal of Visualized Experiments. (52), e2652 (2011).
- Steinbacher, R., von Ritgen, S., Moens, Y. P. S. Laryngeal perforation during a standard intubation procedure in a pig. Laboratory Animals. 46 (3), 261-263 (2012).
- Iliff-Sizemore, S. A., Chrisp, C. E., Rush, H. G. Peritracheolaryngeal abscess: An iatrogenic complication of endotracheal intubation in swine. Laboratory Animal Science. 39 (5), 455-458 (1989).
- Piepho, T., et al. S1 guidelines on airway management. Der Anaesthesist. 64 (11), 859-873 (2015).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesthesia & Analgesia. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Annals of Emergency Medicine. 60 (6), 749-754 (2012).
- Martin, L. D., Mhyre, J. M., Shanks, A. M., Tremper, K. K., Kheterpal, S. 3,423 emergency tracheal intubations at a university hospital: airway outcomes and complications. Anesthesiology. 114 (1), 42-48 (2011).
- Ahmad, I., et al. Difficult Airway Society guidelines for awake tracheal intubation (ATI) in adults. Anaesthesia. 75 (4), 509-528 (2020).
- Frerk, C., et al. Difficult Airway Society 2015 guidelines for management of unanticipated difficult intubation in adults. British Journal of Anaesthesia. 115 (6), 827-848 (2015).
- Cook, T. M., et al. Consensus guidelines for managing the airway in patients with COVID-19: Guidelines from the Difficult Airway Society, the Association of Anaesthetists the Intensive Care Society, the Faculty of Intensive Care Medicine and the Royal College of Anaesthetists. Anaesthesia. 75 (6), 785-799 (2020).
- Kornas, R. L., Owyang, C. G., Sakles, J. C., Foley, L. J., Mosier, J. M. Evaluation and management of the physiologically difficult airway: Consensus recommendations from Society for Airway Management. Anesthesia & Analgesia. 132 (2), 395-405 (2021).
- Higgs, A., et al. Guidelines for the management of tracheal intubation in critically ill adults. British Journal of Anaesthesia. 120 (2), 323-352 (2018).
- Apfelbaum, J. L., et al. American Society of Anesthesiologists Practice Guidelines for Management of the Difficult Airway. Anesthesiology. 136 (1), 31-81 (2022).
- Doyle, D. J. GlideScope-assisted fiberoptic intubation: A new airway teaching method. Anesthesiology. 101 (5), 1252 (2004).
- Lenhardt, R., et al. Is video laryngoscope-assisted flexible tracheoscope intubation feasible for patients with predicted difficult airway? A prospective, randomized clinical trial. Anesthesia & Analgesia. 118 (6), 1259-1265 (2014).
- Ruemmler, R., Ziebart, A., Garcia-Bardon, A., Kamuf, J., Hartmann, E. K. Standardized model of ventricular fibrillation and advanced cardiac life support in swine. Journal of Visualized Experiments. (155), e60707 (2020).
- Dodge, Y. Kolmogorov-Smirnov Test. The Concise Encyclopedia of Statistics. , 283-287 (2008).
- Ross, A., Willson, V. L. Independent Samples T-test. Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , 13-16 (2017).
- Mann, H. B., Whitney, D. R. On a test of whether one of two random variables is stochastically larger than the other. The Annals of Mathematical Statistics. 18 (1), 50-60 (1947).
- Spearman, C. The proof and measurement of association between two things. American Journal of Psychology. 100 (3-4), 441-471 (1987).
- Ziebart, A., et al. Standardized hemorrhagic shock induction guided by cerebral oximetry and extended hemodynamic monitoring in pigs. Journal of Visualized Experiments. (147), e59332 (2019).
- Kamuf, J., et al. Oleic acid-injection in pigs as a model for acute respiratory distress syndrome. Journal of Visualized Experiments. (140), e57783 (2018).
- Kurita, T., Kawashima, S., Morita, K., Nakajima, Y. Assessment of the benefits of head-up preoxygenation using near-infrared spectroscopy with pulse oximetry in a swine model. Journal of Clinical Monitoring and Computing. 35 (1), 155-163 (2021).
- Ruemmler, R., Ziebart, A., Ott, T., Dirvonskis, D., Hartmann, E. K. Flexible fibreoptic intubation in swine - Improvement for resident training and animal safety alike. BMC Anesthesiology. 20 (1), 206 (2020).
- Cook, J. A., Ramsay, C. R., Fayers, P. Using the literature to quantify the learning curve: A case study. International Journal of Technology Assessment in Health Care. 23 (2), 255-260 (2007).
- Buis, M. L., Maissan, I. M., Hoeks, S. E., Klimek, M., Stolker, R. J. Defining the learning curve for endotracheal intubation using direct laryngoscopy: A systematic review. Resuscitation. 99, 63-71 (2016).
- Knapp, S., et al. The assessment of four different methods to verify tracheal tube placement in the critical care setting. Anesthesia & Analgesia. 88 (4), 766-770 (1999).
- Schmidt, R. F. . Physiologie des Menschen. 31, (2010).
- Eberlein, C. M., Luther, I. S., Carpenter, T. A., Ramirez, L. D. First-pass success intubations using video laryngoscopy versus direct laryngoscopy: A retrospective prehospital ambulance service study. Air Medical Journal. 38 (5), 356-358 (2019).
- Lohse, J., Noppens, R. Awake video laryngoscopy - An alternative to awake fiberoptic intubation. Anasthesiologie, Intensivmedizin, Notfallmedizin, Schmerztherapie. 51 (11-12), 656-663 (2016).
- Johnson, C., Roberts, J. T. Clinical competence in the performance of fiberoptic laryngoscopy and endotracheal intubation: A study of resident instruction. Journal of Clinical Anesthesia. 1 (5), 344-349 (1989).
- Geovanini, G. R., Pinna, F. R., Prado, F. A., Tamaki, W. T., Marques, E. Standardization of anesthesia in swine for experimental cardiovascular surgeries. Revista Brasileira de Anestesiologia. 58 (4), 363-370 (2008).
Erratum
Formal Correction: Erratum: Endotracheal Intubation Using a Flexible Intubation Endoscope As a Standardized Model for Safe Airway Management in Swine
Posted by JoVE Editors on 4/03/2023. Citeable Link.
An erratum was issued for: Endotracheal Intubation Using a Flexible Intubation Endoscope As a Standardized Model for Safe Airway Management in Swine. The Protocol, Representative Results, and Discussion sections were updated.
In the Protocol, step 1.5 was updated from:
Disinfect the skin with a disinfectant (alcoholic) before inserting a peripheral vein cannula (22 G) into an ear vein. Spray the area, wipe once, then spray again, and allow the disinfectant to dry.
to:
Disinfect the skin with a disinfectant (alcoholic) before inserting a peripheral vein cannula (22 G) into an ear vein. Spray the area, wipe once, then spray again, and allow the disinfectant to dry. Secure the ear cannula with a band-aid (See Table of Materials).
In the Protocol, step 3.7 was updated from:
While maintaining the position of the endoscope, advance the endotracheal tube until it becomes visible in the camera image.
NOTE: If the endotracheal tube cannot be advanced through the glottic plane, there is a possibility that it has become caught on the arytenoid cartilage. In this case, the endotracheal tube must be withdrawn 1 cm and rotated by 90° before gently advancing again. If necessary, this maneuver can be repeated. Similar calibers of flexible intubation endoscope and endotracheal tube can minimize the risk of this issue occurring. If the endotracheal tube cannot be advanced despite this maneuver, it is likely that the subglottic narrowness-the narrowest part of the porcine larynx-cannot be passed. In this case, a smaller endotracheal tube size needs to be selected. Regular commercially available endotracheal tubes in sizes 6.5 cm or 7.0 cm ID should be able to pass the glottis as long as no anatomic abnormalities are present.
to:
While maintaining the position of the endoscope, advance the endotracheal tube until it becomes visible in the camera image.
NOTE: If the endotracheal tube cannot be advanced through the glottic plane, there is a possibility that it has become caught on the arytenoid cartilage. In this case, the endotracheal tube must be withdrawn 1 cm and rotated by 90° before gently advancing again. If necessary, this maneuver can be repeated. Similar calibers of flexible intubation endoscope and endotracheal tube can minimize the risk of this issue occurring. If the endotracheal tube cannot be advanced despite this maneuver, it is likely that the subglottic narrowness-the narrowest part of the porcine larynx-cannot be passed. In this case, a smaller endotracheal tube size needs to be selected. Regular commercially available endotracheal tubes in sizes 6.5 cm or 7.0 cm ID should be able to pass the glottis as long as no anatomic abnormalities are present. Endotracheal tube size requirements vary depending on the piglet size and breed.
In the Representative Results, the sixth paragraph was updated from:
Statistical analyses were performed using commercially available software (see Table of Materials). Normal distribution was examined using the Kolmogorov-Smirnoff test28. If a normal distribution was determined, group differences were analyzed using t-tests of independent samples29 or the Mann-Whitney U test30 for the non-parametric version. Data are presented as mean (± standard deviation). Correlations of ordinal-scale data were examined using Spearman's correlation coefficient31. A significance level of p < 0.05 was assumed.
to:
Statistical analyses were performed using commercially available software (see Table of Materials). Normal distribution was examined using the Kolmogorov-Smirnoff test28. If a normal distribution was determined, group differences were analyzed using t-tests of independent samples29 or the Mann-Whitney U test30 for the non-parametric version. Data are presented as mean (± standard deviation). Correlations of ordinal-scale data were examined using Spearman's correlation coefficient31. A significance level of p < 0.05 was assumed. All tests were performed with exploratory intention; therefore p-values are descriptive. Nevertheless, p < 0.05 was accepted as indicative of statistical significance.
In the Representative Results, the legend for figure 1 was updated from:
Figure 1: Number of intubation attempts in group comparison. For the group that was intubated using a flexible intubation endoscope, every intubation attempt was successful; in the group that was conventionally intubated, it took an average of 1.4 attempts before the endotracheal tube could be placed correctly. Error bars show the standard deviation. Please click here to view a larger version of this figure.
to:
Figure 1: Number of intubation attempts in group comparison. For the group that was intubated using a flexible intubation endoscope, every intubation attempt was successful; in the group that was conventionally intubated, it took an average of 1.4 attempts before the endotracheal tube could be placed correctly. Error bars show the standard deviation. n = 5 (for each group). Please click here to view a larger version of this figure.
In the Representative Results, figure 2 was updated from:
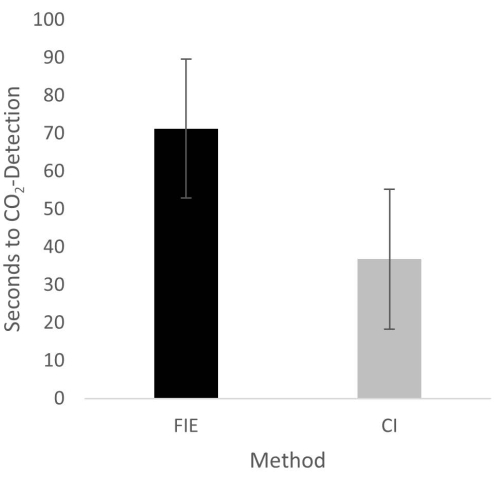
Figure 2: Time until CO2 detection in group comparison. For the group that was intubated using a flexible intubation endoscope, it took significantly longer until end-tidal CO2 could be detected, depicted as mean and standard deviation. Please click here to view a larger version of this figure.
to:
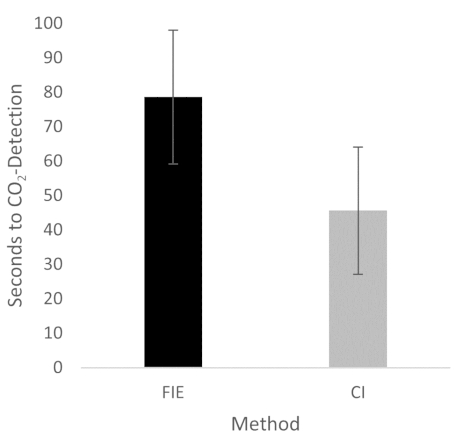
Figure 2: Time until CO2 detection in group comparison. For the group that was intubated using a flexible intubation endoscope, it took significantly longer until end-tidal CO2 could be detected, depicted as mean and standard deviation. n = 5 (for each group). Please click here to view a larger version of this figure.
In the Discussion, the fifth paragraph was updated from:
The increased duration had no clinical significance in this cohort. At no time was the termination criterion-a saturation of less than 93%-reached. This is shown in the results because a procedure change was unnecessary at any time. Prior adequate mask ventilation is a critical step to allow sufficient time for fiberoptic endotracheal tube placement to avoid rapid desaturation34. These results are consistent with previous studies comparing conventional intubation and endoscopically assisted intubations with inexperienced providers35.
to:
The increased duration had no clinical significance in this cohort. At no time was the termination criterion-a saturation of less than 93%-reached. This is shown in the results because a procedure change was unnecessary at any time. Prior adequate mask ventilation is a critical step to allow sufficient time for fiberoptic endotracheal tube placement to avoid rapid desaturation34. These results are consistent with previous studies comparing conventional intubation and endoscopically assisted intubations with inexperienced providers35. We attribute the prolonged duration of fiberoptic intubation to the fact that one must first reorient again after insertion, whereas with conventional intubation, one retains a view of the glottis. It is also important to avoid contact with the mucosa with the flexible intubation endoscope during advancement. This requires occasional corrective maneuvers. Last but not least, after successful placement, retraction of the relatively long endoscope is required, which increases the time to CO2 detection slightly.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved