JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
돼지의 안전한 기도 관리를 위한 표준화된 모델로 유연한 삽관 내시경을 사용한 기관내 삽관
Erratum Notice
요약
최근 몇 년 동안 연구에서 돼지의 사용이 증가했습니다. 그럼에도 불구하고 돼지는기도 해부학이 어렵다는 특징이 있습니다. 내시경으로 유도된 기관내 삽관을 수행하는 방법을 보여줌으로써 본 프로토콜은 동물의 고통과 불필요한 죽음을 피하기 위해 실험실 동물의 안전성을 더욱 높이는 것을 목표로 합니다.
초록
기관내 삽관은 종종 안전한 기도 또는 높은 환기압이 필요한 다양한 개입을 위한 돼지 모델의 중개 연구의 기본 요구 사항입니다. 기관내 삽관은 최적의 조건에서 높은 성공률을 달성하기 위해 최소한의 성공적인 기관내 삽관이 필요한 도전적인 기술이며, 이는 종종 비마취과 연구자에게는 달성할 수 없습니다. 특정 돼지기도 해부학으로 인해 일반적으로 어려운 기도를 가정할 수 있습니다. 안전한 기도를 설정할 수 없으면 실험실 동물의 부상, 부작용 또는 사망을 초래할 수 있습니다. 전향적, 무작위, 통제된 평가 접근 방식을 사용하여 광섬유 보조 기관내 삽관은 임상적으로 관련된 산소 포화도 저하를 일으키지 않으면서 기존 삽관보다 시간이 더 오래 걸리지만 1차 통과 성공률이 더 높은 것으로 나타났습니다. 이 모델은 내시경으로 유도된 기관내 삽관을 위한 표준화된 요법을 제시하며, 특히 직접 후두경 검사를 통한 기관내 삽관 기술에 경험이 없는 연구자에게 안전한 기도를 제공합니다. 이 절차는 동물의 고통과 불필요한 동물 손실을 최소화 할 것으로 기대됩니다.
서문
기관내 삽관은 안전한 기도 또는 높은 환기압(예: 심폐소생술 중 인공호흡 1 또는 급성 호흡곤란 증후군2)이 필요하거나 기도상부 장치에 의한 내부 압박을 통해 뇌 혈류가 손상되지 않아야 하는 다양한 중재를 위한 돼지 모델의중개 연구의 기본 요구 사항인 경우가 많습니다3 , 돼지 4,5에서 예상되는 어려운 기도의 맥락에서 대안으로 때때로 전파됩니다.
돼지의 폐 생리학은 인간과 유사한 특징을 보이지만6, 기도 확보는 돼지의 구강 기관 해부학적 구조에 특별한 차이가 있기 때문에 때때로 훨씬 더 어렵다7. 돼지의 주둥이는 매우 큰 혀를 가진 좁은 구멍을 가지고 있으며, 후두는 매우 움직이며, 후두개는 비교적 크며, 부드러운 입천장까지 뻗어있는 자유 끝이 있습니다. 꼬리 쪽으로, 후두는 기관과 둔각을 형성합니다. 아리테노이드 연골은 크다8. 기도의 가장 좁은 부분은 성문하 수준(subglottic level)9에 있으며, 이는 소아(10)의 기도 해부학적 구조와 비슷하다. 돼지의 후두는 매우 움직이기 때문에 기관내관의 끝이 성대를 통과할 위험이 있지만 후두는 꼬리쪽으로 최대 수 센티미터까지만 변위될 수 있으며 이는 올바른 삽관으로 오인될 수 있습니다 8,11. 또한, 식도 삽관은 돼지 기도 관리를 다룰 때 흔히 발생하는 위험이다12.
실험 또는 조기 사망률에 상응하는 부정적인 영향을 미치는 어렵거나 불가능한 기관 내 삽관의 비율은 체계적으로 기록되지 않았지만 여러 사례 보고서가 발표되었습니다13,14. 인간의 경우, 예상외로 어려운 종래의 삽관의 맥락에서 유연한 삽관 내시경을 사용할 가능성이 있다15. 다양한 거짓 삽관이 종종이 조치에 선행합니다. 이러한 반복적인 삽관 시도는 인간에서의 이상반응과 관련이 있다16,17, 특히 기도 합병증 18. 이러한 사건은 가장 간단한 경우 실험에서 교란 변수를 나타내기 때문에 실험 동물에서 해롭다. 최악의 경우, 그들은 동물의 불필요한 손실로 이어질 수 있습니다.
본 연구는 인간 15,19,20,21,22,23,24에서 예상되는 어려운 기도 관리에 대한 가이드라인에 기초한 모델을 개발하였다. 이전에는 인간 연구25,26에서 광섬유 삽관을 학습하기 위해 유사한 기술이 설명되었습니다. 이 보고서에 제시된 프로토콜은 비기도 전문가가 돼지에서 성공적이고 안전한 기관내 삽관을 수행할 수 있도록 하는 표준화되고 적응하기 쉬운 삽관 모델을 제공하는 것을 목표로 합니다.
프로토콜
이 프로토콜의 실험은 주 및 기관 동물 관리 위원회(Landesuntersuchungsamt Rheinland-Pfalz, Koblenz, Germany; 승인 번호 G20-1-135)에 의해 승인되었습니다. 실험은 ARRIVE 가이드라인에 따라 수행되었다. 전체적으로, 평균 체중 30kg± 2kg, 생후 12-16주령의 마취된 수컷 돼지 10마리(Sus scrofa domestica)를 본 연구에 사용하였다.
1. 동물 준비
- 스트레스를 최소화하기 위해 동물을위한 정상적인 환경을 유지하십시오. 흡인 위험을 낮추기 위해 예정된 실험 6시간 전에 음식을 보류하되 물에 대한 접근을 허용하십시오.
- 둔부 근육이나 목에 midazolam(0.5mg/kg)과 azaperone(2-3mg/kg)( 재료 표 참조)을 병용 주사하여 돼지를 근육주사용 바늘(20G)로 진정시킵니다. 진정제가 시작될 때까지 동물을 방해하지 마십시오 (15-20 분).
참고: 국가 규정에 따라 진정제의 투여는 정밀 조사 대상이 될 수 있으며 훈련된 수의사의 감독이 필요할 수도 있고 필요하지 않을 수도 있습니다. 실험을 계획하기 전에 지역 당국과 상의하십시오. - 진정 된 동물을 마구간에서 실험실로 운반하십시오. 운송 시간은 적절한 진정 시간(여기서는 30-60분)을 초과해서는 안 됩니다. 동물이 저체온증(즉, 38°C 미만)에 걸리지 않도록 충분한 보온성을 확보하고, 외부 온도에 따라 담요로 몸을 덮는다.
- 귀나 꼬리에 끼워진 센서( 재료 표 참조)를 사용하여 말초 산소 포화도(SpO2)를 모니터링합니다.
- 말초 정맥 캐뉼라(22G)를 귀 정맥에 삽입하기 전에 소독제(알코올)로 피부를 소독하십시오. 해당 부위에 스프레이를 뿌리고 한 번 닦은 다음 다시 스프레이하고 소독제를 건조시킵니다. 반창고로 귀 캐뉼라를 고정합니다(재료 표 참조).
2. 마취 및 기계적 환기
- 펜타닐 4μg/kg을 정맥주사하여 진통제를 투여한다. 프로포폴 3mg/kg을 정맥주사하여 마취를 유도합니다( 재료 표 참조).
참고: 볼루스 적용으로 인해 약물이 활성 구획으로 빠르게 유입되어 깊은 마취가 빠르게 시작됩니다. - 돼지를 앙와위 자세로 들것에 놓고 붕대로 고정하십시오. 0.5mg/kg의 아트라쿠륨을 정맥 주사하여 근육 이완제를 바릅니다( 재료 표 참조).
- 개 환기 마스크(재료 표 참조) 또는 유사한 모델을 통해 비침습적 환기를 즉시 시작합니다. 마스크가 꽉 끼도록 하려면 머리 돌출부와 양손의 엄지손가락을 마스크 위에 놓고 나머지 손가락으로 턱을 밀어냅니다.
알림: 환기 매개변수: FiO 2(흡기 산소 분율) = 100%, 최대 흡기압 = <20cmH 2 0, 호흡수= 18-20회/분, PEEP(호기말 양압) = 5cmH2 0. - 0.1-0.2 mg/kg/h의 펜타닐과 8-12 mg/kg/h의 프로포폴을 지속적으로 주입하여 마취를 유지합니다. 5mL/kg/h의 균형 잡힌 전해질 용액( 재료 표 참조)을 지속적으로 주입하기 시작합니다. 적절한 마취 깊이를 지속적으로 유지하십시오.
참고: 이에 대한 대리 매개변수는 움직임의 부재, 삽관 후 자신의 호흡 노력 부족, 심박수의 갑작스러운 증가의 부재입니다. 가능하면 마취 깊이가 불충분하다는 신호로 운동 반응을 가능하게 하기 위해 영구적인 근육 이완을 피하십시오.
3. 기관내 삽관
- 머리의 왼쪽에 조수를 세우십시오. 조수의 왼손으로 입을 벌리고 혀를 바깥쪽으로 꼬집고 압축합니다. 조수에게 오른쪽 집게 손가락으로 오른쪽 윗입술을 눌러 입을 더 잘 벌리도록 요청하십시오.
- 직접 후두경 검사를 수행하십시오. 이렇게하려면 후두경 ( 재료 표 참조)을 입 오른쪽에 삽입하고 혀를 왼쪽으로 밀면서 앞으로 밉니다. 후두경의 끝이 상복부 vallecula에 놓일 때까지 전진시킵니다.
참고: 후두개는 일반적으로 부드러운 입천장에 달라붙어 성문을 가립니다. - 튜브 가이드 와이어( 재료 표 참조)를 사용하여 부드러운 입천장을 따라 오른쪽 piriform 홈에서 왼쪽으로 부드럽게 퍼내는 동작으로 후두개를 조심스럽게 옆으로 밀어냅니다.
- 후두경의 손잡이를 조수에게 전달하여 현재 위치에 고정합니다.
- 이제 기관내관이 이미 장착되어 있고 비디오 모니터에 연결된 유연한 삽관 내시경을 사용합니다. 내시경을 구두로 삽입하고 성문이 시각화 될 때까지 혀 밑 위로 전진시킵니다.
알림: 카메라의 김서림을 방지하려면 김서림 방지제( 재료 표 참조)를 미리 사용하는 것이 좋습니다. - 성대 사이의 내시경을 기관으로 전진시킵니다. 연골 고리와 pars membranacea를 육안으로 식별하여 기관의 해부학을 확인하십시오. 내시경이 카리나 위에 놓일 때까지 내시경을 전진시킵니다. 붓기와 출혈을 피하기 위해 내시경 끝으로 민감한 점막을 만지지 마십시오.
- 내시경의 위치를 유지하면서 카메라 이미지에 보일 때까지 기관내관을 전진시킵니다.
참고: 기관내관이 성문면을 통해 전진할 수 없는 경우 아리테노이드 연골에 걸렸을 가능성이 있습니다. 이 경우 기관내관을 1cm 빼내고 90° 회전한 후 다시 부드럽게 전진시켜야 합니다. 필요한 경우이 조작을 반복 할 수 있습니다. 유사한 구경의 유연한 삽관 내시경 및 기관내관은 이 문제가 발생할 위험을 최소화할 수 있습니다. 이 조작에도 불구하고 기관내관을 전진시킬 수 없다면, 돼지 후두의 가장 좁은 부분인 성문하 협착을 통과할 수 없을 가능성이 높습니다. 이 경우 더 작은 기관내관 크기를 선택해야 합니다. 6.5cm 또는 7.0cm ID 크기의 시중에서 판매되는 일반 기관내 튜브는 해부학적 이상이 없는 한 성문을 통과할 수 있어야 합니다. 기관내 튜브 크기 요구 사항은 새끼 돼지의 크기와 품종에 따라 다릅니다. - 기관내관의 위치를 유지하면서 유연한 삽관 내시경을 빼냅니다.
- 10mL 주사기를 사용하여 10mL의 공기로 커프를 팽창시킵니다. 커프 매니저로 커프 압력을 조절합니다(목표값: 30cmH2O, 재료 표 참조).
- 카프노그래피(capnography)를 통한 주기적이고 규칙적인 이산화탄소 호기와 청진(ausqueation)을 통한 양면 환기(15)를 통해 기관내관의 올바른 배치와 적절한 환기를 확인합니다.
- 튜브를 인공호흡기와 연결한 후 기계적 환기를 시작합니다(PEEP = 5cmH 2 O, 호흡수 = <6kPa, 일반적으로 30-50분-1,FiO2 = 0.4, I:E(흡기 대 호기 비율) = 1:2, 일회 호흡량 = 6-8mL/kg).
- 모니터링을 확장하거나(예: 동맥내 혈압 측정의 설정, 중심 정맥 또는 폐동맥 카테터(27)의 설치) 개입을 계속합니다.
참고: 추가 실험의 질문에 따라 필수 매개변수 및 개입 옵션에 대한 한계 값을 정의하고 연구 프로토콜에서 그에 따라 모니터링을 설정합니다.
결과
전향적, 무작위, 대조 연구 환경에서 10마리의 수컷 돼지(생후 12-16주, 체중 30kg± 3kg)에 대해 기관내 삽관을 수행했습니다. 돼지는 두 그룹으로 무작위 배정되었습니다: 하나는 통상적으로 후두경 삽관(CI 그룹)되었고, 다른 그룹은 프로토콜(FIE 그룹)에 설명된 대로 유연한 삽관 내시경을 통해 삽관 보조를 받았습니다. 그룹 과제는 봉인된 봉투를 잡아당겨 이루어졌습니다. 조사관은 매일 무작...
토론
이전 연구에서, 우리 연구 그룹은 이미 돼지 모델 2,27,32,33의 번역 이점에 관한 구체적인 세부 사항을 설명했습니다. 일반적으로 동물의 스트레스 수준과 불필요한 통증을 줄이는 것은 모든 연구 프로토콜의 필수적인 부분이어야 하며 안정적으로 재현 가능한 데이터를 생성하는 데 가장 중요합니다. ?...
공개
유연한 삽관 내시경과 액세서리는 연구 목적으로만 제조업체에서 무조건 제공했습니다. 저자는 더 이상 재정적 또는 기타 이해 상충을 선언하지 않습니다.
감사의 말
저자는 뛰어난 기술 지원에 대해 Dagmar Dirvonskis에게 감사를 표하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| Ambu aScope Regular | Ambu GmbH, Medizinprodukte, Bad Nauheim, Germany | Disposable fiber optic outer diameter 5 mm | |
| Ambu aView Monitor | Ambu GmbH, Medizinprodukte, Bad Nauheim, Germany | monitor | |
| Atracurium Hikma 50 mg/5mL | Hikma Pharma GmbH, Martinsried | atracurium | |
| Azaperone (Stresnil) 40mg/mL | Lilly Deutschland GmbH, Bad Homburg, Germany | azaperone | |
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy, AB Helsingborg, Schweden | 3-way-stopcock | |
| BD Microlance 3 20 G | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | cannula | |
| Curafix i.v. classics | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Cannula retention dressing | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| IBM SPSS Statistics for Windows, Version 20 | IBM SPSS Statistics for Windows, Version 20.0. Armonk, NY: IBM Corp.) | Statistical software | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland, GmbH | perfusor line | |
| Intrafix Primeline | B. Braun Melsungen AG, Melsungen, Germany | Infusion line | |
| JOZA Einmal Nitril Untersuchungshandschuhe | JOZA, München, Germany | disposable gloves | |
| Laryngoscope, 45.48.50, KL 2000 | Medicon | Laryngoscope handle | |
| Littmann Classic III Stethoscope | 3M Deutschland GmbH, Neuss, Germany | stethoscope | |
| Luer Lock | B.Braun Melsungen AG, Germany | ||
| Maimed Vlieskompresse | Maimed GmbH, Neuenkirchen, Germany | Fleece compress to fix the tongue | |
| Masimo LNCS Adtx SpO2 sensor | Masimo Corporation Irvine, Ca 92618 USA | saturation clip for the tail | |
| Masimo LNCS TC-I SpO2 ear clip sensor | Masimo Corporation Irvine, Ca 92618 USA | Saturation clip for the ear | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Midazolam 15 mg/3 mL | Hameln Pharma GmbH, Hameln, Germany | midazolam | |
| Midmark Canine Mask Small Plastic with Diaphragm FRSCM-0005 | Midmark Corp., Dayton, Ohio, USA | dog ventilation mask | |
| Octeniderm farblos | Schülke & Mayr GmbH, Nordenstedt, Germany | Alcoholic disinfectant | |
| Original Perfusor syringe 50 mL | B.Braun Melsungen AG, Germany | perfusor syringe | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| Propofol 2% 20 mg/mL (50 mL flasks) | Fresenius, Kabi Deutschland, GmbH | propofol | |
| RÜSCH Führungsstab für Endotrachealtubus (ID 5.6 mm) | Teleflex Medical Sdn. Bhd, Malaysia | PVC coated tube guiding wire | |
| Rüschelit Super Safety Clear >ID 6/6.5 /7.0 mm | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Stainless Macintosh Größe 4 | Welch Allyn69604 | blade for laryngoscope | |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | Balanced electrolyte solution | |
| Ultrastop Antibeschlagmittel bottle with dropper 25 mL | Sigmapharm Arzneimittel GmbH, Wien, Austria | Antifog agent | |
| Vasofix Safety 22 G-16 G | B.Braun Melsungen AG, Germany | venous catheter | |
| VBM Cuff Manometer | VBM Medizintechnik GmbH, Sulz a.N., Germany | cuff pressure gauge | |
| Zelette | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Tissue swab |
참고문헌
- Kleinman, M. E., Oh, W., Stonestreet, B. S. Comparison of intravenous and endotracheal epinephrine during cardiopulmonary resuscitation in newborn piglets. Critical Care Medicine. 27 (12), 2748-2754 (1999).
- Rissel, R., et al. Bronchoalveolar lavage and oleic acid-injection in pigs as a double-hit model for acute respiratory distress syndrome (ARDS). Journal of Visualized Experiments. (159), e61358 (2020).
- Segal, N., et al. Impairment of carotid artery blood flow by supraglottic airway use in a swine model of cardiac arrest. Resuscitation. 83 (8), 1025-1030 (2012).
- Goldmann, K., Kalinowski, M., Kraft, S. Airway management under general anaesthesia in pigs using the LMA-ProSeal: A pilot study. Veterinary Anaesthesia and Analgesia. 32 (5), 308-313 (2005).
- Wemyss-Holden, S. A., Porter, K. J., Baxter, P., Rudkin, G. E., Maddern, G. J. The laryngeal mask airway in experimental pig anaesthesia. Lab Animal. 33 (1), 30-34 (1999).
- Kobayashi, E., Hishikawa, S., Teratani, T., Lefor, A. T. The pig as a model for translational research: overview of porcine animal models at Jichi Medical University. Transplantation Research. 1 (1), 8 (2012).
- Judge, E. P., et al. Anatomy and bronchoscopy of the porcine lung. A model for translational respiratory medicine. American Journal of Respiratory Cell and Molecular Biology. 51 (3), 334-343 (2014).
- Dondelinger, R. F., et al. Relevant radiological anatomy of the pig as a training model in interventional radiology. European Radiology. 8 (7), 1254-1273 (1998).
- Nickel, R., Schummer, A., Seiferle, E. . Lehrbuch der Anatomie der Haustiere, Band I: Bewegungsapparat. , (2003).
- Wani, T. M., Rafiq, M., Akhter, N., AlGhamdi, F. S., Tobias, J. D. Upper airway in infants-A computed tomography-based analysis. Paediatric Anaesthesia. 27 (5), 501-505 (2017).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Ettrup, K. S., et al. Basic surgical techniques in the Göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. Journal of Visualized Experiments. (52), e2652 (2011).
- Steinbacher, R., von Ritgen, S., Moens, Y. P. S. Laryngeal perforation during a standard intubation procedure in a pig. Laboratory Animals. 46 (3), 261-263 (2012).
- Iliff-Sizemore, S. A., Chrisp, C. E., Rush, H. G. Peritracheolaryngeal abscess: An iatrogenic complication of endotracheal intubation in swine. Laboratory Animal Science. 39 (5), 455-458 (1989).
- Piepho, T., et al. S1 guidelines on airway management. Der Anaesthesist. 64 (11), 859-873 (2015).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesthesia & Analgesia. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Annals of Emergency Medicine. 60 (6), 749-754 (2012).
- Martin, L. D., Mhyre, J. M., Shanks, A. M., Tremper, K. K., Kheterpal, S. 3,423 emergency tracheal intubations at a university hospital: airway outcomes and complications. Anesthesiology. 114 (1), 42-48 (2011).
- Ahmad, I., et al. Difficult Airway Society guidelines for awake tracheal intubation (ATI) in adults. Anaesthesia. 75 (4), 509-528 (2020).
- Frerk, C., et al. Difficult Airway Society 2015 guidelines for management of unanticipated difficult intubation in adults. British Journal of Anaesthesia. 115 (6), 827-848 (2015).
- Cook, T. M., et al. Consensus guidelines for managing the airway in patients with COVID-19: Guidelines from the Difficult Airway Society, the Association of Anaesthetists the Intensive Care Society, the Faculty of Intensive Care Medicine and the Royal College of Anaesthetists. Anaesthesia. 75 (6), 785-799 (2020).
- Kornas, R. L., Owyang, C. G., Sakles, J. C., Foley, L. J., Mosier, J. M. Evaluation and management of the physiologically difficult airway: Consensus recommendations from Society for Airway Management. Anesthesia & Analgesia. 132 (2), 395-405 (2021).
- Higgs, A., et al. Guidelines for the management of tracheal intubation in critically ill adults. British Journal of Anaesthesia. 120 (2), 323-352 (2018).
- Apfelbaum, J. L., et al. American Society of Anesthesiologists Practice Guidelines for Management of the Difficult Airway. Anesthesiology. 136 (1), 31-81 (2022).
- Doyle, D. J. GlideScope-assisted fiberoptic intubation: A new airway teaching method. Anesthesiology. 101 (5), 1252 (2004).
- Lenhardt, R., et al. Is video laryngoscope-assisted flexible tracheoscope intubation feasible for patients with predicted difficult airway? A prospective, randomized clinical trial. Anesthesia & Analgesia. 118 (6), 1259-1265 (2014).
- Ruemmler, R., Ziebart, A., Garcia-Bardon, A., Kamuf, J., Hartmann, E. K. Standardized model of ventricular fibrillation and advanced cardiac life support in swine. Journal of Visualized Experiments. (155), e60707 (2020).
- Dodge, Y. Kolmogorov-Smirnov Test. The Concise Encyclopedia of Statistics. , 283-287 (2008).
- Ross, A., Willson, V. L. Independent Samples T-test. Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , 13-16 (2017).
- Mann, H. B., Whitney, D. R. On a test of whether one of two random variables is stochastically larger than the other. The Annals of Mathematical Statistics. 18 (1), 50-60 (1947).
- Spearman, C. The proof and measurement of association between two things. American Journal of Psychology. 100 (3-4), 441-471 (1987).
- Ziebart, A., et al. Standardized hemorrhagic shock induction guided by cerebral oximetry and extended hemodynamic monitoring in pigs. Journal of Visualized Experiments. (147), e59332 (2019).
- Kamuf, J., et al. Oleic acid-injection in pigs as a model for acute respiratory distress syndrome. Journal of Visualized Experiments. (140), e57783 (2018).
- Kurita, T., Kawashima, S., Morita, K., Nakajima, Y. Assessment of the benefits of head-up preoxygenation using near-infrared spectroscopy with pulse oximetry in a swine model. Journal of Clinical Monitoring and Computing. 35 (1), 155-163 (2021).
- Ruemmler, R., Ziebart, A., Ott, T., Dirvonskis, D., Hartmann, E. K. Flexible fibreoptic intubation in swine - Improvement for resident training and animal safety alike. BMC Anesthesiology. 20 (1), 206 (2020).
- Cook, J. A., Ramsay, C. R., Fayers, P. Using the literature to quantify the learning curve: A case study. International Journal of Technology Assessment in Health Care. 23 (2), 255-260 (2007).
- Buis, M. L., Maissan, I. M., Hoeks, S. E., Klimek, M., Stolker, R. J. Defining the learning curve for endotracheal intubation using direct laryngoscopy: A systematic review. Resuscitation. 99, 63-71 (2016).
- Knapp, S., et al. The assessment of four different methods to verify tracheal tube placement in the critical care setting. Anesthesia & Analgesia. 88 (4), 766-770 (1999).
- Schmidt, R. F. . Physiologie des Menschen. 31, (2010).
- Eberlein, C. M., Luther, I. S., Carpenter, T. A., Ramirez, L. D. First-pass success intubations using video laryngoscopy versus direct laryngoscopy: A retrospective prehospital ambulance service study. Air Medical Journal. 38 (5), 356-358 (2019).
- Lohse, J., Noppens, R. Awake video laryngoscopy - An alternative to awake fiberoptic intubation. Anasthesiologie, Intensivmedizin, Notfallmedizin, Schmerztherapie. 51 (11-12), 656-663 (2016).
- Johnson, C., Roberts, J. T. Clinical competence in the performance of fiberoptic laryngoscopy and endotracheal intubation: A study of resident instruction. Journal of Clinical Anesthesia. 1 (5), 344-349 (1989).
- Geovanini, G. R., Pinna, F. R., Prado, F. A., Tamaki, W. T., Marques, E. Standardization of anesthesia in swine for experimental cardiovascular surgeries. Revista Brasileira de Anestesiologia. 58 (4), 363-370 (2008).
Erratum
Formal Correction: Erratum: Endotracheal Intubation Using a Flexible Intubation Endoscope As a Standardized Model for Safe Airway Management in Swine
Posted by JoVE Editors on 4/03/2023. Citeable Link.
An erratum was issued for: Endotracheal Intubation Using a Flexible Intubation Endoscope As a Standardized Model for Safe Airway Management in Swine. The Protocol, Representative Results, and Discussion sections were updated.
In the Protocol, step 1.5 was updated from:
Disinfect the skin with a disinfectant (alcoholic) before inserting a peripheral vein cannula (22 G) into an ear vein. Spray the area, wipe once, then spray again, and allow the disinfectant to dry.
to:
Disinfect the skin with a disinfectant (alcoholic) before inserting a peripheral vein cannula (22 G) into an ear vein. Spray the area, wipe once, then spray again, and allow the disinfectant to dry. Secure the ear cannula with a band-aid (See Table of Materials).
In the Protocol, step 3.7 was updated from:
While maintaining the position of the endoscope, advance the endotracheal tube until it becomes visible in the camera image.
NOTE: If the endotracheal tube cannot be advanced through the glottic plane, there is a possibility that it has become caught on the arytenoid cartilage. In this case, the endotracheal tube must be withdrawn 1 cm and rotated by 90° before gently advancing again. If necessary, this maneuver can be repeated. Similar calibers of flexible intubation endoscope and endotracheal tube can minimize the risk of this issue occurring. If the endotracheal tube cannot be advanced despite this maneuver, it is likely that the subglottic narrowness-the narrowest part of the porcine larynx-cannot be passed. In this case, a smaller endotracheal tube size needs to be selected. Regular commercially available endotracheal tubes in sizes 6.5 cm or 7.0 cm ID should be able to pass the glottis as long as no anatomic abnormalities are present.
to:
While maintaining the position of the endoscope, advance the endotracheal tube until it becomes visible in the camera image.
NOTE: If the endotracheal tube cannot be advanced through the glottic plane, there is a possibility that it has become caught on the arytenoid cartilage. In this case, the endotracheal tube must be withdrawn 1 cm and rotated by 90° before gently advancing again. If necessary, this maneuver can be repeated. Similar calibers of flexible intubation endoscope and endotracheal tube can minimize the risk of this issue occurring. If the endotracheal tube cannot be advanced despite this maneuver, it is likely that the subglottic narrowness-the narrowest part of the porcine larynx-cannot be passed. In this case, a smaller endotracheal tube size needs to be selected. Regular commercially available endotracheal tubes in sizes 6.5 cm or 7.0 cm ID should be able to pass the glottis as long as no anatomic abnormalities are present. Endotracheal tube size requirements vary depending on the piglet size and breed.
In the Representative Results, the sixth paragraph was updated from:
Statistical analyses were performed using commercially available software (see Table of Materials). Normal distribution was examined using the Kolmogorov-Smirnoff test28. If a normal distribution was determined, group differences were analyzed using t-tests of independent samples29 or the Mann-Whitney U test30 for the non-parametric version. Data are presented as mean (± standard deviation). Correlations of ordinal-scale data were examined using Spearman's correlation coefficient31. A significance level of p < 0.05 was assumed.
to:
Statistical analyses were performed using commercially available software (see Table of Materials). Normal distribution was examined using the Kolmogorov-Smirnoff test28. If a normal distribution was determined, group differences were analyzed using t-tests of independent samples29 or the Mann-Whitney U test30 for the non-parametric version. Data are presented as mean (± standard deviation). Correlations of ordinal-scale data were examined using Spearman's correlation coefficient31. A significance level of p < 0.05 was assumed. All tests were performed with exploratory intention; therefore p-values are descriptive. Nevertheless, p < 0.05 was accepted as indicative of statistical significance.
In the Representative Results, the legend for figure 1 was updated from:
Figure 1: Number of intubation attempts in group comparison. For the group that was intubated using a flexible intubation endoscope, every intubation attempt was successful; in the group that was conventionally intubated, it took an average of 1.4 attempts before the endotracheal tube could be placed correctly. Error bars show the standard deviation. Please click here to view a larger version of this figure.
to:
Figure 1: Number of intubation attempts in group comparison. For the group that was intubated using a flexible intubation endoscope, every intubation attempt was successful; in the group that was conventionally intubated, it took an average of 1.4 attempts before the endotracheal tube could be placed correctly. Error bars show the standard deviation. n = 5 (for each group). Please click here to view a larger version of this figure.
In the Representative Results, figure 2 was updated from:
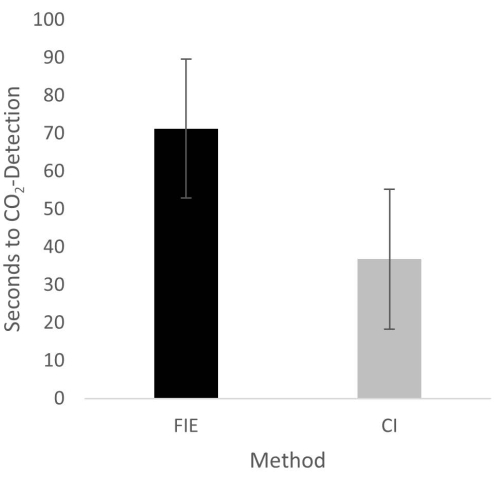
Figure 2: Time until CO2 detection in group comparison. For the group that was intubated using a flexible intubation endoscope, it took significantly longer until end-tidal CO2 could be detected, depicted as mean and standard deviation. Please click here to view a larger version of this figure.
to:
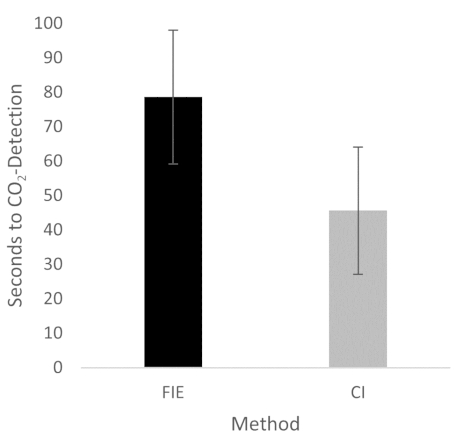
Figure 2: Time until CO2 detection in group comparison. For the group that was intubated using a flexible intubation endoscope, it took significantly longer until end-tidal CO2 could be detected, depicted as mean and standard deviation. n = 5 (for each group). Please click here to view a larger version of this figure.
In the Discussion, the fifth paragraph was updated from:
The increased duration had no clinical significance in this cohort. At no time was the termination criterion-a saturation of less than 93%-reached. This is shown in the results because a procedure change was unnecessary at any time. Prior adequate mask ventilation is a critical step to allow sufficient time for fiberoptic endotracheal tube placement to avoid rapid desaturation34. These results are consistent with previous studies comparing conventional intubation and endoscopically assisted intubations with inexperienced providers35.
to:
The increased duration had no clinical significance in this cohort. At no time was the termination criterion-a saturation of less than 93%-reached. This is shown in the results because a procedure change was unnecessary at any time. Prior adequate mask ventilation is a critical step to allow sufficient time for fiberoptic endotracheal tube placement to avoid rapid desaturation34. These results are consistent with previous studies comparing conventional intubation and endoscopically assisted intubations with inexperienced providers35. We attribute the prolonged duration of fiberoptic intubation to the fact that one must first reorient again after insertion, whereas with conventional intubation, one retains a view of the glottis. It is also important to avoid contact with the mucosa with the flexible intubation endoscope during advancement. This requires occasional corrective maneuvers. Last but not least, after successful placement, retraction of the relatively long endoscope is required, which increases the time to CO2 detection slightly.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유