A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד, אפיון ומיצוי DNA כולל לזיהוי פטריות אנדופיטיות בצמחים מיקוהטרוטרופיים
In This Article
Erratum Notice
Summary
המאמר הנוכחי נועד לספק פרוטוקולים מפורטים ונאותים לבידוד פטריות אנדופיטיות הקשורות לצמחים, שימור ארוך טווח של מבודדים, אפיון מורפולוגי ומיצוי DNA כולל לצורך זיהוי מולקולרי וניתוחים מטאגנומיים לאחר מכן.
Abstract
צמחים Mycoheterotrophic להציג את אחת הצורות הקיצוניות ביותר של תלות mycorrhizal, לאחר שאיבדו לחלוטין את היכולת האוטוטרופית שלהם. חיוני כמו כל משאב חיוני אחר, הפטריות שצמחים אלה מתקשרים איתן באופן אינטימי חיוניות עבורם. לפיכך, כמה מהטכניקות הרלוונטיות ביותר בחקר מינים מיקוהטרוטרופיים הן אלה המאפשרות חקירה של פטריות הקשורות, במיוחד אלה המאכלסות שורשים ואיברים תת קרקעיים. בהקשר זה, טכניקות לזיהוי פטריות אנדופיטיות תלויות תרבית ובלתי תלויות תרבית מיושמות בדרך כלל. בידוד אנדופיטים פטרייתיים מספק אמצעי לזיהוי מורפולוגי שלהם, ניתוח המגוון שלהם ושמירה על החיסון ליישומים בנביטה סימביוטית של זרעי סחלבים. עם זאת, ידוע כי יש מגוון גדול של פטריות שאינן ניתנות לגידול המאכלסות רקמות צמחים. לפיכך, טכניקות זיהוי מולקולרי תלויות תרבות מציעות כיסוי רחב יותר של מגוון המינים ושפע. מאמר זה נועד לספק את התמיכה המתודולוגית הדרושה להתחלת שני הליכי חקירה: תלוי תרבות והליך עצמאי. באשר לפרוטוקול תלוי התרבית, מפורטים תהליכי איסוף ושמירה של דגימות צמחים מאתרי איסוף למתקני מעבדה, לצד בידוד פטריות נימה מאיברים תת-קרקעיים ואוויריים של צמחים מיקוהטרוטרופיים, שמירה על אוסף של מבודדים, אפיון מורפולוגי של קורים על ידי מתודולוגיית תרבית שקופיות, וזיהוי מולקולרי של פטריות על ידי מיצוי DNA כולל. הנהלים המפורטים, הכוללים מתודולוגיות שאינן תלויות בתרבות, כוללים איסוף דגימות צמחים לצורך ניתוח מטאגנומי ומיצוי DNA כולל מאיברי צמח אכלורופילוסים באמצעות ערכה מסחרית. לבסוף, פרוטוקולי המשכיות (למשל, תגובת שרשרת פולימראז [PCR], ריצוף) מוצעים גם הם לניתוחים, וטכניקות מוצגות כאן.
Introduction
פטריות אנדופיטיות הן, מעצם הגדרתן, אלה המאכלסות את פנים איברי הצמח ורקמותיהן בזיהומים לא בולטים (כלומר, מבלי לגרום נזק לפונדקאי שלהן)1,2. פטריות אלה יכולות לקיים אינטראקציה ניטרלית או מועילה עם צמחים מארחים, עשויות להעניק עמידות לפתוגנים ולתנאי סביבה שליליים, ועשויות לתרום לסינתזה של תרכובות מועילות לצמח (למשל, גורמי גדילה ופיטוהורמונים אחרים)1,3. אנדופיטים מיקוריזים הם פטריות המקימות קשרים מיקוריזליים עם הצמח, ולוקחות חלק בהעברת חומרים מזינים4. ב Orchidaceae, האינטראקציה עם אנדופיטים mycorrhizal היא בסיסית נביטת זרעים ברוב המכריע של המינים, והתבססות שתילים בכל הצמחים במשפחה5. בהקשרים כאלה, סחלבים מיקוהטרוטרופיים מייצגים מקרה של תלות מוחלטת בבני זוגם המיקוריזליים, שכן הם תלויים בחומרים מזינים מינרליים ובהעברת תרכובות פחמן על ידי פטריות אלה במהלך כל מחזור החיים שלהם6. לכן, בידוד וזיהוי של שיוך פטריות הוא בסיס בסיסי בעת חקירת אסטרטגיות חיים mycoheterotrophic. יתר על כן, מעט ידוע על תפקידם של אנדופיטים פטרייתיים בצמחים מיקוהטרוטרופיים או אפילו על המגוון האמיתי של פטריות אלה 7,8.
חקירת פטריות אנדופיטיות יכולה להתבצע באמצעות טכניקות שונות, המתוארות באופן מסורתי כבלתי תלויות תרבית או תלויות תרבית, למשל: (א) תצפית ישירה, (ב) בידוד פטרייתי וזיהוי מורפולוגי ו/או מולקולרי, ו-(ג) מיצוי דנ"א כולל של רקמות צמחים וזיהוי מולקולרי9. בתצפית ישירה (a), פטריות אנדופיטיות עשויות להיחקר בעודן בפנים תאי צמחים ורקמות על ידי מיקרוסקופ אור או אלקטרונים9, כפי שפרוטוקולי מיקרוסקופיה שונים מפורטים על ידי Pena-Passos et al.10. בשיטות בידוד (b), אנדופיטים פטרייתיים יכולים להיות מאופיינים על פי מושבותיהם, קוריהם ומורפולוגיה של מבנה הרבייה או ההתנגדות שלהם. כמו כן, באמצעות טכניקות בידוד, ניתן לבצע זיהוי מולקולרי של מבודדים באמצעות מיצוי DNA, הגברה של רצפי זיהוי מולקולריים (ברקודים או טביעות אצבע), וריצוף11. הטכניקה האחרונה (c) מאפשרת זיהוי מולקולרי של פטריות אנדופיטיות לכל מיצוי DNA בפנים רקמות הצמח (metabarcoding), ולאחר מכן הכנת ספרייה וריצוף12.
יתר על כן, מבודדים פטרייתיים עשויים להיות מיושמים בניסויי נביטה סימביוטיים, באמצעות זרעים מסחלבים אוטוטרופיים או מיקוהטרוטרופיים. דוגמה ליישום כזה היא החקירה שנערכה על ידי Sisti et al.13, המתארת את הנביטה ואת השלבים הראשונים של התפתחות פרוטוקורם ב- Pogoniopsis schenckii, סחלב מיקוהטרוטרופי, בשיתוף עם חלק מהמבודדים שלו, הכוללים פטריות אנדופיטיות שאינן מיקוריזליות. פרוטוקול הנביטה הסימביוטי היישומי מפורט ומוצג בסרטון של Pena-Passos et al.10. בידוד פטריות בשיתוף עם איברי צמח שונים מאפשר חקירה מגוונת המתמקדת באופי יחסי הגומלין בין צמח לפטריות (למשל, להבין היבטים אקולוגיים או פיזיולוגיים של הקשר, כמו גם חקירת העברת חומרי מזון מפטריות לצמח)9.
המתודולוגיות המוצגות בסעיף 1 מבוססות על אוסף של דגימות איברים תת-קרקעיים, שכן איברים אלה מציגים את הקשיים הרבים ביותר באיסוף, והם בעלי עניין רב מכיוון שהאנדופיטים מיקוריזים מאכלסים אותם. עם זאת, שני הפרוטוקולים הכלולים (שלבים 1.1 ו-1.2) עשויים להיות מיושמים על איברי צמח מיקוהטרוטרופיים אחרים (למשל, קני שורש, גבעולי פרחים ופירות). מתודולוגיית האיסוף המתוארת בשלב 1.1 מיועדת לבידוד פטריות אנדופיטיות (סעיף 2) לאפיון מורפולוגי (סעיפים 4 ו-5) ו/או מיצוי DNA כולל לזיהוי מבודד (סעיף 6). מצד שני, מתודולוגיית האיסוף המתוארת בשלב 1.2 מוקצית באופן בלעדי למיצוי DNA כולל של רקמות צמחים עבור טכניקות metabarcoding (סעיף 7). בסעיף 3 מוצגות ארבע שיטות לאחסון ושימור פטריות נימה, שתיים לאחסון לטווח קצר (3-6 חודשים) והשתיים האחרות מתאימות לאחסון לטווח ארוך (> שנה). האפיון המורפולוגי (סעיפים 4 ו-5) עשוי להיות קשור לזיהוי מולקולרי כדי לחזק אותו ולספק מידע חשוב על מאקרו פטרייתי ומיקרומורפולוגיה. איור 1 מסכם את המתודולוגיות הקולקטיביות שתוארו להלן.

איור 1: סיכום סכמטי של השיטות המוצגות. איסוף צמחים ובידוד פטריות, שימור וזיהוי מולקולרי על ידי מתודולוגיות תלויות תרבות ובלתי תלויות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. איסוף דגימות צמחים
- איסוף דוגמאות לשיטות תלויות תרבות
- בזהירות לחפור את האיברים התת-קרקעיים; אלה יכולים להיות שורשים, גבעולים, קני שורש, או איברי אחסון של הצמח שיש לאסוף. מלבד קרקעות קומפקטיות מאוד, לאסוף דגימות אלה ביד.
הערה: השימוש בכלים כגון מגבונים או כפות מדידה בשלב זה אינו מומלץ, מכיוון שהוא עלול לפגוע במבנים השבירים של צמחים מיקוהטרוטרופיים ועלול לגרום לזיהום רקמות על ידי פטריות שאינן אנדופיטיות. - לאסוף כמה שיותר איברים תת קרקעיים. שמרו את הדגימות בשקיות נייר בתוך מיכל מקורר (למשל, קופסת קצף פוליסטירן או שקית תרמית עם קרח). אם נאספים גם איברים אוויריים, להעביר אותם בנפרד מן אלה subterrane.
- בזהירות לחפור את האיברים התת-קרקעיים; אלה יכולים להיות שורשים, גבעולים, קני שורש, או איברי אחסון של הצמח שיש לאסוף. מלבד קרקעות קומפקטיות מאוד, לאסוף דגימות אלה ביד.
- איסוף דוגמאות לשיטות תלויות תרבות
- חפרו בזהירות את שורשי הצמח שייאספו תחת אותן המלצות שצוינו בהערה משלב 1.1.1.
- לאסוף כמה שיותר איברים תת קרקעיים. שמור את הדגימות שנאספו בצינורות קריו-צינור בתוך חנקן נוזלי (אפשרות רצויה) או השתמש בצינורות צנטריפוגות מוקפים בקרח יבש (אפשרות חלופית). יש לשמור על איברים אוויריים בנפרד, אם נאספים.
2. בידוד פטריות אנדופיטיות הקשורות לאיברי צמחים14
הערה: כל חומר, תמיסה וריאגנט המשמשים בסעיף זה חייבים להיות סטריליים. אלה שלא ניתן לרכוש כבר מעוקר צריך להיות autoclaved ב 121 ° C במשך 20 דקות.
- התפשטות שטחית של איברי צמח
- שטפו את הדגימות שנאספו (שלב 1.1.2) במים זורמים והוציאו כמה שיותר מצע ופסולת אחרת שהדגימות יכולות להכיל.
- בתוך מכסה מנוע זרימה למינרית, שמרו את הדגימות השטופות טבולות באתנול 70% למשך דקה אחת (ניתן להשתמש בכוס או בצנצנת זכוכית).
- מעבירים את הדגימות למיכל אחר עם נתרן היפוכלוריט עם 2% כלור פעיל למשך 3 דקות.
- החליפו את הדגימות למיכל עם 70% אתנול ושמרו טבולות למשך דקה. לאחר מכן, שטפו את הדגימות ברצף בשני מיכלים עם מים מזוקקים.
- התקנת שברי צמחים במדיום תרבית
הערה: כל שלב המפורט בשלב 2.2 חייב להתבצע בתוך מכסה מנוע זרימה למינרית.- לפני ההתקנה, להכין צלחות פטרי (8-10 ס"מ קוטר) עם 19.5 גרם / ליטר תפוח אדמה דקסטרוז אגר תרבית בינונית (PDA) + 7 גרם / ליטר אגר בקטריולוגי + 3 מ"ל / ליטר אנטיביוטיקה (למשל, סטרפטומיצין, פניצילין, טטרציקלין, אמפיצילין).
- שמור על צלחות פטרי עם מדיום התרבית ב 36 ° C במשך 24 שעות לפני השימוש בהם כדי להבטיח שאין זיהום. השליכו כלים מזוהמים במושבות חיידקים או פטריות.
הערה: תוספת אנטיביוטיקה בתווך חיונית בשלב זה, מכיוון שהאיברים נגועים מאוד בחיידקים שעלולים לעכב צמיחה פטרייתית. ודא אם אנטיביוטיקה עשויה להיות מחוממת במהלך autoclaving; יש להוסיף אנטיביוטיקה מסוימת לאחר קירור המדיום לסביבות 36 מעלות צלזיוס (לפני הכנסתו לכלים). - מיד לאחר פירוק שטחי של הדגימות ועדיין בתוך מכסה מנוע זרימה למינרית, במחשבי כף יד, יש לחסן כמה טיפות של המים המזוקקים מהמיכל האחרון ששימש לשטיפת הדגימות. שלב זה חשוב כדי להעריך את היעילות של disinfestation שטחי של דגימות.
- בצלחת אוטוקלאבית ריקה, מניחים את הדגימות ומשתמשים באזמל להבה ומלקחיים כדי לחלק את הדגימות לעובי של כ-0.2 ס"מ.
- דגימות גליליות חתוכות לאורכן בשני חצאים אם רוצים להגביר את המשטח במגע עם המדיום. כדי לחשוף טוב יותר פירות ואיברים כדוריים אחרים, קוצצים או פורסים את המבנים ביסודיות. הזרעים יכולים להיות גם מקורות פטרייתיים חשובים, לכן יש לוודא שהפרי המקוטע חושף אותם למדיום.
הערה: רק איברים בריאים, ללא נזק לרקמות או אותות של מחלות אפשריות או זיהומים פתוגניים, צריכים לשמש לבידוד אנדופיטים פטרייתיים. - לפזר חמישה שברים של איברים תת קרקעיים בצלחות פטרי עם PDA + אנטיביוטיקה. ודאו שהשברים רחוקים זה מזה ככל האפשר, וגם אינם נוגעים בשולי המנה. אין לסדר שברים כלשהם בתווך. הכינו עותקים משוכפלים של כל איבר מותקן, כאמצעי זהירות במקרה של זיהום.
- אוטמים את צלחות הפטרי בסרט נצמד ומאחסנים אותם בחושך ב 25-27 מעלות צלזיוס (רצוי באינקובטור) למשך 5 ימים.
- חשבון תדירות בידוד (IF)11
- לאחר 5 ימים של דגירה של שברי איברים, חשב את IF, על פי מספר השברים המודגרים המציגים מושבות פטרייתיות הגדלות חלקי סך כל השברים המודגרים, כפי שמיוצג במשוואה הבאה:
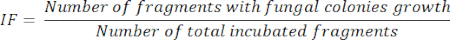
- לאחר 5 ימים של דגירה של שברי איברים, חשב את IF, על פי מספר השברים המודגרים המציגים מושבות פטרייתיות הגדלות חלקי סך כל השברים המודגרים, כפי שמיוצג במשוואה הבאה:
- טיהור של מבודדים פטרייתיים על ידי striating ו subculturing
הערה: כל שלב המפורט בשלב 2.4 חייב להתבצע בתוך מכסה מנוע זרימה למינרית.- הכינו צלחות פטרי (בקוטר 5 ס"מ) עם אגר-אגר 5-7 גרם לליטר (AA; אגר בקטריולוגי בלבד). שמור את הכלים במשך 24 שעות ב 36 ° C כדי לחסל אלה מזוהמים.
- זהה כל מושבה פטרייתית גדלה עם קוד ותחם את שוליה בצד התחתון של המנה (ניתן לעשות זאת עם סמן קבוע). הבדיל בין המושבות לפי צבע, תבנית צמיחה, מרקם ותבנית שוליים.
- בעזרת קיסם עץ אוטוקלאבי, בעזרת הקצה הדק, מחזירים כמות זעירה של תפטיר ממושבת פטריות. יש להתרכז בשולי המושבה ולבחור אזור רחוק ככל האפשר ממושבה אחרת, תוך הימנעות מהתאוששות של יותר מסוג מושבה אחד בבת אחת.
- באמצעות אותו קיסם עם תפטיר בקצה, למתוח את AA לייצר שלושה striae (חריצים). מוודאים שכל סטריה נמצאת במרחק של 1 ס"מ מהשנייה ומקצוות המנה. כתוב את הקוד המתאים (באמצעות נייר מדבקה ועיפרון), אטם את הכלים ושמור אותם מודגרים בחושך ב 25-27 מעלות צלזיוס במשך 3 ימים.
- הכינו צלחות פטרי (בקוטר 8 ס"מ) עם מחשב כף יד 39 גרם/ליטר. אין צורך להוסיף אנטיביוטיקה בשלב זה.
- לאחר הדגירה על צלחות ה-AA, התבוננו בהן בקפדנות כנגד האור (מנורה או חלון), במטרה לזהות קורים עדינים היוצרים מושבות בודדות. תחמו את שטחה של מושבה בודדת בכל מנה, באמצעות סמן קבוע בצד התחתון של צלחת הפטרי.
- במכסה מנוע זרימה למינרית, השתמשו בקיסם אוטוקלאבי כדי לחתוך חלק מהתווך המכיל את המושבה והעבירו את נפח החיתוך למרכז צלחת מחשב כף יד חדשה.
- זהה את צלחות פטרי עם הקודים של המבודדים, אטם את הכלים עם סרט נצמד, ולשמור אותם בחושך ב 25-27 מעלות צלזיוס במשך 7-14 ימים.
3. שימור של מבודדי פטריות מטוהרים
הערה: כל חומר, תמיסה וריאגנט המשמשים בסעיף זה חייבים להיות סטריליים. אלה שלא ניתן לרכוש כבר מעוקר צריך להיות autoclaved ב 121 ° C במשך 20 דקות.
- שימור בשיטת קסטלני או בשמן מינרלי (3-6 חודשים)11,15
- הכינו 2 מ"ל צינורות מיקרוצנטריפוגה עם 0.5 מ"ל מים מזוקקים או המכילים 0.5 מ"ל שמן מינרלי (בהתאם לשיטה שנבחרה). ודא שהצינורות ריקים אוטומטית, והמים והשמן האוטוקלאביים מתווספים לצינורות בתוך מכסה מנוע זרימה למינרית.
- במכסה מנוע זרימה למינרית, הניחו את צלחות הפטרי עם מבודדים מטוהרים שכבר גדלו במחשבי כף יד (39 גרם לליטר) למשך 7-14 ימים. בעזרת קיסם אוטוקלאבי, חותכים קוביות קטנות (0.5 ס"מ x 0.5 ס"מ באזור העליון) של תווך המכיל את שולי התפטיר.
- מניחים ארבע עד שש קוביות בצינורות מיקרוצנטריפוגות עם מים מזוקקים (השיטה של קסטלני) או שמן מינרלי. אחסנו את הצינורות בחושך, בטמפרטורה של 25 מעלות צלזיוס למשך זמן רב ככל שיידרש, תוך התבוננות במגבלות הזמן של השיטה.
הערה: הימנע מהוספת יותר מדי קוביות לצינורות והפיכתן למלאות, מה שעלול להגדיל את סיכויי הזיהום. ניתן לשמור על צינורות בקירור, אשר עשוי להעדיף שימור של כמה מבודדים במשך זמן רב יותר. Currah et al.16 ממליצים לאחסן שכפולים של פטריות מיקוריזה מבודדות מסחלבים טרופיים הן בקירור והן בטמפרטורה של 25 מעלות צלזיוס, מכיוון שהן עלולות ללכת לאיבוד כאשר הן נמצאות באחסון קר. - החזירו קובואיד והניחו אותו במרכז צלחת מחשב כף יד חדשה כדי לגדל מבודד מאוחסן.
- שימור בהקפאה בגרגרי אורז ללא קליפה (>שנה אחת)17
- שוטפים גרגרי אורז לא קלופים במים זורמים ומבשלים אותם עד שקליפת האורז מתחילה להיפתח. מפזרים את הגרגרים המבושלים במבחנות זכוכית עם מכסה בורג ו autoclave פעמיים עם מרווח של 24 שעות ביניהם.
- במכסה מנוע זרימה למינרית, הניחו את צלחות הפטרי עם מבודדים מטוהרים שכבר גדלו במחשבי כף יד (39 גרם לליטר) למשך 7-14 ימים. בעזרת קיסם אוטוקלאבי, מחזירים חמישה שברי קורים קטנים משולי התפטיר ומחסנים אותם בצינור המכיל גרגרי אורז אוטוקלאביים.
הערה: חיסון קורים בנקודות ובעומקים שונים של הצינור מבטיח שהמבודד יישב את גרגרי האורז הלא קלופים בפחות זמן. - לדגור את הצינורות בחושך ב 25-27 מעלות צלזיוס במשך 14 ימים. להסעיר את הצינורות על ידי מערבול אותם כל 3 ימים כדי לשמור על גרגרים בודדים.
- לאחר התבוננות בגידול פטרייתי בגרגרי האורז, פזרו את הגרגרים בצלחת פטרי אוטוקלאבית מרופדת בנייר פילטר כדי לספוג לחות, על הנייר כדי שהגרגרים יוכלו להתייבש. יש לאחסן בחושך בטמפרטורה של 25-27 מעלות צלזיוס למשך 2-3 ימים.
- הכינו צינוריות קריו-צינור עם 1/3 ג'ל סיליקה בתחתית ו-1/3 צמר זכוכית מעל הסיליקה. לבסוף, להפיץ 1/3 של גרגרי אורז עם תפטיר פטרייתי גדל. יש לאחסן בטמפרטורה של -20°C למשך 24 שעות.
- לאחר 24 שעות, לאחסן את cryotubes ב -80 °C כל עוד יש צורך, התבוננות במגבלות הזמן של השיטה.
- שימור בהקפאה בוורמיקוליט באמצעות cryoprotectant (>1 שנה)18
- הכינו תרבית נוזלית המורכבת מ-0.2% תמצית שמרים ו-2% גלוקוז במים מזוקקים. התאם את ה- pH ל -5 ובצע autoclave אותו.
- להפיץ 0.2 גרם של ורמיקוליט (להשתמש גרנולומטריה עדינה) cryotubes עם מכסה בורג autoclave אותם. הוסף 0.8 מ"ל של מדיום נוזלי autoclaved cryotubes המכילים vermiculite.
- במכסה מנוע זרימה למינרית, הניחו את צלחות הפטרי עם מבודדים מטוהרים שכבר גדלו במחשבי כף יד (39 גרם לליטר) למשך 7-14 ימים. בעזרת קיסם אוטוקלאבי מחזירים שלושה עד חמישה שברי קורים משולי התפטיר ומחסנים לאורך הצינור המכיל ורמיקוליט + מדיום תרבית נוזלית. זכור לזהות את ה- cryotubes עם קוד הבידוד המתאים.
הערה: חיסון קורים בנקודות ובעומקים שונים של צינור ההקפאה מבטיח שהמבודד יישב את הוורמיקוליט בפחות זמן. - לאחסן את cryotubes בחושך ב 25-27 ° C עד קולוניזציה של רוב גרגרי vermiculite ניתן לצפות, אשר בדרך כלל לוקח בערך 14 ימים.
- הכינו תמיסה קריופרוטקטורית המורכבת מ-5% גליצרול ו-5% טרהלוז במים מזוקקים ובצעו אוטוקלאב. תנו לתמיסה להתקרר לפני השימוש בה.
- לאחר vermiculite ב cryotubes הוא מושבת על ידי מבודד פטרייתי בהתאמה, להפיץ 0.4 מ"ל של cryoprotectant בכל צינור ולשמור את cryotubes בקירור ב 4 ° C במשך 48 שעות. לאחר מכן, שמור על ה- cryotubes ב -80 °C כל עוד יש צורך, תוך התבוננות במגבלות הזמן של השיטה.
4. אפיון מקרומורפולוגי של פטריות נימה (מורפולוגיה של מושבה)
- שמור רישום צילום של התפטיר גדל בכל צלחת פטרי עם 39 גרם / ליטר מחשב כף יד במשך 7-14 ימים. זכור לרשום את שני צידי המושבה, העליון והתחתון (הפוך). אם הכלים הולכים לשמש בקלות בסעיף 6 או לא מתוחזקים, לפתוח את הכלים בעת צילום אותם כדי לקבל תמונות טובות יותר.
- אם מעוניינים בנתונים כמותיים על מורפולוגיה של מושבות, תת-תרבות משכפלת את המבודדים ומתחזקת אותם באותם תנאי גידול ולתקופה קבועה כדי לרשום את קוטר המושבה ולחשב את קצב הגידול (בדרך כלל במ"מ/שעה).
הערה: ניתן להשיג תוצאות כמותיות מתוחכמות יותר על ידי שימוש בסוגים שונים של אמצעי תרבות להשוואה19 ועל ידי התחשבות בכלי הסטטיסטיקה לטיפול בנתונים. - התבוננו במושבות גם תחת סטריאומיקרוסקופ כדי לזהות מאפיינים מורפולוגיים ולצלם בהגדלה. להעריך את המושבות על פי המאפיינים המקרומורפולוגיים שלהן, כמפורט בסעיף התוצאות. עיין במקורות ביבליוגרפיים מגוונים כדי לעזור לסווג ולקשר את המקרומורפולוגיה לזיהוי מולקולרי ו / או מורפולוגי.
5. אפיון מיקרומורפולוגי של פטריות נימה (מורפולוגיה היפאלית)
הערה: הטכניקות המיקרומורפולוגיות מושוות בחלק הדיון, בהתחשב בשימושים ובחסרונות האפשריים שלהן.
- גדלו את המבודדים על צלחות פטרי עם מחשב כף יד של 39 גרם לליטר למשך 7-14 ימים. להערכת פטריות מיקוריזה משוערות של סחלבים, גדלו את המבודדים על אגר קמח תירס 17 גרם / ליטר (CMA; או מדיום מגביל תזונתי אחר) במשך 3-7 ימים19.
- להקניט הר
- עבודה בתוך מכסה מנוע זרימה למינרית. הניחו טיפה של כתם שנבחר (שלב 5.5) על מגלשת זכוכית נקייה.
- בעזרת קיסם אוטוקלאבי או חומר סטרילי אחר, הסירו בזהירות מעט קורים מהמבודד הגדל והניחו אותם בטיפת הכתם. הניחו מכסה (רצוי בזווית התחלתית של 45° כדי למנוע בועות אוויר) ונתחו תחת מיקרוסקופ אור.
- תושבת סרט הדבקה
הערה: טכניקה זו מיושמת בדרך כלל בתרביות פטרייתיות לשימוש קל בסעיף 6 או לא מתוחזק, שכן סרט הדבקה לא יכול להיות autoclaved, זיהומים עלולים להתרחש לאחר ביצוע השיטה.- הניחו טיפה של כתם שנבחר (שלב 5.5) על מגלשת זכוכית נקייה. חותכים רצועה של סרט הדבקה שקוף בגודל שמתאים למגלשת הזכוכית והכתם המרכזי נופל היטב.
- כוונו את המשטח הדביק של הרצועה למשטח התפטיר. אל תלחץ, ונסה לאסוף כמה hyphae מבלי להדביק יותר מדי מהם.
- הדביקו את הסרט למגלשת הזכוכית, וודאו שהכתם בא במגע עם הקורים שנאספו. מניחים טיפת מים מעל הסרט ומניחים כיסוי. נתח את השקף תחת מיקרוסקופ אור.
- תרבית שקופיות של פטריות נימה20
- בתוך צלחת פטרי גדולה (בקוטר >9 ס"מ, רצוי), מקמים: נייר סינון בחלקו התחתון, מוט זכוכית בצורת U או אדפטציה (המטרה היא לספק הגבהה למגלשת הזכוכית), מגלשת זכוכית אחת ושתי כיסויים. מנות פטרי גבוהות יותר מקלות על המניפולציה. רכבו את הערכות האלה של צלחות פטרי, אחת לכל מבודד.
- הכינו נפח קטן של 39 גרם / ליטר PDA או 17 גרם / ליטר CMA, להוסיף 10 גרם / ליטר אגר בקטריולוגי, ו autoclave (נפח צלחת פטרי אחת מספיק עבור יותר מ 30 מבודדים). אמצעי התרבות המשמשים בתרבות השקופיות חייבים להיות קשים יותר מהמדיה הרגילה. Autoclave 100 מ"ל של מים מזוקקים.
- עבודה בתוך מכסה מנוע זרימה למינרית. מניחים את המדיום הנוזלי בצלחת פטרי, ויוצרים שכבה בגובה של כ-0.5 ס"מ. תנו למדיום להתמצק. לאחר מוצק, להשתמש אזמל סטרילי לחתוך ריבועים של המדיום כי הם 1 ס"מ x 1 ס"מ בגודל.
- פתחו את ערכת צלחת הפטרי בתוך מכסה מנוע זרימה למינרית והשתמשו במלקחיים בוערים כדי לארגן את החומר האוטומטי בתוך המנה. סדרו את החומר בסדר ממוספר, כפי שניתן לראות באיור 2A, והניחו ריבוע של מדיום תרבות על שקופית הזכוכית. לפני הנחת הכיסוי מעל המדיום, המשך לשלב 5.4.5.
- השתמש קיסם autoclaved כדי לשחזר קצת hyphae מבודד בזהירות לשפשף את ארבעת הפנים הצדיים של המדיום מונח על מגלשת זכוכית. הניחו כיסוי אוטומטי על הריבוע הבינוני באמצעות מלקחיים בוערים.
- השתמש בקצה פיפטה סטרילי כדי להניח מים autoclaved בנייר סינון, כדי ליצור תא לח. השתמש בנפח כדי להרוות את הנייר מבלי להניח מים עודפים. אטמו את צלחת הפטרי בסרט נצמד וזהו אותה עם קוד הבידוד המתאים. שמור על הכלים בחושך ב 25-27 מעלות צלזיוס במשך 3-7 ימים.
- העריכו את צמיחת הקורים במגלשת הזכוכית ובכיסוי. מכל ערכת תרבות שקופיות מופקות שתי שקופיות, האחת באמצעות מגלשת הזכוכית עם hyphae ו-autoclaved coverslip, השנייה באמצעות ה-coverslip עם hyphae ושקופית זכוכית נוספת.
- לאחר שנצפתה גדילה של היפה, נתקו בזהירות את ריבוע התווך משקופית הזכוכית (איור 2B), הרכיבו את שתי השקופיות באמצעות כתם שנבחר (שלב 5.5), ונתחו תחת מיקרוסקופ אור. זכור לזהות את קוד הבידוד בשקופית. כדי לייצר שקופיות חצי קבועות, אטמו את הכיסוי בלק שקוף.
- כדי לייצר שקופיות קבועות, שטפו בזהירות את הצבע מקורים שהודבקו לאחר הצביעה ותנו למגלשה להתייבש. הר עם אמצעי הרכבה מהיר (לפרטים, קרא את Pena-Passos et al.10).
הערה: החיסרון של ייצור שקופית קבועה בטכניקה זו הוא שניתן לשטוף נבגים ומבנים שאינם דבוקים לזכוכית.
- שיטות צביעה ותצפית קורים
- לקטופנול כותנה כחולה (LPCB)21: הוסף 20 מ"ל חומצה לקטית, 40 מ"ל גליצרול ו-20 מ"ל מים מזוקקים. יש להמיס 20 גרם גבישי פנול בתמיסה זו על ידי חימום עדין. להמיס 0.05 גרם של כחול מתיל (כותנה כחולה, או 2 מ"ל של תמיסה מימית 1%). LPCB ניתן גם לרכוש בקלות כבר מוכן.
זהירות: פנול רעיל מאוד ונדיף; לתפעל אותו אך ורק בתוך מכסה מנוע מנדף וללבוש כפפות. - Toluidine כחול O10(TBO): להכין 0.05% TBO ב 0.1 M פוספט חיץ (pH 6.8).
- קונגו אדום22,23,24: הכינו תמיסה של 1% קונגו אדום במים מזוקקים וסננו אותה. דוגרים במשך 5-10 דקות. צבע זה יכול להיות מיושם גם עבור מיקרוסקופ פלואורסצנטי25.
- בעת התבוננות וצילום קורים פטרייתיים תחת מיקרוסקופ אור, יש להיוועץ במקורות ביבליוגרפיים מגוונים כדי לסייע בזיהוי מבנים (בדוק את הדיון).
- לקטופנול כותנה כחולה (LPCB)21: הוסף 20 מ"ל חומצה לקטית, 40 מ"ל גליצרול ו-20 מ"ל מים מזוקקים. יש להמיס 20 גרם גבישי פנול בתמיסה זו על ידי חימום עדין. להמיס 0.05 גרם של כחול מתיל (כותנה כחולה, או 2 מ"ל של תמיסה מימית 1%). LPCB ניתן גם לרכוש בקלות כבר מוכן.

איור 2: נהלים לתרבית שקופיות של פטריות נימה . (A) תצורה סכמטית של ערכת תרבית שקופיות, כאשר המספרים מציינים את סדר סידור האלמנטים. (B) ניתוק הריבוע של מדיום התרבית לאחר שנצפתה צמיחה היפלית במגלשת הזכוכית ובכיסוי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
6. מיצוי DNA כולל מבודדי פטריות (פרוטוקול תוצרת בית26 עם שינויים 27)
הערה: כל חומר, תמיסה וריאגנט המשמשים בסעיף זה חייבים להיות סטריליים. אלה שלא ניתן לרכוש כבר מעוקר צריך להיות autoclaved ב 121 ° C במשך 20 דקות. יש ללבוש כפפות במהלך כל הפרוטוקול ולבצע כמה שלבים בתוך מכסה מנוע.
- הכינו את מאגר המיצוי: 1% נתרן דודציל סולפט (SDS), 250 mM NaCl, 200 mM Tris-HCl (pH 8.0) ו-25 mM חומצה אתילאנדיאמיןטטראצטית (EDTA). גדל את המבודדים המטוהרים במחשבי כף יד של 39 גרם/ליטר למשך 7-14 ימים.
- בזהירות לגרד את התפטיר מבודד באמצעות מרית או כף ולהעביר את השברים לטיט autoclaved, הימנעות העברת המדיום תרבית עם אגרגטים hyphae. בעזרת חרסינה טוחנים את התפטיר בחנקן נוזלי לאבקה דקה. אל תתנו לתפטיר הטחון להמיס, והוסיפו חנקן כדי להימנע מכך.
- הוסף 1 מ"ל של חיץ מיצוי בצינור מיקרוצנטריפוגה של 2 מ"ל ומקם את דגימת הקרקע עד לסימן 1.5 מ"ל. בעדינות להתסיס את התוכן של צינורות הומוגניזציה.
- עצבו את הצינורות במערבולת במשך 5 שניות והניחו אותם בתרמובלוק בטמפרטורה של 65 מעלות צלזיוס למשך 20 דקות. בזהירות הומוגני התוכן על ידי היפוך כל 7-10 דקות.
- צנטריפוגה את הצינורות ב 10,000 x גרם במשך 10 דקות ב 4 ° C. מעבירים 800 μL מהשלב העליון לצינור מיקרוצנטריפוגה חדש של 2 מ"ל, מוסיפים 800 μL פנול לצינורות, ומערבבים את התוכן בהיפוך.
זהירות: פנול הוא מגיב רעיל ונדיף ביותר; זה יכול לגרום אריתמה, נמק, נמק רקמות. כאשר נשאף, זה יכול לגרום קוצר נשימה ושיעול. הספיגה המערכתית עלולה לפגוע בכבד, בכליות ובמערכת העצבים המרכזית. יש לתפעל פנול אך ורק בתוך מכסה מנוע מנדף וללבוש כפפות.
הערה: מהשלב הבא ואילך, השתמש בכפפות ונהל את הפרוטוקול בתוך מכסה אדים. - צנטריפוגה את הצינורות ב 10,000 x גרם במשך 10 דקות ב 4 ° C ולהעביר 800 μL מהשלב העליון לצינור חדש 2 מ"ל, בזהירות למנוע העברה של תוכן השלב הנחות.
- הוסף 400 μL של פנול ו 400 μL של כלורופורם לצינורות ולערבב את התוכן על ידי היפוך. צנטריפוגר אותם ב 10,000 x גרם במשך 10 דקות ב 4 ° C.
זהירות: כלורופורם הוא מגיב רעיל ונדיף ביותר; זה יכול לגרום לגירוי ופציעות כאשר באים במגע עם העור, ואם נשאף, משפיע על מערכת העצבים המרכזית ומערכת הלב וכלי הדם, הכבד והכליות. יש לתפעל כלורופורם אך ורק בתוך מכסה מנוע מנדף וללבוש כפפות. - יש להחזיר 800 μL או פחות מהשלב העליון לצינור חדש של 2 מ"ל. מוסיפים 800 מיקרוליטר כלורופורם, מערבבים את התוכן בהיפוך וצנטריפוגה ב-10,000 x גרם למשך 10 דקות ב-4°C.
הערה: בשלב זה, אין להעביר שאריות מהשלב התחתון לצינורות חדשים. לכן, היזהר במיוחד בעת התאוששות השלב העליון. - העבר 600-800 μL מהשלב העליון לצינור חדש של 1.5 מ"ל והוסף 450 μL של איזופרופנול. מערבבים את התוכן בהיפוך ודגרים ב-25°C למשך 5 דקות.
- צנטריפוגה את הצינורות ב 10,000 x גרם במשך 5 דקות ב 4 ° C ו להשליך את supernatant באמצעות micropipette. היזהר לא להשליך את הגלולה שהונחה בתחתית הצינור.
- הוסף 500 μL של 80% אתנול וצנטריפוגה למשך 5 דקות. יש לחזור על הפעולה פעמיים במקרה שהגלולה אינה מובהרת.
- מוציאים את האתנול באמצעות מיקרופיפטה ומייבשים את הגלולה ב 37 מעלות צלזיוס למשך 30-60 דקות. מוסיפים 30-50 μL של מים deionized, פולט את הגלולה באמצעות micropipette.
- שמור על הצינורות ב -4 ° C במשך הלילה עבור eution DNA מלא ולהקפיא את התוכן ב -20 ° C.
7. מיצוי DNA כולל מאיברי צמחים למתודולוגיית metabarcoding (ערכה מסחרית)
הערה: לצורך המתודולוגיה הבאה, יש לרכוש את הערכה המסחרית המצוינת בטבלת החומרים כערכת מיצוי DNA של הקרקע. כל חומר, תמיסה וריאגנט המשמשים בסעיף זה חייבים להיות סטריליים. אלה שלא ניתן לרכוש כבר מעוקר צריך להיות autoclaved ב 121 ° C במשך 20 דקות. מומלץ מאוד ללבוש כפפות במהלך כל הפרוטוקול, ואת השלבים ניתן לבצע בתוך מכסה מנוע זרימה למינרית. הפרוטוקול המתואר שונה מ- De Souza et al.12, מהפרוטוקול המפורט על ידי היצרן.
- בעזרת חומרי חרסינה וטיט, טוחנים את השורשים שנאספו לאחר שלב 1.2 בחנקן נוזלי, ומפחיתים את הדגימות לאבקה דקה. הוסף 0.3 גרם מדגימות הקרקע לצינורות PowerBead והתסיס בעדינות להומוגניזציה.
- הוסף 60 μL של תמיסה C1 (כלולה בערכה) לצינורות PowerBead וערבב את התוכן בהיפוך. באמצעות הומוגנייזר רקמות וליזר תאים (טבלה של חומרים), לקשור את הצינורות בחוזקה לתמיכה נאותה, להתאים את התמיכה למערבולת, ולהפעיל את הציוד במהירות מקסימלית במשך 10-20 דקות.
הערה: במקרה שתמיסת C1 מואצת, חממו אותה ב-60°C עד להמסה מלאה. - צנטריפוגה את הצינורות ב 10,000 x גרם במשך 30 שניות ב 25 ° C. העברת 500 μL של supernatant ל 2 מ"ל צינורות microcentrifuge. התוכן המועבר עשוי להיות חלקיקי.
- הוסף 250 μL של תמיסה C2 לצינורות ולהתסיס במערבולת במשך 5 שניות. יש לדגור ב-4°C למשך 5 דקות ולאחר מכן לצנטריפוגה ב-10,000 x g למשך 1-2 דקות ב-25°C.
- להעביר יותר מ 600 μL של supernatant צינורות חדשים 2 מ"ל, הימנעות גלולה. הוסף 200 μL של תמיסה C3 ולהתסיס על מערבולת במשך 5 שניות.
- יש לדגור ב-4°C למשך 5 דקות ולאחר מכן לצנטריפוגה ב-10,000 x g למשך דקה אחת ב-25°C. בשלב זה, ודא שהסופרנאטנט אינו חלקיקי.
- מעבירים יותר מ-750 מיקרוליטר של הסופרנאטנט לצינורות חדשים של 2 מ"ל, תוך הימנעות מהכדור. הומוגניזציה של התמיסה C4 היטב, להוסיף 1,100 μL של תמיסה C4 לסופרנטנט, ולהתסיס במערבולת במשך 5 שניות.
- טען 675 μL מתכולת הצינורות בעמודות הספין של MB, מעל המסנן, וצנטריפוגה ב- 10,000 x גרם למשך דקה אחת ב- 25 ° C. יש להשליך את תכולת הנוזלים.
- חזור על השלב הקודם פעמיים עד שכל התוכן של כל צינור מעובד. לאחר מכן, הוסף 500 μL של תמיסה C5 במרכז המסנן הנוכחי בעמוד העליון של הצינור וצנטריפוגה ב 10,000 x גרם במשך 30 שניות ב 25 ° C.
- יש להשליך שוב את תכולת הנוזלים והצנטריפוגה באותם תנאים כמו השלב הקודם. העבר בזהירות את העמודה העליונה של עמודת הספין MB לצינורות מיקרוצנטריפוגות חדשים של 2 מ"ל, תוך הימנעות מטפטוף תוכן נוזלי כלשהו בעמודה.
- הוסף 85-100 μL של תמיסה C6 למרכז המסנן והמתן 1 דקה. צנטריפוגה ב- 10,000 x גרם למשך 30 שניות ב- 25 ° C ומחק את עמודת הספין של MB. אחסנו את הצינורות בטמפרטורה של -80°C.
8. כימות DNA בספקטרופוטומטר (בדוק את טבלת החומרים)
- באמצעות הספקטרופוטומטר שצוין, פתח את התוכנה. בחר באפשרות חומצת גרעין, בחר באפשרות DNA והגדר את הריכוז ל - ng/μL.
- הוסף 1 μL של מים שעברו דה-יוניזציה לגלאי הספקטרופוטומטר וכייל על-ידי בחירה באפשרות ריק. לאחר הקריאה, נגב בעדינות את הגלאי בנייר טישו רך.
- תן שם לדוגמת השדה עם קוד הבידוד של הדגימה שיש לקרוא ומקם 1 μL ממנה בגלאי הציוד. בחר באפשרות מדידה; נוצר גרף וטבלה עם התוצאות.
- חזור על שלב 8.3 עד שכל הדגימות ייקראו. מומלץ לשמור את הטבלה עם התוצאות שנוצרו עבור רשומה וניתוח: בחר באפשרות דוחות ואת המיקום שבו הקובץ .xml יישמר.
- הוסף 5 μL של מים deionized לגלאי, לחכות כמה דקות, לנגב אותו בעדינות עם נייר טישו רך.
Access restricted. Please log in or start a trial to view this content.
תוצאות
בפרוטוקול הבידוד, בהתחשב בכך שיש זיהום מהמים ששימשו בשטיפה האחרונה והזיהום מזוהה גם בצלחות פטרי עם שברים מחוסנים, ניתן לנקוט פעולות שונות, בהתאם לסוג המזהם (טבלה 1). יש לחזור על הליך זה מההתחלה במקרה של מזהמים פטרייתיים נבגים מאוד, המציגים גם צמיחה מואצת, וחיידקים...
Access restricted. Please log in or start a trial to view this content.
Discussion
ההתפשטות השטחית של דגימות צמחים היא אחד השלבים הקריטיים ביותר בפרוטוקול המוצג. רצוי מאוד שלא יהיה זיהום בכלי מחשב כף היד עם טיפות מהשטיפה האחרונה. חיידקים נצפים לעתים קרובות כמזהמים בצלחות הבידוד, בדרך כלל יותר מאשר פטריות נבגים הנישאות באוויר, בהתחשב בכך שחיידקים אנדופיטיים נפוצים גם בר...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף ואין ניגוד עניינים.
Acknowledgements
אנו מודים למימון של FAPESP (2015/26479-6) ו- CNPq (447453/2014-9). JLSM מודה ל- CNPq על מענקי פרודוקטיביות (303664/2020-7). MPP מודה Capes (מלגת תואר שני, תהליך 88887.600591/2021-00) ו- CNPq.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Adhesive tape | (from any company, for adhesive tape mount in micromorphological analyses) | ||
| Ampicillin | Sigma-Aldrich | A5354 | (for installation of plant fragments; other antibiotics may be used - check step 2.2.1) |
| Autoclave | (from any company, for materials sterilization in many steps) | ||
| Bacteriological agar | Sigma-Aldrich | A1296 | (for many steps) |
| C1, C2, C3, C4, C5, and C6 solutions | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Centrifuge | Merck/Eppendorf | 5810 G | (for total DNA extraction from fungal isolates) |
| Centrifuge tubes | Merck | CLS430828 | (for samples collection) |
| Chloroform | Sigma-Aldrich | C2432 | (for total DNA extraction from fungal isolates) |
| Congo red | Supelco | 75768 | (for hyphae staining) |
| Cryotubes | Merck | BR114831 | (for many steps) |
| Ethanol | Supelco | 100983 | It will be necessary to carry out the appropriate dilutions (for many steps) |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 3609 | (for total DNA extraction from fungal isolates) |
| Filter paper | Merck | WHA10010155 | (for many steps) |
| Glass test tubes | Merck | CLS7082516 | (for cryopreservation in unhulled rice grains) |
| Glass wool | Supelco | 20411 | (for cryopreservation in unhulled rice grains) |
| Glucose | Sigma-Aldrich | G8270 | Or dextrose (for cryopreservation in vermiculite) |
| Glycerol | Sigma-Aldrich | G5516 | Or glycerin (for cryopreservation in vermiculite, for preparing LPCB) |
| Isopropanol | Sigma-Aldrich | 563935 | (for total DNA extraction from fungal isolates) |
| Lactic acid | Sigma-Aldrich | 252476 | (for preparing LPCB - hyphae staining) |
| Lactophenol blue solution (LPCB) | Sigma-Aldrich | 61335 | (for hyphae staining) |
| Laminar flow hood | (class I, from any company, for many steps) | ||
| Light microscope | (from any company, for hyphae observation) | ||
| MB Spin Columns | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Methyl blue (cotton blue) | Sigma-Aldrich | M5528 | (for preparing LPCB - hyphae staining) |
| Microcentrifuge tube (1.5 mL) | Merck | HS4323 | (for total DNA extraction from fungal isolates) |
| Microcentrifuge tube (2 mL) | Merck | BR780546 | (for many steps) |
| Mineral oil | (for preservation of fungal isolates) | ||
| Paper bags | Average size 150 mm x 200 mm (for samples collection) | ||
| Petri dish (Glass, 120 mm x 20 mm) | Merck/Pyrex | SLW1480/10D | (autoclavable, for fungi slide culture, prefer higher ones) |
| Petri dish (Glass, 50 mm x 17 mm) | Merck/Aldrich | Z740618 | (for purification of fungal isolates); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Petri dish (Glass, 80 mm x 15 mm) | Merck/Brand | BR455732 | (for installation of plant fragments); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Phenol | Sigma-Aldrich | P1037 | (for total DNA extraction from fungal isolates, for preparing LPCB) |
| Porcelain mortar | Sigma-Aldrich | Z247464 | (for total DNA extraction from fungal isolates) |
| Porcelain pestle | Sigma-Aldrich | Z247502 | (for total DNA extraction from fungal isolates) |
| Potato dextrose agar (PDA) | Millipore | P2182 | (for many steps) |
| PowerBead tubes | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Rapid mounting medium (Entellan) | Sigma-Aldrich | 1.0796 | (for fungi slide culture) |
| Silica gel | Supelco | 717185 | (for cryopreservation in unhulled rice grains) |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | (for total DNA extraction from fungal isolates) |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | Lauryl sulfate sodium salt (for total DNA extraction from fungal isolates) |
| Sodium hypochlorite (w/ 2% active chlorine) | (commercial product, for superficial desinfestation) | ||
| Soil DNA extraction kit (DNeasy PowerSoil kit) | Qiagen | 12888-50 | (for total DNA extraction from plant organs) |
| Spectrophotometer - Nanodrop 2000/2000c | ThermoFisher Scientific | ND2000CLAPTOP | (for total DNA extraction from plant organs) |
| Stereomicroscope | (=dissecting microscope, from any company, for macromorphological analyses) | ||
| Tetracycline | Sigma-Aldrich | T7660 | (for installation of plant fragments) |
| Thermoblock | Merck/Eppendorf | EP5362000035 | (or from other companies) |
| Tissue homogenizer and cell lyzer | SPEX SamplePrep | 2010 Geno/Grinder - Automated Tissue Homogenizer and Cell Lyzer (for total DNA extraction from plant organs) | |
| Toluidine blue O | Sigma-Aldrich/Harleco | 364-M | (for hyphae staining) |
| Trehalose | Sigma-Aldrich | T9531 | (for cryopreservation in vermiculite) |
| Tris Base Solution (Tris) | Sigma-Aldrich | T1699 | (for total DNA extraction from fungal isolates) |
| Unhulled rice grains | (for cryopreservation) | ||
| U-shaped glass rod | (or an adaptation - check step 5.4.1, for fungi slide culture) | ||
| Vermiculite | Fine granulometry (for cryopreservation in vermiculite) | ||
| Vortexer | Sigma-Aldrich/BenchMixer | BMSBV1000 | (for total DNA extraction from fungal isolates) |
| Yeast extract | Sigma-Aldrich | Y1625 | (for cryopreservation in vermiculite) |
References
- de Azevedo, J. L. Endophytic microorganisms. Ecologia Microbiana. , 117-137 (1998).
- Stone, J. K., Bacon, C. W., White, J. F. An overview of endophytic microbes: endophytism defined. Microbial Endophytes. , 17-44 (2000).
- Schulz, B., Boyle, C. What are Endophytes. Microbial Root Endophytes. , Springer-Verlag. Berlin. 1-13 (2006).
- Smith, S. E., Read, D. J. Mycorrhizal Symbiosis. , Elsevier Science Academic Press. London. (2008).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Ma, X., Kang, J., Nontachaiyapoom, S., Wen, T., Hyde, K. D. Non-mycorrhizal endophytic fungi from orchids. Current Science. 109 (1), 72-87 (2015).
- Favre-Godal, Q., Gourguillon, L., Lordel-Madeleine, S., Gindro, K., Choisy, P. Orchids and their mycorrhizal fungi: an insufficiently explored relationship. Mycorrhiza. 30 (1), 5-22 (2020).
- Sun, X., Guo, L. -D. Endophytic fungal diversity: review of traditional and molecular techniques. Mycology. 3 (1), 65-76 (2012).
- Pena-Passos, M., Sisti, L. S., Mayer, J. L. S. Microscopy techniques for interpreting fungal colonization in mycoheterotrophic plants tissues and symbiotic germination of seeds. Journal of Visualized Experiments. (183), e63777(2022).
- Araújo, W. L., et al. Endophytic microorganisms: Theoretical and Practical Aspects of Isolation and Characterization. 1st ed. 1, Santarém: UFOPA. 257(2014).
- de Souza, R. S. C., et al. Unlocking the bacterial and fungal communities assemblages of sugarcane microbiome. Scientific Reports. 6, 28774(2016).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589(2019).
- Araújo, W. L., et al. Variability and interactions between endophytic bacteria and fungi isolated from leaf tissues of citrus rootstocks. Canadian Journal of Microbiology. 47 (3), 229-236 (2001).
- Castellani, A. Further researches on the long viability and growth of many pathogenic fungi and some bacteria in sterile distilled water. Mycopathologia. 20 (1-2), 1-6 (1963).
- Currah, R. S., Zelmer, C. D., Hambleton, S., Richardson, K. A. Fungi from orchid mycorrhizas. Orchid Biology: Reviews and Perspectives, VII. , 117-170 (1997).
- Freitas, E. F. S., et al. Diversity of mycorrhizal Tulasnella associated with epiphytic and rupicolous orchids from the Brazilian Atlantic Forest, including four new species. Scientific Reports. 10 (1), 7069(2020).
- Sato, M., Inaba, S., Noguchi, M., Nakagiri, A. Vermiculite as a culture substrate greatly improves the viability of frozen cultures of ectomycorrhizal basidiomycetes. Fungal Biology. 124 (8), 742-751 (2020).
- Pereira, O. L., Kasuya, M. C. M., Borges, A. C., Araújo, E. F. D. Morphological and molecular characterization of mycorrhizal fungi isolated from neotropical orchids in Brazil. Canadian Journal of Botany. 83 (1), 54-65 (2005).
- Riddell, R. W. Permanent stained mycological preparations obtained by slide culture. Mycologia. 42 (2), 265-270 (1950).
- Walsh, T. J., Hayden, R. T., Larone, D. H. Larone's Medically Important Fungi: A Guide to Identification. , ASM Press. (2018).
- Malloch, D. Moulds: Isolation, Cultivation, Identification. , Available from: http://website.nbm-mnb.ca/mycologywebpages/Moulds/Moulds.html (1997).
- Smith, P. Microscopy: Chemical Reagents. British Mycological Society. , Available from: https://www.britmycolsoc.org.uk/field_mycology/microscopy/reagents (2022).
- Senanayake, I. C., et al. Morphological approaches in studying fungi: Collection, examination, isolation, sporulation and preservation. Mycosphere. 11 (1), 2678-2754 (2020).
- Slifkin, M., Cumbie, R. Congo red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Raeder, U., Broda, P. Rapid preparation of DNA from filamentous fungi. Letters in Applied Microbiology. 1 (1), 17-20 (1985).
- Martins, M. K., et al. Molecular characterization of endophytic microorganisms. Endophytic microorganisms: theoretical and practical aspects of isolation and characterization. 1st edition. , Santarém: UFOPA. 189-211 (2014).
- Rayner, R. W. A Mycological Colour Chart. Commonwealth Mycological Institute. , (1970).
- Kornerup, A., Wanscher, J. H. Methuen Handbook of Colour. Methuen handbook of colour. , Methuen & Co. Ltd. London. (1967).
- Ridgway, R. Color Standards and Color Nomenclature. , Washington, DC. Published by the author (1912).
- McGinnis, M. R. Laboratory Handbook of Medical Mycology. , Elsevier Science. (2012).
- Webster, J., Weber, R. Introduction to Fungi. , Cambridge University Press. Cambridge, UK. (2007).
- Sridharan, G., Shankar, A. A. Toluidine blue: A review of its chemistry and clinical utility. Journal of Oral and Maxillofacial Pathology. 16 (2), 251-255 (2012).
- Smith, D., Onions, A. H. S. A comparison of some preservation techniques for fungi. Transactions of the British Mycological Society. 81 (3), 535-540 (1983).
- Ryan, M. J., Smith, D., Jeffries, P. A decision-based key to determine the most appropriate protocol for the preservation of fungi. World Journal of Microbiology and Biotechnology. 16 (2), 183-186 (2000).
- Lalaymia, I., Cranenbrouck, S., Declerck, S. Maintenance and preservation of ectomycorrhizal and arbuscular mycorrhizal fungi. Mycorrhiza. 24 (5), 323-337 (2014).
- Zettler, L. W., Corey, L. L. Orchid mycorrhizal fungi: isolation and identification techniques. Orchid Propagation: From Laboratories to Greenhouses-Methods and Protocols. , 27-59 (2018).
- Yu, S., Wang, Y., Li, X., Yu, F., Li, W. The factors affecting the reproducibility of micro-volume DNA mass quantification in Nanodrop 2000 spectrophotometer. Optik. 145, 555-560 (2017).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Schoch, C. L., et al. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi. Proceedings of the National Academy of Sciences. 109 (16), 6241-6246 (2012).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols: A Guide to Methods and Applications. 18 (1), 315-322 (1990).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proceedings of the National Academy of Sciences. 74 (12), 5463-5467 (1977).
- Ranjard, L., et al. Characterization of bacterial and fungal soil communities by automated ribosomal intergenic spacer analysis fingerprints: biological and methodological variability. Applied and Environmental Microbiology. 67 (10), 4479-4487 (2001).
- Metzker, M. L. Sequencing technologies-the next generation. Nature Reviews Genetics. 11 (1), 31-46 (2010).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Isolation, Characterization, and Total DNA Extraction to Identify Endophytic Fungi in Mycoheterotrophic Plants
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for: Isolation, Characterization, and Total DNA Extraction to Identify Endophytic Fungi in Mycoheterotrophic Plants. The Authors section was updated from:
Juliana Lishcka Sampaio Mayer
to:
Juliana Lischka Sampaio Mayer
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved