Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mikoheterotrofik Bitkilerde Endofitik Mantarları Tanımlamak için İzolasyon, Karakterizasyon ve Toplam DNA Ekstraksiyonu
Bu Makalede
Erratum Notice
Özet
Bu makale, bitki ilişkili endofitik mantarların izolasyonu, izolatların uzun süreli korunması, morfolojik karakterizasyon ve sonraki moleküler tanımlama ve metagenomik analizler için toplam DNA ekstraksiyonu için ayrıntılı ve yeterli protokoller sağlamayı amaçlamaktadır.
Özet
Mikoheterotrofik bitkiler, ototrofik kapasitelerini tamamen kaybetmiş, mikorizal bağımlılığın en aşırı biçimlerinden birini sunar. Diğer hayati kaynaklar kadar önemli olan bu bitkilerin yakından ilişkili olduğu mantarlar onlar için çok önemlidir. Bu nedenle, mikoheterotrofik türlerin incelenmesinde en uygun tekniklerden bazıları, özellikle köklerde ve yeraltı organlarında yaşayanlar olmak üzere, ilişkili mantarların araştırılmasını sağlayan tekniklerdir. Bu bağlamda, kültüre bağımlı ve kültürden bağımsız endofitik mantarların tanımlanması için teknikler yaygın olarak uygulanmaktadır. Mantar endofitlerinin izole edilmesi, onları morfolojik olarak tanımlamak, çeşitliliklerini analiz etmek ve orkide tohumlarının simbiyotik çimlenmesindeki uygulamalar için aşılamayı korumak için bir araç sağlar. Bununla birlikte, bitki dokularında yaşayan çok çeşitli kültürlenemeyen mantarların olduğu bilinmektedir. Bu nedenle, kültürden bağımsız moleküler tanımlama teknikleri, tür çeşitliliği ve bolluğunun daha geniş bir kapsamını sunar. Bu makale, kültüre bağlı ve bağımsız olmak üzere iki soruşturma prosedürünü başlatmak için gerekli metodolojik desteği sağlamayı amaçlamaktadır. Kültüre bağlı protokol ile ilgili olarak, mikoheterotrofik bitkilerin yeraltı ve hava organlarından filamentli mantarların izole edilmesi, izolatların bir koleksiyonunun tutulması, slayt kültürü metodolojisi ile hiflerin morfolojik olarak karakterize edilmesi ve toplam DNA ekstraksiyonu ile mantarların moleküler olarak tanımlanması ile birlikte, toplama alanlarından laboratuvar tesislerine bitki örneklerinin toplanması ve muhafaza edilmesi süreçleri detaylandırılmıştır. Kültürden bağımsız metodolojileri kapsayan ayrıntılı prosedürler, metagenomik analizler için bitki örneklerinin toplanmasını ve ticari bir kit kullanılarak klorofilli bitki organlarından toplam DNA ekstraksiyonunu içerir. Son olarak, analizler için süreklilik protokolleri (örneğin, polimeraz zincir reaksiyonu [PCR], dizileme) de önerilmektedir ve teknikler burada sunulmaktadır.
Giriş
Endofitik mantarlar, tanım gereği, göze çarpmayan enfeksiyonlarda (yani konakçılarına zarar vermeden) bitki organlarının ve dokularının iç kısımlarında yaşayan mantarlardır1,2. Bu mantarlar, konukçu bitkilerle nötr veya faydalı bir şekilde etkileşime girebilir, patojenlere ve elverişsiz çevre koşullarına karşı direnç sağlayabilir ve bitki için faydalı bileşiklerin (örneğin, büyüme faktörleri ve diğer fitohormonlar) sentezine katkıda bulunabilir1,3. Mikorizal endofitler, bitki ile mikorizal ilişkiler kuran ve besin transferinde yer alan mantarlardır4. Orchidaceae'de, mikorizal endofitlerle etkileşim, türlerin büyük çoğunluğunda tohum çimlenmesi ve ailedeki tüm bitkilerde fide oluşumu için temeldir5. Bu bağlamlarda, mikoheterotrofik orkideler, tüm yaşam döngüleri boyunca bu mantarlar tarafından mineral besinlere ve karbon bileşikleri transferine bağlı olduklarından, mikorizal partnerlerine karşı tam bir bağımlılık durumunu temsil eder6. Bu nedenle, ilişkili mantarların izolasyonu ve tanımlanması, mikoheterotrofik yaşam stratejilerini araştırırken temel bir temeldir. Ayrıca, mikoheterotrofik bitkilerde mantar endofitlerinin rolleri ve hatta bu mantarların gerçek çeşitliliği hakkında çok az şey bilinmektedir 7,8.
Endofitik mantarların araştırılması, geleneksel olarak kültürden bağımsız veya bağımlı olarak tanımlanan farklı tekniklerle gerçekleştirilebilir, örneğin: (a) doğrudan gözlem, (b) mantar izolasyonu ve morfolojik ve/veya moleküler tanımlama ve (c) bitki dokularının toplam DNA ekstraksiyonu ve moleküler tanımlama9. Doğrudan gözlemde (a), endofitik mantarlar, bitki hücrelerinin ve dokularının iç kısmındayken ışık veya elektron mikroskobu9 ile araştırılabilir, çünkü farklı mikroskopi protokolleri Pena-Passos ve ark.10 tarafından detaylandırılmıştır. İzolasyon yöntemleri (b) ile mantar endofitleri kolonilerine, hiflerine ve üreme veya direnç yapısı morfolojisine göre karakterize edilebilir. Ayrıca, izolasyon teknikleri ile , DNA ekstraksiyonu, moleküler tanımlama dizilerinin (barkodlar veya parmak izleri) amplifikasyonu ve dizileme yoluyla izolatların moleküler tanımlamasını yapmak mümkündür11. İkinci teknik (c), bitki dokularının iç kısmındayken (metabarkodlama) DNA ekstraksiyonu başına endofitik mantarların moleküler olarak tanımlanmasını ve ardından kütüphane hazırlığı ve dizilenmesinisağlar 12.
Ayrıca, mantar izolatları, ototrofik veya mikoheterotrofik orkidelerden elde edilen tohumlar kullanılarak simbiyotik çimlenme denemelerinde uygulanabilir. Böyle bir uygulamanın bir örneği, Sisti ve ark.13 tarafından yürütülen ve mikorizal olmayan endofitik mantarlar içeren bazı izolatları ile birlikte mikoheterotrofik bir orkide olan Pogoniopsis schenckii'de çimlenmeyi ve protokorm gelişiminin ilk aşamalarını tanımlayan araştırmadır. Uygulanan simbiyotik çimlenme protokolü detaylandırılmıştır ve Pena-Passos ve ark.10 tarafından bir videoda sunulmuştur. Mantarların farklı bitki organlarıyla birlikte izole edilmesi, bitki-mantar etkileşimlerinin doğası ile ilgili çeşitli araştırma odaklarına izin verir (örneğin, ilişkinin ekolojik veya fizyolojik yönlerini anlamak ve ayrıca mantarlardan bitkiye besin transferine ilişkin araştırmaları anlamak)9.
Bölüm 1'de sunulan metodolojiler, yeraltı organ örneklerinin toplanmasına dayanmaktadır, çünkü bu organlar toplamada en fazla zorluğu ortaya çıkarmaktadır ve mikorizal endofitler onları kolonize ettiği için büyük ilgi görmektedir. Bununla birlikte, dahil edilen her iki protokol de (adım 1.1 ve 1.2) diğer mikoheterotrofik bitki organlarına (örneğin, rizomlar, çiçek sapları ve meyveler) uygulanabilir. Adım 1.1'de açıklanan toplama metodolojisi, morfolojik karakterizasyon (bölüm 4 ve 5) için endofitik mantarların (bölüm 2) izole edilmesi ve/veya izolat tanımlaması için toplam DNA ekstraksiyonu (bölüm 6) için belirlenmiştir. Öte yandan, adım 1.2'de açıklanan toplama metodolojisi, yalnızca metabarkodlama teknikleri için bitki dokularının toplam DNA ekstraksiyonuna atanır (bölüm 7). Bölüm 3'te, filamentli mantarların depolanması ve korunması için, ikisi kısa süreli depolama (3-6 ay) ve diğer ikisi uzun süreli depolama (>1 yıl) için yeterli olmak üzere dört yöntem sunulmaktadır. Morfolojik karakterizasyon (bölüm 4 ve 5), onu güçlendirmek ve mantar makro ve mikromorfolojisi hakkında önemli bilgiler sağlamak için moleküler tanımlama ile ilişkilendirilebilir. Şekil 1 , bundan sonra açıklanan kolektif metodolojileri özetlemektedir.

Şekil 1: Sunulan yöntemlerin şematik özeti. Bitki toplama ve mantar izolasyonu, muhafazası ve kültüre bağlı ve bağımsız metodolojilerle moleküler tanımlama. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
1. Bitki örneği toplama
- Kültüre bağlı yöntemler için örnek toplama
- Yeraltı organlarını dikkatlice kazın; Bunlar, toplanacak bitkinin kökleri, gövdeleri, rizomları veya depolama organları olabilir. Son derece kompakt toprakların yanı sıra, bu örnekleri elle toplayın.
NOT: Mikoheterotrofik bitkilerin kırılgan yapılarına zarar verebileceği ve endofitik olmayan mantarlar tarafından doku kontaminasyonuna neden olabileceği için bu adımda mala veya kepçe gibi aletlerin kullanılması tavsiye edilmez. - Mümkün olduğunca çok sayıda yeraltı organı toplayın. Numuneleri soğutulmuş bir kap içinde kağıt torbalarda saklayın (örneğin, polistiren köpük kutu veya buzlu termal torba). Hava organları da toplanırsa, bunları yeraltı organlarından ayrı olarak taşıyın.
- Yeraltı organlarını dikkatlice kazın; Bunlar, toplanacak bitkinin kökleri, gövdeleri, rizomları veya depolama organları olabilir. Son derece kompakt toprakların yanı sıra, bu örnekleri elle toplayın.
- Kültürden bağımsız yöntemler için örnek toplama
- Adım 1.1.1'deki NOT'ta belirtilen tavsiyeler kapsamında toplanacak bitkinin köklerini dikkatlice kazın.
- Mümkün olduğunca çok sayıda yeraltı organı toplayın. Toplanan numuneleri sıvı nitrojen içindeki kriyotüplerde tutun (arzu edilen seçenek) veya kuru buzla çevrili santrifüj tüpleri kullanın (alternatif seçenek). Toplanmışsa hava organlarını ayrı ayrı koruyun.
2. Bitki organları ile ilişkili endofitik mantarların izolasyonu14
NOT: Bu bölümde kullanılan her malzeme, çözelti ve reaktif steril olmalıdır. Sterilize edilmiş olarak satın alınamayanlar 121 °C'de 20 dakika otoklavlanmalıdır.
- Bitki organlarının yüzeysel dezenfeksiyonu
- Toplanan numuneleri (adım 1.1.2) akan suda yıkayın ve numunelerin sahip olabileceği mümkün olduğunca fazla alt tabaka ve diğer kalıntıları temizleyin.
- Laminer akış başlığının içinde, yıkanmış numuneleri %70 etanole batırılmış halde 1 dakika tutun (bir beher veya cam kavanoz kullanılabilir).
- Numuneleri 3 dakika boyunca% 2 aktif klorlu sodyum hipoklorit içeren başka bir kaba aktarın.
- Numuneleri %70 etanol içeren bir kaba değiştirin ve 1 dakika daldırılmış halde tutun. Daha sonra numuneleri iki kapta damıtılmış su ile sırayla yıkayın.
- Bitki parçalarının kültür ortamına yerleştirilmesi
NOT: Adım 2.2'de ayrıntıları verilen her adım, bir laminer akış başlığı içinde gerçekleştirilmelidir.- Kurulumdan önce, 19,5 g/L patates dekstroz agar kültür ortamı (PDA) + 7 g/L bakteriyolojik agar + 3 mL/L antibiyotik (örn., streptomisin, penisilin, tetrasiklin, ampisilin) içeren Petri kapları (8-10 cm çapında) hazırlayın.
- Kontaminasyon olmadığından emin olmak için Petri kaplarını kullanmadan önce kültür ortamında 36 °C'de 24 saat muhafaza edin. Bakteri veya mantar kolonileri ile kontamine olmuş bulaşıkları atın.
NOT: Organlar mantar büyümesini engelleyebilecek bakteriler tarafından yüksek oranda enfekte olduğundan, ortama antibiyotik eklenmesi bu adımda çok önemlidir. Otoklavlama sırasında antibiyotiklerin ısıtılıp ısıtılamayacağını doğrulayın; bazı antibiyotikler, ortamı yaklaşık 36 °C'ye soğuttuktan sonra (bulaşıklara koymadan önce) eklenmelidir. - Numunelerin yüzeysel olarak dezenfekte edilmesinden hemen sonra ve hala bir laminer akış başlığının içinde, PDA'da, numuneleri yıkamak için kullanılan son kaptan damıtılmış suyun birkaç damlasını aşılayın. Bu adım, numunelerin yüzeysel dezenfeksiyonunun etkinliğini değerlendirmek için önemlidir.
- Boş bir otoklavlanmış tabağa numuneleri yerleştirin ve numuneleri yaklaşık 0,2 cm kalınlığa kadar bölmek için alevli bir neşter ve forseps kullanın.
- Ortamla temas eden yüzeyi büyütmek istenirse, silindirik numuneleri uzunlamasına iki yarım halinde kesit alın. Meyveleri ve diğer daha küresel organları daha iyi ortaya çıkarmak için yapıları iyice doğrayın veya dilimleyin. Tohumlar da önemli mantar kaynakları olabilir, bu nedenle dilimlenmiş meyvenin onları ortama maruz bıraktığından emin olun.
NOT: Mantar endofit izolasyonunda sadece doku hasarı veya olası hastalık veya patojenik enfeksiyon belirtileri olmayan sağlıklı organlar kullanılmalıdır. - Yeraltı organlarının beş parçasını Petri kaplarında PDA + antibiyotik ile dağıtın. Parçaların birbirinden mümkün olduğunca uzakta olduğundan ve bulaşık kenarlarına değmediğinden emin olun. Ortama herhangi bir parça dizmeyin. Kontaminasyon durumunda önlem olarak kurulu her organın kopyalarını hazırlayın.
- Petri kaplarını streç filmle kapatın ve karanlıkta 25-27 °C'de (tercihen bir inkübatörde) 5 gün saklayın.
- İzolasyon frekansı (IF) hesabı11
- 5 günlük organ fragmanı inkübasyonundan sonra, aşağıdaki denklemde gösterildiği gibi, büyüyen mantar kolonilerini sunan inkübe edilmiş fragmanların sayısının, inkübe edilmiş fragmanların toplamına bölünmesine göre IF'yi hesaplayın:
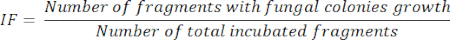
- 5 günlük organ fragmanı inkübasyonundan sonra, aşağıdaki denklemde gösterildiği gibi, büyüyen mantar kolonilerini sunan inkübe edilmiş fragmanların sayısının, inkübe edilmiş fragmanların toplamına bölünmesine göre IF'yi hesaplayın:
- Mantar izolatlarının çizgileme ve alt kültürleme ile saflaştırılması
NOT: Adım 2.4'te ayrıntıları verilen her adım, bir laminer akış başlığı içinde gerçekleştirilmelidir.- 5-7 g/L agar-agar (AA; sadece bakteriyolojik agar) ile Petri kapları (5 cm çapında) hazırlayın. Muhtemelen kontamine olanları ortadan kaldırmak için bulaşıkları 36 °C'de 24 saat muhafaza edin.
- Yetiştirilen her mantar kolonisini bir kodla tanımlayın ve yemeğin alt tarafındaki kenar boşluklarını sınırlayın (kalıcı bir işaretleyici ile yapılabilir). Kolonileri renge, büyüme desenine, dokuya ve kenar boşluğu biçimine göre ayırt edin.
- Otoklavlanmış tahta bir kürdan ile, ince ucu kullanarak, bir mantar kolonisinden az miktarda miselyum geri kazanın. Tercihen koloni sınırlarına konsantre olun ve aynı anda birden fazla koloni türünü geri kazanmaktan kaçınarak başka bir koloniden mümkün olduğunca uzak bir alan seçin.
- Ucunda miselyum bulunan aynı kürdanı kullanarak, AA'yı üç stria (oluk) üretecek şekilde çizin. Her strianın diğerinden ve çanak kenarlarından 1 cm uzakta olduğundan emin olun. Uygun kodu yazın (etiket kağıdı ve kalem kullanarak), bulaşıkları kapatın ve 3 gün boyunca karanlıkta 25-27 °C'de inkübe edin.
- 39 g/L PDA ile Petri kapları (8 cm çapında) hazırlayın. Bu aşamada antibiyotik eklemek gerekli değildir.
- AA kaplarını inkübe ettikten sonra, tek tek kolonileri oluşturan ince hifleri tanımlamayı amaçlayan, ışığa karşı (bir lambadan veya pencereden) titizlikle gözlemleyin. Petri kabının alt tarafında kalıcı bir işaretleyici kullanarak, tabak başına tek bir koloninin alanını sınırlayın.
- Laminer akış başlığında, koloniyi içeren ortamın bir kısmını kesmek için otoklavlanmış bir kürdan kullanın ve kesilen hacmi yeni bir PDA kabının merkezine aktarın.
- Petri kaplarını izolatların kodları ile tanımlayın, bulaşıkları streç film ile kapatın ve 7-14 gün boyunca 25-27 °C'de karanlıkta tutun.
3. Saflaştırılmış mantar izolatlarının korunması
NOT: Bu bölümde kullanılan her malzeme, çözelti ve reaktif steril olmalıdır. Sterilize edilmiş olarak satın alınamayanlar 121 °C'de 20 dakika otoklavlanmalıdır.
- Castellani yöntemi ile veya mineral yağda muhafaza (3-6 ay)11,15
- 0,5 mL damıtılmış su içeren veya 0,5 mL mineral yağ içeren (seçilen yönteme bağlı olarak) 2 mL mikrosantrifüj tüpü hazırlayın. Tüplerin boş olduğundan ve otoklavlanmış su ve yağın laminer akış başlığı içindeki tüplere eklendiğinden emin olun.
- Laminer akışlı bir başlıkta, 7-14 gün boyunca PDA'da (39 g/L) yetiştirilmiş saflaştırılmış izolatlara sahip Petri kaplarını yerleştirin. Otoklavlanmış bir kürdan kullanarak, miselyum kenarlarını içeren ortamın küçük küboidlerini (üst alanda 0,5 cm x 0,5 cm) kesin.
- Damıtılmış su (Castellani'nin yöntemi) veya mineral yağ ile mikrosantrifüj tüplerine dört ila altı küboid yerleştirin. Tüpleri karanlıkta, 25 ° C'de gerektiği kadar uzun süre saklayın ve yöntemin zaman sınırlamalarına uyun.
NOT: Tüplere çok fazla küboid eklemekten ve onları doldurmaktan kaçının, bu da kontaminasyon olasılığını artırabilir. Tüpleri buzdolabında tutmak mümkündür, bu da bazı izolatların daha uzun süre korunmasını sağlayabilir. Currah ve ark.16 , tropikal orkidelerden izole edilen mikorizal mantar izolatlarının kopyalarının hem buzdolabında hem de 25 °C'de saklanmasını önermektedir, çünkü bunlar soğuk hava deposundayken kaybolabilir. - Bir küboidi geri kazanın ve depolanmış bir izolat yetiştirmek için yeni bir PDA kabının ortasına yerleştirin.
- Kabuksuz pirinç tanelerinde dondurularak saklanma (>1 yıl)17
- Kabuksuz pirinç tanelerini akan suda yıkayın ve pirinç kabuğu açılmaya başlayana kadar pişirin. Pişmiş taneleri vidalı kapaklı cam test tüplerine dağıtın ve aralarında 24 saat arayla iki kez otoklavlayın.
- Laminer akışlı bir başlıkta, 7-14 gün boyunca PDA'da (39 g/L) yetiştirilmiş saflaştırılmış izolatlara sahip Petri kaplarını yerleştirin. Otoklavlanmış bir kürdan kullanarak, miselyum kenarlarından beş küçük hif parçasını geri kazanın ve bunları otoklavlanmış pirinç taneleri içeren tüpe aşılayın.
NOT: Tüpün farklı noktalarında ve derinliklerinde hiflerin aşılanması, izolatın kabuksuz pirinç tanelerini daha kısa sürede kolonize etmesini garanti eder. - Tüpleri karanlıkta 25-27 °C'de 14 gün inkübe edin. Tahılları bireyselleştirmek için tüpleri her 3 günde bir vorteksleyerek çalkalayın.
- Pirinç tanelerinde mantar üremesini gözlemledikten sonra, taneleri nemi emmek için filtre kağıdıyla kaplı otoklavlanmış bir Petri kabına, tanelerin kuruması için kağıdın üzerine dağıtın. Karanlıkta 25-27 °C'de 2-3 gün saklayın.
- Altta 1/3 silika jel ve silikanın üstünde 1/3 cam yünü bulunan kriyotüpler hazırlayın. Son olarak, pirinç tanelerinin 1 / 3'ünü yetiştirilmiş mantar miselyumu ile dağıtın. -20 °C'de 24 saat saklayın.
- 24 saat sonra, yöntemin zaman sınırlamalarına uyarak kriyotüpleri -80 °C'de gerektiği kadar saklayın.
- Kriyoprotektan kullanarak vermikülitte kriyoprezervasyon (>1 yıl)18
- Damıtılmış suda% 0.2 maya özü ve% 2 glikozdan oluşan bir sıvı kültür ortamı hazırlayın. PH'ı 5'e ayarlayın ve otoklavlayın.
- 0.2 g vermikülit (ince granülometri kullanın) vidalı kapaklı kriyotüplere dağıtın ve otoklavlayın. Vermikülit içeren kriyotüplere 0.8 mL otoklavlanmış sıvı ortam ekleyin.
- Laminer akışlı bir başlıkta, 7-14 gün boyunca PDA'da (39 g/L) yetiştirilmiş saflaştırılmış izolatlara sahip Petri kaplarını yerleştirin. Otoklavlanmış bir kürdan kullanarak, miselyum kenarlarından üç ila beş hif parçasını geri kazanın ve vermikülit + sıvı kültür ortamı içeren tüp boyunca aşılayın. Kriyotüpleri ilgili izolat koduyla tanımlamayı unutmayın.
NOT: Kriyotüpün farklı noktalarında ve derinliklerinde hiflerin aşılanması, izolatın vermiküliti daha kısa sürede kolonize etmesini garanti eder. - Kriyotüpleri, genellikle yaklaşık 14 gün süren vermikülit tanelerinin çoğunun kolonizasyonu gözlemlenene kadar karanlıkta 25-27 °C'de saklayın.
- Damıtılmış suda %5 gliserol ve %5 trehalozdan oluşan bir kriyoprotektan solüsyon hazırlayın ve otoklavlayın. Kullanmadan önce çözeltiyi soğumaya bırakın.
- Kriyotüplerdeki vermikülit, ilgili mantar izolatı tarafından kolonize edildikten sonra, her tüpe 0.4 mL kriyoprotektan dağıtın ve kriyotüpleri 48 saat boyunca 4 ° C'de buzdolabında tutun. Daha sonra, yöntemin zaman sınırlamalarına uyarak kriyotüpleri gerektiği kadar -80 °C'de tutun.
4. Filamentli mantarların makromorfolojik karakterizasyonu (koloni morfolojisi)
- 7-14 gün boyunca 39 g / L PDA ile her Petri kabında yetiştirilen miselyumun fotoğrafik kaydını tutun. Koloninin her iki tarafını, üst ve alt tarafını (ters) kaydetmeyi unutmayın. Bulaşıklar 6. bölümde kolayca kullanılacaksa veya bakımı yapılmayacaksa, daha iyi fotoğraflar elde etmek için fotoğraflarını çekerken bulaşıkları açın.
- Koloni morfolojisi ile ilgili nicel verilerle ilgileniyorsa, alt kültür izolatları çoğaltır ve koloni çapını kaydetmek ve büyüme oranını hesaplamak için (genellikle mm/s cinsinden) aynı yetiştirme koşullarında ve sabit bir süre boyunca tutar.
NOT: Karşılaştırma için farklı kültür ortamı türleri kullanılarak daha karmaşık nicel sonuçlar elde edilebilir19 ve verileri işlemek için istatistik araçları dikkate alınarak. - Morfolojik özellikleri belirlemek ve büyütme fotoğrafını çekmek için kolonileri stereomikroskop altında da gözlemleyin. Kolonileri, sonuçlar bölümünde ayrıntılı olarak açıklandığı gibi makromorfolojik özelliklerine göre değerlendirin. Makromorfolojiyi kategorize etmeye ve moleküler ve/veya morfolojik tanımlamayla ilişkilendirmeye yardımcı olması için çeşitli bibliyografik kaynaklara başvurun.
5. Filamentli mantarların mikromorfolojik karakterizasyonu (hif morfolojisi)
NOT: Mikromorfolojik teknikler, olası kullanımları ve dezavantajları göz önünde bulundurularak tartışma bölümünde karşılaştırılmıştır.
- Petri kaplarındaki izolatları 7-14 gün boyunca 39 g / L PDA ile büyütün. Varsayılan orkide mikorizal mantarlarını değerlendirmek için, izolatları 17 g / L mısır unu agar (CMA; veya başka bir besin sınırlayıcı ortam) üzerinde 3-7 gün boyunca büyütün19.
- Kızdırma montajı
- Laminer akış başlığı içinde çalışın. Seçilen bir lekeden bir damla (adım 5.5) temiz bir cam slayt üzerine yerleştirin.
- Otoklavlanmış bir kürdan veya başka bir steril malzeme kullanarak, yetiştirilen izolattan bir miktar hifleri dikkatlice çıkarın ve bunları leke damlasına yerleştirin. Bir lamel yerleştirin (hava kabarcıklarını önlemek için tercihen 45°'lik bir başlangıç açısıyla) ve ışık mikroskobu altında analiz edin.
- Yapışkan bant montajı
NOT: Bu teknik genellikle mantar kültürlerinde bölüm 6'da kolayca kullanılacak veya bakımı yapılmayacaktır, çünkü yapışkan bant otoklavlanamaz ve yöntem uygulandıktan sonra kontaminasyonlar meydana gelebilir.- Seçilen bir lekeden bir damla (adım 5.5) temiz bir cam slayt üzerine yerleştirin. Cam slayta ve merkezi leke damlasına tam olarak uyan boyutta şeffaf bir yapışkan bant şeridi kesin.
- Şeridin yapışkan yüzeyini miselyum yüzeyine yönlendirin. Basmayın ve çok fazla yapıştırmadan biraz hif toplamaya çalışın.
- Bandı cam slayta yapıştırın ve lekenin toplanan hiflerle temas halinde olduğundan emin olun. Bandın üzerine bir damla su damlatın ve bir lamel yerleştirin. Slaydı ışık mikroskobu altında analiz edin.
- Filamentli mantarların slayt kültürü20
- Büyük bir Petri kabının içine (tercihen >9 cm çapında) yerleştirin: alt kısımda filtre kağıdı, U şeklinde bir cam çubuk veya bir uyarlama (amaç cam slayt için bir yükseklik sağlamaktır), bir cam slayt ve iki lamel yerleştirin. Daha yüksek Petri kapları manipülasyonu kolaylaştırır. Her izolat için bir tane olmak üzere bu Petri kapları kitlerini otoklavlayın.
- Küçük bir hacimde 39 g / L PDA veya 17 g / L CMA hazırlayın, 10 g / L bakteriyolojik agar ekleyin ve otoklav ekleyin (bir Petri kabının hacmi 30'dan fazla izolat için yeterlidir). Slayt kültüründe kullanılan kültür ortamı, normal ortamdan daha sert olmalıdır. Otoklav 100 mL damıtılmış su.
- Laminer akış başlığı içinde çalışın. Sıvı ortamı yaklaşık 0,5 cm yüksekliğinde bir tabaka oluşturacak şekilde bir Petri kabına yerleştirin. Ortamın katılaşmasına izin verin. Katılaştıktan sonra, ortamın 1 cm x 1 cm boyutlarındaki karelerini kesmek için steril bir neşter kullanın.
- Petri kabı kitini laminer akış başlığının içinde açın ve kabın içinde otoklavlanan malzemeyi düzenlemek için alevli forseps kullanın. Malzemeyi Şekil 2A'da görüldüğü gibi numaralandırılmış sıraya göre düzenleyin ve cam slayt üzerine bir kare kültür ortamı yerleştirin. Lameli ortamın üzerine yerleştirmeden önce adım 5.4.5'e geçin.
- Bir izolattan bir miktar hif geri kazanmak için otoklavlanmış bir kürdan kullanın ve cam slayt üzerine yerleştirilen ortamın dört yan yüzünü dikkatlice ovalayın. Alevli forseps kullanarak orta karenin üzerine otoklavlanmış bir lamel yerleştirin.
- Nemli bir oda oluşturmak için filtre kağıdına otoklavlanmış su yerleştirmek için steril bir pipet ucu kullanın. Kağıdı fazla su koymadan doyurmak için bir hacim kullanın. Petri kabını streç filmle kapatın ve ilgili izolat koduyla tanımlayın. Bulaşıkları karanlıkta 25-27 °C'de 3-7 gün bekletin.
- Cam slaytta ve lamel içindeki hif büyümesini değerlendirin. Her bir slayt kültürü kitinden biri hifli cam lamel ve otoklavlanmış lamel kullanılarak, ikincisi hifli lamel ve başka bir cam lamel kullanılarak iki slayt üretilir.
- Hif büyümesi gözlendikten sonra, ortamın karesini cam slayttan dikkatlice ayırın (Şekil 2B), seçilen bir lekeyi kullanarak iki slaydı monte edin (adım 5.5) ve bir ışık mikroskobu altında analiz edin. Slayttaki ayırma kodunu tanımlamayı unutmayın. Yarı kalıcı slaytlar üretmek için, lamel şeffaf oje ile kapatın.
- Kalıcı slaytlar elde etmek için, boyayı boyayı boyadıktan sonra yapışmış hiflerden dikkatlice yıkayın ve slaytın kurumasını bekleyin. Hızlı bir montaj ortamıyla monte edin (ayrıntılar için Pena-Passos et al.10'u okuyun).
NOT: Bu teknikle kalıcı bir slayt üretmenin dezavantajı, cama yapışmayan sporların ve yapıların yıkanabilmesidir.
- Boyama yöntemleri ve hif gözlemi
- Laktofenol pamuk mavisi (LPCB)21: 20 mL laktik asit, 40 mL gliserol ve 20 mL damıtılmış su ekleyin. Bu çözeltide 20 g fenol kristallerini hafifçe ısıtarak çözün. 0.05 g metil mavisi (pamuk mavisi veya 2 mL% 1 sulu çözelti) çözün. LPCB ayrıca önceden hazırlanmış olarak kolayca satın alınabilir.
DİKKAT: Fenol oldukça toksik ve uçucudur; Sadece bir davlumbaz içinde manipüle edin ve eldiven giyin. - Toluidin mavisi O10 (TBO): 0.1 M fosfat tamponunda (pH 6.8) %0.05 TBO hazırlayın.
- Kongo kırmızısı22,23,24: Damıtılmış suda %1 Kongo kırmızısı çözeltisi hazırlayın ve süzün. 5-10 dakika inkübe edin. Bu boya, floresan mikroskobu25 için de uygulanabilir.
- Mantar hiflerini ışık mikroskobu altında gözlemlerken ve fotoğraflarken, yapıları tanımlamaya yardımcı olması için çeşitli bibliyografik kaynaklara başvurun (tartışmayı kontrol edin).
- Laktofenol pamuk mavisi (LPCB)21: 20 mL laktik asit, 40 mL gliserol ve 20 mL damıtılmış su ekleyin. Bu çözeltide 20 g fenol kristallerini hafifçe ısıtarak çözün. 0.05 g metil mavisi (pamuk mavisi veya 2 mL% 1 sulu çözelti) çözün. LPCB ayrıca önceden hazırlanmış olarak kolayca satın alınabilir.

Şekil 2: Filamentli mantarların slayt kültürü için prosedürler . (A) Sayıların elemanların düzenlenme sırasını gösterdiği bir slayt kültürü kitinin şematik konfigürasyonu. (B) Cam slaytta ve lamel içinde hif büyümesi gözlendikten sonra kültür ortamının karesinin ayrılması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
6. Mantar izolatlarından toplam DNA ekstraksiyonu (modifikasyonlar27 ile ev yapımı protokol 26)
NOT: Bu bölümde kullanılan her malzeme, çözelti ve reaktif steril olmalıdır. Sterilize edilmiş olarak satın alınamayanlar 121 °C'de 20 dakika otoklavlanmalıdır. Tüm protokol boyunca eldiven giyin ve çeker ocak içinde bazı aşamaları gerçekleştirin.
- Ekstraksiyon tamponunu hazırlayın:% 1 sodyum dodesil sülfat (SDS), 250 mM NaCl, 200 mM Tris-HCl (pH 8.0) ve 25 mM etilendiamintetraasetik asit (EDTA). Saflaştırılmış izolatları 7-14 gün boyunca 39 g / L PDA'da büyütün.
- Miselyumu bir spatula veya kaşık kullanarak bir izolattan dikkatlice kazıyın ve parçaları otoklavlanmış bir harca aktarın, kültür ortamının hif agregası ile aktarılmasını önleyin. Porselen bir havaneli kullanarak, miselyumun sıvı nitrojen ile ince bir toz haline getirilmesini sağlayın. Öğütülen miselyumun erimesine izin vermeyin, bunu önlemek için nitrojen ekleyin.
- 2 mL'lik bir mikrosantrifüj tüpüne 1 mL ekstraksiyon tamponu ekleyin ve öğütülmüş numuneyi 1.5 mL işaretine kadar yerleştirin. Homojenize etmek için tüplerin içeriğini hafifçe çalkalayın.
- Tüpleri 5 saniye boyunca bir girdapta çalkalayın ve 20 dakika boyunca 65 ° C'de bir termoblok içine yerleştirin. İçeriği her 7-10 dakikada bir ters çevirerek dikkatlice homojenize edin.
- Tüpleri 10.000 x g'da 4 °C'de 10 dakika santrifüjleyin. Üst fazdan 800 μL'yi yeni bir 2 mL'lik mikrosantrifüj tüpüne aktarın, tüplere 800 μL fenol ekleyin ve içeriği ters çevirerek karıştırın.
DİKKAT: Fenol oldukça toksik ve uçucu bir reaktiftir; Eritem, kangren ve doku nekrozuna neden olabilir. Solunduğunda nefes darlığı ve öksürüğe neden olabilir. Sistemik emilim karaciğere, böbreklere ve merkezi sinir sistemine zarar verebilir. Fenolü yalnızca bir davlumbaz içinde manipüle edin ve eldiven giyin.
NOT: Bir sonraki adımdan itibaren eldiven kullanın ve protokolü çeker ocak içinde gerçekleştirin. - Tüpleri 4 ° C'de 10 dakika boyunca 10.000 x g'da santrifüjleyin ve 800 μL'yi üst fazdan yeni bir 2 mL tüpe aktarın, düşük faz içeriğinin aktarılmasını dikkatlice önleyin.
- Tüplere 400 μL fenol ve 400 μL kloroform ekleyin ve içeriği ters çevirerek karıştırın. 4 °C'de 10 dakika boyunca 10.000 x g'da santrifüjleyin.
DİKKAT: Kloroform oldukça toksik ve uçucu bir reaktiftir; Cilt ile temas ettiğinde tahrişe ve yaralanmalara neden olabilir ve solunması halinde merkezi sinir ve kardiyorespiratuar sistemleri, karaciğeri ve böbrekleri etkiler. Kloroformu yalnızca bir davlumbaz içinde manipüle edin ve eldiven giyin. - Üst fazdan 800 μL veya daha azını yeni bir 2 mL tüpe geri kazanın. 800 μL kloroform ekleyin, içeriği ters çevirerek karıştırın ve 4 °C'de 10 dakika boyunca 10.000 x g'da santrifüjleyin.
NOT: Bu adımda, alt fazdan hiçbir kalıntı yeni tüplere aktarılmamalıdır. Bu nedenle, üstün fazı geri kazanırken ekstra dikkatli olun. - Üst fazdan 600-800 μL'yi yeni bir 1.5 mL'lik tüpe aktarın ve 450 μL izopropanol ekleyin. İçeriği ters çevirerek karıştırın ve 25 °C'de 5 dakika inkübe edin.
- Tüpleri 10.000 x g'da 4 °C'de 5 dakika santrifüjleyin ve süpernatanı bir mikropipet kullanarak atın. Tüpün dibinde biriken peleti atmamaya dikkat edin.
- 500 μL %80 etanol ekleyin ve 5 dakika santrifüjleyin. Peletin netleşmemesi durumunda iki kez tekrarlayın.
- Etanolü bir mikropipet kullanarak çıkarın ve peleti 37 °C'de 30-60 dakika kurutun. 30-50 μL deiyonize su ekleyin, peleti bir mikropipet kullanarak çıkarın.
- Tam DNA elüsyonu için tüpleri gece boyunca 4 °C'de tutun ve içeriği -20 °C'de dondurun.
7. Metabarkodlama metodolojisi için bitki organlarından toplam DNA ekstraksiyonu (ticari kit)
NOT: Aşağıdaki metodoloji için, Malzeme Tablosunda belirtilen ticari kitin toprak DNA ekstraksiyon kiti olarak satın alınması gerekmektedir. Bu bölümde kullanılan her malzeme, çözelti ve reaktif steril olmalıdır. Sterilize edilmiş olarak satın alınamayanlar 121 °C'de 20 dakika otoklavlanmalıdır. Tüm protokol boyunca eldiven giyilmesi şiddetle tavsiye edilir ve adımlar bir laminer akış başlığı içinde gerçekleştirilebilir. Açıklanan protokol, üretici tarafından detaylandırılan protokolden De Souza ve ark.12'den değiştirilmiştir.
- Porselen tokmaklar ve havanlar kullanarak, 1.2. adımdan sonra toplanan kökleri sıvı nitrojen içinde öğütün ve numuneleri ince bir toz haline getirin. Öğütülmüş numunelerden PowerBead tüplerine 0,3 g ekleyin ve homojenize etmek için hafifçe çalkalayın.
- PowerBead tüplerine 60 μL C1 çözeltisi (kitte bulunur) ekleyin ve içeriği ters çevirerek karıştırın. Bir doku homojenizatörü ve hücre parçalayıcı (Malzeme Tablosu) kullanarak, tüpleri yeterli bir desteğe sıkıca bağlayın, desteği girdaba bağlayın ve ekipmanı 10-20 dakika boyunca maksimum hızda çalıştırın.
NOT: C1 çözeltisinin çökelmesi durumunda, tamamen çözünene kadar 60 °C'de ısıtın. - Tüpleri 10.000 x g'da 25 °C'de 30 saniye santrifüjleyin. 500 μL süpernatanı 2 mL mikrosantrifüj tüplerine aktarın. Aktarılan içerik parçacıklı olabilir.
- Tüplere 250 μL C2 çözeltisi ekleyin ve 5 saniye boyunca bir girdapta çalkalayın. 4 °C'de 5 dakika inkübe edin ve ardından 25 °C'de 1-2 dakika boyunca 10.000 x g'da santrifüjleyin.
- 600 μL'den fazla süpernatanı yeni 2 mL'lik tüplere aktarın ve peletten kaçının. 200 μL C3 çözeltisi ekleyin ve 5 saniye boyunca bir girdap üzerinde çalkalayın.
- 4 °C'de 5 dakika inkübe edin ve ardından 25 °C'de 1 dakika boyunca 10.000 x g'da santrifüjleyin. Bu aşamada, süpernatantın partikül olmadığından emin olun.
- 750 μL'den fazla süpernatanı yeni 2 mL'lik tüplere aktarın ve peletten kaçının. C4 çözeltisini iyice homojenize edin, süpernata 1.100 μL çözelti C4 ekleyin ve 5 saniye boyunca bir girdapta çalkalayın.
- MB Spin Kolonlarındaki tüplerin içeriğinden 675 μL'yi filtrenin üzerine yükleyin ve 25 °C'de 1 dakika boyunca 10.000 x g'da santrifüjleyin. Sıvı içeriğini atın.
- Her tüpün tüm içeriği işlenene kadar önceki adımı iki kez tekrarlayın. Ardından, tüpün üst kolonunda bulunan filtrenin ortasına 500 μL C5 çözeltisi ekleyin ve 25 ° C'de 30 saniye boyunca 10.000 x g'de santrifüjleyin.
- Sıvı içeriği atın ve önceki adımla aynı koşullar altında tekrar santrifüjleyin. MB Spin Kolonunun üst kolonunu yeni 2 mL'lik mikrosantrifüj tüplerine dikkatlice aktarın ve kolonda herhangi bir sıvı içeriğinin damlamasını önleyin.
- Filtrenin ortasına 85-100 μL C6 çözeltisi ekleyin ve 1 dakika bekleyin. 25 °C'de 30 saniye boyunca 10.000 x g'da santrifüjleyin ve MB Spin Sütununu atın. Tüpleri -80 °C'de saklayın.
8. Bir spektrofotometrede DNA miktar tayini (Malzeme Tablosuna bakın)
- Belirtilen spektrofotometreyi kullanarak yazılımı açın. Nükleik asit seçeneğini seçin, DNA seçeneğini seçin ve konsantrasyonu ng/μL olarak ayarlayın.
- Spektrofotometre dedektörüne 1 μL deiyonize su ekleyin ve Boş seçeneğini seçerek kalibre edin. Okuduktan sonra, dedektörü yumuşak kağıt mendille hafifçe silin.
- Alan numunesini, okunacak numunenin izolat koduyla adlandırın ve 1 μL'sini ekipman dedektörüne yerleştirin. Ölç seçeneğini seçin; Sonuçları içeren bir grafik ve tablo oluşturulur.
- Tüm örnekler okunana kadar adım 8.3'ü tekrarlayın. Tablonun kayıt ve analiz için oluşturulan sonuçlarla birlikte kaydedilmesi önerilir: Raporlar seçeneğini ve .xml dosyasının kaydedileceği konumu seçin.
- Dedektöre 5 μL deiyonize su ekleyin, birkaç dakika bekleyin ve yumuşak kağıt mendille hafifçe silin.
Sonuçlar
İzolasyon protokolünde, son yıkamada kullanılan sudan kontaminasyon olduğu ve kontaminasyonun aşılanmış fragmanlı Petri kaplarında da tespit edildiği göz önüne alındığında, kirleticinin türüne bağlı olarak farklı önlemler alınabilir (Tablo 1). Bu prosedür, aynı zamanda hızlandırılmış büyüme gösteren yüksek oranda sporlu mantar kontaminantları ve seçilen antibiyotiklere dirençli yoğun çoğalan bakteriler durumunda baştan tekrarlan...
Tartışmalar
Bitki örneklerinin yüzeysel olarak dezenfekte edilmesi, sunulan protokoldeki en kritik aşamalardan biridir. PDA bulaşıklarında son yıkamadan damla damla ile kirlenme olmaması çok arzu edilir. Endofitik bakterilerin bitki dokularında da yaygın olduğu göz önüne alındığında, bakteriler genellikle havadaki sporlu mantarlardan daha fazla olmak üzere, izolasyon kaplarında kirletici olarak sıklıkla gözlenir 3,11. Bu nedenle, organ parçalarını ...
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi ve çıkar çatışması yoktur.
Teşekkürler
FAPESP (2015/26479-6) ve CNPq (447453/2014-9) tarafından sağlanan fonlara teşekkür ederiz. JLSM, üretkenlik hibeleri için CNPq'ya teşekkür eder (303664/2020-7). MPP, Capes'e (yüksek lisans bursu, süreç 88887.600591/2021-00) ve CNPq'ye teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Adhesive tape | (from any company, for adhesive tape mount in micromorphological analyses) | ||
| Ampicillin | Sigma-Aldrich | A5354 | (for installation of plant fragments; other antibiotics may be used - check step 2.2.1) |
| Autoclave | (from any company, for materials sterilization in many steps) | ||
| Bacteriological agar | Sigma-Aldrich | A1296 | (for many steps) |
| C1, C2, C3, C4, C5, and C6 solutions | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Centrifuge | Merck/Eppendorf | 5810 G | (for total DNA extraction from fungal isolates) |
| Centrifuge tubes | Merck | CLS430828 | (for samples collection) |
| Chloroform | Sigma-Aldrich | C2432 | (for total DNA extraction from fungal isolates) |
| Congo red | Supelco | 75768 | (for hyphae staining) |
| Cryotubes | Merck | BR114831 | (for many steps) |
| Ethanol | Supelco | 100983 | It will be necessary to carry out the appropriate dilutions (for many steps) |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 3609 | (for total DNA extraction from fungal isolates) |
| Filter paper | Merck | WHA10010155 | (for many steps) |
| Glass test tubes | Merck | CLS7082516 | (for cryopreservation in unhulled rice grains) |
| Glass wool | Supelco | 20411 | (for cryopreservation in unhulled rice grains) |
| Glucose | Sigma-Aldrich | G8270 | Or dextrose (for cryopreservation in vermiculite) |
| Glycerol | Sigma-Aldrich | G5516 | Or glycerin (for cryopreservation in vermiculite, for preparing LPCB) |
| Isopropanol | Sigma-Aldrich | 563935 | (for total DNA extraction from fungal isolates) |
| Lactic acid | Sigma-Aldrich | 252476 | (for preparing LPCB - hyphae staining) |
| Lactophenol blue solution (LPCB) | Sigma-Aldrich | 61335 | (for hyphae staining) |
| Laminar flow hood | (class I, from any company, for many steps) | ||
| Light microscope | (from any company, for hyphae observation) | ||
| MB Spin Columns | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Methyl blue (cotton blue) | Sigma-Aldrich | M5528 | (for preparing LPCB - hyphae staining) |
| Microcentrifuge tube (1.5 mL) | Merck | HS4323 | (for total DNA extraction from fungal isolates) |
| Microcentrifuge tube (2 mL) | Merck | BR780546 | (for many steps) |
| Mineral oil | (for preservation of fungal isolates) | ||
| Paper bags | Average size 150 mm x 200 mm (for samples collection) | ||
| Petri dish (Glass, 120 mm x 20 mm) | Merck/Pyrex | SLW1480/10D | (autoclavable, for fungi slide culture, prefer higher ones) |
| Petri dish (Glass, 50 mm x 17 mm) | Merck/Aldrich | Z740618 | (for purification of fungal isolates); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Petri dish (Glass, 80 mm x 15 mm) | Merck/Brand | BR455732 | (for installation of plant fragments); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Phenol | Sigma-Aldrich | P1037 | (for total DNA extraction from fungal isolates, for preparing LPCB) |
| Porcelain mortar | Sigma-Aldrich | Z247464 | (for total DNA extraction from fungal isolates) |
| Porcelain pestle | Sigma-Aldrich | Z247502 | (for total DNA extraction from fungal isolates) |
| Potato dextrose agar (PDA) | Millipore | P2182 | (for many steps) |
| PowerBead tubes | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Rapid mounting medium (Entellan) | Sigma-Aldrich | 1.0796 | (for fungi slide culture) |
| Silica gel | Supelco | 717185 | (for cryopreservation in unhulled rice grains) |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | (for total DNA extraction from fungal isolates) |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | Lauryl sulfate sodium salt (for total DNA extraction from fungal isolates) |
| Sodium hypochlorite (w/ 2% active chlorine) | (commercial product, for superficial desinfestation) | ||
| Soil DNA extraction kit (DNeasy PowerSoil kit) | Qiagen | 12888-50 | (for total DNA extraction from plant organs) |
| Spectrophotometer - Nanodrop 2000/2000c | ThermoFisher Scientific | ND2000CLAPTOP | (for total DNA extraction from plant organs) |
| Stereomicroscope | (=dissecting microscope, from any company, for macromorphological analyses) | ||
| Tetracycline | Sigma-Aldrich | T7660 | (for installation of plant fragments) |
| Thermoblock | Merck/Eppendorf | EP5362000035 | (or from other companies) |
| Tissue homogenizer and cell lyzer | SPEX SamplePrep | 2010 Geno/Grinder - Automated Tissue Homogenizer and Cell Lyzer (for total DNA extraction from plant organs) | |
| Toluidine blue O | Sigma-Aldrich/Harleco | 364-M | (for hyphae staining) |
| Trehalose | Sigma-Aldrich | T9531 | (for cryopreservation in vermiculite) |
| Tris Base Solution (Tris) | Sigma-Aldrich | T1699 | (for total DNA extraction from fungal isolates) |
| Unhulled rice grains | (for cryopreservation) | ||
| U-shaped glass rod | (or an adaptation - check step 5.4.1, for fungi slide culture) | ||
| Vermiculite | Fine granulometry (for cryopreservation in vermiculite) | ||
| Vortexer | Sigma-Aldrich/BenchMixer | BMSBV1000 | (for total DNA extraction from fungal isolates) |
| Yeast extract | Sigma-Aldrich | Y1625 | (for cryopreservation in vermiculite) |
Referanslar
- de Azevedo, J. L. Endophytic microorganisms. Ecologia Microbiana. , 117-137 (1998).
- Stone, J. K., Bacon, C. W., White, J. F. An overview of endophytic microbes: endophytism defined. Microbial Endophytes. , 17-44 (2000).
- Schulz, B., Boyle, C. What are Endophytes. Microbial Root Endophytes. , 1-13 (2006).
- Smith, S. E., Read, D. J. . Mycorrhizal Symbiosis. , (2008).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Ma, X., Kang, J., Nontachaiyapoom, S., Wen, T., Hyde, K. D. Non-mycorrhizal endophytic fungi from orchids. Current Science. 109 (1), 72-87 (2015).
- Favre-Godal, Q., Gourguillon, L., Lordel-Madeleine, S., Gindro, K., Choisy, P. Orchids and their mycorrhizal fungi: an insufficiently explored relationship. Mycorrhiza. 30 (1), 5-22 (2020).
- Sun, X., Guo, L. -. D. Endophytic fungal diversity: review of traditional and molecular techniques. Mycology. 3 (1), 65-76 (2012).
- Pena-Passos, M., Sisti, L. S., Mayer, J. L. S. Microscopy techniques for interpreting fungal colonization in mycoheterotrophic plants tissues and symbiotic germination of seeds. Journal of Visualized Experiments. (183), e63777 (2022).
- Araújo, W. L., et al. . Endophytic microorganisms: Theoretical and Practical Aspects of Isolation and Characterization. 1st ed. 1, 257 (2014).
- de Souza, R. S. C., et al. Unlocking the bacterial and fungal communities assemblages of sugarcane microbiome. Scientific Reports. 6, 28774 (2016).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Araújo, W. L., et al. Variability and interactions between endophytic bacteria and fungi isolated from leaf tissues of citrus rootstocks. Canadian Journal of Microbiology. 47 (3), 229-236 (2001).
- Castellani, A. Further researches on the long viability and growth of many pathogenic fungi and some bacteria in sterile distilled water. Mycopathologia. 20 (1-2), 1-6 (1963).
- Currah, R. S., Zelmer, C. D., Hambleton, S., Richardson, K. A. Fungi from orchid mycorrhizas. Orchid Biology: Reviews and Perspectives, VII. , 117-170 (1997).
- Freitas, E. F. S., et al. Diversity of mycorrhizal Tulasnella associated with epiphytic and rupicolous orchids from the Brazilian Atlantic Forest, including four new species. Scientific Reports. 10 (1), 7069 (2020).
- Sato, M., Inaba, S., Noguchi, M., Nakagiri, A. Vermiculite as a culture substrate greatly improves the viability of frozen cultures of ectomycorrhizal basidiomycetes. Fungal Biology. 124 (8), 742-751 (2020).
- Pereira, O. L., Kasuya, M. C. M., Borges, A. C., Araújo, E. F. D. Morphological and molecular characterization of mycorrhizal fungi isolated from neotropical orchids in Brazil. Canadian Journal of Botany. 83 (1), 54-65 (2005).
- Riddell, R. W. Permanent stained mycological preparations obtained by slide culture. Mycologia. 42 (2), 265-270 (1950).
- Walsh, T. J., Hayden, R. T., Larone, D. H. . Larone's Medically Important Fungi: A Guide to Identification. , (2018).
- Microscopy: Chemical Reagents. British Mycological Society Available from: https://www.britmycolsoc.org.uk/field_mycology/microscopy/reagents (2022)
- Senanayake, I. C., et al. Morphological approaches in studying fungi: Collection, examination, isolation, sporulation and preservation. Mycosphere. 11 (1), 2678-2754 (2020).
- Slifkin, M., Cumbie, R. Congo red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Raeder, U., Broda, P. Rapid preparation of DNA from filamentous fungi. Letters in Applied Microbiology. 1 (1), 17-20 (1985).
- Martins, M. K., et al. Molecular characterization of endophytic microorganisms. Endophytic microorganisms: theoretical and practical aspects of isolation and characterization. 1st edition. , 189-211 (2014).
- Rayner, R. W. A Mycological Colour Chart. Commonwealth Mycological Institute. , (1970).
- Kornerup, A., Wanscher, J. H. . Methuen Handbook of Colour. Methuen handbook of colour. , (1967).
- Ridgway, R. . Color Standards and Color Nomenclature. , (1912).
- McGinnis, M. R. . Laboratory Handbook of Medical Mycology. , (2012).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sridharan, G., Shankar, A. A. Toluidine blue: A review of its chemistry and clinical utility. Journal of Oral and Maxillofacial Pathology. 16 (2), 251-255 (2012).
- Smith, D., Onions, A. H. S. A comparison of some preservation techniques for fungi. Transactions of the British Mycological Society. 81 (3), 535-540 (1983).
- Ryan, M. J., Smith, D., Jeffries, P. A decision-based key to determine the most appropriate protocol for the preservation of fungi. World Journal of Microbiology and Biotechnology. 16 (2), 183-186 (2000).
- Lalaymia, I., Cranenbrouck, S., Declerck, S. Maintenance and preservation of ectomycorrhizal and arbuscular mycorrhizal fungi. Mycorrhiza. 24 (5), 323-337 (2014).
- Zettler, L. W., Corey, L. L. Orchid mycorrhizal fungi: isolation and identification techniques. Orchid Propagation: From Laboratories to Greenhouses-Methods and Protocols. , 27-59 (2018).
- Yu, S., Wang, Y., Li, X., Yu, F., Li, W. The factors affecting the reproducibility of micro-volume DNA mass quantification in Nanodrop 2000 spectrophotometer. Optik. 145, 555-560 (2017).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Schoch, C. L., et al. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi. Proceedings of the National Academy of Sciences. 109 (16), 6241-6246 (2012).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols: A Guide to Methods and Applications. 18 (1), 315-322 (1990).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proceedings of the National Academy of Sciences. 74 (12), 5463-5467 (1977).
- Ranjard, L., et al. Characterization of bacterial and fungal soil communities by automated ribosomal intergenic spacer analysis fingerprints: biological and methodological variability. Applied and Environmental Microbiology. 67 (10), 4479-4487 (2001).
- Metzker, M. L. Sequencing technologies-the next generation. Nature Reviews Genetics. 11 (1), 31-46 (2010).
Erratum
Formal Correction: Erratum: Isolation, Characterization, and Total DNA Extraction to Identify Endophytic Fungi in Mycoheterotrophic Plants
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for: Isolation, Characterization, and Total DNA Extraction to Identify Endophytic Fungi in Mycoheterotrophic Plants. The Authors section was updated from:
Juliana Lishcka Sampaio Mayer
to:
Juliana Lischka Sampaio Mayer
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır