Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение, характеристика и выделение общей ДНК для идентификации эндофитных грибов в микогетеротрофных растениях
В этой статье
Erratum Notice
Резюме
Целью настоящей статьи является предоставление подробных и адекватных протоколов выделения растительно-ассоциированных эндофитных грибов, долговременной консервации изолятов, морфологической характеристики и экстракции общей ДНК для последующей молекулярной идентификации и метагеномного анализа.
Аннотация
Микогетеротрофные растения представляют собой одну из самых крайних форм микоризной зависимости, полностью утратив свою автотрофную способность. Так же важны, как и любой другой жизненно важный ресурс, грибы, с которыми эти растения тесно связаны, необходимы для них. Таким образом, некоторые из наиболее актуальных методов в изучении микогетеротрофных видов позволяют исследовать ассоциированные грибы, особенно те, которые обитают в корнях и подземных органах. В этом контексте обычно применяются методы идентификации культурально-зависимых и культурально-независимых эндофитных грибов. Изоляция эндофитов грибов обеспечивает средства для их морфологической идентификации, анализа их разнообразия и сохранения инокулатуры для применения в симбиотическом проращивании семян орхидей. Однако известно, что существует большое разнообразие некультивируемых грибов, населяющих ткани растений. Таким образом, методы молекулярной идентификации, не зависящие от культуры, обеспечивают более широкий охват видового разнообразия и численности. Целью данной статьи является методологическое сопровождение, необходимое для запуска двух процедур исследования: культурно-зависимой и независимой. Что касается культурально-зависимого протокола, то подробно описаны процессы сбора и хранения образцов растений от мест сбора до лабораторных помещений, а также выделение нитчатых грибов из подземных и надземных органов микогетеротрофных растений, ведение коллекции изолятов, морфологически охарактеризовать гифы методом культивирования на предметных стеклах и молекулярная идентификация грибов методом тотальной экстракции ДНК. Детальные процедуры, включающие в себя независимые от культуры методики, включают сбор образцов растений для метагеномного анализа и извлечение общей ДНК из органов ахлорофилловых растений с использованием коммерческого набора. Наконец, протоколы непрерывности (например, полимеразная цепная реакция [ПЦР], секвенирование) также предлагаются для анализа, и здесь представлены методы.
Введение
Эндофитные грибы – это, по определению, те, которые обитают внутри органов и тканей растений при незаметных инфекциях (т.е. не причиняя вреда своему хозяину)1,2. Эти грибы могут нейтрально или благотворно взаимодействовать с растениями-хозяевами, могут обеспечивать устойчивость к патогенам и неблагоприятным условиям окружающей среды, а также могут способствовать синтезу полезных для растения соединений (например, факторов роста и других фитогормонов)1,3. Микоризные эндофиты – это грибы, которые устанавливают микоризные ассоциации с растением, принимая участие в переносе питательных веществ4. У Orchidaceae взаимодействие с микоризными эндофитами имеет основополагающее значение для прорастания семян у подавляющего большинства видов и укоренения проростков у всех растений семейства5. В таких условиях микогетеротрофные орхидеи представляют собой случай полной зависимости от своих микоризных партнеров, поскольку они зависят от переноса минеральных питательных веществ и углеродных соединений этими грибами в течение всего своегожизненного цикла. Поэтому выделение и идентификация ассоциативных грибов является фундаментальной базой при исследовании микогетеротрофных жизненных стратегий. Более того, мало что известно о роли грибных эндофитов в микогетеротрофных растениях или даже о реальном разнообразии этих грибов 7,8.
Исследование эндофитных грибов может проводиться с помощью различных методов, традиционно описываемых как независимые от культуры или зависимые, например: (а) прямое наблюдение, (б) выделение грибов и морфологическая и/или молекулярная идентификация, и (в) полная экстракция ДНК растительных тканей и молекулярная идентификация9. При непосредственном наблюдении (а) эндофитные грибы могут быть исследованы еще в недрах растительных клеток и тканей с помощью световой или электронной микроскопии9, поскольку различные протоколы микроскопии подробно описаны Pena-Passos et al.10. С помощью методов выделения (b) эндофиты грибов могут быть охарактеризованы в соответствии с их колониями, гифами и морфологией репродуктивной структуры или структуры резистентности. Кроме того, с помощью методов выделения можно проводить молекулярную идентификацию изолятов путем экстракции ДНК, амплификации молекулярных идентификационных последовательностей (штрих-кодов или отпечатков пальцев) и секвенирования11. Последний метод (c) позволяет проводить молекулярную идентификацию эндофитных грибов с помощью экстракции ДНК во внутренней части растительных тканей (метабаркодирование) с последующей подготовкой библиотеки и секвенированием12.
Кроме того, грибные изоляты могут быть применены в симбиотических испытаниях проращивания с использованием семян автотрофных или микогетеротрофных орхидей. Примером такого применения является исследование, проведенное Sisti et al.13, описывающее прорастание и начальные стадии развития протокорма у микогетеротрофной орхидеи Pogoniopsis schenckii в ассоциации с некоторыми из ее изолятов, включающих немикоризные эндофитные грибы. Применяемый протокол проращивания симбиоза подробно описан и представлен в видео Pena-Passos et al.10. Выделение грибов в ассоциации с различными органами растений позволяет по-разному исследовать природу взаимодействия растений и грибов (например, понять экологические или физиологические аспекты ассоциации, а также исследовать перенос питательных веществ от грибов к растению)9.
Методики, представленные в разделе 1, основаны на сборе образцов подземных органов, поскольку эти органы представляют наибольшие трудности при сборе и представляют большой интерес, поскольку их колонизируют микоризные эндофиты. Тем не менее, оба включенных протокола (шаги 1.1 и 1.2) могут быть применены к другим микогетеротрофным органам растений (например, корневищам, цветочным стеблям и плодам). Методика сбора, описанная на шаге 1.1, предназначена для выделения эндофитных грибов (раздел 2) для морфологической характеристики (разделы 4 и 5) и/или выделения общей ДНК для идентификации изолятов (раздел 6). С другой стороны, методология сбора, описанная в шаге 1.2, предназначена исключительно для тотальной экстракции ДНК растительных тканей для методов метабаркодирования (раздел 7). В разделе 3 представлены четыре способа хранения и консервации нитчатых грибов: два для кратковременного хранения (3-6 месяцев) и два других для длительного хранения (>1 год). Морфологическая характеристика (разделы 4 и 5) может быть связана с молекулярной идентификацией для ее усиления и получения важной информации о макро- и микроморфологии грибов. На рисунке 1 обобщены коллективные методологии, описанные ниже.

Рисунок 1: Схематическое обобщение представленных методов. Сбор растений и выделение, консервация и молекулярная идентификация растений с помощью культурно-зависимых и независимых методологий. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
протокол
1. Отбор проб растений
- Отбор проб для методов, зависящих от языка и региональных параметров
- Осторожно выкопайте подземные органы; Это могут быть корни, стебли, корневища или органы хранения растения, подлежащего сбору. Помимо очень плотных почв, эти пробы собирают вручную.
ПРИМЕЧАНИЕ: Использование таких инструментов, как мастерки или совки, на этом этапе не рекомендуется, так как это может повредить хрупкие структуры микогетеротрофных растений и вызвать загрязнение тканей неэндофитными грибами. - Соберите как можно больше подземных органов. Храните образцы в бумажных пакетах внутри охлаждаемого контейнера (например, коробки из пенополистирола или термосумки со льдом). Если собираются и воздушные органы, транспортируйте их отдельно от подземных.
- Осторожно выкопайте подземные органы; Это могут быть корни, стебли, корневища или органы хранения растения, подлежащего сбору. Помимо очень плотных почв, эти пробы собирают вручную.
- Отбор образцов для методов, не зависящих от языка и региональных параметров
- Осторожно выкопайте корни растения, подлежащего сбору, в соответствии с теми же рекомендациями, указанными в ПРИМЕЧАНИИ к шагу 1.1.1.
- Соберите как можно больше подземных органов. Храните собранные образцы в криопробирках внутри жидкого азота (предпочтительный вариант) или используйте центрифужные пробирки, окруженные сухим льдом (альтернативный вариант). Поддерживайте воздушные органы отдельно, если они собраны.
2. Выделение эндофитных грибов, ассоциированных с органами растений14
ПРИМЕЧАНИЕ: Каждый материал, раствор и реагент, используемые в этом разделе, должны быть стерильными. Те, которые не могут быть куплены уже стерилизованными, должны быть автоклавированы при 121 °C в течение 20 минут.
- Поверхностное дезинсекция органов растений
- Промойте собранные образцы (шаг 1.1.2) в проточной воде и удалите как можно больше субстрата и другого мусора, который может быть в образцах.
- Внутри ламинарного колпака выдержите промытые образцы, погруженные в 70% этанол в течение 1 минуты (можно использовать стакан или стеклянную банку).
- Переложите образцы в другую емкость с гипохлоритом натрия с 2% активным хлором на 3 мин.
- Переложите образцы в контейнер с 70% этанолом и держите погруженным в воду в течение 1 минуты. После этого образцы последовательно промывают в двух емкостях с дистиллированной водой.
- Установка фрагментов растений в питательную среду
ПРИМЕЧАНИЕ: Каждый шаг, описанный в шаге 2.2, должен выполняться внутри ламинарного колпака.- Перед установкой подготовьте чашки Петри (8-10 см в диаметре) с питательной средой картофельного декстрозы (КПК) 19,5 г/л + 7 г/л бактериологического агара + 3 мл/л антибиотиков (например, стрептомицина, пенициллина, тетрациклина, ампициллина).
- Перед использованием выдержите чашки Петри с питательной средой при температуре 36 °C в течение 24 ч, чтобы убедиться в отсутствии загрязнения. Выбросьте посуду, зараженную колониями бактерий или грибков.
ПРИМЕЧАНИЕ: Добавление антибиотиков в среду имеет важное значение на этом этапе, так как органы сильно инфицированы бактериями, которые могут подавлять рост грибков. Проверьте, можно ли нагревать антибиотики во время автоклавирования; некоторые антибиотики необходимо добавлять после охлаждения среды примерно до 36 °C (перед тем, как поместить ее в посуду). - Сразу после поверхностной дезинсекции образцов и все еще внутри ламинарного колпака, в КПК, засейте несколько капель дистиллированной воды из последней емкости, используемой для промывки образцов. Этот этап важен для оценки эффективности поверхностной дезинсекции образцов.
- Поместите образцы в пустую автоклавную посуду и с помощью опламененного скальпеля и щипцов разрежьте образцы до толщины около 0,2 см.
- Разрез цилиндрических образцов продольно на две половины, при желании усиливают поверхность, контактирующую со средой. Чтобы лучше обнажить плоды и другие более шаровидные органы, тщательно измельчите или нарежьте структуры. Семена также могут быть важными источниками грибков, поэтому убедитесь, что разрезанные плоды подвергают их воздействию среды.
ПРИМЕЧАНИЕ: Только здоровые органы, без повреждений тканей или сигналов о возможных заболеваниях или патогенных инфекциях, должны использоваться для выделения эндофитов грибов. - Распределите пять фрагментов подземных органов в чашках Петри с КПК + антибиотик. Убедитесь, что фрагменты находятся как можно дальше друг от друга, а также не касаются краев блюда. Не массивируйте какие-либо фрагменты на носителе. Подготовьте копии каждого установленного органа в качестве меры предосторожности на случай загрязнения.
- Запечатайте чашки Петри пищевой пленкой и храните их в темноте при температуре 25-27 °C (лучше в инкубаторе) в течение 5 дней.
- Исчисление частоты изоляции (ПЧ)11
- Через 5 дней инкубации фрагментов органов рассчитайте IF, в соответствии с количеством инкубационных фрагментов, в которых растут колонии грибов, разделенным на общее количество инкубированных фрагментов, как представлено в следующем уравнении:
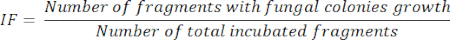
- Через 5 дней инкубации фрагментов органов рассчитайте IF, в соответствии с количеством инкубационных фрагментов, в которых растут колонии грибов, разделенным на общее количество инкубированных фрагментов, как представлено в следующем уравнении:
- Очистка грибковых изолятов путем бороздчатости и субкультивирования
ПРИМЕЧАНИЕ: Каждый шаг, описанный в шаге 2.4, должен выполняться внутри ламинарного колпака.- Приготовьте чашки Петри (5 см в диаметре) с 5-7 г/л агар-агара (АА; только бактериологический агар). Выдерживайте посуду в течение 24 часов при температуре 36 °C, чтобы исключить возможные загрязнения.
- Определите каждую выращенную грибковую колонию кодом и разграничите ее края на нижней стороне чашки (можно сделать перманентным маркером). Дифференциация колоний по цвету, характеру роста, текстуре и формату полей.
- С помощью автоклавной деревянной зубочистки, используя тонкий наконечник, восстановите небольшое количество мицелия из колонии грибов. Желательно сконцентрироваться на границах колонии и выбрать область как можно дальше от другой колонии, избегая одновременного восстановления более чем одного типа колонии.
- Используя ту же зубочистку с мицелием на кончике, расчешите АА, образуя три стрии (бороздки). Следите за тем, чтобы каждая полоска находилась на расстоянии 1 см от другой и краев посуды. Напишите соответствующий код (используя бумагу для стикеров и карандаш), запечатайте посуду и выдержите ее в инкубации в темноте при температуре 25-27 °C в течение 3 дней.
- Приготовьте чашки Петри (диаметром 8 см) с 39 г/л КПК. Добавлять антибиотики на этом этапе не нужно.
- После инкубации чашек с АА внимательно наблюдайте за ними на фоне света (от лампы или окна), стремясь выявить тонкие гифы, образующие отдельные колонии. Разграничьте площадь отдельной колонии в чашке, используя перманентный маркер на нижней стороне чашки Петри.
- В ламинарном вытяжном шкафу используйте автоклавную зубочистку, чтобы отрезать часть среды, содержащей колонию, и переместить срезанный объем в центр новой чашки с КПК.
- Определите чашки Петри с кодами изолятов, запечатайте чашки пищевой пленкой и выдержите в темноте при температуре 25-27 °C в течение 7-14 дней.
3. Консервация очищенных грибковых изолятов
ПРИМЕЧАНИЕ: Каждый материал, раствор и реагент, используемые в этом разделе, должны быть стерильными. Те, которые не могут быть куплены уже стерилизованными, должны быть автоклавированы при 121 °C в течение 20 минут.
- Консервирование по методу Кастеллани или в минеральном масле (3-6 месяцев)11,15
- Приготовьте пробирки для микроцентрифуг объемом 2 мл с 0,5 мл дистиллированной воды или содержащие 0,5 мл минерального масла (в зависимости от выбранного метода). Убедитесь, что пробирки автоклавированы пустыми, а автоклавная вода и масло добавляются в трубки внутри ламинарного колпака.
- В ламинарный колпак поместите чашки Петри с очищенными изолятами, уже выращенными в КПК (39 г/л) на 7-14 дней. Используя автоклавную зубочистку, вырежьте небольшие кубоиды (0,5 см х 0,5 см в верхней области) из среды, содержащей края мицелия.
- Поместите от четырех до шести кубоидов в пробирки микроцентрифуги с дистиллированной водой (метод Кастеллани) или минеральным маслом. Храните пробирки в темноте при температуре 25 °C столько, сколько необходимо, соблюдая временные ограничения метода.
ПРИМЕЧАНИЕ: Не добавляйте слишком много кубоидов в пробирки и не делайте их заполненными, так как это может увеличить вероятность загрязнения. Пробирки можно хранить в холодильнике, что может способствовать более длительному хранению некоторых изолятов. Currah et al.16 рекомендуют хранить реплики изолятов микоризных грибов из тропических орхидей как в холодильнике, так и при температуре 25 °C, так как они могут быть потеряны при хранении в холодильнике. - Восстановите кубоид и поместите его в центр новой чашки с КПК, чтобы вырастить хранимый изолят.
- Криоконсервация в неочищенных рисовых зернах (>1 год)17
- Неочищенные рисовые зерна промыть в проточной воде и варить до тех пор, пока рисовая шелуха не начнет открываться. Приготовленные зерна распределить по стеклянным пробиркам с завинчивающейся крышкой и автоклавировать дважды с интервалом 24 ч между ними.
- В ламинарный колпак поместите чашки Петри с очищенными изолятами, уже выращенными в КПК (39 г/л) на 7-14 дней. Используя автоклавную зубочистку, восстановите пять небольших фрагментов гиф с краев мицелия и поместите их в пробирку, содержащую автоклавные зерна риса.
ПРИМЕЧАНИЕ: Посев гиф в разных точках и на разной глубине трубки гарантирует, что изолят колонизирует неочищенные рисовые зерна за меньшее время. - Инкубируют пробирки в темноте при температуре 25-27 °C в течение 14 дней. Перемешивайте трубки, вихревая их каждые 3 дня, чтобы зерна оставались индивидуальными.
- Наблюдая за ростом грибков в рисовых зернах, распределите зерна в автоклавной чашке Петри, выстланной фильтровальной бумагой для впитывания влаги, поверх бумаги, чтобы зерна могли высохнуть. Хранить в темноте при температуре 25-27 °C в течение 2-3 дней.
- Подготовьте криопробирки с 1/3 силикагеля внизу и 1/3 стекловаты над кремнеземом. Наконец, распределите 1/3 рисовых зерен с выращенным грибным мицелием. Хранить при температуре -20 °C в течение 24 часов.
- Через 24 ч храните криопробирки при температуре -80 °C столько, сколько необходимо, соблюдая временные ограничения метода.
- Криоконсервация в вермикулите с использованием криопротектора (>1 год)18
- Готовят жидкую питательную среду, состоящую из 0,2% дрожжевого экстракта и 2% глюкозы в дистиллированной воде. Отрегулируйте pH до 5 и автоклавируйте его.
- Распределите 0,2 г вермикулита (используйте мелкую гранулометрию) в криопробирки с завинчивающейся крышкой и автоклавируйте их. В криопробирки, содержащие вермикулит, добавить 0,8 мл автоклавной жидкой среды.
- В ламинарный колпак поместите чашки Петри с очищенными изолятами, уже выращенными в КПК (39 г/л) на 7-14 дней. Используя автоклавную зубочистку, рекуперируют от трех до пяти фрагментов гиф с краев мицелия и высевают по пробирке, содержащую вермикулит + жидкая питательная среда. Не забудьте идентифицировать криопробирки с соответствующим кодом изолята.
ПРИМЕЧАНИЕ: Инокуляция гиф в разных точках и глубинах криопробирки гарантирует, что изолят колонизирует вермикулит за меньшее время. - Храните криопробирки в темноте при температуре 25-27 °C до тех пор, пока не будет наблюдаться колонизация большей части зерен вермикулита, что обычно занимает около 14 дней.
- Приготовьте раствор криопротектора, состоящий из 5% глицерина и 5% трегалозы, в дистиллированной воде и автоклавируйте его. Дайте раствору остыть перед использованием.
- После того, как вермикулит в криопробирках будет колонизирован соответствующим грибковым изолятом, распределите 0,4 мл криопротектора в каждой пробирке и храните криопробирки в холодильнике при температуре 4 °C в течение 48 часов. После этого поддерживайте криопробирки при температуре -80 °C столько, сколько необходимо, соблюдая временные ограничения метода.
4. Макроморфологическая характеристика нитчатых грибов (морфология колоний)
- Вести фотографический регистр мицелия, выращенного в каждой чашке Петри, с 39 г/л КПК в течение 7-14 дней. Не забудьте зарегистрировать обе стороны колонии, верхнюю и нижнюю (обратную). Если посуда будет легко использоваться в разделе 6 или за ней не ухаживать, откройте посуду при ее фотографировании, чтобы получить более качественные фотографии.
- Если вас интересуют количественные данные о морфологии колоний, субкультура реплицирует изоляты и поддерживает их в тех же условиях произрастания и в течение постоянного периода времени, чтобы зарегистрировать диаметр колонии и рассчитать скорость роста (обычно в мм/ч).
ПРИМЕЧАНИЕ: Более сложные количественные результаты могут быть достигнуты путем использования различных типов питательных сред для сравнения19 и рассмотрения статистических инструментов для обработки данных. - Понаблюдайте за колониями под стереомикроскопом, чтобы определить морфологические характеристики и сфотографировать в увеличении. Оцените колонии в соответствии с их макроморфологическими характеристиками, как подробно описано в разделе результатов. Обратитесь к различным библиографическим источникам, чтобы помочь классифицировать и связать макроморфологию с молекулярной и/или морфологической идентификацией.
5. Микроморфологическая характеристика нитчатых грибов (гифальная морфология)
ПРИМЕЧАНИЕ: Микроморфологические методы сравниваются в разделе обсуждения, учитывая их возможное использование и недостатки.
- Выращивайте изоляты на чашках Петри с 39 г/л КПК в течение 7-14 дней. Для оценки предполагаемых микоризных грибов орхидей выращивают изоляты на агаре кукурузной муки 17 г/л (КМА; или другой питательно-лимитирующей среде) в течение 3-7 дней19.
- Дразнящее крепление
- Работа внутри ламинарного колпака. Капните каплю выбранного пятна (шаг 5.5) на чистое предметное стекло.
- Используя автоклавную зубочистку или другой стерильный материал, аккуратно удалите несколько гиф из выращенного изолята и поместите их в каплю пятна. Поместите покровное стекло (желательно под начальным углом 45°, чтобы избежать пузырьков воздуха) и проанализируйте под световым микроскопом.
- Крепление на клейкую ленту
ПРИМЕЧАНИЕ: Этот метод обычно применяется в грибных культурах, которые легко используются в разделе 6 или не поддерживаются, так как клейкая лента не может быть автоклавирована, и после выполнения метода может произойти загрязнение.- Капните каплю выбранного пятна (шаг 5.5) на чистое предметное стекло. Отрежьте полоску прозрачной клейкой ленты по размеру, который подходит к предметному стеклу и центральному пятну хорошо капли.
- Направьте липкую поверхность полоски на поверхность мицелия. Не давите и постарайтесь собрать несколько гиф, не приклеивая их слишком много.
- Приклейте ленту к предметному стеклу, убедившись, что пятно находится в контакте с собранными гифами. Поместите каплю воды над лентой и положите покровный листок. Проанализируйте предметное стекло под световым микроскопом.
- Слайд-культура нитчатых грибов20
- Внутри большой чашки Петри (предпочтительно >9 см в диаметре) поместите: фильтровальную бумагу в нижней части, U-образный стеклянный стержень или приспособление (цель состоит в том, чтобы обеспечить возвышение предметного стекла), одно предметное стекло и два покровных стекла. Более высокие чашки Петри облегчают манипуляции. Автоклавируйте эти наборы чашек Петри, по одному на каждый изолят.
- Готовят небольшой объем 39 г/л КПК или 17 г/л КМА, добавляют 10 г/л бактериологического агара и автоклавируют (объема для одной чашки Петри хватает более чем на 30 изолятов). Питательная среда, используемая в культуре слайдов, должна быть более твердой, чем обычная среда. Автоклав 100 мл дистиллированной воды.
- Работа внутри ламинарного колпака. Поместите жидкую среду в чашку Петри, образуя слой высотой около 0,5 см. Дайте среде застыть. После затвердевания стерильным скальпелем вырежьте квадраты среды размером 1 см x 1 см.
- Откройте набор чашки Петри внутри колпака с ламинарным потоком и используйте пламенные щипцы, чтобы упорядочить материал, автоклавный внутри чашки. Расположите материал в пронумерованном порядке, как показано на рисунке 2A, поместив квадрат питательной среды на предметное стекло. Перед тем, как поместить покровный лист на носитель, перейдите к шагу 5.4.5.
- Используйте автоклавную зубочистку, чтобы извлечь гифы из изолята, и осторожно потрите четыре боковые грани среды, помещенной на предметное стекло. Поместите автоклавный покровный листок на средний квадрат с помощью пламенных щипцов.
- Используйте стерильный наконечник пипетки, чтобы поместить автоклавную воду в фильтровальную бумагу, чтобы создать влажную камеру. Используйте объем, чтобы пропитать бумагу, не добавляя лишнего количества воды. Запечатайте чашку Петри пищевой пленкой и определите ее соответствующим кодом изолята. Выдерживайте посуду в темноте при температуре 25-27 °C в течение 3-7 дней.
- Оцените рост гиф в предметном стекле и покровном стекле. Из каждого набора для культивирования слайдов изготавливаются два предметных стекла: один с использованием предметного стекла с гифами и автоклавным покровным стеклом, второй с использованием покровного стекла с гифами, а другой со стеклянным предметным стеклом.
- После наблюдения за ростом гифа осторожно отделите квадрат среды от предметного стекла (рис. 2Б), закрепите два предметных стекла с помощью выбранного красителя (шаг 5.5) и проанализируйте под световым микроскопом. Не забудьте идентифицировать изолированный код на слайде. Чтобы получить полуперманентные слайды, запечатайте покровное стекло прозрачным лаком для ногтей.
- Чтобы получить перманентные предметные стекла, тщательно смойте краситель с прилипших гиф после окрашивания и дайте предметному стеколу высохнуть. Монтаж с быстросъемным монтажным материалом (подробнее см. Pena-Passos et al.10).
ПРИМЕЧАНИЕ: Недостаток изготовления перманентного предметного стекла с помощью этой техники заключается в том, что споры и структуры, не прилипшие к стеклу, могут быть промыты.
- Методы окрашивания и наблюдение за гифами
- Лактофенол хлопковый синий (LPCB)21: добавьте 20 мл молочной кислоты, 40 мл глицерина и 20 мл дистиллированной воды. Растворите в этом растворе 20 г кристаллов фенола, слегка нагревая. Растворяют 0,05 г метилового синего (хлопкового синего, или 2 мл 1% водного раствора). LPCB также можно легко приобрести уже готовым.
ВНИМАНИЕ: Фенол очень токсичен и летуч; Манипулируйте им исключительно внутри вытяжного шкафа и надевайте перчатки. - Толуидиновый синий O10 (TBO): Приготовьте 0,05% TBO в 0,1 М фосфатном буфере (pH 6,8).
- Конголезское красное22,23,24: Приготовьте раствор 1% конголезского красного в дистиллированной воде и отфильтруйте его. Выдерживать 5-10 мин. Этот краситель также может быть применен для флуоресцентной микроскопии25.
- При наблюдении и фотографировании гиф грибов под световым микроскопом обращайтесь к различным библиографическим источникам, которые помогут идентифицировать структуры (см. обсуждение).
- Лактофенол хлопковый синий (LPCB)21: добавьте 20 мл молочной кислоты, 40 мл глицерина и 20 мл дистиллированной воды. Растворите в этом растворе 20 г кристаллов фенола, слегка нагревая. Растворяют 0,05 г метилового синего (хлопкового синего, или 2 мл 1% водного раствора). LPCB также можно легко приобрести уже готовым.

Рисунок 2: Процедуры культивирования предметных стекол нитчатых грибов . (A) Схематическая конфигурация набора для культивирования предметных стекол, где цифры обозначают порядок расположения элементов. (Б) В предметном стекле и покровном стекле наблюдается отслоение квадрата питательной среды после роста гифы. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
6. Выделение общей ДНК из грибных изолятов (самодельный протокол26 с модификациями 27)
ПРИМЕЧАНИЕ: Каждый материал, раствор и реагент, используемые в этом разделе, должны быть стерильными. Те, которые не могут быть куплены уже стерилизованными, должны быть автоклавированы при 121 °C в течение 20 минут. Надевайте перчатки в течение всего протокола и выполняйте некоторые этапы в вытяжном шкафу.
- Приготовьте буфер для экстракции: 1% додецилсульфат натрия (SDS), 250 мМ NaCl, 200 мМ Tris-HCl (pH 8,0) и 25 мМ этилендиаминтетрауксусной кислоты (ЭДТА). Выращивают очищенные изоляты в 39 г/л КПК в течение 7-14 дней.
- Аккуратно соскребают мицелий с изолята с помощью шпателя или ложки и переносят фрагменты в автоклавную ступку, избегая переноса питательной среды с агрегатом гиф. С помощью фарфорового пестика измельчите мицелий с жидким азотом до состояния мелкого порошка. Не позволяйте измельчаемому мицелию растаять, добавляя азот, чтобы избежать этого.
- Добавьте 1 мл экстракционного буфера в пробирку для микроцентрифуги объемом 2 мл и поместите измельченный образец до отметки 1,5 мл. Осторожно перемешайте содержимое пробирок для гомогенизации.
- Перемешайте пробирки в вихре в течение 5 с и поместите их в термоблок при температуре 65 °C на 20 минут. Тщательно гомогенизируйте содержимое путем инверсии каждые 7-10 минут.
- Центрифугируйте пробирки при 10 000 x g в течение 10 мин при 4 °C. Перелейте 800 мкл из верхней фазы в новую пробирку для микроцентрифуги объемом 2 мл, добавьте в пробирки 800 мкл фенола и перемешайте содержимое путем инверсии.
ВНИМАНИЕ: Фенол является высокотоксичным и летучим реагентом; Он может вызвать эритему, гангрену и некроз тканей. При вдыхании может вызвать одышку и кашель. Системная абсорбция может повредить печень, почки и центральную нервную систему. Манипулируйте фенолом исключительно в вытяжном шкафу и надевайте перчатки.
ПРИМЕЧАНИЕ: Начиная со следующего шага, используйте перчатки и проводите протокол в вытяжном шкафу. - Центрифужируют пробирки при 10 000 x g в течение 10 мин при 4 °C и переносят 800 мкл из верхней фазы в новую пробирку объемом 2 мл, осторожно избегая переноса содержимого нижней фазы.
- Добавьте в пробирки 400 мкл фенола и 400 мкл хлороформа и перемешайте содержимое методом инверсии. Центрифугируйте их при 10 000 x g в течение 10 минут при 4 °C.
ВНИМАНИЕ: Хлороформ является высокотоксичным и летучим реагентом; При контакте с кожей он может вызывать раздражение и травмы, а при вдыхании поражает центральную нервную и кардиореспираторную системы, печень и почки. Манипулируйте хлороформом исключительно в вытяжном шкафу и надевайте перчатки. - Рекуперация 800 мкл или менее из верхней фазы в новую пробирку объемом 2 мл. Добавьте 800 мкл хлороформа, перемешайте содержимое путем инверсии и центрифугируйте при 10 000 x g в течение 10 мин при 4 °C.
ПРИМЕЧАНИЕ: На этом этапе остатки нижней фазы не должны перекладываться в новые пробирки. Таким образом, будьте особенно осторожны при рекуперации верхней фазы. - Перенесите 600-800 мкл из верхней фазы в новую пробирку объемом 1,5 мл и добавьте 450 мкл изопропанола. Содержимое перемешивают инверсией и инкубируют при 25 °С в течение 5 мин.
- Центрифугируют пробирки при 10 000 x g в течение 5 мин при 4 °C и удаляют надосадочную жидкость с помощью микропипетки. Будьте осторожны, чтобы не выбросить гранулы, осевшие на дне тюбика.
- Добавьте 500 мкл 80% этанола и центрифугируйте в течение 5 минут. Повторите дважды, если гранула не осветлена.
- Удалите этанол с помощью микропипетки и высушите гранулу при температуре 37 °C в течение 30-60 минут. Добавьте 30-50 мкл деионизированной воды, элюируя гранулы с помощью микропипетки.
- Выдержите пробирки при температуре 4 °C в течение ночи для полного элюирования ДНК и заморозьте содержимое при -20 °C.
7. Выделение общей ДНК из органов растений для методики метабаркодирования (коммерческий набор)
ПРИМЕЧАНИЕ: Для следующей методики необходимо приобрести коммерческий набор, указанный в таблице материалов , как набор для экстракции почвенной ДНК. Каждый материал, раствор и реагент, используемые в этом разделе, должны быть стерильными. Те, которые не могут быть куплены уже стерилизованными, должны быть автоклавированы при 121 °C в течение 20 минут. Настоятельно рекомендуется носить перчатки в течение всего протокола, а шаги можно проводить внутри ламинарного колпака. Описанный протокол является модификацией De Souza et al.12 из протокола, подробно описанного производителем.
- Используя фарфоровые пестики и ступки, измельчите корни, собранные после шага 1.2, в жидком азоте, измельчив образцы до мелкого порошка. Добавьте 0,3 г измельченных образцов в пробирки PowerBead и осторожно перемешайте до гомогенизации.
- Добавьте 60 мкл раствора С1 (входит в комплект) в пробирки PowerBead и перемешайте содержимое методом инверсии. Используя тканевый гомогенизатор и лизер клеток (таблица материалов), прочно привяжите трубки к соответствующей опоре, соедините опору с вихрем и запустите оборудование на максимальной скорости в течение 10-20 минут.
ПРИМЕЧАНИЕ: Если раствор C1 выпадает в осадок, нагрейте его при 60 °C до полного растворения. - Центрифугируйте пробирки при 10 000 x g в течение 30 с при 25 °C. Переносят 500 мкл надосадочной жидкости в пробирки микроцентрифуги объемом 2 мл. Переносимое содержимое может быть твердыми частицами.
- Добавить в пробирки 250 мкл раствора С2 и перемешать в вихре в течение 5 с. Инкубируют при 4 °C в течение 5 минут, а затем центрифугируют при 10 000 x G в течение 1-2 минут при 25 °C.
- Перенесите более 600 мкл надосадочной жидкости в новые пробирки объемом 2 мл, избегая гранул. Добавляют 200 мкл раствора С3 и перемешивают на вихре в течение 5 с.
- Инкубируют при 4 °C в течение 5 мин, а затем центрифугируют при 10 000 x G в течение 1 мин при 25 °C. На этом этапе убедитесь, что надосадочная жидкость не содержит твердых частиц.
- Перенесите более 750 мкл надосадочной жидкости в новые пробирки объемом 2 мл, избегая гранул. Раствор С4 хорошо гомогенизируют, добавляют к надосадочной жидкости 1100 мкл раствора С4 и перемешивают в вихре в течение 5 с.
- Загрузите 675 мкл из содержимого пробирок в колонках MB Spin Columns, через фильтр и центрифугу при 10 000 x g в течение 1 мин при 25 °C. Выбросьте жидкое содержимое.
- Повторите предыдущий шаг дважды, пока не будет обработано все содержимое каждой пробирки. Затем добавьте 500 мкл раствора C5 в центр фильтра, находящегося в верхней колонне пробирки, и центрифугу при 10 000 x g в течение 30 с при 25 °C.
- Выбросьте жидкое содержимое и снова центрифугируйте в тех же условиях, что и на предыдущем этапе. Осторожно переложите верхнюю колонку колонки MB Spin Column в новые пробирки для микроцентрифуг объемом 2 мл, избегая попадания жидкости в колонку.
- Добавьте 85-100 мкл раствора С6 в центр фильтра и подождите 1 минуту. Центрифуга при 10 000 x g в течение 30 с при 25 °C и утилизируйте колонку MB Spin Column. Хранить пробирки при температуре -80 °C.
8. Количественное определение ДНК в спектрофотометре (см. Таблицу материалов)
- С помощью указанного спектрофотометра откройте программное обеспечение. Выберите опцию Нуклеиновая кислота, выберите опцию ДНК и установите концентрацию нг/мкл.
- Добавьте 1 мкл деионизированной воды в детектор спектрофотометра и выполните калибровку, выбрав опцию Пусто. После считывания аккуратно протрите датчик мягкой папиросной бумагой.
- Назовите полевой образец кодом изолята считываемой пробы и поместите 1 мкл его в детектор оборудования. Выберите опцию Измерить; Формируется график и таблица с результатами.
- Повторяйте шаг 8.3 до тех пор, пока не будут прочитаны все образцы. Таблицу со сформированными результатами рекомендуется сохранить для записи и анализа: выберите опцию Отчеты и место, куда будет сохранен .xml файл.
- Добавьте в детектор 5 мкл деионизированной воды, подождите несколько минут и аккуратно протрите мягкой папиросной бумагой.
Результаты
В протоколе изоляции, учитывая наличие загрязнения от воды, использованной при последней промывке, а также обнаружение загрязнения в чашках Петри с инокулированными фрагментами, могут быть предприняты различные действия в зависимости от типа загрязняющего вещества ...
Обсуждение
Поверхностная дезинсекция образцов растений является одним из наиболее ответственных этапов в представленном протоколе. Крайне желательно отсутствие загрязнений в посуде КПК каплями от последней стирки. Бактерии часто наблюдаются в качестве загрязняющих веществ в изоляционных чаш?...
Раскрытие информации
Авторам нечего раскрывать и нет конфликта интересов.
Благодарности
Мы благодарим FAPESP (2015/26479-6) и CNPq (447453/2014-9). JLSM благодарит CNPq за гранты на повышение производительности (303664/2020-7). MPP благодарит Capes (стипендия магистратуры, процесс 88887.600591/2021-00) и CNPq.
Материалы
| Name | Company | Catalog Number | Comments |
| Adhesive tape | (from any company, for adhesive tape mount in micromorphological analyses) | ||
| Ampicillin | Sigma-Aldrich | A5354 | (for installation of plant fragments; other antibiotics may be used - check step 2.2.1) |
| Autoclave | (from any company, for materials sterilization in many steps) | ||
| Bacteriological agar | Sigma-Aldrich | A1296 | (for many steps) |
| C1, C2, C3, C4, C5, and C6 solutions | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Centrifuge | Merck/Eppendorf | 5810 G | (for total DNA extraction from fungal isolates) |
| Centrifuge tubes | Merck | CLS430828 | (for samples collection) |
| Chloroform | Sigma-Aldrich | C2432 | (for total DNA extraction from fungal isolates) |
| Congo red | Supelco | 75768 | (for hyphae staining) |
| Cryotubes | Merck | BR114831 | (for many steps) |
| Ethanol | Supelco | 100983 | It will be necessary to carry out the appropriate dilutions (for many steps) |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 3609 | (for total DNA extraction from fungal isolates) |
| Filter paper | Merck | WHA10010155 | (for many steps) |
| Glass test tubes | Merck | CLS7082516 | (for cryopreservation in unhulled rice grains) |
| Glass wool | Supelco | 20411 | (for cryopreservation in unhulled rice grains) |
| Glucose | Sigma-Aldrich | G8270 | Or dextrose (for cryopreservation in vermiculite) |
| Glycerol | Sigma-Aldrich | G5516 | Or glycerin (for cryopreservation in vermiculite, for preparing LPCB) |
| Isopropanol | Sigma-Aldrich | 563935 | (for total DNA extraction from fungal isolates) |
| Lactic acid | Sigma-Aldrich | 252476 | (for preparing LPCB - hyphae staining) |
| Lactophenol blue solution (LPCB) | Sigma-Aldrich | 61335 | (for hyphae staining) |
| Laminar flow hood | (class I, from any company, for many steps) | ||
| Light microscope | (from any company, for hyphae observation) | ||
| MB Spin Columns | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Methyl blue (cotton blue) | Sigma-Aldrich | M5528 | (for preparing LPCB - hyphae staining) |
| Microcentrifuge tube (1.5 mL) | Merck | HS4323 | (for total DNA extraction from fungal isolates) |
| Microcentrifuge tube (2 mL) | Merck | BR780546 | (for many steps) |
| Mineral oil | (for preservation of fungal isolates) | ||
| Paper bags | Average size 150 mm x 200 mm (for samples collection) | ||
| Petri dish (Glass, 120 mm x 20 mm) | Merck/Pyrex | SLW1480/10D | (autoclavable, for fungi slide culture, prefer higher ones) |
| Petri dish (Glass, 50 mm x 17 mm) | Merck/Aldrich | Z740618 | (for purification of fungal isolates); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Petri dish (Glass, 80 mm x 15 mm) | Merck/Brand | BR455732 | (for installation of plant fragments); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Phenol | Sigma-Aldrich | P1037 | (for total DNA extraction from fungal isolates, for preparing LPCB) |
| Porcelain mortar | Sigma-Aldrich | Z247464 | (for total DNA extraction from fungal isolates) |
| Porcelain pestle | Sigma-Aldrich | Z247502 | (for total DNA extraction from fungal isolates) |
| Potato dextrose agar (PDA) | Millipore | P2182 | (for many steps) |
| PowerBead tubes | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Rapid mounting medium (Entellan) | Sigma-Aldrich | 1.0796 | (for fungi slide culture) |
| Silica gel | Supelco | 717185 | (for cryopreservation in unhulled rice grains) |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | (for total DNA extraction from fungal isolates) |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | Lauryl sulfate sodium salt (for total DNA extraction from fungal isolates) |
| Sodium hypochlorite (w/ 2% active chlorine) | (commercial product, for superficial desinfestation) | ||
| Soil DNA extraction kit (DNeasy PowerSoil kit) | Qiagen | 12888-50 | (for total DNA extraction from plant organs) |
| Spectrophotometer - Nanodrop 2000/2000c | ThermoFisher Scientific | ND2000CLAPTOP | (for total DNA extraction from plant organs) |
| Stereomicroscope | (=dissecting microscope, from any company, for macromorphological analyses) | ||
| Tetracycline | Sigma-Aldrich | T7660 | (for installation of plant fragments) |
| Thermoblock | Merck/Eppendorf | EP5362000035 | (or from other companies) |
| Tissue homogenizer and cell lyzer | SPEX SamplePrep | 2010 Geno/Grinder - Automated Tissue Homogenizer and Cell Lyzer (for total DNA extraction from plant organs) | |
| Toluidine blue O | Sigma-Aldrich/Harleco | 364-M | (for hyphae staining) |
| Trehalose | Sigma-Aldrich | T9531 | (for cryopreservation in vermiculite) |
| Tris Base Solution (Tris) | Sigma-Aldrich | T1699 | (for total DNA extraction from fungal isolates) |
| Unhulled rice grains | (for cryopreservation) | ||
| U-shaped glass rod | (or an adaptation - check step 5.4.1, for fungi slide culture) | ||
| Vermiculite | Fine granulometry (for cryopreservation in vermiculite) | ||
| Vortexer | Sigma-Aldrich/BenchMixer | BMSBV1000 | (for total DNA extraction from fungal isolates) |
| Yeast extract | Sigma-Aldrich | Y1625 | (for cryopreservation in vermiculite) |
Ссылки
- de Azevedo, J. L. Endophytic microorganisms. Ecologia Microbiana. , 117-137 (1998).
- Stone, J. K., Bacon, C. W., White, J. F. An overview of endophytic microbes: endophytism defined. Microbial Endophytes. , 17-44 (2000).
- Schulz, B., Boyle, C. What are Endophytes. Microbial Root Endophytes. , 1-13 (2006).
- Smith, S. E., Read, D. J. . Mycorrhizal Symbiosis. , (2008).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Ma, X., Kang, J., Nontachaiyapoom, S., Wen, T., Hyde, K. D. Non-mycorrhizal endophytic fungi from orchids. Current Science. 109 (1), 72-87 (2015).
- Favre-Godal, Q., Gourguillon, L., Lordel-Madeleine, S., Gindro, K., Choisy, P. Orchids and their mycorrhizal fungi: an insufficiently explored relationship. Mycorrhiza. 30 (1), 5-22 (2020).
- Sun, X., Guo, L. -. D. Endophytic fungal diversity: review of traditional and molecular techniques. Mycology. 3 (1), 65-76 (2012).
- Pena-Passos, M., Sisti, L. S., Mayer, J. L. S. Microscopy techniques for interpreting fungal colonization in mycoheterotrophic plants tissues and symbiotic germination of seeds. Journal of Visualized Experiments. (183), e63777 (2022).
- Araújo, W. L., et al. . Endophytic microorganisms: Theoretical and Practical Aspects of Isolation and Characterization. 1st ed. 1, 257 (2014).
- de Souza, R. S. C., et al. Unlocking the bacterial and fungal communities assemblages of sugarcane microbiome. Scientific Reports. 6, 28774 (2016).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Araújo, W. L., et al. Variability and interactions between endophytic bacteria and fungi isolated from leaf tissues of citrus rootstocks. Canadian Journal of Microbiology. 47 (3), 229-236 (2001).
- Castellani, A. Further researches on the long viability and growth of many pathogenic fungi and some bacteria in sterile distilled water. Mycopathologia. 20 (1-2), 1-6 (1963).
- Currah, R. S., Zelmer, C. D., Hambleton, S., Richardson, K. A. Fungi from orchid mycorrhizas. Orchid Biology: Reviews and Perspectives, VII. , 117-170 (1997).
- Freitas, E. F. S., et al. Diversity of mycorrhizal Tulasnella associated with epiphytic and rupicolous orchids from the Brazilian Atlantic Forest, including four new species. Scientific Reports. 10 (1), 7069 (2020).
- Sato, M., Inaba, S., Noguchi, M., Nakagiri, A. Vermiculite as a culture substrate greatly improves the viability of frozen cultures of ectomycorrhizal basidiomycetes. Fungal Biology. 124 (8), 742-751 (2020).
- Pereira, O. L., Kasuya, M. C. M., Borges, A. C., Araújo, E. F. D. Morphological and molecular characterization of mycorrhizal fungi isolated from neotropical orchids in Brazil. Canadian Journal of Botany. 83 (1), 54-65 (2005).
- Riddell, R. W. Permanent stained mycological preparations obtained by slide culture. Mycologia. 42 (2), 265-270 (1950).
- Walsh, T. J., Hayden, R. T., Larone, D. H. . Larone's Medically Important Fungi: A Guide to Identification. , (2018).
- Microscopy: Chemical Reagents. British Mycological Society Available from: https://www.britmycolsoc.org.uk/field_mycology/microscopy/reagents (2022)
- Senanayake, I. C., et al. Morphological approaches in studying fungi: Collection, examination, isolation, sporulation and preservation. Mycosphere. 11 (1), 2678-2754 (2020).
- Slifkin, M., Cumbie, R. Congo red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Raeder, U., Broda, P. Rapid preparation of DNA from filamentous fungi. Letters in Applied Microbiology. 1 (1), 17-20 (1985).
- Martins, M. K., et al. Molecular characterization of endophytic microorganisms. Endophytic microorganisms: theoretical and practical aspects of isolation and characterization. 1st edition. , 189-211 (2014).
- Rayner, R. W. A Mycological Colour Chart. Commonwealth Mycological Institute. , (1970).
- Kornerup, A., Wanscher, J. H. . Methuen Handbook of Colour. Methuen handbook of colour. , (1967).
- Ridgway, R. . Color Standards and Color Nomenclature. , (1912).
- McGinnis, M. R. . Laboratory Handbook of Medical Mycology. , (2012).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sridharan, G., Shankar, A. A. Toluidine blue: A review of its chemistry and clinical utility. Journal of Oral and Maxillofacial Pathology. 16 (2), 251-255 (2012).
- Smith, D., Onions, A. H. S. A comparison of some preservation techniques for fungi. Transactions of the British Mycological Society. 81 (3), 535-540 (1983).
- Ryan, M. J., Smith, D., Jeffries, P. A decision-based key to determine the most appropriate protocol for the preservation of fungi. World Journal of Microbiology and Biotechnology. 16 (2), 183-186 (2000).
- Lalaymia, I., Cranenbrouck, S., Declerck, S. Maintenance and preservation of ectomycorrhizal and arbuscular mycorrhizal fungi. Mycorrhiza. 24 (5), 323-337 (2014).
- Zettler, L. W., Corey, L. L. Orchid mycorrhizal fungi: isolation and identification techniques. Orchid Propagation: From Laboratories to Greenhouses-Methods and Protocols. , 27-59 (2018).
- Yu, S., Wang, Y., Li, X., Yu, F., Li, W. The factors affecting the reproducibility of micro-volume DNA mass quantification in Nanodrop 2000 spectrophotometer. Optik. 145, 555-560 (2017).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Schoch, C. L., et al. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi. Proceedings of the National Academy of Sciences. 109 (16), 6241-6246 (2012).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols: A Guide to Methods and Applications. 18 (1), 315-322 (1990).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proceedings of the National Academy of Sciences. 74 (12), 5463-5467 (1977).
- Ranjard, L., et al. Characterization of bacterial and fungal soil communities by automated ribosomal intergenic spacer analysis fingerprints: biological and methodological variability. Applied and Environmental Microbiology. 67 (10), 4479-4487 (2001).
- Metzker, M. L. Sequencing technologies-the next generation. Nature Reviews Genetics. 11 (1), 31-46 (2010).
Erratum
Formal Correction: Erratum: Isolation, Characterization, and Total DNA Extraction to Identify Endophytic Fungi in Mycoheterotrophic Plants
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for: Isolation, Characterization, and Total DNA Extraction to Identify Endophytic Fungi in Mycoheterotrophic Plants. The Authors section was updated from:
Juliana Lishcka Sampaio Mayer
to:
Juliana Lischka Sampaio Mayer
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены