A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זיהוי תאים שקטים במודל לוקמיה לימפובלסטית חריפה של תאי T של דג זברה באמצעות צביעת התפשטות תאים
In This Article
Summary
השתמשנו בצביעת התפשטות תאים כדי לזהות תאים שקטים במודל לוקמיה לימפובלסטית חריפה מסוג T של דג הזברה. הכתם נשמר בתאים שאינם מתחלקים ומצטמצם במהלך התפשטות התאים, מה שמאפשר בחירה של תאים רדומים להמשך חקירה. פרוטוקול זה מספק כלי פונקציונלי לחקר התחדשות עצמית בהקשר של שקט תאי.
Abstract
שקט תאי הוא מצב של עצירת גדילה או התפשטות איטית המתואר בתאי גזע נורמליים וסרטניים (CSC). שקט עשוי להגן על CSCs מפני תרופות כימותרפיות נוגדות שגשוג. במודלים של עכברי מסוג T-cell acute lymphoblastic leukemia (T-ALL) שמקורם בחולה xenograft (PDX), תאים שקטים קשורים לעמידות לטיפול ולגזע. צבעי התפשטות תאים הם כלים פופולריים למעקב אחר חלוקת התא. הצבע הפלואורסצנטי מעוגן באופן קוולנטי לקבוצות אמין על הממברנה ומקרומולקולות בתוך התא. זה מאפשר מעקב אחר תאים מסומנים עבור עד 10 חלוקות, אשר ניתן לפתור על ידי ציטומטריית זרימה.
בסופו של דבר, תאים עם שיעורי ההתרבות הגבוהים ביותר יהיו בעלי שימור צבע נמוך, מכיוון שהוא ידולל עם כל חלוקת תא, בעוד שתאים רדומים המתחלקים לאט יותר יהיו בעלי השימור הגבוה ביותר. השימוש בצבעי התרבות תאים כדי לבודד תאים רדומים עבר אופטימיזציה ותואר במודלים של עכברי T-ALL. מודל T-ALL של דג הזברה שמקורו ב-rag2:Myc, המשלים את דגמי העכברים הקיימים, מספק מקום מצוין לחקור התחדשות עצמית ב-T-ALL בשל התדירות הגבוהה של תאי גזע לוקמיים (LSCs) והנוחות של דגי זברה לניסויי השתלה בקנה מידה גדול.
במאמר זה אנו מתארים את תהליך העבודה לצביעה של תאי T-ALL של דגי זברה באמצעות צבע להתרבות תאים, אופטימיזציה של ריכוז הצבע עבור תאי דגי זברה, העברת תאים מוכתמים בהצלחה in vivo, ואיסוף תאים עם רמות שונות של שימור צבע על ידי מיון תאים חיים מבעלי חיים מושתלים. בהתחשב בהיעדרם של יצרני משטחי תאים מבוססים היטב עבור LSCs ב- T-ALL, גישה זו מספקת אמצעי פונקציונלי לחקור תאים שקטים in vivo. לקבלת תוצאות מייצגות, אנו מתארים את יעילות הקליטה ואת תדר LSC של תאים שומרי צבע גבוהים ונמוכים. שיטה זו יכולה לסייע בחקירת תכונות נוספות של תאים שקטים, כולל תגובה לתרופות, פרופילי שעתוק ומורפולוגיה.
Introduction
תאי גזע בוגרים אחראים להתחדשות של סוגי תאים ממוינים באיבר נתון והם נמצאים בעיקר במצב רדום, לא מתחלק 1,2. לדוגמה, תאי גזע המטופויטיים (HSCs), אשר שומרים על הדם, נשארים במידה רבה שקטים, ורק חלק קטן נכנס למחזור התא כדי לחדש את עצמם או להתמיין כדי לייצר מרכיבי דם בוגרים3. באופן דומה, בסרטן, תת-אוכלוסייה נדירה של תאים הנקראת תאי גזע סרטניים (CSC) היא בעלת יכולת התחדשות עצמית ואחראית לתחזוקה ארוכת טווח של הממאירות4. תאי גזע סרטניים קיימים in vivo במצב של שקט או צמיחה איטית, מה שעשוי לאפשר להם להימלט מטיפולים אנטי-שגשוגייםלסרטן 5, להתחמק מפינוי על ידי מערכת החיסון6, להפחית את העקה החמצונית ולשפר את מסלולי תיקון הדנ"א שלהם7. אפילו מספר נמוך של CSCs שנותרו מאחור לאחר הטיפול יכול פוטנציאלית לאכלס מחדש את הגידול, וכתוצאה מכך הישנות של המטופל8. בהתאם לכך, הבנת השקט התאי טומנת בחובה הבטחה גדולה לזיהוי נקודות תורפה פוטנציאליות של CSCs ופיתוח דרכים חדשות להתמקד בהם.
צבעי התפשטות תאים, כגון כתם carboxyfluorescein succinimidyl ester (CFSE) ונגזרותיו, משמשים בדרך כלל למעקב אחר תדירות חלוקות התא9. הצבע חודר לרוחב קרום התא, וברגע שהוא נכנס לתא, הוא עובר הפעלה על ידי אסטרזות תוך-תאיות למוצר פלואורסצנטי. התרכובת הפלואורסצנטית המתקבלת נשמרת בתוך התא באמצעות קשרי האמיד הקוולנטיים הנוצרים בין succinimidyl moiety לבין קבוצות תפקודיות אמין של חלבונים תוך תאיים10. עם כל חלוקה תאית, התרכובת הפלואורסצנטית מחולקת באופן שווה בין שני התאים המתקבלים, מה שגורם לדילול אות כפול. צבע זה מאפשר זיהוי של עד 10 חלוקות תאים באמצעות ניתוח ציטומטריית זרימה11.
גישה זו שימשה בעבר להעשרת אוכלוסיות CSC במבחנה על ידי זיהוי אוכלוסיות מחזור איטי של תאים עם שימור גבוה של צבע11,12. ב- T-ALL, CFSE שימש למעקב אחר צמיחת הגידול in vivo ב- xenografts שמקורם בחולים בעכברים. לאחר תיוג תאים ושלושה שבועות של השתלה, ניתוח ציטומטריית זרימה הראה אוכלוסייה נדירה של תאים שעדיין שמרו על פלואורסצנטיות CFSE. אוכלוסייה זו נמצאה קשורה לגבעול, עמידות לטיפול ודמיון גבוה לתאים הגורמים להישנות בחולים13. בהתאם לכך, צבע זה מספק כלי שימושי לחקר פנוטיפים של תאי גזע לוקמיה (LSC) ב- T-ALL.
מטרת העבודה היא להרחיב את היישום של צבע התפשטות התאים כדי לחקור שקט in vivo באמצעות מודל T-ALL של דג זברה. בפרט, דג הזברה מונע rag2:Myc T-ALL מודל14 מספק מקום מצוין לחקר התחדשות עצמית בשל התדירות הגבוהה של LSCs בהשוואה למודלים עכברים ומחלות אנושיות15. בנוסף, השימוש בדגי זברה מאפשר מחקרי השתלה בקנה מידה גדול, אשר יכולים להיעשות בעלות נמוכה בהרבה של טיפול ותחזוקה בהשוואה לעמיתיהם העכבר16. דגי זברה מצוינים גם ליישומי הדמיה חיים, שכן ניתן לצפות בקלות בתאי גידול המסומנים באופן פלואורסצנטי באמצעות מיקרוסקופ פלואורסצנטי פשוט כדי להעריך את קצב התפתחות הגידול16.
בפרוטוקול זה, אנו מתארים את תהליך העבודה להכתמת תאי T-ALL של דגי זברה עם צבע התפשטות תאים ולאחר מכן התפשטות in vivo של תאים מוכתמים בדגי זברה CG1 סינגניים. עם התפתחות לוקמיה, אנו מתארים את מיון התאים ששמרו על הצבע ואת השימוש בהם לניסוי השתלת דילול מגביל לאחר מכן כדי לכמת את שיעורי ההתחדשות העצמית של LSC. פרוטוקול זה יכול להיות מורחב עבור יישומים נוספים, כולל סינון תרופות in vivo של תרכובות פוטנציאליות עבור מיקוד של LSCs שקט. בנוסף, תאים שנאספו יכולים לשמש לניתוחים שונים במורד הזרם, כגון פרופיל שעתוק, פרוטאומיקה ומטבולומיקה, ומציעים תובנות ייחודיות על ההתנהגות של LSCs שקטים ב- T-ALL.
Protocol
בפרוטוקול זה, אנו משתמשים בתאי T-ALL של דגי זברה בעלי תווית GFP שנוצרו בעבר בזן CG1 ולכן ניתן להזריק ישירות לדגי זברה CG1 סינגניים15. בקצרה, לוקמיה נוצרה על ידי מיקרו-הזרקה של DNA של rag2:Myc ו- rag2:GFP לעוברים חד-תאיים של דגי זברה CG1. בעלי חיים נוטרו להתפתחות לוקמיה החל מ-3 שבועות לאחר ההזרקה, באמצעות מיקרוסקופ פלואורסצנטי. תאי לוקמיה חיוביים ל-GFP בודדו ב-FACS והושתלו סדרתית בדגי זברה CG1 מושתלים כדי ליצור שיבוטים בתדירות גבוהה של LSC. פרטים על הפרוטוקול כולו מתוארים על ידי Blackburn et al.15.
לחלופין, T-ALL ראשוני שמקורו ב-Rag2:Myc יכול להיווצר על ידי מיקרו-הזרקה של DNA של עוברי דגי זברה17. מיקרו-הזרקת DNA של rag2:Myc עם כתב פלואורסצנטי מונע rag2 כגון GFP יכולה לגרום להתפתחות של תאי B, תאי T, וערבוב כל18. שיבוטי הלוקמיה המשמשים בפרוטוקול זה אומתו בעבר כ-T-ALL15. כל ההליכים הניסיוניים המערבים דגי זברה נבדקו ואושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת קנטקי, פרוטוקול 2019-3399.
1. התפשטות דגי זברה T-ALL תאים in vivo
- הפשירו בקבוקון אחד המכיל 1 מ"ל של תאי T-ALL קפואים של דגי זברה עם תווית GFP באמבט מים של 37 מעלות צלזיוס עם ניעור עדין, עד להפשרה. לאחר ההפשרה, מעבירים לקרח.
- לאט פיפטה את התוכן של הצינור לתוך צינור חרוטי 15 מ"ל עם 4 מ"ל של מדיה דגים (0.9x PBS + 5% FBS) כדי לדלל את מדיה הקפאה.
- יש לסחוט כלפי מטה במשך 5 דקות בטמפרטורה של 2,500 × גרם ב-4°C. הסר את המדיה מהכדור. להשהות ב 0.5 מ"ל של מדיה דגים ולשמור את התאים על קרח.
- ספרו את התאים ודללו אותם במידת הצורך ל-100,000 תאים / 5 מיקרוליטר.
- הרדימו את דג הזברה CG1 הבוגר על ידי הוספת 200 מיקרוליטר של 4 מ"ג/מ"ל חומר הרדמה (MS-222) ל-25 מ"ל של מי מערכת דגים בצלחת פטרי. החזיקו את דג CG1, צד הגחון כלפי מעלה והזריקו 5-6 μL לחלל התוך צפקי (IP) באמצעות מזרק מיקרוליטר של המילטון. החזירו את בעלי החיים למכלים שלהם ועקבו אחר החזרה לשחייה רגילה לפני החזרתם למערכת.
הערה: דגי זברה בוגרים, בני 60 יום ומעלה, שימשו למחקרי ההשתלות המתוארים בפרוטוקול זה. - עקוב אחר צמיחת לוקמיה פעם בשבוע באמצעות מיקרוסקופ פלואורסצנטי. ראה סעיף 2 להלן לפרטים על הליך המיון.
2. קצירת תאי לוקמיה המסומנים באופן פלואורסצנטי
- בערך 21-28 ימים לאחר ההשתלה, מרדימים את דג הזברה CG1 הבוגר על ידי הוספת 200 μL (4-5 טיפות) של 4 מ"ג / מ"ל הרדמה ל 25 מ"ל של מי מערכת דגים בצלחת פטרי.
- בחן את דג הזברה CG1 עבור נטל לוקמיה על ידי הערכת אחוז תאי לוקמיה המסומנים GFP בחיה עם מיקרוסקופ אפיפלואורסצנטי, באמצעות המסנן המתאים כדי לזהות את פלואורסצנטיות GFP. לוקמיה חיובית GFP מוכן להיקצר אם הוא התפשט על פני >70% של החיה.
- הרדימו את בעל החיים על ידי הוספת 1 מ"ל של 4 מ"ג/מ"ל חומר הרדמה בצלוחית פטרי המכילה 9 מ"ל מי מערכת דגים. לאפשר לכל סימני החיים להיפסק; לדוגמה, התבוננו בדגים להפסקת התנועה האונקולרית (~ 5 דקות).
- העבירו את דגי הזברה לצלחת פטרי חדשה והוסיפו 1 מ"ל של מצע דגים כדי לשמש כחיץ לתאים. באמצעות סכין גילוח חדש, תחילה ערפו את ראשו של דג הזברה, ולאחר מכן השרו את הרקמה באמצעות אותו סכין גילוח. פיפט למעלה ולמטה כדי לעקור גושים גדולים של תאים.
- מעבירים את התאים דרך מסננת תאים של 40 מיקרומטר לתוך צינור חרוטי של 50 מ"ל כדי להתנתק לתרחיף חד-תאי. שמור את התאים על קרח.
3. אופטימיזציה של ריכוז צבע התרבות התאים (CellTrace Far Red) לצביעה וכדאיות תאי זברה
הערה: עבור פרוטוקול זה, ומאחר שתאי הגידול מסומנים בתווית GFP, השתמשנו בצבע התפשטות תאים אדומים רחוק (CellTrace Far Red) כדי למנוע חפיפה ספקטרלית, שתיקרא CT-FR.
- הכן תמיסה של 1 mM של צבע פלואורסצנטי מיד לפני השימוש על ידי הוספת נפח מתאים של DMSO בהתאם להמלצות היצרן. יש פתרונות עבודה של 1 mM, 0.5 mM, 0.1 mM, ו 0.01 mM; יש לדלל לפי הצורך במצע הדגים כדי לבדוק את כדאיות התאים לאחר הצביעה.
- לספור את התאים ולאסוף 1 × 106 תאים ב 1.5 מ"ל צינורות מיקרוצנטריפוגה.
- צנטריפוגה ב-2,500 × גרם ב-4°C למשך 5 דקות. הסר את הנוזל להשעות מחדש את התאים ב 1 מ"ל של 0.9x PBS.
- לפצל את תרחיף התא בין ארבעה צינורות של 250 μL כל אחד לטיפול עם CT-FR.
- הוסף 250 μL של PBS 0.9x כדי להביא את הנפח עד 500 μL כל אחד עם כ 250,000 תאים / צינור.
- הוסף את הכמויות הנדרשות של תמיסות העבודה המתוארות לעיל, לכל אחד מארבעת הצינורות כדי להשיג את הריכוזים הסופיים הבאים: 1 מיקרומטר, 0.5 מיקרומטר, 0.1 מיקרומטר ו- 0.05 מיקרומטר. דגירה למשך 20 דקות ב- 37 מעלות צלזיוס, מוגנת מפני אור.
- יש לסובב את התאים ב-2,500 × גרם למשך 5 דקות בטמפרטורת החדר. הסר את הנוזל ולשטוף את התאים עם 500 μL של מדיה דגים כדי להסיר את הצבע העודף.
- גלולה שוב, להסיר את הנוזל, ו resuspend ב 25 μL של מדיה דגים. השתמש ב- 1 μL כדי לספור תאים בדילול 1:10 ב- 50% Trypan Blue.
- לבחון את התאים תחת המיקרוסקופ עבור קיום התא; תאים חיים לא ישמרו על כחול טריפאן וייראו בהירים מתחת למיקרוסקופ, בעוד תאים מתים יתפסו את הצבע וייראו כהים. בחן תחילה את התאים מתחת לתעלה הפלואורסצנטית המתאימה כדי לזהות תאים סרטניים ולאחר מכן השתמש בערוץ שדה בהיר כדי להעריך את כדאיות התא.
- בחר את הריכוז שגורם לצביעה מוצלחת תוך שמירה על כדאיות התא (>90% תאי טריפאן כחולים-שליליים).
הערה: עבור תאי T-ALL של דגי הזברה שנבדקו בניסוי זה, ריכוז של 1 מיקרומטר שימש לצביעה מוצלחת, ו->90% מיכולת הקיום של התא.
4. התפשטות תאי דגי זברה מוכתמים CT-FR T-ALL in vivo
- באמצעות ריכוז CT-FR אופטימלי מסעיף 3, מכתימים את תאי דגי הזברה. השאירו חלק מתאי הגידול לא מוכתמים ליצירת הגידול T-ALL המסומן ב-GFP, כבקרה חיובית ל-GFP במהלך מיון FACS. לדלל תאים מוכתמים ולא מוכתמים ל-50,000 תאים / 5 μL להשתלה.
- הרדימו את דג הזברה CG1 הבוגר על ידי הוספת 200 מיקרוליטר של 4 מ"ג/מ"ל חומר הרדמה ל-25 מ"ל של מי מערכת דגים בצלחת פטרי.
- הזריקו 5 μL של תרחיף התא לחלל ה-IP של דג הזברה כמתואר בסעיף 1 הן עבור התאים המוכתמים והן עבור התאים הלא מוכתמים. הזריקו 5-6 דגי זברה לכל קבוצה כדי לקחת בחשבון את פוטנציאל התמותה לאחר ההזרקה.
- בדקו את בעלי החיים במיקרוסקופ פלואורסצנטי תחת טשטוש פעמיים בשבוע להתפתחות לוקמיה.
הערה: לאחר ~ 10-14 ימים, לוקמיה צריכה לתפוס כ 30-40% של הגוף הזה. תכנן קציר לוקמיה ומיון לאחר מכן במסגרת זמן זו. המתנה להתרחבות הגידול לגודל גדול עלולה לגרום לדילול גדול יותר של צבע התא הפלואורסצנטי ולקושי לזהות את האות שלו. שקול אופטימיזציה של עיתוי קצירת הגידול עבור מודל הגידול שנבחר. בנוסף, מומלץ כאן ניטור גידול תכוף יותר כדי להבטיח את לכידת גודל הגידול הרצוי.
5. הכנה למיון תאי T-ALL של דגי זברה מוכתמים ב-CT-FR
- הכן את הפקדים הבאים למיון התא: ללא בקרת צבע (לא מוכתמת, לא מהונדסת, תרחיף חד-תאי, מדגי זברה מסוג בר), תאי T-ALL עם תווית GFP ותאי דג זברה CT-FR WT שהוכתמו לאחרונה (לקביעת סף מרבי של אות אדום רחוק).
- הכנת בקרות CT-FR לא מוכתמות
- קצרו תאי דגים מסוג בר (WT) על ידי המתת חסד של דג זברה CG1 שלא הושתל על ידי הוספת 1 מ"ל של 4 מ"ג/מ"ל חומר הרדמה בצלוחית פטרי המכילה 9 מ"ל של מי מערכת דגים.
- העבירו את דגי הזברה לצלחת פטרי חדשה והוסיפו 1 מ"ל של מצע דגים כדי לשמש כחיץ לתאים. השתמש בסכין גילוח חדש כדי לערוף תחילה את ראשו ולאחר מכן לערוף את ראשו של דג הזברה באמצעות אותו סכין גילוח; צינור למעלה ולמטה כדי לעקור גושי תאים גדולים.
- מעבירים את התאים דרך מסננת תאים של 40 מיקרומטר לתוך צינור חרוטי של 50 מ"ל כדי להתנתק לתרחיף חד-תאי. שמור את התאים על קרח.
- עבור בקרת CT-FR, להעביר 250,000 תאי WT לתוך צינור מיקרוצנטריפוגה ו pellet את התאים על ידי צנטריפוגה ב 2,500 × גרם במשך 5 דקות בטמפרטורת החדר. הסר את מצע הדגים והוסף 500 μL של 0.9x PBS+ 1% FBS.
- הוסף 0.5 μL של תמיסת מלאי הצבע 1 mM CT-FR לקבלת ריכוז סופי של 1 μM. צינור עדין עם 1,000 μL pipet לערבוב. יש לדגור בטמפרטורה של 37°C למשך 20 דקות, מוגן מפני אור.
- הסר את הנוזל ולשטוף את התאים עם 500 μL של מדיה דגים כדי להסיר את הצבע העודף.
- הוציאו שוב את התאים באמצעות צנטריפוגה, הסירו את הנוזל והשהו מחדש את התאים ב-500 מיקרוליטר של 0.9x PBS+ 1% FBS והעבירו דרך מכסה מסנן של 35 מיקרומטר לתוך צינור FACS. שמור על קרח.
- הכנת צלחת התורם
הערה: לוחית התורם היא לוחית V תחתונה בעלת 96 בארות שלתוכה ימוינו תאי T-ALL המוכתמים ב-CT-FR מדגי זברה מושתלים. כל באר של הצלחת מכילה 5,000 תאי WT CG1 לא מוכתמים ב-50 מיקרוליטר של מצע דגים כדי לשמש כנשא כדי לסייע בהטלת התאים הממוינים בשלבים הבאים.- ספרו 500,000 תאי WT CG1 והעבירו אותם לצינור חרוטי בנפח 15 מ"ל.
- דללו את מלאי התאים הזה ל-100 תאים/מיקרוליטר על ידי הוספת 5 מ"ל של מצע דגים.
- יש לפזר 50 μL של תרחיף התא לכל באר של צלחת 96 בארות. ערבבו את צינור תרחיף התא לאחר כל שורה כדי לשמור על הומוגניות תרחיף התא. שומרים את הצלחת בטמפרטורה של 4°C עד למיון.
- הכנת דגימות הדגים המושתלים
- בחר דגים מושתלים בנטל של 30-40% T-ALL. אספו דגים שהושתלו עם תאים מוכתמים CT-FR ותאי גידול GFP לא מוכתמים.
- קציר תאים כמתואר בסעיף 2.
הערה: מכיוון שהתאים שומרי הצבע צפויים להיות נוכחים בשפע נמוך, התכוננו למיין מספר רב של תאים מדגימת CT-FR GFP. - לדלל לריכוז מתאים למיון ~ 3-5 × 106 תאים / מ"ל ב 0.9x PBS + 1% FBS ולעבור דרך מכסה מסנן 35 מיקרומטר לתוך צינור FACS. הוסף DAPI (1 מ"ג/מ"ל) בדילול 1:1,000 כצבע חיוני כדי לא לכלול תאים מתים. שמור על קרח.
- עבור תאי גידול GFP לא מוכתמים, להעביר 250,000 תאים לתוך צינור מיקרוצנטריפוגה גלולה ב 2,500 × גרם במשך 5 דקות בטמפרטורת החדר. הסר את מצע הדגים, הוסף 500 μL של PBS, והעבר דרך מכסה מסנן 35 מיקרומטר לתוך צינור FACS. שמור על קרח.
6. מיון
הערה: יש לשמור את כל הצינורות ואת צלחת התורם על קרח כל הזמן, למעט כאשר משתמשים בהם למיון.
- למיון פרמטרים ושערים, התחל בהחלת Gating פיזור קדימה וצד כדי לזהות את התאים המעניינים בהתבסס על גודלם ולסלק פסולת תאים. לאחר מכן, השתמש בגובה פיזור קדימה לעומת אזור פיזור קדימה כדי לא לכלול תאים כפולים ולשמור רק סינגלטים. לבסוף, השתמש בפקדים ללא צבע ובצבע יחיד כדי לצייר את הרבעים כדי לזהות אוכלוסיות תאים חיוביות ל- GFP ו- CT-FR.
הערה: בקרת CT-FR צפויה להיות בהירה בהרבה מהדגימות למיון מכיוון שהצביעה לבקרה נעשתה טרייה ללא חלוקות תאים; תאים מדגימות CT-FR GFP צפויים להופיע בקצה התחתון של השער החיובי של CT-FR. - מיין את מספר התאים שיושתלו בכל דג לבאר אחת של צלחת התורם.
הערה: עבור ניסוי זה, השתמשנו בבדיקת דילול מגבילה כדי להעריך את התדירות של תאי גזע לוקמיה ב- CT-FR גבוה ו- CT-FR נמוך. בדיקה זו השתמשה במינון של 25 תאים, שהושתלו ב-3 בעלי חיים, ובמינון של 10 תאים, שהושתלו ב-10 בעלי חיים. בדיקת דילול מגבילה טיפוסית באמצעות דג הזברה rag2:Myc-all תכלול קבוצה עם מספר גבוה יותר של תאים (500 או 1,000) מכיוון שתדר LSC במודל זה מוערך כ- 1 LSC במאות תאים. עם זאת, בבדיקה זו, אנו משתמשים באחד השיבוטים של T-ALL שתוארו בעבר על ידי Blackburn et al.15. תדר LSC במדגם המשמש כאן הוא ~ 1 LSC בעשרות תאים; אנו צופים כי לוקמיה תתגלה בבעלי חיים שהושתלו בקבוצת 25 התאים. בעת אופטימיזציה של בדיקה זו עבור מודל המחלה שלך, יש לנקוט בזהירות בעת בחירת קבוצת מספר התאים הגבוה יותר כדי להבטיח את קליטת הגידול. - לאחר המיון, שומרים את הצלחת על קרח עד שהיא מוכנה להשתלה.
הערה: הליכי מיון יכולים להיות מלחיצים ולהשפיע על כדאיות התא. לפני ביצוע ניסוי הדילול המגביל בפועל, נעשה ניסוי מיון פיילוט. תאים ממוינים הושתלו ובוצע מעקב אחר התפתחות לוקמיה כדי לקבוע אם המיון מזיק ליכולת הקיום של התא. לחלופין, ניתן להעריך את כדאיות התאים על ידי צביעת התאים הממוינים בכחול טריפאן ובדיקתם תחת המיקרוסקופ לפני ההשתלה.
7. השתלת תאים ממוינים בהגבלת דילול ומעקב אחר הופעת הגידול
- סובבו את הצלחת כלפי מטה באמצעות צנטריפוגה גדולה בטמפרטורה של 2,500 × גרם ב-4°C.
- הוציאו בזהירות 45 μL של הסופרנאטנט מכל באר, השאירו 5 μL נוזל מאחור והקפידו להימנע מלגעת בכדורית התא בתחתית הבאר.
- להשעות את התאים עם pipet 20 μL. יש להשהות מחדש 2-3 בארות עם הפיפט ולאחר מכן באמצעות מזרק המיקרוליטר של המילטון, להזריק את מתלי התאים מכל באר למספר הרצוי של דגי זברה CG1 באמצעות השתלת IP. לאחר מכן, להשעות מחדש את התאים בקבוצה הבאה של בארות כדי למנוע התיישבות מחדש של התאים.
- בדוק את דג הזברה במיקרוסקופ פלואורסצנטי תחת טשטוש פעם בשבוע להתפתחות T-ALL במשך 6 שבועות לפחות.
8. קביעת תדירות תאי גזע לוקמיה
- רשום את מספר בעלי החיים החיוביים למנת תא וקבוצת טיפול לאחר 6 שבועות לאחר ההשתלה, תוך התחשבות בבעלי חיים עם כל כמות של אות GFP כחיוביים. קחו בחשבון בעלי חיים שיש להם נטל לוקמיה משמעותי כאשר אות GFP תופס >50% מהגוף.
- השתמש בתוכנה הסטטיסטית מבוססת האינטרנט ELDA (Extreme Limiting Dilution Analysis) (http://bioinf.wehi.edu.au/software/elda/)19 כדי לחשב את התדירות של LSCs בכל אוכלוסיית תאים.
הערה: איור סכמטי של זרימת העבודה מוצג באיור 1.
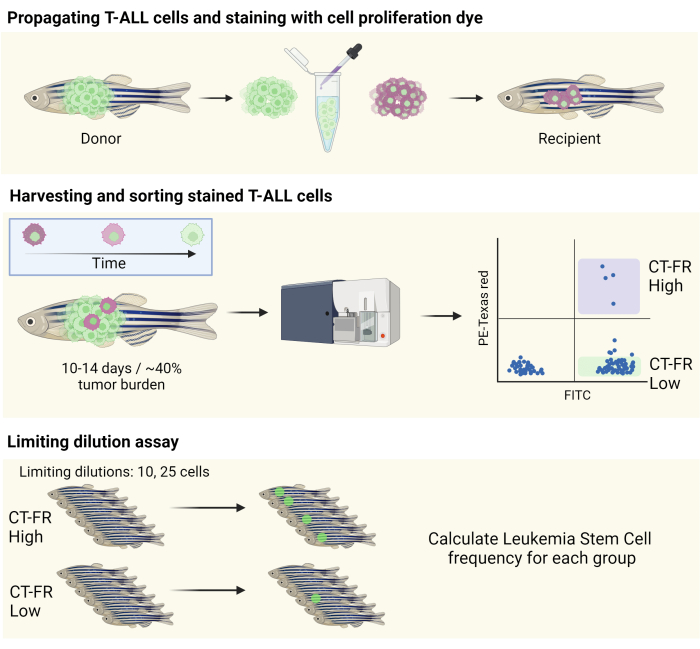
איור 1: זרימת עבודה לשימוש בכתם מעקב אחר תאים כדי לבודד תאים שקטים במודל T-ALL של דגי הזברה. המחשה סכמטית של צביעת תאי T-ALL של דגי זברה עם כתם התפשטות התא, התפשטות לדג זברה CG1 (פאנל עליון), ומיון תאים על בסיס שימור כתם התפשטות התאים (פאנל אמצעי). תאים שנאספו שימשו לבדיקת דילול מגבילה כדי לקבוע את התדירות של LSCs (לוח תחתון). קיצורים: T-ALL = לוקמיה לימפובלסטית חריפה של תאי T; LSCs = תאי גזע לוקמיים; CT-FR = CellTrace אדום רחוק; FITC = isothiocyanate fluorescein; PE = phycoerythrin. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
עקבנו אחר הפרוטוקול המתואר לעיל כדי למיין תאים ששמרו על צבע התפשטות התא, CT-FR, והשתמשנו בהם לבדיקת דילול מגביל (LDA) כדי להעריך את תדירות LSC באוכלוסיות CT-FR High ו- CT-FR Low. כדי להגדיר את הגאטינג לניסוי ציטומטריית הזרימה, השתמשנו בפקד ללא פלואורופור (ללא צבע) בנוסף לבקרות בצבע יחיד <...
Discussion
LSCs ידועים כעמידים לטיפולים כימותרפיים קונבנציונליים ואנטי-שגשוגיים, ומציאת טיפולים ממוקדים נגד תאים אלה טומנת בחובה הבטחה גדולה בהפחתת התרחשות הישנות ושיפור פרוגנוזה20 של המטופל. מחקר קודם תיאר את השימוש בכתמי התפשטות תאים פלואורסצנטיים כדי לזהות אוכלוסי...
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
המימון למחקר זה ניתן על ידי המכון הלאומי לסרטן (R37CA227656 ל-JSB). מחקר זה נתמך גם על ידי Flow Cytometry and Immune Monitoring Shared Resources of the University of Kentucky Markey Cancer Center (P30CA177558).
Materials
| Name | Company | Catalog Number | Comments |
| 26 G/2” micro-syringe | Hamilton | 87930 | NA |
| 35 µm filter cap FACS tubes | Falcon | 352235 | NA |
| 40 µm cell strainer | CELLTREAT | 229482 | NA |
| 96-well skirted PCR plate | Thermo Fisher Scientific | AB0800 | NA |
| Cell sorter | Sony Biotechnology | SY3200 | NA |
| CellTrace Far Red | Thermo Fisher Scientific | C34564 | NA |
| Conical tubes | VWR | 10026-078 | NA |
| DAPI | Thermo Fisher Scientific | 62248 | NA |
| DMSO | Sigma-Aldrich | D4818 | NA |
| Dulbecco'sPhosphate-buffered saline (PBS) | Caisson Labs | 22110001 | NA |
| Epifluorescence stereo microscope | Nikon | SMZ25 | NA |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | 12306C | NA |
| Fish system water | N/A | N/A | 0.03-0.05% salinity, pH 6.5-8, buffered with sodium bicarbonate |
| Microcentrifuge tubes | Thermo Fisher Scientific | C2171 | NA |
| MS-222 | Pentaire | TRS-1 | tricaine mesylate, an anesthetic |
| Petri dishes | Corning | 07-202-011 | NA |
| Razor blades | American Line | 66-0089 | NA |
| Trypan Blue | Thermo Fisher Scientific | T10282 | NA |
References
- Reya, T., Morrison, S. J., Clarke, M. F., Weissman, I. L. Stem cells, cancer, and cancer stem cells. Nature. 414 (6859), 105-111 (2001).
- Arai, F., et al. Tie2/angiopoietin-1 signaling regulates hematopoietic stem cell quiescence in the bone marrow niche. Cell. 118 (2), 149-161 (2004).
- Li, L., Bhatia, R. Stem cell quiescence. Clin. Cancer Res. 17 (15), 4936-4941 (2011).
- Kreso, A., Dick, J. E. Evolution of the cancer stem cell model. Cell Stem Cell. 14 (3), 275-291 (2014).
- Chen, W., Dong, J., Haiech, J., Kilhoffer, M. -. C., Zeniou, M. Cancer stem cell quiescence and plasticity as major challenges in cancer therapy. Stem Cells Int. 2016, 1740936 (2016).
- Kleffel, S., Schatton, T. Tumor dormancy and cancer stem cells: Two sides of the same coin. Adv Exp Med Biol. 734, 145-179 (2013).
- Tuy, K., Rickenbacker, L., Hjelmeland, A. B. Reactive oxygen species produced by altered tumor metabolism impacts cancer stem cell maintenance. Redox Biol. 44, 101953 (2021).
- Zhou, B. -. B. S., et al. Tumour-initiating cells: Challenges and opportunities for anticancer drug discovery. Nat Rev Drug Discov. 8 (10), 806-823 (2009).
- Lyons, A. B., Blake, S. J., Doherty, K. V. Flow cytometric analysis of cell division by dilution of cfse and related dyes. Curr Protoc Cytom. 64 (1), 11-12 (2013).
- Lyons, A. B. Analysing cell division in vivo and in vitro using flow cytometric measurement of cfse dye dilution. J Immunol Methods. 243 (1-2), 147-154 (2000).
- Azari, H., Deleyrolle, L. P., Reynolds, B. A. Using carboxy fluorescein succinimidyl ester (cfse) to identify quiescent glioblastoma stem-like cells. Methods Mol Biol. 1686, 59-67 (2018).
- Deleyrolle, L. P., Rohaus, M. R., Fortin, J. M., Reynolds, B. A., Azari, H. Identification and isolation of slow-dividing cells in human glioblastoma using carboxy fluorescein succinimidyl ester (cfse). J Vis Exp. (62), e3918 (2012).
- Ebinger, S., et al. Characterization of rare, dormant, and therapy-resistant cells in acute lymphoblastic leukemia. Cancer Cell. 30 (6), 849-862 (2016).
- Langenau, D. M., et al. Myc-induced t cell leukemia in transgenic zebrafish. Science. 299 (5608), 887-890 (2003).
- Blackburn, J. S., et al. Clonal evolution enhances leukemia-propagating cell frequency in t cell acute lymphoblastic leukemia through akt/mtorc1 pathway activation. Cancer Cell. 25 (3), 366-378 (2014).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24 (3), 2288 (2023).
- Blackburn, J. S., Liu, S., Langenau, D. M. Quantifying the frequency of tumor-propagating cells using limiting dilution cell transplantation in syngeneic zebrafish. J Vis Exp. (53), e2790 (2011).
- Borga, C., et al. Simultaneous b and t cell acute lymphoblastic leukemias in zebrafish driven by transgenic myc: Implications for oncogenesis and lymphopoiesis. Leukemia. 33 (2), 333-347 (2019).
- Hu, Y., Smyth, G. K. Elda: Extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. J Immunol Methods. 347 (1-2), 70-78 (2009).
- Bhojwani, D., Pui, C. -. H. Relapsed childhood acute lymphoblastic leukaemia. Lancet Oncol. 14 (6), e205-e217 (2013).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nat Rev Drug Discov. 4 (1), 35-44 (2005).
- Al-Hamaly, M. A., et al. Zebrafish drug screening identifies erlotinib as an inhibitor of wnt/β-catenin signaling and self-renewal in t-cell acute lymphoblastic leukemia. Biomed Pharmacother. 170, 116013 (2024).
- Yan, C., et al. Visualizing engrafted human cancer and therapy responses in immunodeficient zebrafish. Cell. 177 (7), 1903-1914 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved