JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
세포 증식 염색을 사용한 제브라피시 T 세포 급성 림프모구성 백혈병 모델에서 정지 세포 식별
요약
우리는 세포 증식 염색을 사용하여 제브라피시 T-급성 림프모구성 백혈병 모델에서 정지 세포를 식별했습니다. 염색은 분열하지 않는 세포에 유지되고 세포 증식 중에 감소하여 추가 조사를 위해 휴면 세포를 선택할 수 있습니다. 이 프로토콜은 세포 정지의 맥락에서 자가 재생을 연구하기 위한 기능적 도구를 제공합니다.
초록
세포 정지는 정상 및 암 줄기 세포(CSC)에 설명된 성장 정지 또는 느린 증식 상태입니다. Quiescence는 항증식성 화학 요법 약물로부터 CSC를 보호할 수 있습니다. T세포 급성 림프모구성 백혈병(T-ALL) 환자 유래 이종이식(PDX) 마우스 모델에서 정지 세포는 치료 저항성 및 줄기 농도와 관련이 있습니다. 세포 증식 염료는 세포 분열을 추적하는 데 널리 사용되는 도구입니다. 형광 염료는 세포막의 아민기와 세포 내부의 거대분자에 공유 결합되어 있습니다. 이를 통해 최대 10개의 분열에 대해 라벨링된 세포를 추적할 수 있으며, 이는 유세포 분석으로 해결할 수 있습니다.
궁극적으로 증식 속도가 가장 높은 세포는 세포 분열할 때마다 희석되기 때문에 염료 유지율이 낮고, 휴면 상태이며 분열 속도가 느린 세포는 가장 높은 유지력을 갖습니다. 휴면 세포를 분리하기 위한 세포 증식 염료의 사용은 T-ALL 마우스 모델에서 최적화되고 설명되었습니다. 기존 마우스 모델을 보완하는 rag2:Myc 유래 제브라피시 T-ALL 모델은 백혈병 줄기세포(LSC)의 빈도가 높고 대규모 이식 실험을 위한 제브라피시의 편리성으로 인해 T-ALL에서 자가 재생을 조사할 수 있는 훌륭한 장소를 제공합니다.
여기에서는 세포 증식 염료를 사용한 제브라피시 T-ALL 세포 염색, 제브라피시 세포의 염료 농도 최적화, 성공적으로 염색된 생체 내 세포 패시에이지, 이식된 동물에서 살아있는 세포 분류를 통해 다양한 염료 머무름 수준을 가진 세포 수집을 위한 워크플로우에 대해 설명합니다. T-ALL에 LSC에 대한 잘 정립된 세포 표면 메이커가 없다는 점을 감안할 때, 이 접근 방식은 생체 내에서 정지 세포를 조사할 수 있는 기능적 수단을 제공합니다. 대표적인 결과를 위해, 우리는 생착 효율과 고농도 및 저염료 보유 세포의 LSC 빈도를 설명합니다. 이 방법은 약물 반응, 전사 프로필 및 형태를 포함한 정지 세포의 추가 특성을 조사하는 데 도움이 될 수 있습니다.
서문
성체 줄기세포는 주어진 장기에서 분화된 세포 유형의 재생을 담당하며, 주로 휴면 상태, 분열하지 않는 상태로 존재한다 1,2. 예를 들어, 혈액을 유지하는 조혈모세포(hematopoietic stem cell, HSC)는 대부분 정지 상태를 유지하며, 극히 일부만이 세포주기에 들어가 자가 재생하거나 분화하여 성숙한 혈액 성분을 생성한다3. 이와 유사하게, 암의 경우, 암 줄기세포(cancer stem cell, CSCs)라고 불리는 희귀한 세포의 하위 집단(subpopulation)이 자가 재생 능력을 가지고 있으며, 악성 종양의 장기 유지를 담당한다4. 암 줄기세포는 생체 내에서 정지 상태 또는 느린 성장 상태로 존재하며, 이로 인해 항증식성 암 치료5를회피하고, 면역 체계의 제거를 회피하고6, 산화 스트레스를 줄이고, DNA 복구 경로를 향상시킬 수있다7. 치료 후 남겨진 CSC의 수가 적어도 종양이 다시 증식할 수 있으며, 이로 인해 환자의 재발이 발생할 수 있다8. 따라서 셀룰러 정지를 이해하는 것은 CSC의 잠재적 취약성을 식별하고 이를 표적으로 하는 새로운 방법을 개발하는 데 큰 가능성을 제공합니다.
카르복시플루오레세인 숙시니미딜 에스테르(carboxyfluorescein succinimidyl ester, CFSE) 염색 및 그 유도체와 같은 세포 증식 염료는 세포 분열 빈도를 추적하는 데 일반적으로 사용된다9. 염료는 세포막을 가로질러 투과되며 세포 내부로 들어가면 세포 내 에스테라아제에 의해 활성화되어 형광 생성물이 됩니다. 생성된 형광 화합물은 세포내 단백질(10)의 숙시니미딜 부분과 아민 작용기 사이에 형성된 공유 아미드 결합을 통해 세포 내부에 유지됩니다. 각 세포 분열과 함께 형광 화합물은 생성된 두 세포 사이에서 균등하게 분할되어 2배 신호 희석을 일으킵니다. 이 염료는 유세포 분석11을 통해 최대 10개의 세포 분열을 검출할 수 있습니다.
이 접근법은 이전에 염료11,12의 높은 머무름을 가진 세포의 느린 순환 집단을 식별함으로써 시험관 내에서 CSC 집단을 농축하는 데 사용되었습니다. T-ALL에서 CFSE는 마우스의 환자 유래 이종이식에서 생체 내 종양 성장을 추적하는 데 사용되었습니다. 세포 라벨링과 3주간의 이식 후 유세포 분석 결과 CFSE 형광을 여전히 유지하는 드문 세포 집단이 나타났습니다. 이 집단은 환자에서 줄기세포, 치료 저항성, 재발 유발 세포와의 높은 유사성과 관련이 있었다13. 따라서 이 염료는 T-ALL에서 백혈병 줄기세포(LSC) 표현형을 연구하는 데 유용한 도구를 제공합니다.
이 연구의 목적은 제브라피시 T-ALL 모델을 사용하여 생체 내 정지를 연구하기 위해 세포 증식 염료의 적용을 확장하는 것입니다. 특히, rag2:Myc-driven zebrafish T-ALL model14 는 마우스 모델 및 인간 질병15에 비해 LSC의 빈도가 높기 때문에 자가 재생 연구를 위한 훌륭한 장소를 제공한다. 또한, 제브라피시를 사용하면 대규모 이식 연구가 가능하며, 이는 생쥐에 비해 훨씬 저렴한 관리 및 유지 관리 비용으로 수행할 수 있습니다16. 제브라피쉬는 간단한 형광 현미경을 사용하여 종양 발생 속도를 추정하기 위해 형광 표지된 종양 세포를 쉽게 볼 수 있기 때문에 실시간 이미징 응용 분야에도 탁월합니다16.
이 프로토콜에서는 세포 증식 염료로 제브라피시 T-ALL 세포를 염색한 후 합성 CG1 제브라피시에서 염색된 세포의 생체 내 증식을 수행하는 워크플로우를 설명합니다. 백혈병 발병 시, 염료를 유지한 세포의 분류와 LSC 자가 재생률을 정량화하기 위한 후속 제한 희석 이식 실험에 사용하는 방법에 대해 설명합니다. 이 프로토콜은 정지 LSC를 표적으로 하기 위한 잠재적 화합물의 생체 내 약물 스크리닝을 포함한 추가 응용 분야로 확장될 수 있습니다. 또한 수집된 세포는 전사체 프로파일링, 단백질체학 및 대사체학과 같은 다양한 다운스트림 분석에 사용할 수 있으며, T-ALL에서 정지 LSC의 거동에 대한 고유한 통찰력을 제공합니다.
프로토콜
이 프로토콜에서는 이전에 CG1 균주에서 생성된 GFP 표지 제브라피시 T-ALL 세포를 사용하여 수혜자 합성 CG1 제브라피시15에 직접 주입할 수 있습니다. 간단히 말해서, 백혈병은 단세포 CG1 제브라피시 배아에 rag2:Myc 및 rag2:GFP 의 DNA 미세 주입에 의해 생성되었습니다. 동물은 형광 현미경을 사용하여 주사 후 3주부터 백혈병 발병을 모니터링했습니다. GFP 양성 백혈병 세포를 FACS로 분리하고 수혜자 CG1 제브라피시에 연속적으로 이식하여 고빈도의 LSC를 가진 클론을 생성했습니다. 전체 프로토콜에 대한 자세한 내용은 Blackburn et al.15에 설명되어 있습니다.
대안적으로, 1차 rag2:Myc-유래 T-ALL은 제브라피시 배아17의 DNA 미세주입에 의해 생성될 수 있다. GFP와 같은 rag2 기반 형광 리포터를 사용하여 rag2:Myc 의 DNA 미세 주입은 B 세포, T 세포 및 혼합 ALL18의 발달을 초래할 수 있습니다. 이 프로토콜에 사용된 백혈병 클론은 이전에 T-ALL15로 확인되었습니다. 제브라피시와 관련된 모든 실험 절차는 켄터키 대학교의 기관 동물 관리 및 사용 위원회(프로토콜 2019-3399)의 검토 및 승인을 받았습니다.
1. in vivo 제브라피시 T-ALL 세포 증식
- 1mL의 냉동 GFP 표지 제브라피시 T-ALL 세포가 들어 있는 바이알 1개를 37°C 수조에서 부드럽게 흔들어 해동할 때까지 해동합니다. 해동이 끝나면 얼음으로 옮깁니다.
- 튜브의 내용물을 4mL의 생선 배지(0.9x PBS + 5% FBS)가 있는 15mL 원뿔형 튜브에 천천히 피펫팅하여 동결 매체를 희석합니다.
- 4°C에서 2,500× g 에서 5분 동안 스핀 다운합니다. 펠릿에서 매체를 제거합니다. 0.5mL의 생선 배지에 재현탁시키고 세포를 얼음 위에 유지합니다.
- 세포를 세고 필요한 경우 100,000 cells/5 μL로 희석합니다.
- 페트리 접시에 200mL의 어류 시스템 물 25mL에 4mg/mL 마취제(MS-222) 25μL를 첨가하여 성인 CG1 제브라피시를 마취합니다. CG1 물고기를 복부 쪽이 위로 향하게 잡고 Hamilton 마이크로리터 주사기를 사용하여 복강내(IP) 공간에 5-6μL를 주입합니다. 동물을 수조로 다시 옮기고 시스템에 다시 넣기 전에 정상적인 수영으로 돌아가는지 모니터링합니다.
참고: 60일 이상의 성인 제브라피시가 이 프로토콜에 설명된 이식 연구에 사용되었습니다. - 형광 현미경을 사용하여 일주일에 한 번 백혈병 성장을 모니터링합니다. 심사 절차에 대한 자세한 내용은 아래 섹션 2를 참조하십시오.
2. 형광 표지된 백혈병 세포의 채취
- 이식 후 약 21-28일 후, 페트리 접시에 25mL의 어류 시스템 물에 4mg/mL 마취제 200μL(4-5방울)를 첨가하여 성인 CG1 제브라피시를 마취합니다.
- GFP 형광을 검출하기 위해 적절한 필터를 사용하여 epifluorescent microscope로 동물에서 GFP 표지된 백혈병 세포의 비율을 평가하여 CG1 제브라피시의 백혈병 부담을 검사합니다. GFP 양성 백혈병은 동물의 >70%에 퍼진 경우 수확할 준비가 된 것입니다.
- 9mL의 어류 시스템 물이 들어있는 페트리 접시에 4mg/mL 마취제 1mL를 추가하여 동물을 안락사시킵니다. 생명의 모든 징후가 멈추게 하십시오. 예를 들어, 물고기가 수술 움직임이 멈추는지 관찰하십시오 (~ 5 분).
- 제브라피시를 새 페트리 접시에 옮기고 세포의 완충액 역할을 할 생선 배지 1mL를 추가합니다. 새 면도날을 사용하여 먼저 제브라피시의 목을 베고 동일한 면도날을 사용하여 조직을 침수합니다. 큰 세포 덩어리를 제거하기 위해 위아래로 피펫을 만듭니다.
- 40μm 세포 여과기를 통해 세포를 50mL 코니컬 튜브에 통과시켜 단일 세포 현탁액으로 해리합니다. 세포를 얼음 위에 두십시오.
3. 염색 및 제브라피시 세포 생존율을 위한 세포 증식 염료(CellTrace Far Red) 농도 최적화
참고: 이 프로토콜의 경우 종양 세포가 GFP 라벨링되어 있기 때문에 CT-FR이라고 하는 스펙트럼 중복을 피하기 위해 원적색 세포 증식 염료(CellTrace Far Red)를 사용했습니다.
- 제조업체의 권장 사항에 따라 적절한 양의 DMSO를 추가하여 사용 직전에 형광 염료 1mM 용액을 준비합니다. 1mM, 0.5mM, 0.1mM 및 0.01mM의 작업 솔루션이 있습니다. 염색 후 세포 생존력을 테스트하기 위해 필요에 따라 어류 배지에 희석합니다.
- 세포 수를 세고 1.5mL 미세 원심분리 튜브에 1 × 106 개의 세포를 수집합니다.
- 4°C에서 2,500× g 으로 5분 동안 원심분리기 액체를 제거하고 세포를 0.9x PBS 1mL에 재현탁시킵니다.
- CT-FR로 처리하기 위해 세포 현탁액을 각각 250μL의 튜브 4개로 분할합니다.
- 250 μL의 0.9x PBS를 추가하여 약 250,000개의 세포/튜브로 각각 500 μL의 부피를 만듭니다.
- 위에서 설명한 작업 용액의 필요한 양을 4개의 튜브 각각에 추가하여 1μM, 0.5μM, 0.1μM 및 0.05μM의 최종 농도를 얻습니다. 빛으로부터 보호된 37°C에서 20분 동안 배양합니다.
- 실온에서 2,500 × g 에서 5분 동안 회전시켜 세포를 펠렛화합니다. 액체를 제거하고 500μL의 생선 배지로 세포를 세척하여 과도한 염료를 제거합니다.
- 다시 펠렛하고 액체를 제거한 다음 25μL의 어류 배지에 재현탁시킵니다. 1 μL를 사용하여 50% 트리판 블루로 1:10 희석하여 세포를 계수합니다.
- 세포 생존력을 위해 현미경으로 세포를 검사합니다. 살아있는 세포는 트리판 블루를 유지하지 않고 현미경으로 볼 때 밝게 보이는 반면, 죽은 세포는 염료를 흡수하여 어둡게 보입니다. 먼저 적절한 형광 채널 아래의 세포를 검사하여 종양 세포를 식별한 다음 명시야 채널을 사용하여 세포 생존율을 평가합니다.
- 세포 생존율을 유지하면서 성공적인 염색을 할 수 있는 농도를 선택합니다(>90% 트리판 블루-음성 세포).
참고: 이 실험에서 테스트한 제브라피시 T-ALL 세포의 경우 성공적인 염색을 위해 1μM 농도가 사용되었으며 세포 생존율의 >90%가 사용되었습니다.
4. 생체 내에서 CT-FR 염색된 T-ALL 제브라피시 세포 증식
- 섹션 3에서 최적화된 CT-FR 농도를 사용하여 제브라피시 세포를 염색합니다. FACS 분류 중 GFP 양성 대조군으로 GFP 표지 T-ALL 종양의 생성을 위해 일부 종양 세포를 염색하지 않은 상태로 둡니다. 이식을 위해 염색된 세포와 염색되지 않은 세포를 모두 50,000 cells/5 μL로 희석합니다.
- 페트리 접시에 200mL의 어류 시스템 물 25mL에 4mg/mL 마취제 200μL를 추가하여 성인 CG1 제브라피시를 마취합니다.
- 염색된 세포와 염색되지 않은 세포 모두에 대해 섹션 1에 설명된 대로 세포 현탁액 5μL를 제브라피시의 IP 구멍에 주입합니다. 주사 후 잠재적인 사망률을 고려하기 위해 그룹당 5-6마리의 제브라피시를 주입합니다.
- 백혈병 발병을 위해 매주 2회 진정제 하에 형광 현미경으로 동물을 검사합니다.
참고: ~10-14일 후, 백혈병은 이 몸의 약 30-40%를 차지해야 합니다. 이 기간 내에 백혈병 수확 및 후속 분류를 계획하십시오. 종양이 큰 크기로 확장될 때까지 기다리면 형광 세포 염료가 더 많이 희석되고 신호를 감지하기 어려울 수 있습니다. 선택한 종양 모델에 대한 종양 수확 시기의 최적화를 고려하십시오. 또한 원하는 종양 크기를 캡처하기 위해 더 자주 종양을 모니터링하는 것이 좋습니다.
5. CT-FR 염색 제브라피시 T-ALL 세포 분류 준비
- 세포 분류를 위해 다음 컨트롤을 준비합니다: 색상 제어 없음(야생형 제브라피시에서 추출한 염색되지 않은, 비유전자 변형, 단일 세포 현탁액), GFP-Labeled T-ALL 세포 및 새로 염색된 CT-FR WT 제브라피시 세포(Far-Red 신호의 최대 임계값 설정용).
- 염색되지 않은 대조군 및 CT-FR 대조군 준비
- 9mL의 어류 시스템 물이 들어 있는 페트리 접시에 4mg/mL 마취제 1mL를 추가하여 이식되지 않은 CG1 제브라피시를 안락사시켜 야생형(WT) 어류 세포를 수확합니다.
- 제브라피시를 새 페트리 접시에 옮기고 세포의 완충액 역할을 할 생선 배지 1mL를 추가합니다. 새 면도날을 사용하여 먼저 목을 베고 동일한 면도날을 사용하여 제브라피시를 침식시키십시오. 큰 세포 덩어리를 제거하기 위해 위아래로 피펫을 만듭니다.
- 40μm 세포 여과기를 통해 세포를 50mL 코니컬 튜브에 통과시켜 단일 세포 현탁액으로 해리합니다. 세포를 얼음 위에 두십시오.
- CT-FR 제어의 경우 250,000 WT 세포를 마이크로 원심분리 튜브에 옮기고 실온에서 2,500 × g 에서 5분 동안 원심분리하여 세포를 펠트합니다. 생선 매체를 제거하고 500μL의 0.9x PBS+ 1% FBS를 추가합니다.
- 최종 농도 1μM를 위해 1mM CT-FR 염료 원액 0.5μL를 추가합니다. 1,000μL 피펫으로 부드럽게 피펫하여 혼합합니다. 빛으로부터 보호된 상태에서 37°C에서 20분 동안 배양합니다.
- 액체를 제거하고 500μL의 생선 배지로 세포를 세척하여 과도한 염료를 제거합니다.
- 원심분리로 세포를 다시 펠렛화하고 액체를 제거한 다음 세포를 0.9x PBS+ 1% FBS 500μL에 재현탁시키고 35μm 필터 캡을 통해 FACS 튜브로 통과시킵니다. 얼음 위에 두십시오.
- 기증자 플레이트 준비
참고: 기증자 플레이트는 이식된 제브라피시에서 CT-FR 염색된 T-ALL 세포를 분류하는 96웰 V-바닥 플레이트입니다. 플레이트의 각 웰에는 50μL의 어류 배지에 5,000개의 염색되지 않은 WT CG1 세포가 들어 있어 후속 단계에서 분류된 세포를 펠릿화하는 데 도움이 되는 운반체 역할을 합니다.- 500,000 WT CG1 세포를 계수하여 15mL 코니컬 튜브에 전달합니다.
- 5mL의 생선 배지를 추가하여 이 세포 스톡을 100세포/μL로 희석합니다.
- 50μL의 셀 현탁액을 96웰 플레이트의 각 웰에 분주합니다. 세포 현탁액 균질성을 유지하기 위해 각 행 뒤에 세포 현탁액 스톡 튜브를 혼합합니다. 분류할 때까지 플레이트를 4°C로 유지하십시오.
- 이식된 물고기 샘플 준비
- 30-40% T-ALL 부담으로 이식된 물고기를 선택하십시오. CT-FR 염색 세포와 염색되지 않은 GFP 종양 세포를 모두 이식한 물고기를 수집합니다.
- 섹션 2에 설명된 대로 세포를 채취합니다.
참고: 염료 보유 세포는 소량으로 존재할 것으로 예상되므로 CT-FR GFP 샘플에서 많은 수의 세포를 분류할 준비를 하십시오. - 0.9x PBS + 1% FBS에서 ~3-5 × 106 cells/mL를 분류하기 위한 적절한 농도로 희석하고 35μm 필터 캡을 통해 FACS 튜브에 통과시킵니다. 1:1,000 희석액으로 DAPI(1mg/mL)를 필수 염료로 첨가하여 죽은 세포를 배제합니다. 얼음 위에 두십시오.
- 염색되지 않은 GFP 종양 세포의 경우 250,000개의 세포를 마이크로 원심분리기 튜브에 넣고 실온에서 5분 동안 2,500× g 의 펠릿으로 이송합니다. 생선 배지를 제거하고 500μL의 PBS를 추가한 다음 35μm 필터 캡을 통해 FACS 튜브에 넣습니다. 얼음 위에 두십시오.
6. 정렬
알림: 분류에 사용할 때를 제외하고 모든 튜브와 기증자 플레이트를 얼음 위에 두십시오.
- 파라미터와 게이트를 정렬하려면 먼저 전방 및 측면 산란 게이팅을 적용하여 크기에 따라 관심 세포를 식별하고 세포 파편을 제거합니다. 다음으로, 전방 분산 높이와 전방 분산 영역을 사용하여 중복 셀을 제외하고 단일 셀만 유지합니다. 마지막으로, no-color 및 single-color 컨트롤을 사용하여 GFP 양성 및 CT-FR 양성 세포 집단을 식별하기 위한 사분면을 그립니다.
참고: CT-FR 대조군은 대조군의 염색이 세포 분열 없이 신선하게 이루어졌기 때문에 분류를 위한 샘플보다 훨씬 밝을 것으로 예상됩니다. CT-FR GFP 샘플의 세포는 CT-FR 양성 게이트의 하단에 나타날 것으로 예상됩니다. - 각 물고기에 이식할 세포의 수를 기증자 플레이트의 한 웰로 분류합니다.
참고: 이 실험에서는 제한 희석 분석을 사용하여 CT-FR High 및 CT-FR Low에서 백혈병 줄기 세포의 빈도를 추정했습니다. 이 분석은 3 마리의 동물에 이식 된 25 개의 세포와 10 마리의 동물에 이식 된 10 개의 세포를 사용했습니다. 제브라피시 rag2:Myc 유래 T-ALL을 사용하는 일반적인 제한 희석 분석에는 이 모델의 LSC 빈도가 수백 개의 세포에서 1 LSC로 추정되기 때문에 세포 수가 더 많은 그룹(500 또는 1,000)이 포함됩니다. 그러나, 이 분석에서는, 우리는 이전에 Blackburn et al.15에 의해 기술된 T-ALL 클론 중 하나를 사용하고 있다. 여기에 사용된 샘플의 LSC 주파수는 수십 개의 셀에서 ~1 LSC입니다. 우리는 25개의 세포군에 이식된 동물에서 백혈병이 검출될 것으로 예측합니다. 질병 모델에 대해 이 분석을 최적화할 때 종양의 생착을 보장하기 위해 더 높은 세포 수 그룹을 선택할 때 주의를 기울여야 합니다. - 분류 후 이식 준비가 될 때까지 접시를 얼음 위에 두십시오.
참고: 분류 절차는 스트레스가 많을 수 있으며 세포 생존력에 영향을 미칠 수 있습니다. 실제 제한 희석 실험을 실행하기 전에 파일럿 선별 실험이 수행되었습니다. 분류된 세포를 이식하고 백혈병 발병을 모니터링하여 분류가 세포 생존력에 해로운지 확인했습니다. 또는 분류된 세포를 Trypan blue로 염색하고 이식 전에 현미경으로 검사하여 세포 생존율을 평가할 수 있습니다.
7. 희석을 제한하고 종양 발병을 추적하면서 분류된 세포를 이식합니다.
- 4°C에서 2,500× g 의 대형 탁상형 원심분리기를 사용하여 플레이트를 회전시킵니다.
- 각 웰에서 45μL의 상층액을 조심스럽게 제거하고 5μL의 액체를 남기고 웰 바닥의 세포 펠릿을 만지지 않도록 합니다.
- 20μL 피펫으로 세포를 재현탁시킵니다. 피펫으로 2-3 웰을 재현탁 한 다음 Hamilton 마이크로 리터 주사기를 사용하여 각 웰의 세포 현탁액을 IP 이식을 통해 원하는 수의 CG1 제브라피시에 주입합니다. 그런 다음 세포가 재정착하는 것을 방지하기 위해 다음 웰 그룹에 세포를 재현탁시킵니다.
- 최소 6주 동안 T-ALL 발달을 위해 매주 한 번 진정제 하에 형광 현미경으로 제브라피시를 검사합니다.
8. 백혈병 줄기세포 빈도 측정
- 이식 후 6주에 세포 용량 및 치료군당 양성 동물의 수를 기록하고 GFP 신호의 양이 있는 동물을 양성으로 간주합니다. GFP 신호가 신체의 >50%를 차지할 때 동물이 상당한 백혈병 부담을 가지고 있다고 생각하십시오.
- 웹 기반 ELDA(Extreme Limiting Dilution Analysis) 통계 소프트웨어(http://bioinf.wehi.edu.au/software/elda/)19를 사용하여 각 세포 집단 내에서 LSC의 빈도를 계산합니다.
참고: 워크플로의 개략도는 그림 1에 나와 있습니다.
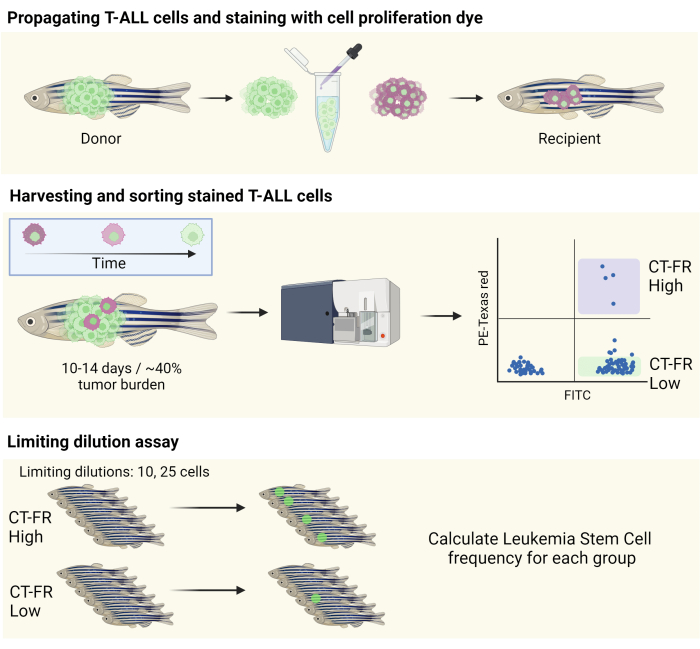
그림 1: 제브라피시 T-ALL 모델에서 정지 세포를 분리하기 위해 세포 추적 염색을 사용하기 위한 워크플로우. 세포 증식 염색으로 제브라피시 T-ALL 세포 염색, CG1 제브라피시로 증식(상단 패널), 세포 증식 염색의 머무름에 따른 세포 분류(중간 패널)의 개략도. 수집된 세포는 LSC(하단 패널)의 빈도를 측정하기 위한 제한 희석 분석에 사용되었습니다. 약어: T-ALL = T-세포 급성 림프구성 백혈병; LSC = 백혈병 줄기 세포; CT-FR = CellTrace 원적색; FITC = 플루오레세인 이소티오시아네이트; PE = 피코에리트린. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
위에서 설명한 프로토콜에 따라 세포 증식 염료인 CT-FR을 유지한 세포를 분류하고 이를 제한 희석 분석(LDA)에 사용하여 CT-FR High 및 CT-FR Low 집단에서 LSC 빈도를 추정했습니다. 유세포 분석 실험에 대한 게이팅을 설정하기 위해 단색 대조군 외에 형광단 없음(색상 없음) 대조군을 사용했습니다 (그림 2A). 이러한 사분면은 분류 게이트 설정?...
토론
LSC는 기존의 항증식 화학요법 치료에 내성이 있는 것으로 알려져 있으며, 이러한 세포에 대한 표적 치료법을 찾는 것은 재발 발생을 줄이고 환자 예후를 개선하는 데 큰 가능성을 가지고 있습니다20. 이전 연구에서는 T-ALL PDX 모델13에서 약물 내성 및 줄기성과 관련된 소량의 정지 세포 집단을 식별하기 위해 형광 세포 증식 염색을 사용?...
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구를 위한 자금은 미국 국립암연구소(National Cancer Institute, R37CA227656에서 JSB로)에서 제공했다. 이 연구는 또한 켄터키 대학교 마키 암 센터(P30CA177558)의 유세포 분석 및 면역 모니터링 공유 리소스의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 26 G/2” micro-syringe | Hamilton | 87930 | NA |
| 35 µm filter cap FACS tubes | Falcon | 352235 | NA |
| 40 µm cell strainer | CELLTREAT | 229482 | NA |
| 96-well skirted PCR plate | Thermo Fisher Scientific | AB0800 | NA |
| Cell sorter | Sony Biotechnology | SY3200 | NA |
| CellTrace Far Red | Thermo Fisher Scientific | C34564 | NA |
| Conical tubes | VWR | 10026-078 | NA |
| DAPI | Thermo Fisher Scientific | 62248 | NA |
| DMSO | Sigma-Aldrich | D4818 | NA |
| Dulbecco'sPhosphate-buffered saline (PBS) | Caisson Labs | 22110001 | NA |
| Epifluorescence stereo microscope | Nikon | SMZ25 | NA |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | 12306C | NA |
| Fish system water | N/A | N/A | 0.03-0.05% salinity, pH 6.5-8, buffered with sodium bicarbonate |
| Microcentrifuge tubes | Thermo Fisher Scientific | C2171 | NA |
| MS-222 | Pentaire | TRS-1 | tricaine mesylate, an anesthetic |
| Petri dishes | Corning | 07-202-011 | NA |
| Razor blades | American Line | 66-0089 | NA |
| Trypan Blue | Thermo Fisher Scientific | T10282 | NA |
참고문헌
- Reya, T., Morrison, S. J., Clarke, M. F., Weissman, I. L. Stem cells, cancer, and cancer stem cells. Nature. 414 (6859), 105-111 (2001).
- Arai, F., et al. Tie2/angiopoietin-1 signaling regulates hematopoietic stem cell quiescence in the bone marrow niche. Cell. 118 (2), 149-161 (2004).
- Li, L., Bhatia, R. Stem cell quiescence. Clin. Cancer Res. 17 (15), 4936-4941 (2011).
- Kreso, A., Dick, J. E. Evolution of the cancer stem cell model. Cell Stem Cell. 14 (3), 275-291 (2014).
- Chen, W., Dong, J., Haiech, J., Kilhoffer, M. -. C., Zeniou, M. Cancer stem cell quiescence and plasticity as major challenges in cancer therapy. Stem Cells Int. 2016, 1740936 (2016).
- Kleffel, S., Schatton, T. Tumor dormancy and cancer stem cells: Two sides of the same coin. Adv Exp Med Biol. 734, 145-179 (2013).
- Tuy, K., Rickenbacker, L., Hjelmeland, A. B. Reactive oxygen species produced by altered tumor metabolism impacts cancer stem cell maintenance. Redox Biol. 44, 101953 (2021).
- Zhou, B. -. B. S., et al. Tumour-initiating cells: Challenges and opportunities for anticancer drug discovery. Nat Rev Drug Discov. 8 (10), 806-823 (2009).
- Lyons, A. B., Blake, S. J., Doherty, K. V. Flow cytometric analysis of cell division by dilution of cfse and related dyes. Curr Protoc Cytom. 64 (1), 11-12 (2013).
- Lyons, A. B. Analysing cell division in vivo and in vitro using flow cytometric measurement of cfse dye dilution. J Immunol Methods. 243 (1-2), 147-154 (2000).
- Azari, H., Deleyrolle, L. P., Reynolds, B. A. Using carboxy fluorescein succinimidyl ester (cfse) to identify quiescent glioblastoma stem-like cells. Methods Mol Biol. 1686, 59-67 (2018).
- Deleyrolle, L. P., Rohaus, M. R., Fortin, J. M., Reynolds, B. A., Azari, H. Identification and isolation of slow-dividing cells in human glioblastoma using carboxy fluorescein succinimidyl ester (cfse). J Vis Exp. (62), e3918 (2012).
- Ebinger, S., et al. Characterization of rare, dormant, and therapy-resistant cells in acute lymphoblastic leukemia. Cancer Cell. 30 (6), 849-862 (2016).
- Langenau, D. M., et al. Myc-induced t cell leukemia in transgenic zebrafish. Science. 299 (5608), 887-890 (2003).
- Blackburn, J. S., et al. Clonal evolution enhances leukemia-propagating cell frequency in t cell acute lymphoblastic leukemia through akt/mtorc1 pathway activation. Cancer Cell. 25 (3), 366-378 (2014).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24 (3), 2288 (2023).
- Blackburn, J. S., Liu, S., Langenau, D. M. Quantifying the frequency of tumor-propagating cells using limiting dilution cell transplantation in syngeneic zebrafish. J Vis Exp. (53), e2790 (2011).
- Borga, C., et al. Simultaneous b and t cell acute lymphoblastic leukemias in zebrafish driven by transgenic myc: Implications for oncogenesis and lymphopoiesis. Leukemia. 33 (2), 333-347 (2019).
- Hu, Y., Smyth, G. K. Elda: Extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. J Immunol Methods. 347 (1-2), 70-78 (2009).
- Bhojwani, D., Pui, C. -. H. Relapsed childhood acute lymphoblastic leukaemia. Lancet Oncol. 14 (6), e205-e217 (2013).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nat Rev Drug Discov. 4 (1), 35-44 (2005).
- Al-Hamaly, M. A., et al. Zebrafish drug screening identifies erlotinib as an inhibitor of wnt/β-catenin signaling and self-renewal in t-cell acute lymphoblastic leukemia. Biomed Pharmacother. 170, 116013 (2024).
- Yan, C., et al. Visualizing engrafted human cancer and therapy responses in immunodeficient zebrafish. Cell. 177 (7), 1903-1914 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유