Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Zebra Balığı T Hücreli Akut Lenfoblastik Lösemi Modelinde Hareketsiz Hücrelerin Hücre Proliferasyonu Boyama Kullanılarak Tanımlanması
Bu Makalede
Özet
Zebra balığı T-akut lenfoblastik lösemi modelindeki hareketsiz hücreleri tanımlamak için hücre proliferasyon boyaması kullandık. Leke, bölünmeyen hücrelerde tutulur ve hücre proliferasyonu sırasında azaltılır, bu da daha fazla sorgulama için hareketsiz hücrelerin seçilmesini sağlar. Bu protokol, hücresel sessizlik bağlamında kendini yenilemeyi incelemek için işlevsel bir araç sağlar.
Özet
Hücresel sessizlik, normal ve kanser kök hücrelerinde (CSC'ler) tanımlanan bir büyüme durması veya yavaş proliferasyon durumudur. Sessizlik, CSC'leri antiproliferatif kemoterapi ilaçlarından koruyabilir. T hücreli akut lenfoblastik lösemi (T-ALL) hasta kaynaklı ksenogreft (PDX) fare modellerinde, hareketsiz hücreler tedavi direnci ve saplılık ile ilişkilidir. Hücre proliferasyon boyaları, hücre bölünmesinin izlenmesi için popüler araçlardır. Floresan boya, hücre içindeki zar ve makromoleküller üzerindeki amin gruplarına kovalent olarak sabitlenir. Bu, etiketli hücrelerin akış sitometrisi ile çözülebilen 10 bölünmeye kadar izlenmesine izin verir.
Sonuç olarak, en yüksek proliferasyon oranlarına sahip hücreler, her hücre bölünmesiyle seyreltileceği için düşük boya tutma özelliğine sahip olurken, uykuda, daha yavaş bölünen hücreler en yüksek tutma özelliğine sahip olacaktır. Uyuyan hücreleri izole etmek için hücre proliferasyon boyalarının kullanımı optimize edilmiş ve T-ALL fare modellerinde tanımlanmıştır. Mevcut fare modellerini tamamlayıcı olarak rag2:Myc'den türetilen zebra balığı T-ALL modeli, lösemik kök hücrelerin (LSC'ler) yüksek sıklığı ve zebra balığının büyük ölçekli nakil deneyleri için rahatlığı nedeniyle T-ALL'de kendini yenilemeyi sorgulamak için mükemmel bir mekan sağlar.
Burada, zebra balığı T-ALL hücrelerinin bir hücre proliferasyon boyası ile boyanması, zebra balığı hücreleri için boya konsantrasyonunun optimize edilmesi, başarılı şekilde boyanmış hücrelerin in vivo olarak geçirilmesi ve nakledilen hayvanlardan canlı hücre sınıflandırması ile değişen seviyelerde boya tutma özelliklerine sahip hücrelerin toplanması için iş akışını açıklıyoruz. T-ALL'de LSC'ler için iyi kurulmuş hücre yüzeyi yapıcılarının yokluğu göz önüne alındığında, bu yaklaşım hareketsiz hücreleri in vivo olarak sorgulamak için işlevsel bir araç sağlar. Temsili sonuçlar için, yüksek ve düşük boya tutucu hücrelerin aşılama verimliliğini ve LSC frekansını açıklıyoruz. Bu yöntem, ilaç tepkisi, transkripsiyonel profiller ve morfoloji dahil olmak üzere hareketsiz hücrelerin ek özelliklerinin araştırılmasına yardımcı olabilir.
Giriş
Yetişkin kök hücreler, belirli bir organda farklılaşmış hücre tiplerinin yenilenmesinden sorumludur ve ağırlıklı olarak uykuda, bölünmeyen bir durumda bulunur 1,2. Örneğin, kanı koruyan hematopoetik kök hücreler (HSC'ler) büyük ölçüde hareketsiz kalır ve olgun kan bileşenleri oluşturmak için kendini yenilemek veya farklılaşmak için hücre döngüsüne sadece küçük bir kısım girer3. Benzer şekilde, kanserlerde, kanser kök hücreleri (CSC'ler) adı verilen nadir bir hücre alt popülasyonu, kendini yenileme yeteneğine sahiptir ve malignitenin uzun süreli bakımından sorumludur4. Kanser kök hücreleri in vivo olarak anti-proliferatif kanser tedavilerinden5 kaçmalarını,bağışıklık sistemi tarafından temizlenmeden kaçınmalarını, oksidatif stresi azaltmalarını ve DNA onarım yollarınıgeliştirmelerini 7 sağlayabilen bir sessizlik veya yavaş büyüme durumunda bulunur. Tedaviden sonra geride kalan az sayıda CSC bile tümörü potansiyel olarak yeniden doldurabilir ve bu da hastanın nüksetmesine neden olabilir8. Buna göre, hücresel sessizliği anlamak, CSC'lerin potansiyel güvenlik açıklarının belirlenmesi ve bunları hedeflemek için yeni yolların geliştirilmesi için büyük umut vaat etmektedir.
Karboksifloresein süksinimidil ester (CFSE) boyası ve türevleri gibi hücre proliferasyon boyaları, hücre bölünmelerinin9 sıklığını izlemek için yaygın olarak kullanılır. Boya, hücre zarı boyunca nüfuz eder ve hücrenin içine girdikten sonra, hücre içi esterazlar tarafından bir floresan ürüne aktivasyona uğrar. Elde edilen floresan bileşik, süksinimidil kısmı ile hücre içi proteinlerin10 amin fonksiyonel grupları arasında oluşan kovalent amid bağları yoluyla hücre içinde tutulur. Her hücresel bölünme ile, floresan bileşik, elde edilen iki hücre arasında eşit olarak bölünür ve iki kat sinyal seyrelmesine neden olur. Bu boya, akış sitometrisi analizi11 yoluyla 10'a kadar hücre bölünmesinin tespit edilmesini sağlar.
Bu yaklaşım daha önce, boya11,12'nin yüksek tutulumuna sahip yavaş döngülü hücre popülasyonlarını tanımlayarak CSC popülasyonlarını in vitro olarak zenginleştirmek için kullanılmıştır. T-ALL'de CFSE, farelerde hasta kaynaklı ksenogreftlerde in vivo tümör büyümesini izlemek için kullanılmıştır. Hücre etiketleme ve üç haftalık nakilden sonra, akış sitometri analizi, CFSE floresansını hala koruyan nadir bir hücre popülasyonu gösterdi. Bu popülasyon, hasta13'te saplılık, tedavi direnci ve nüksetmeye neden olan hücrelere yüksek benzerlik ile ilişkilendirildi. Buna göre, bu boya, T-ALL'deki lösemi kök hücre (LSC) fenotiplerinin incelenmesi için yararlı bir araç sağlar.
Çalışmanın amacı, bir zebra balığı T-ALL modeli kullanarak in vivo olarak sessizliği incelemek için hücre proliferasyon boyasının uygulamasını genişletmektir. Özellikle, rag2:Myc güdümlü zebra balığı T-ALL model14 , fare modellerine ve insan hastalıklarına15 kıyasla LSC'lerin yüksek sıklığı nedeniyle kendini yenileme çalışmaları için mükemmel bir yer sağlar. Ek olarak, zebra balığının kullanımı, fare muadillerine kıyasla çok daha düşük bir bakım ve bakım maliyetiyle yapılabilen büyük ölçekli nakil çalışmalarına izin verir16. Zebra balığı ayrıca canlı görüntüleme uygulamaları için mükemmeldir, çünkü floresanla etiketlenmiş tümör hücreleri, tümör gelişim hızını tahmin etmek için basit bir floresan mikroskobu kullanılarak kolayca görüntülenebilir16.
Bu protokolde, zebra balığı T-ALL hücrelerinin hücre proliferasyon boyası ile boyanması ve ardından sinjeneik CG1 zebra balığında lekeli hücrelerin in vivo çoğaltılması için iş akışını açıklıyoruz. Lösemi gelişimi üzerine, boyayı tutan hücrelerin sınıflandırılmasını ve LSC kendini yenileme oranlarını ölçmek için müteakip bir sınırlayıcı seyreltme transplantasyon deneyi için kullanımlarını açıklıyoruz. Bu protokol, hareketsiz LSC'lerin hedeflenmesi için potansiyel bileşiklerin in vivo ilaç taraması dahil olmak üzere ek uygulamalar için genişletilebilir. Ek olarak, toplanan hücreler, transkriptomik profilleme, proteomik ve metabolomik gibi farklı aşağı akış analizleri için kullanılabilir ve T-ALL'deki hareketsiz LSC'lerin davranışına ilişkin benzersiz bilgiler sunar.
Protokol
Bu protokolde, daha önce CG1 suşunda üretilen ve bu nedenle doğrudan alıcı sinjeneik CG1 zebra balığına15 enjekte edilebilen GFP etiketli zebra balığı T-ALL hücrelerini kullanıyoruz. Kısaca lösemi, tek hücreli CG1 zebra balığı embriyolarına rag2:Myc ve rag2:GFP'nin DNA mikroenjeksiyonu ile oluşturulmuştur. Hayvanlar, floresan mikroskobu kullanılarak enjeksiyondan 3 hafta sonra başlayarak lösemi gelişimi açısından izlendi. GFP pozitif lösemi hücreleri FACS izole edildi ve yüksek LSC frekansına sahip klonlar oluşturmak için alıcı CG1 zebra balığına seri olarak nakledildi. Tüm protokolün detayları Blackburn ve ark.15 tarafından açıklanmıştır.
Alternatif olarak, birincil rag2: Myc'den türetilen T-ALL, zebra balığı embriyolarının17 DNA mikroenjeksiyonu ile üretilebilir. rag2: Myc'nin GFP gibi rag2 tahrikli bir floresan raportör ile DNA mikroenjeksiyonu, B hücresi, T hücresi ve karışık ALL18'in gelişmesine neden olabilir. Bu protokolde kullanılan lösemi klonlarının daha önce T-ALL15 olduğu doğrulandı. Zebra balığı içeren tüm deneysel prosedürler, Kentucky Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi, 2019-3399 protokolü tarafından gözden geçirildi ve onaylandı.
1. Zebra balığı T-ALL hücrelerinin in vivo olarak çoğaltılması
- 1 mL donmuş GFP etiketli zebra balığı T-ALL hücreleri içeren bir şişeyi 37 ° C'lik bir su banyosunda hafifçe çalkalayarak çözülene kadar çözdürün. Çözüldükten sonra buza aktarın.
- Dondurma ortamını seyreltmek için tüpün içeriğini 4 mL balık ortamı (0,9x PBS +% 5 FBS) ile 15 mL'lik konik bir tüpe yavaşça pipetleyin.
- 4 °C'de 2.500 × g'da 5 dakika döndürün. Ortamı peletten çıkarın. 0,5 mL balık ortamında tekrar süspanse edin ve hücreleri buz üzerinde tutun.
- Hücreleri sayın ve gerekirse 100.000 hücre / 5 μL'ye seyreltin.
- Bir Petri kabındaki 25 mL balık sistemi suyuna 200 μL 4 mg / mL anestezik (MS-222) ekleyerek yetişkin CG1 zebra balığını uyuşturun. CG1 balığını ventral tarafı yukarı bakacak şekilde tutun ve bir Hamilton mikrolitre şırınga kullanarak intraperitoneal (IP) boşluğa 5-6 μL enjekte edin. Hayvanları tanklarına geri götürün ve sisteme geri koymadan önce normal yüzmeye dönüşü izleyin.
NOT: Bu protokolde açıklanan transplantasyon çalışmaları için 60 günlük veya daha büyük yetişkin zebra balığı kullanılmıştır. - Floresan mikroskobu kullanarak haftada bir kez lösemi büyümesini izleyin. Tarama prosedürünün ayrıntıları için aşağıdaki Bölüm 2'ye bakın.
2. Floresan etiketli lösemi hücrelerinin toplanması
- Nakilden yaklaşık 21-28 gün sonra, bir Petri kabındaki 25 mL balık sistemi suyuna 200 μL (4-5 damla) 4 mg / mL anestezik ekleyerek yetişkin CG1 zebra balığını uyuşturun.
- GFP floresansını tespit etmek için uygun filtreyi kullanarak, hayvandaki GFP etiketli lösemi hücrelerinin yüzdesini bir epifloresan mikroskop ile değerlendirerek CG1 zebra balığını lösemi yükü açısından inceleyin. GFP pozitif lösemi, hayvanın %>70'ine yayılmışsa hasat edilmeye hazırdır.
- 9 mL balık sistemi suyu içeren bir Petri kabına 1 mL 4 mg / mL anestezik ekleyerek hayvanı ötenazi yapın. Tüm yaşam belirtilerinin durmasına izin verin; Örneğin, operküler hareketin durması için balığı gözlemleyin (~ 5 dk).
- Zebra balığını yeni bir Petri kabına taşıyın ve hücreler için tampon görevi görmesi için 1 mL balık ortamı ekleyin. Yeni bir tıraş bıçağı kullanarak önce zebra balığının kafasını kesin, ardından aynı tıraş bıçağını kullanarak dokuyu yumuşatın. Büyük hücre kümelerini çıkarmak için yukarı ve aşağı pipetleyin.
- Hücreleri 40 μm'lik bir hücre süzgecinden geçirerek tek hücreli bir süspansiyona ayrışmak için 50 mL'lik bir konik tüpe geçirin. Hücreleri buz üzerinde tutun.
3. Boyama ve zebra balığı hücre canlılığı için hücre proliferasyon boyası (CellTrace Far Red) konsantrasyonunun optimizasyonu
NOT: Bu protokol için ve tümör hücreleri GFP etiketli olduğundan, CT-FR olarak adlandırılacak olan spektral örtüşmeyi önlemek için uzak kırmızı hücre proliferasyon boyası (CellTrace Far Red) kullandık.
- Üreticinin tavsiyelerine göre uygun hacimde DMSO ekleyerek kullanmadan hemen önce 1 mM'lik bir floresan boya çözeltisi hazırlayın. 1 mM, 0,5 mM, 0,1 mM ve 0,01 mM çalışma çözümlerine sahip olun; Boyamayı takiben hücre canlılığını test etmek için balık ortamında gerektiği kadar seyreltin.
- Hücreleri sayın ve 1.5 mL mikrosantrifüj tüplerinde 1 ×10 6 hücre toplayın.
- 2.500 × g'da 4 °C'de 5 dakika santrifüjleyin. Sıvıyı çıkarın ve hücreleri 1 mL 0.9x PBS'de yeniden süspanse edin.
- CT-FR ile tedavi için hücre süspansiyonunu her biri 250 μL'lik dört tüp arasında bölün.
- Her biri yaklaşık 250.000 hücre/tüp ile hacmi 500 μL'ye çıkarmak için 250 μL 0.9x PBS ekleyin.
- Aşağıdaki nihai konsantrasyonları elde etmek için 1 μM, 0.5 μM, 0.1 μM ve 0.05 μM. Işıktan korunarak 37 ° C'de 20 dakika inkübe edin.
- Oda sıcaklığında 5 dakika boyunca 2.500 × g'da döndürerek hücreleri peletleyin. Sıvıyı çıkarın ve fazla boyayı çıkarmak için hücreleri 500 μL balık ortamı ile yıkayın.
- Tekrar pelet yapın, sıvıyı çıkarın ve 25 μL balık ortamında yeniden süspanse edin. %50 Tripan Mavisi'nde 1:10 seyreltmede hücreleri saymak için 1 μL kullanın.
- Hücreleri mikroskop altında hücre canlılığı açısından inceleyin; canlı hücreler Tripan mavisini korumayacak ve mikroskop altında parlak görünecek, ölü hücreler ise boyayı alacak ve koyu görünecektir. Tümör hücrelerini tanımlamak için önce uygun floresan kanalı altındaki hücreleri inceleyin ve ardından hücre canlılığını değerlendirmek için parlak alan kanalını kullanın.
- Hücre canlılığını korurken başarılı boyama ile sonuçlanan konsantrasyonu seçin (%>90 tripan mavisi negatif hücreler).
NOT: Bu deneyde test edilen zebra balığı T-ALL hücreleri için, başarılı boyama için 1 μM konsantrasyon ve hücre canlılığının %>90'ı kullanılmıştır.
4. CT-FR lekeli T-ALL zebra balığı hücrelerinin in vivo olarak çoğaltılması
- Bölüm 3'teki optimize edilmiş CT-FR konsantrasyonunu kullanarak zebra balığı hücrelerini boyayın. FACS sıralaması sırasında GFP pozitif kontrol olarak, GFP etiketli T-ALL tümörünün oluşumu için bazı tümör hücrelerini lekesiz bırakın. Hem lekeli hem de lekesiz hücreleri nakil için 50.000 hücre / 5 μL'ye seyreltin.
- Bir Petri kabında 25 mL balık sistemi suyuna 200 μL 4 mg / mL anestezik ekleyerek yetişkin CG1 zebra balığını uyuşturun.
- Hem lekeli hem de lekesiz hücreler için Bölüm 1'de açıklandığı gibi zebra balığının IP boşluğuna 5 μL hücre süspansiyonu enjekte edin. Enjeksiyon sonrası potansiyel mortaliteyi hesaba katmak için grup başına 5-6 zebra balığı enjekte edin.
- Hayvanları lösemi gelişimi açısından haftada 2 kez sedasyon altında floresan mikroskobu ile inceleyin.
NOT: ~ 10-14 gün sonra, lösemi bu vücudun yaklaşık% 30-40'ını işgal etmelidir. Lösemi hasadı için plan yapın ve bu zaman dilimi içinde müteakip sıralamayı yapın. Tümörün büyük bir boyuta genişlemesini beklemek, floresan hücre boyasının daha fazla seyreltilmesine ve sinyalini tespit etmede zorluğa neden olabilir. Seçilen tümör modeli için tümör toplama zamanlamasının optimizasyonunu düşünün. Ek olarak, istenen tümör boyutunun yakalanmasını sağlamak için burada daha sık tümör monitörizasyonu önerilir.
5. CT-FR lekeli zebra balığı T-ALL hücrelerinin sınıflandırılması için hazırlık
- Hücre sıralaması için aşağıdaki kontrolleri hazırlayın: Renk kontrolü yok (lekelenmemiş, transgenik olmayan, tek hücreli süspansiyon, vahşi tip bir zebra balığından), GFP Etiketli T-ALL hücreleri ve yeni boyanmış CT-FR WT zebra balığı hücreleri (maksimum Uzak-Kırmızı sinyal eşiğini ayarlamak için).
- Lekesiz ve CT-FR kontrollerinin hazırlanması
- 9 mL balık sistemi suyu içeren bir Petri kabına 1 mL 4 mg / mL anestezik ekleyerek nakledilmemiş bir CG1 zebra balığına ötenazi yaparak vahşi tip (WT) balık hücrelerini hasat edin.
- Zebra balığını yeni bir Petri kabına taşıyın ve hücreler için tampon görevi görmesi için 1 mL balık ortamı ekleyin. Aynı tıraş bıçağını kullanarak zebra balığının önce kafasını kesmek ve ardından yumuşatmak için yeni bir tıraş bıçağı kullanın; Büyük hücre kümelerini çıkarmak için yukarı ve aşağı pipetleyin.
- Hücreleri 40 μm'lik bir hücre süzgecinden geçirerek tek hücreli bir süspansiyona ayrışmak için 50 mL'lik bir konik tüpe geçirin. Hücreleri buz üzerinde tutun.
- CT-FR kontrolü için, 250.000 WT hücresini bir mikrosantrifüj tüpüne aktarın ve hücreleri oda sıcaklığında 5 dakika boyunca 2.500 × g'da santrifüjleme ile peletleyin. Balık ortamını çıkarın ve 500 μL 0.9x PBS+ %1 FBS ekleyin.
- 1 μM'lik bir nihai konsantrasyon için 1 mM CT-FR boya stok çözeltisinden 0,5 μL ekleyin. Karıştırmak için 1.000 μL pipet ile hafifçe pipetleyin. 37 °C'de 20 dakika inkübe edin, ışıktan koruyun.
- Sıvıyı çıkarın ve fazla boyayı çıkarmak için hücreleri 500 μL balık ortamı ile yıkayın.
- Hücreleri tekrar santrifüjleme ile peletleyin, sıvıyı çıkarın ve hücreleri 500 μL 0.9x PBS +% 1 FBS'de yeniden süspanse edin ve 35 μm'lik bir filtre kapağından bir FACS tüpüne geçirin. Buz üzerinde tutun.
- Donör plağın hazırlanması
NOT: Donör plakası, nakledilen zebra balığından CT-FR lekeli T-ALL hücrelerinin sıralanacağı 96 oyuklu bir v-tabanlı plakadır. Plakanın her bir oyuğu, sonraki adımlarda sıralanan hücrelerin peletlenmesine yardımcı olmak için bir taşıyıcı görevi görmek üzere 50 μL balık ortamında 5.000 boyanmamış, WT CG1 hücresi içerir.- 500.000 WT CG1 hücresini sayın ve bunları 15 mL'lik konik bir tüpe aktarın.
- Bu hücre stoğunu 5 mL balık ortamı ekleyerek 100 hücre / μL'ye seyreltin.
- 96 oyuklu plakanın her bir oyuğuna 50 μL hücre süspansiyonu dağıtın. Hücre süspansiyonu homojenliğini korumak için her sıradan sonra hücre süspansiyon stok tüpünü karıştırın. Sıralamaya kadar plakayı 4 °C'de tutun.
- Nakledilen balık örneklerinin hazırlanması
- Nakledilen balıkları %30-40 T-ALL yükünde seçin. Hem CT-FR ile boyanmış hücreler hem de boyanmamış GFP tümör hücreleri ile nakledilen balıkları toplayın.
- Hücreleri Bölüm 2'de açıklandığı gibi hasat edin.
NOT: Boya tutucu hücrelerin düşük bollukta bulunması beklendiğinden, CT-FR GFP örneğinden çok sayıda hücreyi sıralamaya hazırlanın. - 0.9x PBS +% 1 FBS'de ~ 3-5 × 106 hücre / mL'yi ayırmak için uygun konsantrasyona seyreltin ve 35 μm'lik bir filtre kapağından bir FACS tüpüne geçirin. Ölü hücreleri dışlamak için hayati bir boya olarak 1: 1.000 seyreltmede DAPI (1 mg / mL) ekleyin. Buz üzerinde tutun.
- Boyanmamış GFP tümör hücreleri için, 250.000 hücreyi bir mikrosantrifüj tüpüne aktarın ve oda sıcaklığında 5 dakika boyunca 2.500 × g'da pelet yapın. Balık ortamını çıkarın, 500 μL PBS ekleyin ve 35 μm'lik bir filtre kapağından bir FACS tüpüne geçirin. Buz üzerinde tutun.
6. Sıralama
NOT: Sıralama için kullanıldığı durumlar dışında tüm tüpleri ve verici plakayı tüm süre boyunca buz üzerinde tutun.
- Parametreleri ve kapıları sıralamak için, ilgilenilen hücreleri boyutlarına göre tanımlamak ve hücre kalıntılarını ortadan kaldırmak için ileri ve yan saçılma kapısını uygulayarak başlayın. Ardından, yinelenen hücreleri dışlamak ve yalnızca tekli hücreleri tutmak için ileri dağılım yüksekliğini ve ileri dağılım alanını kullanın. Son olarak, GFP pozitif ve CT-FR pozitif hücre popülasyonlarını tanımlamak için kadranları çizmek için renksiz ve tek renkli kontrolleri kullanın.
NOT: CT-FR kontrolünün, sıralama için numunelerden çok daha parlak olması beklenir, çünkü kontrol için boyama hücre bölünmesi olmadan taze olarak yapılmıştır; CT-FR GFP örneklerinden alınan hücrelerin CT-FR pozitif kapısının alt ucunda görünmesi beklenir. - Her bir balığa nakledilecek hücre sayısını donör plakasının bir oyuğuna sıralayın.
NOT: Bu deney için, CT-FR Yüksek ve CT-FR Düşük'teki lösemi kök hücrelerinin sıklığını tahmin etmek için sınırlayıcı bir seyreltme testi kullandık. Bu tahlil, 3 hayvana nakledilen 25 hücrelik bir doz ve 10 hayvana nakledilen 10 hücrelik bir doz kullandı. Zebra balığı rag2: Myc'den türetilen T-ALL kullanılarak yapılan tipik bir sınırlayıcı seyreltme testi, bu modeldeki LSC frekansının yüzlerce hücrede 1 LSC olduğu tahmin edildiğinden, daha fazla sayıda hücreye (500 veya 1.000) sahip bir grubu içerecektir. Bununla birlikte, bu tahlilde, daha önce Blackburn ve ark.15 tarafından tanımlanan T-ALL klonlarından birini kullanıyoruz. Burada kullanılan örnekteki LSC frekansı onlarca hücrede ~1 LSC'dir; 25 hücre grubunda nakledilen hayvanlarda lösemi tespit edileceğini tahmin ediyoruz. Bu testi hastalık modeliniz için optimize ederken, tümörün aşılanmasını sağlamak için daha yüksek hücre sayısı grubunu seçerken dikkatli olunmalıdır. - Ayırma işleminden sonra, nakil için hazır olana kadar plakayı buz üzerinde tutun.
NOT: Sıralama prosedürleri stresli olabilir ve hücre canlılığını etkileyebilir. Gerçek sınırlayıcı seyreltme deneyini çalıştırmadan önce, bir pilot sıralama deneyi yapıldı. Sıralanan hücreler nakledildi ve sıralamanın hücre canlılığına zararlı olup olmadığını belirlemek için lösemi gelişimi izlendi. Alternatif olarak, hücre canlılığı, sıralanan hücrelerin Tripan mavisi ile boyanması ve nakilden önce mikroskop altında incelenmesiyle değerlendirilebilir.
7. Seyreltmeyi sınırlamak ve tümör başlangıcını izlemek için sıralanmış hücrelerin nakli
- 4 °C'de 2.500 × g'da büyük bir tezgah üstü santrifüj kullanarak plakayı aşağı doğru döndürün.
- Her kuyucuktan 45 μL süpernatanı dikkatlice çıkarın, geride 5 μL sıvı bırakın ve kuyu dibindeki hücre peletine dokunmaktan kaçının.
- Hücreleri 20 μL'lik bir pipetle tekrar süspanse edin. Pipet ile 2-3 kuyucuğu yeniden süspanse edin ve ardından Hamilton mikrolitre şırıngayı kullanarak, her bir oyuktan hücre süspansiyonlarını IP nakli yoluyla istenen sayıda CG1 zebra balığına enjekte edin. Ardından, hücrelerin yeniden yerleşmesini önlemek için bir sonraki kuyucuk grubundaki hücreleri yeniden askıya alın.
- Zebra balığını en az 6 hafta boyunca T-ALL gelişimi için haftada bir kez sedasyon altında floresan mikroskobu ile inceleyin.
8. Lösemi kök hücre sıklığının belirlenmesi
- Herhangi bir miktarda GFP sinyali olan hayvanların pozitif olduğunu göz önünde bulundurarak, nakilden 6 hafta sonra hücre dozu ve tedavi grubu başına pozitif hayvan sayısını kaydedin. GFP sinyali vücudun %>50'sini kapladığında hayvanların önemli lösemi yüküne sahip olduğunu düşünün.
- Her hücre popülasyonundaki LSC'lerin sıklığını hesaplamak için web tabanlı ELDA (Aşırı Sınırlayıcı Seyreltme Analizi) istatistik yazılımını (http://bioinf.wehi.edu.au/software/elda/)19 kullanın.
NOT: İş akışının şematik bir gösterimi Şekil 1'de verilmiştir.
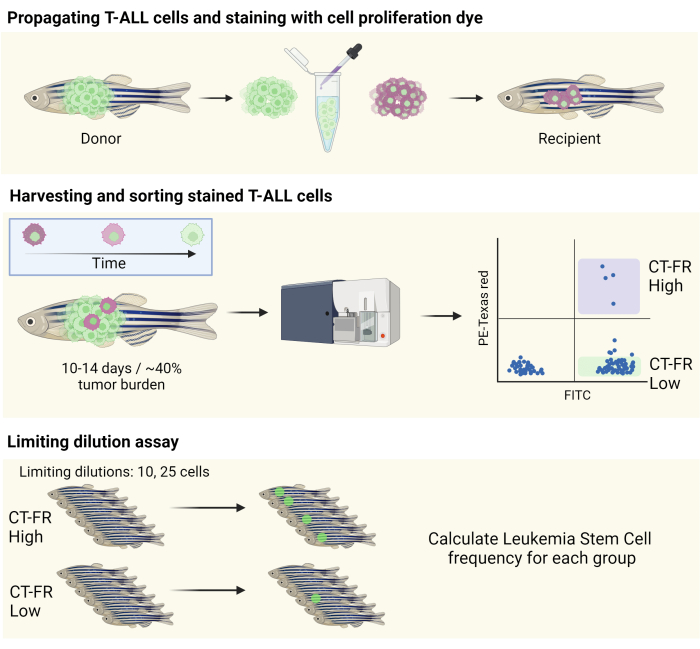
Şekil 1: Zebra balığı T-ALL modelinde hareketsiz hücreleri izole etmek için hücre izleme lekesinin kullanımına ilişkin iş akışı. Zebra balığı T-ALL hücrelerinin hücre proliferasyon boyası ile boyanmasının, bir CG1 zebra balığına yayılmasının (üst panel) ve hücre proliferasyon lekesinin tutulmasına dayalı olarak hücrelerin sıralanmasının (orta panel) şematik gösterimi. Toplanan hücreler, LSC'lerin frekansını belirlemek için sınırlayıcı bir seyreltme testi için kullanıldı (alt panel). Kısaltmalar: T-ALL = T hücreli akut lenfoblastik lösemi; LSC'ler = lösemik kök hücreler; CT-FR = CellTrace Uzak Kırmızı; FITC = floresein izotiyosiyanat; PE = fikoeritrin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Hücre proliferasyon boyası olan CT-FR'yi koruyan hücreleri sıralamak için yukarıda açıklanan protokolü takip ettik ve bunları CT-FR Yüksek ve CT-FR Düşük popülasyonlarında LSC frekansını tahmin etmek için bir Sınırlayıcı seyreltme testi (LDA) için kullandık. Akış sitometrisi deneyi için geçiti ayarlamak için, tek renkli kontrollere ek olarak florofor içermeyen (renk yok) bir kontrol kullandık (Şekil 2A). Bu k...
Tartışmalar
LSC'lerin konvansiyonel, anti-proliferatif kemoterapi tedavilerine dirençli olduğu bilinmektedir ve bu hücrelere karşı hedefe yönelik tedavilerin bulunması, nüks oluşumunu azaltmada ve hasta prognozunu iyileştirmede büyük umut vaat etmektedir20. Önceki araştırmalar, T-ALL PDX modellerinde13 ilaç direnci ve saplılık ile ilişkili küçük bir hareketsiz hücre popülasyonunu tanımlamak için floresan hücre proliferasyon l...
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu araştırmanın finansmanı Ulusal Kanser Enstitüsü (JSB'ye R37CA227656) tarafından sağlandı. Bu araştırma aynı zamanda Kentucky Üniversitesi Markey Kanser Merkezi'nin (P30CA177558) Flow Sitometrisi ve İmmün İzleme Ortak Kaynakları tarafından da desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 26 G/2” micro-syringe | Hamilton | 87930 | NA |
| 35 µm filter cap FACS tubes | Falcon | 352235 | NA |
| 40 µm cell strainer | CELLTREAT | 229482 | NA |
| 96-well skirted PCR plate | Thermo Fisher Scientific | AB0800 | NA |
| Cell sorter | Sony Biotechnology | SY3200 | NA |
| CellTrace Far Red | Thermo Fisher Scientific | C34564 | NA |
| Conical tubes | VWR | 10026-078 | NA |
| DAPI | Thermo Fisher Scientific | 62248 | NA |
| DMSO | Sigma-Aldrich | D4818 | NA |
| Dulbecco'sPhosphate-buffered saline (PBS) | Caisson Labs | 22110001 | NA |
| Epifluorescence stereo microscope | Nikon | SMZ25 | NA |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | 12306C | NA |
| Fish system water | N/A | N/A | 0.03-0.05% salinity, pH 6.5-8, buffered with sodium bicarbonate |
| Microcentrifuge tubes | Thermo Fisher Scientific | C2171 | NA |
| MS-222 | Pentaire | TRS-1 | tricaine mesylate, an anesthetic |
| Petri dishes | Corning | 07-202-011 | NA |
| Razor blades | American Line | 66-0089 | NA |
| Trypan Blue | Thermo Fisher Scientific | T10282 | NA |
Referanslar
- Reya, T., Morrison, S. J., Clarke, M. F., Weissman, I. L. Stem cells, cancer, and cancer stem cells. Nature. 414 (6859), 105-111 (2001).
- Arai, F., et al. Tie2/angiopoietin-1 signaling regulates hematopoietic stem cell quiescence in the bone marrow niche. Cell. 118 (2), 149-161 (2004).
- Li, L., Bhatia, R. Stem cell quiescence. Clin. Cancer Res. 17 (15), 4936-4941 (2011).
- Kreso, A., Dick, J. E. Evolution of the cancer stem cell model. Cell Stem Cell. 14 (3), 275-291 (2014).
- Chen, W., Dong, J., Haiech, J., Kilhoffer, M. -. C., Zeniou, M. Cancer stem cell quiescence and plasticity as major challenges in cancer therapy. Stem Cells Int. 2016, 1740936 (2016).
- Kleffel, S., Schatton, T. Tumor dormancy and cancer stem cells: Two sides of the same coin. Adv Exp Med Biol. 734, 145-179 (2013).
- Tuy, K., Rickenbacker, L., Hjelmeland, A. B. Reactive oxygen species produced by altered tumor metabolism impacts cancer stem cell maintenance. Redox Biol. 44, 101953 (2021).
- Zhou, B. -. B. S., et al. Tumour-initiating cells: Challenges and opportunities for anticancer drug discovery. Nat Rev Drug Discov. 8 (10), 806-823 (2009).
- Lyons, A. B., Blake, S. J., Doherty, K. V. Flow cytometric analysis of cell division by dilution of cfse and related dyes. Curr Protoc Cytom. 64 (1), 11-12 (2013).
- Lyons, A. B. Analysing cell division in vivo and in vitro using flow cytometric measurement of cfse dye dilution. J Immunol Methods. 243 (1-2), 147-154 (2000).
- Azari, H., Deleyrolle, L. P., Reynolds, B. A. Using carboxy fluorescein succinimidyl ester (cfse) to identify quiescent glioblastoma stem-like cells. Methods Mol Biol. 1686, 59-67 (2018).
- Deleyrolle, L. P., Rohaus, M. R., Fortin, J. M., Reynolds, B. A., Azari, H. Identification and isolation of slow-dividing cells in human glioblastoma using carboxy fluorescein succinimidyl ester (cfse). J Vis Exp. (62), e3918 (2012).
- Ebinger, S., et al. Characterization of rare, dormant, and therapy-resistant cells in acute lymphoblastic leukemia. Cancer Cell. 30 (6), 849-862 (2016).
- Langenau, D. M., et al. Myc-induced t cell leukemia in transgenic zebrafish. Science. 299 (5608), 887-890 (2003).
- Blackburn, J. S., et al. Clonal evolution enhances leukemia-propagating cell frequency in t cell acute lymphoblastic leukemia through akt/mtorc1 pathway activation. Cancer Cell. 25 (3), 366-378 (2014).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24 (3), 2288 (2023).
- Blackburn, J. S., Liu, S., Langenau, D. M. Quantifying the frequency of tumor-propagating cells using limiting dilution cell transplantation in syngeneic zebrafish. J Vis Exp. (53), e2790 (2011).
- Borga, C., et al. Simultaneous b and t cell acute lymphoblastic leukemias in zebrafish driven by transgenic myc: Implications for oncogenesis and lymphopoiesis. Leukemia. 33 (2), 333-347 (2019).
- Hu, Y., Smyth, G. K. Elda: Extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. J Immunol Methods. 347 (1-2), 70-78 (2009).
- Bhojwani, D., Pui, C. -. H. Relapsed childhood acute lymphoblastic leukaemia. Lancet Oncol. 14 (6), e205-e217 (2013).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nat Rev Drug Discov. 4 (1), 35-44 (2005).
- Al-Hamaly, M. A., et al. Zebrafish drug screening identifies erlotinib as an inhibitor of wnt/β-catenin signaling and self-renewal in t-cell acute lymphoblastic leukemia. Biomed Pharmacother. 170, 116013 (2024).
- Yan, C., et al. Visualizing engrafted human cancer and therapy responses in immunodeficient zebrafish. Cell. 177 (7), 1903-1914 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır