A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדמיית העברת אנרגיית תהודה של תאים חיים של דינמיקת הפעלת Akt מווסתת מטבולית בתאי HepG2
In This Article
Summary
כאן, אנו מציגים פרוטוקול לכימות הדינמיקה המרחבית-זמנית של הפעלת Akt וזרחון בתאי HepG2 חיים. הדמיית העברת אנרגיית תהודה של פורסטר (FRET) היא כלי רב עוצמה המספק תובנות חשובות לגבי מסלולי איתות אינסולין וויסות מטבולי בתאי סרטן.
Abstract
הפעלת Akt מווסתת מטבולית היא צומת קריטי במפל איתות האינסולין ומספקת תובנות חשובות לגבי הקשר בין סוכרת לסרטן. כדי לכמת במדויק את פעילות Akt בתאי HepG2, פיתחנו פרוטוקול חזק וניתן לשחזור המשתמש בהעברת אנרגיית תהודה של Förster (FRET) עם חיישנים ביולוגיים ספציפיים ל-Akt מקודדים גנטית. פרוטוקול זה מתאר שלבים מפורטים לתרבית תאים, הכנת צלחת הדמיה וטרנספקציה של תאי HepG2 כדי לבטא חיישנים ביולוגיים מבוססי FRET, לצד הנחיות ספציפיות לסריקת לייזר תצורת חומרה ותוכנה של מיקרוסקופ קונפוקלי. התוצאות הדגימו דפוסים ייחודיים של איתות אינסולין בתאי HepG2, המציגים מתג בלתי הפיך המאופיין בהפעלת Akt מכוננת עם סף הפעלה מוגדר אך ללא סף כיבוי. לעומת זאת, myotubes מציגים מתג הפיך. הפעלת Akt המתמשכת בתאי HepG2 מרמזת על מנגנונים העומדים בבסיס עמידות לאינסולין וחוסר ויסות מטבולי בתאי הכבד, עם השלכות רחבות יותר להבנת התקדמות הפרעות מטבוליות וסרטן. פרוטוקול זה מציע מסגרת רבת ערך לחקר מסלולי איתות והתנהגויות תאיות הקשורות ל-Akt בהקשרי מחלה שונים.
Introduction
סוכרת מהווה אתגר בריאותי עולמי גדול, המאופיין בתנגודת לאינסולין ופגיעה בהומאוסטזיס גלוקוז1. הבנה מקיפה של מסלולי איתות אינסולין חיונית להבהרת הפתופיזיולוגיה של מחלה זו, שכן אינסולין ממלא תפקיד מרכזי בחילוף החומרים של גלוקוז, צמיחת תאים והישרדות2. מחקרים רבים הוכיחו כי איתות אינסולין משפיע באופן משמעותי על סוגי סרטן שונים, וקושר תנגודת לאינסולין להתקדמות הגידול ותוצאות גרועות של המטופלים 3,4,5,6. תאי HepG2, קו תאי קרצינומה הפטו-תאית נפוץ, משמשים כמודל רב ערך לחקר עמידות לאינסולין ויחסי הגומלין בין חוסר ויסות מטבולי והתפתחות סרטן7. באופן מסורתי, חוקרים ראו את תגובות האינסולין כמדורגות; עם זאת, מחקרים אחרונים גילו כי תאים בודדים יכולים להפגין תגובות דו-יציבות, ולהציג מעברים בולטים בין חוסר תגובה לתגובה מלאה המתרחשים בסף ריכוז אינסולין ספציפי 8,9.
הדמיית העברת אנרגיית תהודה של פורסטר (FRET) היא כלי רב עוצמה לחקר ההתפלגות המרחבית-זמנית של ביומולקולות בתאים חיים10. על ידי חילוץ מידע מדינמיקה מולקולרית, FRET מספק תובנות לגבי תהליכים כגון הפעלת Akt בזמן אמת, מה שהופך אותו לטכניקה שלא יסולא בפז לחקר תאים חיים11,12. שיטת הדמיה זו הוכחה כחיונית בחקר הדינמיקה התאית, במיוחד במחלות מטבוליות וסרטן, שם אינטראקציות מולקולריות מדויקות הן קריטיות13. FRET מאפשר גם ניטור בזמן אמת של אינטראקציות מולקולריות, ושופך אור על מנגנונים כגון עמידות לאינסולין והתקדמות הגידול14,15. חיישני FRET ביולוגיים חיוניים בחקר הסרטן לחקר מיקרו-סביבות גידול, עמידות לתרופות והפרעות מטבוליות16. שיטות זיהוי FRET, כגון פליטה רגישה (SE), הלבנת מקבל (AB), מיקרוסקופ הדמיה לכל החיים פלואורסצנטי (FLIM) וספקטרוסקופיה, כל אחת מהן מציעה יתרונות מובהקים לכימות אינטראקציות מולקולריות17. SE מודד העברת אנרגיה בין פלואורופורים תורמים ומקבלים, וכתוצאה מכך שינוי מדיד בספקטרום הפליטה המתאם עם הקרבה של ביומולקולות אינטראקטיביות18. AB משתמש בפוטו-הלבנה סלקטיבית של הפלואורופור המקבל ועוקב אחר שינויים בפלואורסצנטיות של התורם, מה שמאפשר לחוקרים להעריך קינטיקה ומרחקים של אינטראקציה19. FLIM מעריך את שיעורי הדעיכה הקרינה של הפלואורופור התורם, המושפעים ישירות מיעילות FRET, כדי לספק מדידות מדויקות בקנה מידה ננומטרי של אינטראקציות מולקולריות20.
באמצעות טכניקות FRET, הדגמנו לאחרונה תגובות אינסולין דו-יציבות ב-myotubes שמקורם ב-C2C12 8,9,21,22,23,24. ספי ההפעלה והכיבוי המובהקים להפעלת Akt, כפי שגילינו, מצביעים על כך שתגובת מינון האינסולין המדורגת בכל הגוף סותרת את המורכבות של מפל האיתות התת-תאי החל מגירוי אינסולין, שמגיע לשיאו בתגובה של הכל או כלום ברמת התא הבודד 21,22,23,24. כדי לבחון נוכחות של דו-יציבות בסוגי תאים אחרים, גירינו תאי HepG2 עם אינסולין ורשמנו את תגובתם באמצעות הדמיית FRET של תא בודד. גירינו תאי HepG2 עם ריכוזי אינסולין משתנים וניטרנו את פעילות Akt ברמת התא הבודד באמצעות חיישן ביולוגי של Akt. החיישן הביולוגי של Akt כולל חלבון פלואורסצנטי ציאן משופר (ECFP)25 כפלואורופור התורם והגרסה הבהירה ביותר של חלבון פלואורסצנטי צהוב (YPet)26 כפלואורופור המקבל, המקושר על ידי מקשר Eevee המכיל את רצף הפפטידים SGRPRTTTFADSCKP. פפטיד זה פועל כמצע ל-Akt זרחני (pAkt), המותאם לגליקוגן סינתאז קינאז אנושי 3β (GSK3β). במצבו הלא זרחני, ההפרדה המרחבית בין הפלואורופורים התורם והמקבל עולה על רדיוס פורסטר, המעכב את העברת האנרגיה. עם גירוי אינסולין, מתרחשת זרחון Akt ומוביל לזרחון של SGRPRTTTFADSCKP. תהליך זה גורם לשינוי קונפורמציה המביא את התורם והמקבל לרדיוס פורסטר, ומאפשר FRET27. כתוצאה מכך, עוצמת אות ה-FRET מתואמת עם כמות מולקולות ה-Akt הזרחניות ומאפשרת כימות בזמן אמת של תגובות תאיות בתיווך אינסולין.
פרוטוקול זה, שפותח בתחילה כדי לחקור איתות אינסולין בשרירים שמקורם ב-C2C12, יושם בהצלחה על תאי HepG2 ונעשה בו שימוש בפלטפורמות חומרה ותוכנה שונות, ובכך מדגים את הישימות שלו, יכולת ההסתגלות והרבגוניות שלו. תאי HepG2 מציגים פעילות Akt מכוננת, מה שהופך אותם למודל אידיאלי במבחנה לחקר איתות אינסולין ספציפי לכבד ותהליכים מטבוליים. התכונות העיקריות של הפרוטוקול מתוארות שלב אחר שלב בסעיף הפרוטוקול.
Protocol
סקירה כללית של השלבים הניסיוניים המעורבים בהדמיית תאים חיים FRET לניטור זרחון Akt בתאי HepG2 בודדים מוצגת באיור 1.
1. רכישה, התפשטות וטיהור פלסמיד
הערה: סעיף זה מתאר את השלבים החיוניים לרכישה, הגברה וטיהור הפלסמיד הנדרש לניתוח FRET של תא יחיד.
- השתמש בפלסמיד pEevee-iAkt-NES-YPet (איור 2A).
הערה: הפלסמיד סופק בנדיבות על ידי פרופ' קזוהירו אאוקי במכון הלאומי לביולוגיה בסיסית (NIBB), יפן.מפות פלסמיד עבור חיישני הביו-FRET המשמשים לניטור Akt והבקרות שלהם בהתאמה מתוארות באיור 2. ה-pEevee-iAkt-NES-ECFP (תורם; איור 2B) ו-pEevee-iAkt-NES-Ypet (מקבל; איור 2C) פלסמידים משמשים כבקרות כיול במהלך ניסויי FRET9.
הערה: איור 3 מציג את ההרכב והמנגנון של החיישן הביולוגי FRET התוך-מולקולרי. - כדי להפיץ את הפלסמיד, בצע טרנספורמציה חיידקית באמצעות תאי E. coli מוכשרים כימית (ראה טבלת חומרים). צלחת את התאים שעברו טרנספורמציה על אגר לוריא-ברטאני (LB) המכיל 100 מיקרוגרם/מ"ל אמפיצילין ודגירה למשך הלילה ב-37 מעלות צלזיוס. למחרת, בחר מושבה עמידה לאמפיצילין ותרבית אותה במרק LB בתוספת 100 מיקרוגרם/מ"ל אמפיצילין להגברת פלסמיד.
- כדי לטהר את ה-DNA של הפלסמיד, השתמש בערכת טיהור DNA פלסמיד זמינה מסחרית (ראה טבלת חומרים) כדי להשיג טוהר ותשואה גבוהים. הערכת איכות ה-DNA על ידי מדידת יחסי ספיגה (A260/A280 ו-A260/A230) באמצעות ספקטרופוטומטר (ראה טבלת חומרים). יחסים בין 1.8-2.0 ו-2.0-2.2 נחשבים אופטימליים. ודא את תקינות הפלסמיד באמצעות אלקטרופורזה של ג'ל אגרוז כדי להבטיח שהוא מתאים לטרנספקציה.
2. הליך תרבית תאים
הערה: בצע את כל הליכי תרבית התאים בתוך מכסה זרימה למינרי כדי לשמור על סביבה סטרילית ולמנוע זיהום. זרימת העבודה של תרבית תאים HepG2 מוצגת באיור 4. המדיה המלאה לתאי HepG2 מורכבת ממדיום חיוני מינימלי (MEM), 10% סרום בקר עוברי (FBS), 1% חומצות אמינו לא חיוניות (NEAA), 1 מ"מ נתרן פירובט, 2 מ"מ תוסף L-גלוטמין, 100 U/mL פניצילין-סטרפטומיצין ו-2.5 מיקרוגרם/מ"ל תמיסה אנטיביוטית-אנטי-פטרייקוטית (ראה טבלת חומרים, טבלה 1).
- הפשרה מהירה של תאי HepG2 קפואים על ידי הנחת הבקבוקון בתרמו-מיקסר של 37 מעלות צלזיוס או באמבט מים עד להפשרה מלאה.
- העבירו את התאים המופשרים לצינור חרוטי של 15 מ"ל המכיל 10 מ"ל של מצע גידול שלם (ראה טבלת חומרים).
הערה: יש לחמם מראש את מדיום הגידול המלא ל-37 מעלות צלזיוס לפני השימוש כדי למזער הלם תרמי לתאים. - צנטריפוגה את הצינור ב-200 x גרם למשך 5 דקות כדי לגלול את התאים.
- שאפו בזהירות את הסופרנטנט באמצעות קצה פיפטה רחב קדח כדי למנוע הפרעה לכדור התא.
- השעו מחדש את הגלולה ב -10 מ"ל של מדיום גידול שלם טרי.
- העבירו את תרחיף התאים לבקבוק תרבית רקמה בגודל 75 ס"מ.
- דגרו את הבקבוק בטמפרטורה של 37 מעלות צלזיוס באווירה לחה עם 5% CO2
הערה: התבונן בתאים במהלך 24-48 השעות הבאות כדי לאשר את ההתקשרות ולהעריך את ההתאוששות. אל תפריע לתאים למשך 4 שעות לפחות כדי להבטיח הצמדה נכונה לפני החלפת המדיום. הימנע מפתיחת החממה לעתים קרובות במהלך 4 השעות הראשונות, מכיוון שהדבר עלול לשבש את חיבור התאים. עקוב אחר פרוטוקולי בטיחות ביולוגית מוסדיים והשתמש בציוד מגן אישי מתאים (PPE) כדי לשמור על סביבת עבודה בטוחה במהלך כל הליכי תרבית התאים. תת-תרבית תאי HepG2 כאשר הם מגיעים למפגש של 70%-80% לשמירה על תנאי גידול אופטימליים ומניעת צפיפות, מה שעלול להשפיע על כדאיות התאים ופוטנציאל הצמיחה. - לתת-תרבית, שאפו את המדיום ושטפו את התאים פעם אחת עם 5 מ"ל של מי מלח עם חוצץ פוספט (PBS).
- הוסף 1 מ"ל של 0.25% טריפסין כדי לכסות את שכבת התא החד-שכבתית (ראה טבלת חומרים).
הערה: ודא שהטריפסין מחומם מראש ל-37 מעלות צלזיוס לפעילות מיטבית. אל תנסה יתר על המידה את התאים, מכיוון שהדבר עלול להפחית את הכדאיות. עקוב אחר התאים במיקרוסקופ כדי לאשר ניתוק. - דגירה בטמפרטורה של 37 מעלות צלזיוס למשך כ-5 דקות.
- כאשר התאים מתנתקים, הוסף 2 מ"ל של מדיום שלם כדי לנטרל את הטריפסין ולאסוף את התאים על ידי פיפטינג.
- פיפטה בעדינות את מתלה התא כדי לפרק גושים ולהשיג תרחיף חד-תאי.
- הוסף 3 מ"ל של מדיום שלם לכל בקבוק חדש, ולאחר מכן העביר את התאים ביחס מפוצל של 1:2 לכל בקבוק.
הערה: עבור קטעים מוקדמים, פצל את התאים בדילול של 1:2. לאחר פסקאות 4-5, ניתן לבצע דילולים של 1:4 או 1:5 לפי הצורך. - דגרו על התאים בטמפרטורה של 37 מעלות צלזיוס באטמוספירה לחה עם 5% CO2.
הערה: בדוק את התאים לאחר 24 שעות כדי לאשר את ההתקשרות ולהעריך את ההתאוששות. - לתרבית שגרתית, החלף את מדיום התרבות כל 2-3 ימים או מוקדם יותר אם מחוון ה- pH משתנה מוורוד לצהוב, מה שמעיד על החמצה.
הערה: אל תתנו למדיום להיות חומצי מדי, מכיוון שהדבר עלול לפגוע בתאים. - בדוק את המורפולוגיה של התא באופן קבוע תחת מיקרוסקופ כדי להבטיח את בריאות התא.
הערה: לאחסון לטווח קצר, הקפיאו תאי HepG2 בטמפרטורה של -80 מעלות צלזיוס; לאחסון לטווח הארוך, יש לאחסן בחנקן נוזלי. הרכב אמצעי ההקפאה ששימש בניסוי זה מתואר בטבלה 2.
3. ציפוי צלחות הדמיה בפולי-ליזין
- השתמש ב-1 מ"ל של תמיסת פולי-L-ליזין של 0.1 מ"ג/מ"ל לכל צלחת הדמיה כדי לכסות את כל פני השטח (ראה טבלת חומרים).
הערה: התאם את ריכוז הפולי-L-ליזין בהתאם לדרישות סוג התא הספציפיות. - נדנד את המנה בעדינות כדי להשיג ציפוי אחיד של משטח התרבות.
הערה: הקפידו על תנאים סטריליים לאורך כל התהליך כדי למנוע זיהום. - דגרו את הכלים למשך הלילה בטמפרטורת החדר (RT).
- שאפו עודפי תמיסת פולי-L-ליזין מהכלים על ידי פיפטינג החוצה.
- שטפו את המשטח עם PBS שלוש פעמים, במנוחה במשך 5 דקות בכל פעם (ראו טבלת חומרים). הסר לחלוטין את הפולי-L-ליזין הלא קשור מצלחת ההדמיה כדי למנוע עיכוב צמיחת תאים. שטפו את הצלחות בעדינות כדי למנוע גירוד או נזק לתחתית הזכוכית.
- יבש באוויר את כלי ההדמיה המצופים בטמפרטורה של 37 מעלות צלזיוס למשך 3 שעות לפחות.
- השתמש מיד בכלי ההדמיה המצופים או אחסן אותם בטמפרטורה של 4 מעלות צלזיוס למשך עד שבועיים.
4. טרנספקציה של תאי HepG2
הערה: שיטת הטרנספקציה HepG2 מודגמת באיור 5.
- תאי HepG2 זרעים בצלחות הדמיה מצופות מראש 24-48 שעות לפני הטרנספקציה כדי להבטיח שהם מגיעים למפגש של 70%-90%.
- הפשירו את מגיב הטרנספקציה והפלסמיד המקודד את החיישן הביולוגי FRET על קרח. מערבולת ביסודיות ובצע סיבוב קצר (למשל, 5,000 x גרם למשך 5 שניות) לפני השימוש (ראה טבלת חומרים).
הערה: ודא שמגיב הטרנספקציה והפלסמיד מופשרים במלואם לפני השימוש.
זהירות: הימנע ממחזורי הקפאה-הפשרה חוזרים ונשנים, מכיוון שהדבר עלול להפחית את היעילות של מגיב הטרנספקציה. - הוסף 8 מיקרוגרם של פלסמיד המקודד את החיישן הביולוגי FRET עם מאגר התגובה לנפח סופי של 100 מיקרוליטר. מערבבים היטב על ידי מערבולת במשך 5 שניות במהירות גבוהה (כ-3,000-5,000 x גרם).
הערה: הוסף תמיד פלסמיד למאגר לפני הוספת מגיב הטרנספקציה מבוסס הפולימר. לפחות 50 מיקרוליטר מהתמיסה חייבת להיות מורכבת ממאגר התגובה (ראה טבלת חומרים). - הוסף 2.4 מיקרוליטר של פולימר הטרנספקציה לצינור המכיל את ה-DNA של הפלסמיד המדולל. מערבבים היטב על ידי מערבולת במשך 15 שניות במהירות גבוהה (כ 3,000-5,000 × גרם).
הערה: השתמש תמיד ב-0.3 מיקרוליטר של פולימר הטרנספקציה לכל 1 מיקרוגרם של DNA.
זהירות: ודא שפולימר הטרנספקציה מעורבב היטב עם ה-DNA של הפלסמיד ליצירת קומפלקסים אחידים של ננו-חלקיקים. - דגרו את תערובת החיישן הביולוגי והפולימר ב-37 מעלות צלזיוס למשך 15 דקות כדי לאפשר היווצרות קומפלקסים של ננו-חלקיקים.
הערה: הימנע משמירה על פולימר הטרנספקציה בתמיסה במשך למעלה מ-30 דקות, מכיוון שהדבר עלול להפחית את יעילות ההעברה.
זהירות: עקוב אחר זמן הדגירה בקפידה כדי למנוע דגירה יתר, מה שעלול להוביל ליעילות טרנספקציה מופחתת. - סובב את הצינור למשך 5 שניות ב-5,000 x g כדי לאסוף את התוכן בתחתית, ולאחר מכן הוסף את כל 100 מיקרוליטר של תמיסה מורכבת של ננו-חלקיקים טיפה למדיום תרבית התא. נדנד בעדינות את הצלחת קדימה ואחורה כדי לערבב.
הערה: ודא שהתמיסה המורכבת של ננו-חלקיקים מתווספת טיפה כדי לפזר אותה באופן שווה על פני מדיום תרבית התאים.
זהירות: הימנע מנדנוד נמרץ, מכיוון שהדבר עלול לעקור תאים או לגרום לפיזור לא אחיד של המתחמים. - דגרו את הצלחת בטמפרטורה של 37 מעלות צלזיוס למשך 4 שעות עד לילה.
הערה: ניתן להתאים את זמן הדגירה על סמך צרכי הניסוי, אך 4 שעות מספיקות בדרך כלל להעברה יעילה.
אזהרה: יש להימנע מדגירה ממושכת (>16 שעות), מכיוון שהדבר עלול להפחית את חיוניות התאים. - הסר את קומפלקסי הננו-חלקיקים מהתאים על ידי שאיפה, החלף אותם ב-2 מ"ל של מצע גידול שלם טרי, והחזיר את הצלחת לחממה של 37 מעלות צלזיוס עד למועד הניתוח. ביטוי שיא מגיע בדרך כלל ל-48 שעות לאחר הטרנספקציה.
- נתח את התאים במיקרוסקופיה פלואורסצנטית.
הערה: ודא שהמיקרוסקופ מכויל כראוי להדמיית פלואורסצנטי כדי לקבל תוצאות מדויקות.
זהירות: צמצם את חשיפת התאים לאור עז במהלך ההדמיה כדי למנוע פוטוטוקסיות.
5. רעב של תאי HepG2
הערה: לאחר השלמת שלב הטרנספקציה, יש להרעיב את התאים בסרום לפני גירוי אינסולין והדמיית FRET. זה ממזער את הפעלת מסלול Akt עקב אינסולין הקיים ב-FBS ומבטיח רמות בסיס עקביות של פעילות Akt. הרכב תווך הרעב ששימש בניסוי זה מתואר בטבלה 3. BSA מגיע בצורת אבקה. להכנת תמיסה של 0.1% (w/v), יש להרכיב מחדש 0.1 גרם BSA ב-3 מ"ל DMEM, תוך ערבוב יסודי. עקרו את התמיסה באמצעות מסנן של 0.45 מיקרומטר והתאימו את הנפח הסופי ל-100 מ"ל על ידי הוספת DMEM.
- הסר את מדיום התרבית ושטוף את כלי ההדמיה עם PBS 1x פעמיים למשך 5 דקות כל אחד.
הערה: שתי שטיפות ה-PBS עוזרות להסיר לחלוטין שאריות סרום וכל אינסולין או גורמי גדילה שעלולים להפריע לניסוי. - הוסף 2 מ"ל של מדיום רעב לצלחות ההדמיה (ראה טבלת חומרים). מוסיפים בעדינות את המדיום סביב קצה הכלי כדי למנוע עקירת התאים מתחתית הזכוכית. יש לדגור בטמפרטורה של 37 מעלות צלזיוס למשך 4 שעות.
הערה: הדגירה של 4 שעות אופטימלית לסנכרון חילוף החומרים התאי; עם זאת, ניתן להאריך את משך הזמן בהתאם לצרכי הניסוי.
6. הדמיית תאים חיים FRET לתאי HepG2
הערה: סעיף זה מספק הוראות להדמיית תאים חיים של FRET לניטור הדינמיקה המרחבית-זמנית של זרחון Akt בתאי HepG2 בודדים. חיוני לייעל את הגדרת המיקרוסקופ, נהלי הטיפול ותנאי ההדמיה עבור תאי HepG2 חיים, כמפורט להלן. מערך המיקרוסקופ חיוני לאופטימיזציה של תנאי הדמיה להדמיית FRET. עקוב אחר הגדרת מיקרוסקופ סריקת לייזר PC/קונפוקלי (CLSM) שלב בהתאם להוראות היצרן כדי להבטיח פעולה יציבה. תצורת ה-CLSM המותאמת אישית להדמיית FRET מוצגת ב (איור 6).
- הפעל את המתג המרוחק כדי להפעיל את המיקרוסקופ, המחשב, הסורק, שיגור הלייזר, שלב הפיזו ומקור אור LED אפיפלואורסצנטי. ודא שכל הרכיבים מחוברים כהלכה לפני ההפעלה כדי למנוע נזק אפשרי.
- סובב את המקש למצב ON בשיגור הלייזר ולחץ על הכפתורים כדי להפעיל את שני הלייזרים הנדרשים ל-FRET (קווי לייזר של 457 ננומטר ו-514 ננומטר).
הערה: ודא שהמסננים וההגדרות המתאימים נמצאים במקום להדמיית FRET אופטימלית. בחירת קו הלייזר צריכה להתבסס על פרופילי העירור והפליטה של החיישן הביולוגי. - הפעל את מפצל החשמל כדי להפעיל את המחשב והצג המחוברים למיקרוסקופ.
הערה: ודא שכל החיבורים מאובטחים לפני ההפעלה כדי למנוע נזק לציוד. - היכנס ל-Windows והפעל את תוכנת המיקרוסקופיה.
- לחץ על A1 for Acquisition כדי להתחיל את הגדרת ההדמיה. בחר את התצורות האופטיות המתאימות על סמך הדרישות של ניסוי FRET.
- התאם את עוצמת הלייזר ורגישות הגלאי לפי הצורך לתנאי הדמיה מיטביים. התקן בזהירות את החממה העליונה של שלב המיקרוסקופ ואבטח אותו באמצעות ברגים.
הערה: אין להדק יתר על המידה את הברגים כדי למנוע נזק לחממה או למיקרוסקופtagה. - מלאו את אמבט המים הפנימי במים מזוקקים כפולים סטריליים (ddH2O). התקן את המחמם העליון בצורה מאובטחת והפעל את ספק הכוח עבור ה-stagמחמם, מחמם האמבטיה ומחמם העדשות (איור 7A).
הערה: אין למלא יתר על המידה כדי למנוע שפיכה למערכת. ודא שכל תנורי החימום פועלים כראוי כדי לשמור על תנאי טמפרטורה עקביים להדמיית תאים חיים. - השתמש בעדשת טבילת שמן 40x להדמיה (ראה טבלת חומרים).
הערה: עיין ביצרן webאתר למפרט טכני. - נגב את עדשת המטרה בנייר עדשה רטוב באתנול 95%. הנח טיפה קטנה של שמן טבילה על עדשת האובייקט (איור 7B). הנח את צלחת ההדמיה המכילה את תאי HepG2 על שלב המיקרוסקופ ואבטח אותה עם המחזיק (איור 7C).
הערה: ודא שצלחת ההדמיה מיושרת ומאובטחת כהלכה כדי למנוע תנועה במהלך ההדמיה. הימנע מלחץ על העדשה כדי למנוע נזק הן לעדשה והן לתחתית הזכוכית של הכלי. - סגרו את התא ודגרו על התאים בתוך תא התאים החיים למשך 1-2 שעות כדי לאפשר להם להתייצב בשיווי משקל (איור 7D).
- במהלך הדמיית זמן-lapse, עצור במרווחי זמן ספציפיים והסר בעדינות את המדיה (איור 7E), ולאחר מכן הוסף 1 מ"ל של מדיה טרייה שהוכנה עם ריכוז האינסולין הנתון (איור 7F, טבלת החומרים).
הערה: הכן תמיסת מלאי אינסולין של 1 מ"ג/מ"ל על ידי המסת 1 מ"ג אינסולין ב-1 מ"ל של 10 מ"ל של חומצה אצטית של 10 מ"מ. סנן את התמיסה דרך מסנן מזרק סטרילי של 0.2 מיקרומטר ואחסן את הכמויות בטמפרטורה של -20 מעלות צלזיוס. - הפעל את חלון רכישת ND מתפריט File של תוכנת המיקרוסקופיה.
הערה: הגדרת רכישת ND מוצגת ב (איור 8). - בחר את הכרטיסיה זמן כדי להגדיר את מרווח הזמן, משך הזמן והלולאות הרצויות עבור הדמיית זמן-lapse. לאחר מכן, לחץ על XY הכרטיסייה ולחץ על + להוסיף כפתור כדי לכלול תאי HepG2 בודדים להדמיה.
- כדי להוסיף תאים מרובים, אתר תאים מתאימים, סרוק, כוונן את המיקוד ונעל את פונקציית התפשטות הנקודה (PSF). חזור על שלב זה עבור כל תא חדש שנוסף להדמיה. סרוק תאים מרובים במיקומים שונים בתוך צלחות ההדמיה כדי לזהות תאי מטרה שונים להכללה.
- לחץ על סמל ה- X האדום כדי לבטל את הבחירה בתאים. סמן את התיבה 'Z' כדי להגדיר את מיקום Z. לאחר בחירת כל הפרמטרים, הזן את שם הניסוי בתיבה 'שם קובץ' .
- לחץ על עיון כדי לבחור את תיקיית היעד ולאחר מכן סמן את התיבה שמור בקובץ. לחץ על הפעל עכשיו הכרטיסייה כדי להתחיל את רכישת ה-ND. חלון רכישת ND יציג את ההתקדמות בזמן אמת של הדמיית זמן-lapse, כולל הזמן שחלף והזמן שנותר.
- רשום מדידות בסיסיות עד 30 דקות מבלי לגרות את התאים באינסולין.
- אתר תאים מתאימים, התקרב/הקטן כדי להביא תא בודד למיקוד ובחר תאים בעלי עוצמת פלואורסצנטיות גבוהה. הוסף את התאים בזה אחר זה, עד 6 תאים לכל היותר.
הערה: הגבל את מספר התאים כדי למנוע עיכובים ברכישת תמונות והקפאת חלונות במהלך ההדמיה. - הגדר את הזמן ואת תדירות ההדמיה עבור הדמיית דולג הזמן. התחל את הדמיית דולג הזמן.
הערה: ודא שכל הפרמטרים, כולל זמן החשיפה ועוצמת הלייזר, ממוטבים לפני תחילת הפעלת ההדמיה. - השהה את ההדמיה במרווחי זמן קבועים, הסר בעדינות את המדיה מכלי הזכוכית והוסף 1 מ"ל של מדיום בתוספת ריכוז האינסולין המתאים.
- המשך את רכישת התמונה. חזור על שלב 6.20 כנדרש.
- בסוף הניסוי, לחץ על הכרטיסייה סיום כדי לסגור. גבה ואחסן תמונות שנרכשו בצורה מאובטחת לניתוח.
7. ניתוח נתונים
- תקן את נתוני הדמיית ה-FRET המעובדים מראש מדגימות בקרה עבור הצלבה ספקטרלית ואוטופלואורסצנציה של CFP, מה שמביא לערכי FRET מתוקנים ויעילות FRET מדויקת. השתמש בתוכנת הדמיה לרכישה, עיבוד וניתוח של תמונות FRET, בהתאם לפרוטוקולים שתוארו במחקרים קודמים 27,28,29,30 (איור 9).
8. חישובי יעילות FRET
- כדי לקבוע את יעילות FRET, רכוש שבע תמונות: תא (IDA(D), IDD(D), IDA(A), IAA(A), IDD, IAA ו-IDA). חשב את יעילות ה- FRET באמצעות הנוסחה הבאה:
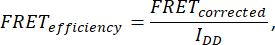
כאשר FRETCorrected מתקבל מהמשוואה:
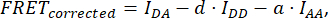
עם d ו-a מוגדרים כ:
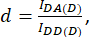
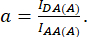
כאן IDA, IDD ו-IAA מייצגים תמונות של תאים שעברו טרנספטציה עם החיישן הביולוגי. IDA(D) ו-IDD(D)) הן תמונות בקרה של תורמים בלבד, ו-IDA(A) ו-IAA(A) הן תמונות בקרה של מקבלים בלבד.
9. רכישת תמונות
- IDA : השג את התמונה על ידי עירור תורם (434 ננומטר) עם פליטת מקבל (530 ננומטר).
- IDD : השג את התמונה על ידי עירור תורם (434 ננומטר) עם פליטת תורם (477 ננומטר).
- IAA : השג את התמונה על ידי עירור מקבל (517 ננומטר) עם פליטת מקבל (530 ננומטר).
- IDA(D) ו - IDA(A) : רכוש את התמונה באמצעות אותו עירור ופליטה כמו IDA אך מתאים המבטאים רק את התורם והמקבל, בהתאמה.
- IDD(D) : רכוש את התמונה באותם תנאים כמו IDD לשליטת התורם בלבד.
- IAA(A) : השג את התמונה תוך שימוש באותם תנאים כמו IAA אך היא ספציפית לבקרת המקבל בלבד.
10. תיקון רקע
- פתח את תוכנת ניתוח התמונות במחשב. משורת התפריטים העליונה, גש לתפריט קובץ. בחר פתח או פתח קובץ מהאפשרויות הנפתחות.
- נווט אל הספרייה המכילה את נתוני התמונה של זמן-lapse. אתר את תמונת דולג הזמן הדורשת ניתוח (למשל, פורמט nd2).
- בחר את הקובץ ולחץ על פתח או אישור כדי לטעון אותו לתוכנה להצגה וניתוח. הגדר אזור עניין (ROI) בתוך התא (או השתמש בתא כולו כ- ROI) ורשום את הערך האפור של כל פיקסל באזור זה.
- בחר אזור נטול תאים כרקע וחשב את ערך האפור הממוצע שלו. צור את התמונה המתוקנת על ידי הפחתת ממוצע רקע זה מערך האפור של כל פיקסל בתוך החזר ה-ROI של התא.
11. חיסול דימום FRET (הצלבה)
הערה: החפיפה הספקטרלית בין פליטת התורם לעירור המקבל מתוארת באיור 3B, שהיא קריטית ליעילות FRET ולתהליך העברת האנרגיה. דימום בהדמיית FRET בזמן-lapse הוא אתגר משמעותי הנובע מהחפיפה הספקטרלית של פלואורופורים תורמים ומקבלים, מה שמוביל למדידות לא מדויקות. דיבור צולב הוא אינהרנטי מכיוון שהספקטרום של הפלואורופורים התורמים והמקבלים חופפים במידה מסוימת (איור 3C, D). בעיה זו מחמירה על ידי גורמים כמו ריכוזי פלואורופור גבוהים ותצורות מסנן לא תקינות. טיפול בדימום הוא חיוני להבטחת האמינות של מדידות FRET.
- עיין במחקר קודם לשיטה להפחתת השפעות הדימום9.
12. כימות וניתוח סטטיסטי
- לבצע ניתוחים סטטיסטיים באמצעות תוכנת ניתוח סטטיסטי.
תוצאות
כדי לחקור את הפעלת Akt בתאי HepG2, התאים נזרעו על צלחות הדמיה מצופות מראש והועברו עם החיישן הביולוגי מבוסס FRET pEevee-iAkt-NES (איור 2A), שנועד לאפשר ניטור בזמן אמת של זרחון Akt. לאחר הטרנספקציה, התאים עברו רעב בסרום במשך 4 שעות במדיום נטול סרום כדי לסנכרן את מצבם המטבולי ?...
Discussion
הפרוטוקול להדמיית FRET של תאים חיים לניטור זרחון Akt בתאי HepG2 כולל מספר שלבים מרכזיים כדי להבטיח תוצאות אמינות וניתנות לשחזור. השלב הקריטי הראשון הוא תרבית תאים, הכוללת תחזוקה שוטפת של תאים, ציפוי צלחות הדמיה וזריעת תאים. ציפוי נכון חיוני לחיבור תאים במהלך ניסויי הדמיה בזמן-...
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
עבודה זו נתמכה בחלקה על ידי הקרן למדעי הטבע של שנזן (JCYJ20240813113606009), אזור שיתוף הפעולה שנג'ן-הונג קונג לטכנולוגיה וחדשנות (HZQB-KCZYB-2020056), הקרן הלאומית למדעי הטבע של סין (32070681), תוכנית המו"פ הלאומית של סין (2019YFA0906002) ותוכנית הטווס של שנזן (KQTD2016053117035204).
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin-EDTA | Gibco | Cat#25200-056 | Use ice-cold PBS for cell wash |
| 15 mm glass bottom cell culture dish | NEST | Cat#801001 | |
| 2 mL Nalgene cryogenic vials | Thermo Scientific | Cat#5012-0020 | |
| 5 mL Stripette Serological Pipets | Corning | Cat#4487 | |
| 95% Ethanol | Kermel | Cat#C028005 | |
| A1 HD25/A1R HD25 confocal microscope | Nikon | https://www.nikon.com/ | Magnification: 40×, Numerical Aperture (NA): 1.30, Pixel Dwell Time: 2.4 ms, Pixel Size: 1024 |
| Ampicillin | Sigma-Aldrich | Cat#A9393 | |
| Bovine serum albumin (BSA) | VWR Life Science | Cat#N208-10g | |
| Corning 25 cm2 rectangular culture flasks | Corning | Cat#430639 | |
| Countess 3 automated cell counter | Thermo Scientific | http://www.thermofisher.com/#AMQAX2000 | |
| Countess cell counting chamber slides | Thermo Scientific | http://www.thermofisher.com/#C10228 | |
| Digital vortex mixers | Thermo Scientific | https://www.thermofisher.com/ | |
| Dimethyl sulfoxide | Sigma-Aldrich | Cat#D2650 | |
| Eppendorf Safe-Lock Tubes 1.5 mL | Eppendorf | Cat#022363204 | |
| EZ-PCR mycoplasma detection kit | Biological Industries | Cat# 20-700-20 | |
| Fetal Bovine Serum, qualified, Australia | Gibco | Cat#10099141 | |
| GlutaMAX Supplement | Gibco | Cat#35050061 | |
| GraphPad Prism 9 | GraphPad Software | https://www.graphpad.com/ | |
| HepG2 | National Collection of Authenticated Cell Cultures | #CSTR:19375.09.3101HUMSCSP510 http://www.cellbank.org.cn/ | |
| Immersion Oil Type 37 | Cargille Laboratories | Cat #16237 | |
| Insulin | Sigma-Aldrich | Cat#I5500-50MG | Warm to 37 °C before use |
| LB Broth (1x) | Invitrogen | Cat#10855001 | |
| Minimum Essential Medium (MEM) | Gibco | Cat#11095080 | Warm to 37 °C before use |
| mySPIN 12 mini centrifuge | Thermo Scientific | https://www.thermofisher.com/ | |
| NanoDrop One | Thermo Scientific | https://www.thermofisher.com | |
| Nikon Plan Fluor 40×/1.30 Oil Lens | Nikon | https://www.nikon.com/ | |
| NIS-Elements-AR | Nikon | https://www.nikon.com/ | |
| Non-Essential Amino Acids (NEAA) (100x) | Gibco | Cat#11140050 | |
| One Shot LB Agar Plates | Invitrogen | Cat#A55802 | |
| One Shot Stbl3 chemically competent E. coli | Invitrogen | Cat#C737303 | |
| Parafilm | PARAFILM | Cat#B8R05606 | |
| PBS (phosphate buffered saline) | Gibco | Cat#10010023 | |
| pEevee-iAkt-NES (7,033 bp) | Miura et al31 | https://benchling.com/s/seq-q46zFYCfl0swLAun0t28/edit | |
| Penicillin-streptomycin | Gibco | Cat#15070063 | |
| Plasmocin prophylactic | InvivoGen | Cat#ant-mpp | |
| Poly-L-Lysine Hydrobromide | Sigma-Aldrich | Cat#P4832 | |
| Precision general purpose baths | Thermo Scientific | https://www.thermofisher.com/ | |
| QIAprep spin miniprep kit | QIAGEN | Cat#27106 | |
| SnapGene | SnapGene by Dotmatics | https://www.snapgene.com | |
| Sodium Pyruvate (100 mM) | Gibco | Cat#11360070 | |
| Syringe filter unit, 0.22 μm | Millipore | Cat#SLGP033RS | |
| Tokai Hit stage top incubator | TOKAI HIT | https://www.tokaihit-livecell.com/stagetopincubator | |
| UltraPure DNase/RNase-free distilled water | Invitrogen | Cat#10977015 | |
| Xfect Transfection Reagent | Takara Bio | Cat#631317 |
References
- GBD 2021 Diabetes Collaborators. Global, regional, and national burden of diabetes from 1990 to 2021, with projections of prevalence to 2050: a systematic analysis for the Global Burden of Disease Study 2021. Lancet. 402 (10397), 203-234 (2023).
- Li, M., et al. Trends in insulin resistance: insights into mechanisms and therapeutic strategy. Signal Transduct Target Ther. 7 (1), 216 (2022).
- Poloz, Y., Stambolic, V. Obesity and cancer, a case for insulin signaling. Cell Death Dis. 6 (12), e2037 (2015).
- Arcidiacono, B., et al. Insulin resistance and cancer risk: an overview of the pathogenetic mechanisms. Exp Diabetes Res. 2012, 789174 (2012).
- Godsland, I. F. Insulin resistance and hyperinsulinaemia in the development and progression of cancer. Clin Sci (Lond). 118 (5), 315-332 (2009).
- Tsugane, S., Inoue, M. Insulin resistance and cancer: epidemiological evidence. Cancer Sci. 101 (5), 1073-1079 (2010).
- Yudhani, R. D., et al. In vitro insulin resistance model: A recent update. J Obes. 2023, 1964732 (2023).
- Akhtar, J., et al. Bistable insulin response: The win-win solution for glycemic control. iScience. 25 (12), 105561 (2022).
- Akhtar, J., Imran, M., Wang, G. Protocol for live-cell Forster resonance energy transfer imaging to reveal the bistable insulin response of single C2C12-derived myotubes. STAR Protoc. 5 (2), 103109 (2024).
- Kamino, K., et al. Optimal inference of molecular interaction dynamics in FRET microscopy. Proc Natl Acad Sci U S A. 120 (15), e2211807120 (2023).
- Kraft, A. E., Nikolaev, V. O. FRET microscopy for real-time visualization of second messengers in living cells. Methods Mol Biol. 1563, 85-90 (2017).
- Veeriah, S., et al. High-throughput time-resolved FRET reveals Akt/PKB activation as a poor prognostic marker in breast cancer. Cancer Res. 74 (18), 4983-4995 (2014).
- Conway, J. R. W., et al. Monitoring AKT activity and targeting in live tissue and disease contexts using a real-time Akt-FRET biosensor mouse. Sci Adv. 9 (17), eadf9063 (2023).
- Chandris, P., Giannouli, C. C., Panayotou, G. Imaging approaches for the study of metabolism in real time using genetically encoded reporters. Front Cell Dev Biol. 9, 725114 (2021).
- Yang, J., et al. Longitudinal FRET imaging of glucose and lactate dynamics and response to therapy in breast cancer cells. Mol Imaging Biol. 24 (1), 144-155 (2022).
- Mandrou, E., et al. A reliable system for quantitative G-protein activation imaging in cancer cells. Cells. 13 (13), 1114 (2024).
- Fang, C., Huang, Y., Zhao, Y. Review of FRET biosensing and its application in biomolecular detection. Am J Transl Res. 15 (2), 694-709 (2023).
- Miller, J. N. Fluorescence energy transfer methods in bioanalysis. Analyst. 130 (3), 265-270 (2005).
- Verveer, P. J., Rocks, O., Harpur, A. G., Bastiaens, P. I. Imaging protein interactions by FRET microscopy: FRET measurements by acceptor photobleaching. CSH Protoc. 2006 (6), (2006).
- Vu, C. Q., Arai, S. Quantitative imaging of genetically encoded fluorescence lifetime biosensors. Biosensors (Basel). 13 (10), 939 (2023).
- Wang, G. A more holistic view of the logarithmic dose-response curve offers greater insights into insulin response. J Biol Chem. 301 (1), 108037 (2025).
- Wang, G. Body mass dynamics is determined by the metabolic Ohm's law and adipocyte-autonomous fat mass homeostasis. iScience. 23 (6), 101176 (2020).
- Wang, G. Raison d'être of insulin resistance: the adjustable threshold hypothesis. J R Soc Interface. 11 (101), 20140892 (2014).
- Wang, G. Optimal homeostasis necessitates bistable control. J R Soc Interface. 9, 2723 (2012).
- Heim, R., Tsien, R. Y. Engineering green fluorescent protein for improved brightness, longer wavelengths and fluorescence resonance energy transfer. Curr Biol. 6 (2), 178-182 (1996).
- Nguyen, A. W., Daugherty, P. S. Evolutionary optimization of fluorescent proteins for intracellular FRET. Nat Biotechnol. 23 (3), 355-360 (2005).
- Broussard, J. A., Rappaz, B., Webb, D. J., Brown, C. M. Fluorescence resonance energy transfer microscopy as demonstrated by measuring the activation of the serine/threonine kinase Akt. Nat Protoc. 8 (2), 265-281 (2013).
- Gordon, G. W., Berry, G., Liang, X. H., Levine, B., Herman, B. Quantitative fluorescence resonance energy transfer measurements using fluorescence microscopy. Biophys J. 74 (5), 2702-2713 (1998).
- Tron, L., et al. Flow cytometric measurement of fluorescence resonance energy transfer on cell surfaces. Quantitative evaluation of the transfer efficiency on a cell-by-cell basis. Biophys J. 45 (5), 939-946 (1984).
- Youvan, D. C., et al. Calibration of fluorescence resonance energy transfer in microscopy. , (2002).
- Miura, H., Matsuda, M., Aoki, K. Development of a FRET biosensor with high specificity for Akt. Cell Struct Funct. 39 (1), 9-20 (2014).
- Liberio, M. S., Sadowski, M. C., Soekmadji, C., Davis, R. A., Nelson, C. C. Differential effects of tissue culture coating substrates on prostate cancer cell adherence, morphology and behavior. PLoS One. 9 (11), e112122 (2014).
- Rani, K., Sengupta, S. Multi-stimuli programmable FRET based RGB absorbing antennae towards ratiometric temperature, pH and multiple metal ion sensing. Chem Sci. 12 (47), 15533-15542 (2021).
- Betolngar, D. B., et al. pH sensitivity of FRET reporters based on cyan and yellow fluorescent proteins. Anal Bioanal Chem. 407 (14), 4183-4193 (2015).
- Salonikidis, P. S., et al. An ion-insensitive cAMP biosensor for long term quantitative ratiometric fluorescence resonance energy transfer (FRET) measurements under variable physiological conditions. J Biol Chem. 286 (26), 23419-23431 (2011).
- Youvan, D. C., et al. Calibration of fluorescence resonance energy transfer in microscopy using genetically engineered GFP derivatives on nickel chelating beads. Biotechnol Alia. 3, 1-18 (1997).
- Menaesse, A., et al. Simplified instrument calibration for wide-field fluorescence resonance energy transfer (FRET) measured by the sensitized emission method. Cytometry A. 99 (4), 407-416 (2021).
- Batta, A., Hajdu, T., Nagy, P. Improved estimation of the ratio of detection efficiencies of excited acceptors and donors for FRET measurements. Cytometry A. 103 (7), 563-574 (2023).
- Coullomb, A., et al. QuanTI-FRET: a framework for quantitative FRET measurements in living cells. Sci Rep. 10 (1), 6504 (2020).
- Hoppe, A., Christensen, K., Swanson, J. A. Fluorescence resonance energy transfer-based stoichiometry in living cells. Biophys J. 83 (6), 3652-3664 (2002).
- Zal, T., Gascoigne, N. R. Photobleaching-corrected FRET efficiency imaging of live cells. Biophys J. 86 (6), 3923-3939 (2004).
- Hochreiter, B., Kunze, M., Moser, B., Schmid, J. A. Advanced FRET normalization allows quantitative analysis of protein interactions including stoichiometries and relative affinities in living cells. Sci Rep. 9 (1), 8233 (2019).
- Liu, H., Zhang, F., Mishra, S. K., Zhou, S., Zheng, J. Knowledge-guided fuzzy logic modeling to infer cellular signaling networks from proteomic data. Sci Rep. 6, 35652 (2016).
- Garrido-Rodriguez, M., Zirngibl, K., Ivanova, O., Lobentanzer, S., Saez-Rodriguez, J. Integrating knowledge and omics to decipher mechanisms via large-scale models of signaling networks. Mol Syst Biol. 18 (7), e11036 (2022).
- Greenwald, E. C., Polanowska-Grabowska, R. K., Saucerman, J. J. Integrating fluorescent biosensor data using computational models. Methods Mol Biol. 1071, 227-248 (2014).
- Zhao, Z., Xia, J. Computational Approaches for Modeling Signal Transduction Networks. Encyclopedia of Bioinformatics and Computational Biology. , (2019).
- Wang, G., Krueger, G. R. Computational analysis of mTOR signaling pathway: bifurcation, carcinogenesis, and drug discovery. Anticancer Res. 30 (7), 2683-2688 (2010).
- Wang, G. Singularity analysis of the AKT signaling pathway reveals connections between cancer and metabolic diseases. Phys Biol. 7 (4), 046015 (2010).
- Chedere, A., Hari, K., Kumar, S., Rangarajan, A., Jolly, M. K. Multi-stability and consequent phenotypic plasticity in AMPK-Akt double negative feedback loop in cancer cells. J Clin Med. 10 (3), 472 (2021).
- Mosca, E., et al. Computational modeling of the metabolic States regulated by the kinase akt. Front Physiol. 3, 418 (2012).
- Liao, J., Madahar, V., Dang, R., Jiang, L. Quantitative FRET (qFRET) technology for the determination of protein-protein interaction affinity in solution. Molecules. 26 (21), 6339 (2021).
- Verma, A. K., Noumani, A., Yadav, A. K., Solanki, P. R. FRET based biosensor: Principle applications recent advances and challenges. Diagnostics (Basel). 13 (8), 1375 (2023).
- Mattheisen, J. M., et al. Application of bioluminescence resonance energy transfer to quantitate cell-surface expression of membrane proteins. Anal Biochem. 684, 115361 (2024).
- Lionetti, M. C., La Porta, C. A. M. FLIM-FRET investigation of heterogeneous huntingtin aggregation in HeLa cells. Methods Mol Biol. 2551, 595-604 (2023).
- Petutschnig, E. K., Pierdzig, L., Mittendorf, J., Niebisch, J. M., Lipka, V. A novel fluorescent protein pair facilitates FLIM-FRET analysis of plant immune receptor interaction under native conditions. J Exp Bot. 75 (3), 746-759 (2024).
- Sprenger, J. U., Perera, R. K., Gotz, K. R., Nikolaev, V. O. FRET microscopy for real-time monitoring of signaling events in live cells using unimolecular biosensors. J Vis Exp. 66, e4081 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved