Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
HepG2 Hücrelerinde Metabolik Olarak Düzenlenmiş Akt Aktivasyon Dinamiğinin Canlı Hücre Förster Rezonans Enerji Transferi Görüntülemesi
Bu Makalede
Özet
Burada, canlı HepG2 hücrelerinde Akt aktivasyonu ve fosforilasyonunun uzay-zamansal dinamiklerini ölçmek için bir protokol sunuyoruz. Förster rezonans enerji transferi (FRET) görüntüleme, kanser hücrelerinde insülin sinyal yolları ve metabolik düzenleme hakkında değerli bilgiler sağlayan güçlü bir araçtır.
Özet
Metabolik olarak düzenlenmiş Akt aktivasyonu, insülin sinyal kaskadında kritik bir düğümdür ve diyabet ile kanser arasındaki ilişkiye dair değerli bilgiler sağlar. HepG2 hücrelerindeki Akt aktivitesini hassas bir şekilde ölçmek için, genetik olarak kodlanmış Akt'a özgü biyosensörlerle Förster Rezonans Enerji Transferini (FRET) kullanan sağlam, tekrarlanabilir bir protokol geliştirdik. Bu protokol, lazer taramalı konfokal mikroskop donanımı ve yazılım konfigürasyonu için özel yönergelerin yanı sıra, FRET tabanlı biyosensörleri eksprese etmek için hücre kültürü, görüntüleme kabı hazırlığı ve HepG2 hücrelerinin transfeksiyonu için ayrıntılı adımları ana hatlarıyla belirtir. Sonuçlar, tanımlanmış bir açma eşiği olan ancak kapanma eşiği olmayan yapısal Akt aktivasyonu ile karakterize edilen geri dönüşümsüz bir anahtar sergileyen HepG2 hücrelerinde benzersiz insülin sinyalleme modellerini gösterdi. Buna karşılık, miyotüpler tersine çevrilebilir bir anahtar gösterir. HepG2 hücrelerindeki kalıcı Akt aktivasyonu, metabolik bozuklukların ve kanserin ilerlemesini anlamak için daha geniş etkilerle birlikte, hepatik hücrelerde insülin direnci ve metabolik düzensizliğin altında yatan mekanizmaları düşündürmektedir. Bu protokol, çeşitli hastalık bağlamlarında Akt ile ilgili sinyal yollarını ve hücresel davranışları keşfetmek için değerli bir çerçeve sunar.
Giriş
Diabetes mellitus, insülin direnci ve bozulmuş glukoz homeostazı ile karakterize önemli bir küresel sağlık sorunu oluşturmaktadır1. İnsülin glikoz metabolizmasında, hücre büyümesinde ve sağkalımda çok önemli bir rol oynadığından, bu hastalığın patofizyolojisini aydınlatmak için insülin sinyal yollarının kapsamlı bir şekilde anlaşılması çok önemlidir2. Çok sayıda çalışma, insülin sinyalinin çeşitli kanserleri önemli ölçüde etkilediğini, insülin direncini tümör ilerlemesine ve kötü hasta sonuçlarına bağladığını göstermiştir 3,4,5,6. Yaygın olarak kullanılan bir hepatoselüler karsinom hücre hattı olan HepG2 hücreleri, insülin direncini ve metabolik düzensizlik ile kanser gelişimi arasındaki etkileşimi incelemek için değerli bir model görevi görür7. Geleneksel olarak, araştırmacılar insülin tepkilerini dereceli olarak görmüşlerdir; Bununla birlikte, son çalışmalar, tek tek hücrelerin, spesifik insülin konsantrasyon eşiklerindemeydana gelen yanıtsızlık ve tam yanıt arasında belirgin geçişler sergileyen iki durumlu yanıtlar sergileyebileceğini ortaya koymuştur 8,9.
Förster rezonans enerji transferi (FRET) görüntüleme, canlı hücrelerdeki biyomoleküllerin uzaysal-zamansal dağılımını incelemek için güçlü bir araçtır10. FRET, moleküler dinamiklerden bilgi çıkararak, gerçek zamanlı olarak Akt aktivasyonu gibi süreçler hakkında bilgi sağlar ve bu da onu canlı hücreleri incelemek için paha biçilmez bir teknik haline getirir11,12. Bu görüntüleme yönteminin, özellikle kesin moleküler etkileşimlerin çok önemli olduğu metabolik hastalıklar ve kanserde hücresel dinamiklerin incelenmesinde gerekli olduğu kanıtlanmıştır13. FRET ayrıca moleküler etkileşimlerin gerçek zamanlı olarak izlenmesini sağlayarak insülin direnci ve tümör ilerlemesi gibi mekanizmalara ışık tutar14,15. FRET biyosensörleri, tümör mikro ortamlarını, ilaç direncini ve metabolik bozuklukları incelemek için kanser araştırmalarında çok önemlidir16. Hassaslaştırılmış emisyon (SE), alıcı ağartma (AB), floresan ömür boyu görüntüleme mikroskobu (FLIM) ve spektroskopi gibi FRET algılama yöntemlerinin her biri moleküler etkileşimleri ölçmek için belirgin avantajlar sunar17. SE, verici ve alıcı floroforlar arasındaki enerji transferini ölçerek, etkileşen biyomoleküllerin18 yakınlığı ile ilişkili emisyon spektrumlarında ölçülebilir bir kayma ile sonuçlanır. AB, alıcı floroforun seçici fotoağartmasını kullanır ve donör floresansındaki değişiklikleri izler, bu da araştırmacıların etkileşim kinetiğini ve mesafelerini19 değerlendirmesine olanak tanır. FLIM, moleküler etkileşimlerin20 hassas nano ölçekli ölçümlerini sağlamak için FRET verimliliğinden doğrudan etkilenen donör floroforun floresan bozunma oranlarını değerlendirir.
FRET tekniklerini kullanarak, yakın zamanda C2C12 türevi miyotüplerde 8,9,21,22,23,24 bistabil insülin yanıtları gösterdik. Keşfettiğimiz gibi, Akt aktivasyonu için farklı açma ve kapama eşikleri, kademeli tüm vücut insülin doz yanıtının, insülin uyaranından başlayarak hücre altı sinyal kaskadının karmaşıklığını yalanladığını ve bu da tek hücre düzeyinde ya hep ya hiç yanıtı ile sonuçlandığını göstermektedir 21,22,23,24. Diğer hücre tiplerinde bistabilitenin varlığını test etmek için, HepG2 hücrelerini insülin ile uyardık ve yanıtlarını tek hücreli FRET görüntüleme kullanarak kaydettik. HepG2 hücrelerini değişen insülin konsantrasyonları ile uyardık ve bir Akt biyosensörü kullanarak tek hücre düzeyinde Akt aktivitesini izledik. Akt biyosensörü, donör florofor olarak gelişmiş camgöbeği floresan proteini (ECFP)25 ve alıcı florofor olarak sarı floresan proteinin (YPet) en parlak varyantını içerir.26, peptit dizisi SGRPRTTTFADSCKP içeren bir Eevee bağlayıcı ile bağlanır. Bu peptit, insan glikojen sentaz kinaz 3β'dan (GSK3β) optimize edilmiş fosforile Akt (pAkt) için bir substrat görevi görür. Fosforile edilmemiş durumda, verici ve alıcı floroforlar arasındaki uzamsal ayrım, enerji transferini engelleyen Förster yarıçapını aşıyor. İnsülin stimülasyonu üzerine, Akt fosforilasyonu meydana gelir ve SGRPRTTTFADSCKP'nin fosforilasyonuna yol açar. Bu süreç, vericiyi ve alıcıyı Förster yarıçapı içine getiren ve FRET27'yi mümkün kılan konformasyonel bir değişikliğe neden olur. Sonuç olarak, FRET sinyal yoğunluğu, fosforile Akt moleküllerinin miktarı ile ilişkilidir ve insülin aracılı hücresel yanıtların gerçek zamanlı olarak ölçülmesine izin verir.
Başlangıçta C2C12'den türetilmiş miyotüplerde insülin sinyalini incelemek için geliştirilen bu protokol, HepG2 hücrelerine başarıyla uygulanmış ve farklı donanım ve yazılım platformlarında kullanılmıştır, böylece uygulanabilirliğini, uyarlanabilirliğini ve çok yönlülüğünü göstermiştir. HepG2 hücreleri, yapısal Akt aktivitesi sergiler, bu da onları karaciğere özgü insülin sinyalini ve metabolik süreçleri incelemek için ideal bir in vitro model yapar. Protokolün temel özellikleri protokol bölümünde adım adım açıklanmıştır.
Protokol
Tek HepG2 hücrelerinde Akt fosforilasyonunu izlemek için FRET canlı hücre görüntülemede yer alan deneysel adımlara genel bir bakış Şekil 1'de gösterilmektedir.
1. Plazmid edinimi, yayılması ve saflaştırılması
NOT: Bu bölüm, tek hücreli FRET analizi için gerekli olan plazmidin elde edilmesi, çoğaltılması ve saflaştırılması için temel adımları özetlemektedir.
- pEevee-iAkt-NES-YPet plazmidini kullanın (Şekil 2A).
NOT: Plazmid, Japonya'daki Ulusal Temel Biyoloji Enstitüsü'nden (NIBB) Prof. Kazuhiro Aoki tarafından cömertçe sağlanmıştır.Akt izleme için kullanılan FRET biyosensörleri ve ilgili kontrolleri için plazmid haritaları Şekil 2'de gösterilmektedir. pEevee-iAkt-NES-ECFP (bağışçı; Şekil 2B) ve pEevee-iAkt-NES-Ypet (alıcı; Şekil 2C) Plazmitler, FRET deneyleri9 sırasında kalibrasyon kontrolleri olarak kullanılır.
NOT: Şekil 3 , molekül içi FRET biyosensörünün bileşimini ve mekanizmasını göstermektedir. - Plazmidi çoğaltmak için, kimyasal olarak yetkin E. coli hücreleri kullanarak bakteriyel transformasyon gerçekleştirin (bkz. Malzeme Tablosu). Dönüştürülmüş hücreleri 100 μg / mL ampisilin içeren Luria-Bertani (LB) agar üzerine yerleştirin ve gece boyunca 37 ° C'de inkübe edin. Ertesi gün, ampisiline dirençli bir koloni seçin ve plazmid amplifikasyonu için 100 μg/mL ampisilin ile takviye edilmiş LB suyunda kültürleyin.
- Plazmit DNA'yı saflaştırmak için, yüksek saflık ve verim elde etmek için ticari olarak temin edilebilen bir plazmit DNA saflaştırma kiti ( Malzeme Tablosuna bakınız) kullanın. Bir spektrofotometre kullanarak absorbans oranlarını (A260 / A280 ve A260 / A230) ölçerek DNA kalitesini değerlendirin (bkz. 1.8-2.0 ve 2.0-2.2 arasındaki oranlar optimal olarak kabul edilir. Transfeksiyon için uygun olduğundan emin olmak için agaroz jel elektroforezi yoluyla plazmit bütünlüğünü doğrulayın.
2. Hücre kültürü prosedürü
NOT: Steril bir ortam sağlamak ve kontaminasyonu önlemek için tüm hücre kültürü prosedürlerini bir laminer akış başlığı içinde gerçekleştirin. HepG2 hücre kültürü iş akışı Şekil 4'te gösterilmiştir. HepG2 hücreleri için komple besiyeri, Minimum Esansiyel Besiyeri (MEM), %10 fetal sığır serumu (FBS), %1 Esansiyel Olmayan Amino Asitler (NEAA), 1 mM Sodyum Piruvat, 2 mM L-glutamin takviyesi, 100 U/mL Penisilin-Streptomisin ve 2.5 μg/mL antibiyotik-antimikotik solüsyondan oluşur (bkz. Malzeme Tablosu, Tablo 1).
- Dondurulmuş HepG2 hücrelerini, şişeyi tamamen çözülene kadar 37 ° C'lik bir termomikser veya su banyosuna yerleştirerek hızla çözün.
- Çözülmüş hücreleri, 10 mL tam büyüme ortamı içeren 15 mL'lik konik bir tüpe aktarın (bkz. Malzeme Tablosu).
NOT: Hücrelere termal şoku en aza indirmek için kullanmadan önce tüm büyüme ortamını 37 °C'ye kadar önceden ısıtın. - Hücreleri peletlemek için tüpü 200 x g'da 5 dakika santrifüjleyin.
- Hücre peletini rahatsız etmemek için geniş delikli bir pipet ucu kullanarak süpernatanı dikkatlice aspire edin.
- Peletleri 10 mL taze tam büyüme ortamında yeniden süspanse edin.
- Hücre süspansiyonunu 75 cm²'lik bir doku kültürü şişesine aktarın.
- Şişeyi 37 °C'de% 5 CO2 ile nemlendirilmiş bir atmosferde inkübe edin
NOT: Eki onaylamak ve iyileşmeyi değerlendirmek için hücreleri sonraki 24-48 saat boyunca gözlemleyin. Ortamı değiştirmeden önce düzgün bağlanmayı sağlamak için hücreleri en az 4 saat rahatsız etmeyin. İlk 4 saat boyunca inkübatörü sık sık açmaktan kaçının, çünkü bu hücre bağlanmasını bozabilir. Tüm hücre kültürü prosedürleri sırasında güvenli bir çalışma ortamı sağlamak için kurumsal biyogüvenlik protokollerini takip edin ve uygun kişisel koruyucu ekipman (KKD) kullanın. HepG2 hücrelerini, optimal büyüme koşullarını korumak ve hücre canlılığını ve büyüme potansiyelini etkileyebilecek aşırı kalabalıklaşmayı önlemek için %70-80 birleşmeye ulaştıklarında alt kültür. - Alt kültürleme için, ortamı aspire edin ve hücreleri bir kez 5 mL fosfat tamponlu salin (PBS) ile durulayın.
- Hücre tek tabakasını kaplamak için 1 mL% 0.25 tripsin ekleyin (Malzeme Tablosuna bakınız).
NOT: Optimum aktivite için tripsinin 37 °C'ye önceden ısıtıldığından emin olun. Hücreleri aşırı tripsinize etmeyin, çünkü bu canlılığı azaltabilir. Ayrılmayı doğrulamak için hücreleri mikroskop altında izleyin. - 37 °C'de yaklaşık 5 dakika inkübe edin.
- Hücreler ayrıldığında, tripsini nötralize etmek için 2 mL tam ortam ekleyin ve hücreleri pipetleme yoluyla toplayın.
- Topakları parçalamak ve tek hücreli bir süspansiyon elde etmek için hücre süspansiyonunu nazikçe pipetleyin.
- Her yeni şişeye 3 mL tam ortam ekleyin, ardından hücreleri her şişeye 1:2 oranında bölünerek aktarın.
NOT: Erken geçişler için, hücreleri 1:2 oranında seyrelterek bölün. 4-5. pasajlardan sonra, uygun şekilde 1:4 veya 1:5 oranında seyreltmeler gerçekleştirilebilir. - Hücreleri 37 °C'de% 5 CO2 ile nemlendirilmiş bir atmosferde inkübe edin.
NOT: Eki onaylamak ve kurtarmayı değerlendirmek için 24 saat sonra hücreleri kontrol edin. - Rutin kültür için, pH indikatörü pembeden sarıya değişirse ve asitlenmeyi gösterirse kültür ortamını her 2-3 günde bir veya daha erken değiştirin.
NOT: Hücrelere zarar verebileceğinden ortamın çok asidik hale gelmesine izin vermeyin. - Hücre sağlığını sağlamak için hücre morfolojisini düzenli olarak mikroskop altında kontrol edin.
NOT: Kısa süreli depolama için HepG2 hücrelerini -80 °C'de dondurun; Uzun süreli depolama için sıvı nitrojen içinde saklayın. Bu deneyde kullanılan dondurma ortamının bileşimi (Tablo 2)'de özetlenmiştir.
3. Görüntüleme kaplarının poli-l-lizin ile kaplanması
- Tüm yüzeyi kaplamak için görüntüleme kabı başına 1 mL 0.1 mg / mL Poli-L-Lizin çözeltisi kullanın (Malzeme Tablosuna bakınız).
NOT: Poli-L-Lizin konsantrasyonunu belirli hücre tipi gereksinimlerine göre ayarlayın. - Kültür yüzeyinin düzgün bir şekilde kaplanmasını sağlamak için tabağı hafifçe sallayın.
NOT: Kontaminasyonu önlemek için süreç boyunca steril koşullar sağlayın. - Bulaşıkları gece boyunca oda sıcaklığında (RT) inkübe edin.
- Pipetleyerek bulaşıklardan fazla Poli-L-Lizin çözeltisini aspire edin.
- Yüzeyi PBS ile üç kez durulayın, her seferinde 5 dakika dinlendirin ( Malzeme Tablosuna bakınız). Hücre büyümesinin inhibisyonunu önlemek için bağlanmamış Poli-L-Lizin'i görüntüleme kabından tamamen çıkarın. Cam tabanın kazınmasını veya zarar görmesini önlemek için plakaları nazikçe durulayın.
- Kaplanmış görüntüleme kaplarını en az 3 saat boyunca 37 °C'de havayla kurutun.
- Kaplanmış görüntüleme kaplarını hemen kullanın veya 4 °C'de 2 haftaya kadar saklayın.
4. HepG2 hücrelerinin transfeksiyonu
NOT: HepG2 transfeksiyon yöntemi Şekil 5'te gösterilmiştir.
- HepG2 hücrelerini, transfeksiyondan 24-48 saat önce önceden kaplanmış görüntüleme kaplarına tohumlayın ve %70-90 birleşmeye ulaştıklarından emin olun.
- FRET biyosensörünü kodlayan transfeksiyon reaktifini ve plazmidi buz üzerinde çözün. Kullanmadan önce iyice girdap yapın ve kısa bir dönüş yapın (örn. 5,000 saniye boyunca 5 x g) ( Malzeme Tablosuna bakın).
NOT: Kullanmadan önce transfeksiyon reaktifinin ve plazmidin tamamen çözüldüğünden emin olun.
DİKKAT: Transfeksiyon reaktifinin verimliliğini azaltabileceğinden, tekrarlanan donma-çözülme döngülerinden kaçının. - FRET biyosensörünü reaksiyon tamponu ile kodlayan 8 μg plazmidi 100 μL'lik bir nihai hacme ekleyin. Yüksek hızda (yaklaşık 3.000-5.000 x g) 5 saniye vorteksleyerek iyice karıştırın.
NOT: Polimer bazlı transfeksiyon reaktifini eklemeden önce daima tampona plazmit ekleyin. Çözeltinin en az 50 μL'si reaksiyon tamponundan oluşmalıdır (bkz. Malzeme Tablosu). - Seyreltilmiş plazmit DNA'sını içeren tüpe 2.4 μL transfeksiyon polimeri ekleyin. Yüksek hızda (yaklaşık 3.000-5.000 × g) 15 saniye girdap yaparak iyice karıştırın.
NOT: Her zaman 1 μg DNA başına 0,3 μL transfeksiyon polimeri kullanın.
DİKKAT: Tek tip nanopartikül kompleksleri oluşturmak için transfeksiyon polimerinin plazmit DNA ile iyice karıştırıldığından emin olun. - Nanopartikül komplekslerinin oluşmasına izin vermek için biyosensör ve polimer karışımını 37 ° C'de 15 dakika inkübe edin.
NOT: Transfeksiyon polimerini 30 dakikadan fazla çözelti içinde tutmaktan kaçının, çünkü bu transfeksiyon verimliliğini azaltabilir.
DİKKAT: Transfeksiyon verimliliğinin azalmasına neden olabilecek aşırı inkübasyonu önlemek için inkübasyon süresini dikkatlice izleyin. - Alttaki içeriği toplamak için tüpü 5.000 x g'da 5 saniye boyunca döndürün, ardından 100 μL nanopartikül kompleks çözeltisinin tamamını hücre kültürü ortamına damla damla ekleyin. Karıştırmak için plakayı hafifçe ileri geri sallayın.
NOT: Nanopartikül kompleks çözeltisinin, hücre kültürü ortamına eşit olarak dağıtmak için damla damla eklendiğinden emin olun.
DİKKAT: Hücreleri yerinden oynatabileceğinden veya komplekslerin eşit olmayan dağılımına neden olabileceğinden, kuvvetli sallanmaktan kaçının. - Plakayı 37 ° C'de 4 saat ila gece boyunca inkübe edin.
NOT: Kuluçka süresi deneysel ihtiyaçlara göre ayarlanabilir, ancak verimli transfeksiyon için tipik olarak 4 saat yeterlidir.
DİKKAT: Uzun süreli inkübasyondan (>16 saat) kaçının, çünkü bu hücre canlılığını azaltabilir. - Nanopartikül komplekslerini aspirasyon ile hücrelerden çıkarın, bunları 2 mL taze tam büyüme ortamı ile değiştirin ve plakayı analiz zamanına kadar 37 ° C inkübatöre geri koyun. En yüksek ekspresyon tipik olarak transfeksiyondan 48 saat sonra ulaşır.
- Hücreleri floresan mikroskobu altında analiz edin.
NOT: Doğru sonuçlar elde etmek için mikroskobun floresan görüntüleme için uygun şekilde kalibre edildiğinden emin olun.
DİKKAT: Fototoksisiteyi önlemek için görüntüleme sırasında hücrelerin yoğun ışığa maruz kalmasını en aza indirin.
5. HepG2 hücrelerinin açlıktan ölmesi
NOT: Transfeksiyon adımını tamamladıktan sonra, insülin stimülasyonu ve FRET görüntülemeden önce hücreleri serumdan aç bırakın. Bu, FBS'de bulunan insüline bağlı Akt yolu aktivasyonunu en aza indirir ve tutarlı temel Akt aktivitesi seviyeleri sağlar. Bu deneyde kullanılan açlık ortamının bileşimi (Tablo 3)'te açıklanmıştır. BSA toz halinde gelir. % 0.1 (a / h) bir çözelti hazırlamak için, iyice karıştırarak 3 mL DMEM içinde 0.1 g BSA'yı sulandırın. Solüsyonu 0.45 μm'lik bir filtre kullanarak sterilize edin ve DMEM ekleyerek son hacmi 100 mL'ye ayarlayın.
- Kültür ortamını çıkarın ve görüntüleme kaplarını 1x PBS ile her biri 5 dakika boyunca iki kez durulayın.
NOT: İki PBS yıkaması, artık serumun ve deneye müdahale edebilecek herhangi bir insülin veya büyüme faktörünün tamamen çıkarılmasına yardımcı olur. - Görüntüleme kaplarına 2 mL açlık ortamı ekleyin (Malzeme Tablosuna bakınız). Hücrelerin cam tabandan çıkmasını önlemek için ortamı tabağın kenarına yavaşça ekleyin. 37 °C'de 4 saat inkübe edin.
NOT: 4 saatlik inkübasyon, hücresel metabolizmayı senkronize etmek için idealdir; Bununla birlikte, deneysel ihtiyaçlara bağlı olarak süre uzatılabilir.
6. HepG2 hücreleri için FRET canlı hücre görüntüleme
NOT: Bu bölüm, tek HepG2 hücrelerinde Akt fosforilasyonunun uzay-zamansal dinamiklerini izlemek için FRET canlı hücre görüntüleme için talimatlar sağlar. Aşağıda ayrıntılı olarak açıklandığı gibi, canlı HepG2 hücreleri için mikroskop kurulumunu, işleme prosedürlerini ve görüntüleme koşullarını optimize etmek önemlidir. Mikroskop kurulumu, FRET görüntüleme için görüntüleme koşullarını optimize etmek için çok önemlidir. Kararlı çalışmayı sağlamak için PC/konfokal lazer tarama mikroskobu (CLSM) kurulumunu üreticinin talimatlarına göre adım adım izleyin. FRET görüntüleme için özelleştirilmiş CLSM konfigürasyonu (Şekil 6)'da gösterilmiştir.
- Mikroskobu, bilgisayarı, tarayıcıyı, lazer başlatmayı, piezo aşamasını ve epifloresan LED ışık kaynağını çalıştırmak için uzaktan kumanda anahtarını açın. Herhangi bir olası hasarı önlemek için gücü açmadan önce tüm bileşenlerin doğru şekilde bağlandığından emin olun.
- Lazer başlatmada anahtarı AÇIK konuma çevirin ve FRET için gerekli olan her iki lazeri (457 nm ve 514 nm lazer çizgileri) etkinleştirmek için düğmelere basın.
NOT: Optimum FRET görüntüleme için uygun filtrelerin ve ayarların yerinde olduğundan emin olun. Lazer çizgisi seçimi, biyosensörün uyarma ve emisyon profillerine dayanmalıdır. - Mikroskoba bağlı bilgisayara ve monitöre güç sağlamak için anahtarlı uzatma kablosunu açın.
NOT: Herhangi bir ekipman hasarını önlemek için gücü açmadan önce tüm bağlantıların sağlam olduğundan emin olun. - Windows'ta oturum açın ve mikroskopi yazılımını başlatın.
- Görüntüleme kurulumunu başlatmak için Edinme için A1'e tıklayın. FRET deneyinin gereksinimlerine göre uygun optik konfigürasyonları seçin.
- Optimum görüntüleme koşulları için lazer gücünü ve dedektör hassasiyetini gerektiği gibi ayarlayın. Mikroskop tablası üst inkübatörünü dikkatlice takın ve vidalarla sabitleyin.
NOT: İnkübatöre veya mikroskop aşamasına zarar vermemek için vidaları aşırı sıkmayın. - İç su banyosunu steril çift damıtılmış su (ddH2O) ile doldurun. Üst ısıtıcıyı güvenli bir şekilde takın ve sahne ısıtıcısı, banyo ısıtıcısı ve lens ısıtıcısı için güç kaynağını açın (Şekil 7A).
NOT: Sisteme dökülmesini önlemek için aşırı doldurmayın. Canlı hücre görüntüleme için tutarlı sıcaklık koşullarını korumak için tüm ısıtıcıların düzgün çalıştığından emin olun. - Görüntüleme için 40x yağa daldırma lensini kullanın (Malzeme Tablosuna bakın).
NOT: Teknik özellikler için üreticinin web sitesine bakın. - Objektif merceği %95 etanol ile nemlendirilmiş mercek kağıdı ile silin. Objektif merceğin üzerine küçük bir damla daldırma yağı yerleştirin (Şekil 7B). HepG2 hücrelerini içeren görüntüleme kabını mikroskop tablasına yerleştirin ve tutucu ile sabitleyin (Şekil 7C).
NOT: Görüntüleme sırasında herhangi bir hareketi önlemek için görüntüleme kabının düzgün şekilde hizalandığından ve sabitlendiğinden emin olun. Hem lense hem de tabağın cam tabanına zarar vermemek için lense baskı uygulamaktan kaçının. - Odayı kapatın ve hücreleri dengelenmelerini sağlamak için canlı hücre odası içinde 1-2 saat inkübe edin (Şekil 7D).
- Hızlandırılmış görüntüleme sırasında, belirli aralıklarla duraklatın ve ortamı nazikçe çıkarın (Şekil 7E), ardından verilen insülin konsantrasyonu ile 1 mL yeni hazırlanmış ortam ekleyin (Şekil 7F, Malzeme Tablosu).
NOT: 1 mg insülini 1 mL 10 mM asetik asit içinde çözerek 1 mg / mL insülin stok çözeltisi hazırlayın. Çözeltiyi 0.2 μm steril şırınga filtresinden süzün ve alikotları -20 ° C'de saklayın. - Mikroskopi yazılımının Dosya menüsünden ND Edinme penceresini başlatın.
NOT: ND Edinme kurulumu (Şekil 8)'de gösterilmiştir. - Zaman atlamalı görüntüleme için aralığı, süreyi ve istenen döngüleri ayarlamak için Zaman sekmesini seçin. Ardından, XY sekmesine tıklayın ve görüntüleme için tek tek HepG2 hücrelerini dahil etmek için + ekle düğmesine basın.
- Birden çok hücre eklemek için uygun hücreleri bulun, tarayın, odakta ince ayar yapın ve Nokta Yayma İşlevini (PSF) kilitleyin. Görüntüleme için eklenen her yeni hücre için bu adımı yineleyin. Dahil edilmek üzere çeşitli hedef hücreleri belirlemek için görüntüleme plakaları içinde farklı konumlardaki birden fazla hücreyi tarayın.
- Hücrelerin seçimini kaldırmak için kırmızı X simgesini tıklayın. Z konumunu ayarlamak için 'Z' kutusunu işaretleyin. Tüm parametreleri seçtikten sonra, 'Dosya Adı' kutusuna deneme adını girin.
- Hedef klasörü seçmek için Gözat'ı tıklayın, ardından dosyaya kaydet kutusunu işaretleyin. I vur Şimdi çalıştır ND alımını başlatmak için sekmesine tıklayın. ND alım penceresi, geçen ve kalan süre de dahil olmak üzere zaman atlamalı görüntülemenin gerçek zamanlı ilerlemesini gösterecektir.
- Hücreleri insülin ile uyarmadan 30 dakikaya kadar temel ölçümleri kaydedin.
- Uygun hücreleri bulun, tek bir hücreyi odaklamak için yakınlaştırın/uzaklaştırın ve yüksek floresan yoğunluğuna sahip hücreleri seçin. Hücreleri en fazla 6 hücreye kadar tek tek ekleyin.
NOT: Görüntüleme sırasında görüntü alımındaki gecikmeleri ve pencere donmasını önlemek için hücre sayısını sınırlayın. - Hızlandırılmış görüntüleme için zamanı ve görüntüleme frekansını ayarlayın. Zaman atlamalı görüntülemeyi başlatın.
NOT: Görüntüleme seansına başlamadan önce pozlama süresi ve lazer gücü de dahil olmak üzere tüm parametrelerin optimize edildiğinden emin olun. - Görüntülemeyi düzenli aralıklarla duraklatın, ortamı cam tabanlı tabaktan nazikçe çıkarın ve uygun insülin konsantrasyonu ile desteklenmiş 1 mL ortam ekleyin.
- Görüntü alımına devam edin. Adım 6.20'yi gerektiği kadar tekrarlayın.
- Denemenin sonunda, kapatmak için Son sekmesine tıklayın. Elde edilen görüntüleri analiz için güvenli bir şekilde yedekleyin ve saklayın.
7. Veri analizi
- Spektral karışma ve CFP otofloresan için kontrol örneklerinden önceden işlenmiş hızlandırılmış FRET görüntüleme verilerini düzeltin, bu da düzeltilmiş FRET değerleri ve hassas FRET verimliliği ile sonuçlanır. FRET görüntülerinin alınması, işlenmesi ve analizi için önceki çalışmalarda 27,28,29,30 belirtilen protokolleri izleyerek görüntüleme yazılımı kullanın (Şekil 9).
8. FRET verimlilik hesaplamaları
- FRET verimliliğini belirlemek için yedi görüntü elde edin: hücre (IDA (D), IDD (D), IDA (A), IAA(A), I DD, IAA VE IDA). Aşağıdaki formülü kullanarak FRET verimliliğini hesaplayın:
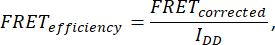
burada FRETDüzeltilmiş denklemden elde edilir:
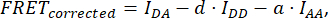
D ve A ile şu şekilde tanımlanır:
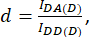
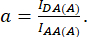
Burada IDA, IDD ve IAA, biyosensör ile transfekte edilen hücrelerin görüntülerini temsil eder. IDA(D) ve IDD(D)) yalnızca donör kontrol görüntüleridir ve IDA(A) ve IAA(A) yalnızca alıcı kontrol görüntüleridir.
9. Görüntü edinme
- IDA : Alıcı emisyonu (530 nm) ile donör uyarması (434 nm) ile görüntüyü elde edin.
- IDD : Görüntüyü donör emisyonu (477 nm) ile donör uyarması (434 nm) ile elde edin.
- IAA : Görüntüyü, alıcı emisyonu (530 nm) ile alıcı uyarma (517 nm) ile elde edin.
- IDA(D) ve IDA(A) : IDA ile aynı uyarma ve emisyonu kullanarak, ancak sırasıyla yalnızca vericiyi ve alıcıyı ifade eden hücrelerden görüntüyü elde edin.
- IDD(D) : Görüntüyü, yalnızca donör kontrolü için IDD ile aynı koşullar altında elde edin.
- IAA(A) : IAA ile aynı koşulları kullanarak görüntüyü elde edin, ancak yalnızca alıcı kontrolüne özgüdür.
10. Arka plan düzeltmesi
- Bilgisayardaki görüntü analiz yazılımını açın. Üst menü çubuğundan Dosya menüsüne erişin. Açılır seçeneklerden Aç veya Dosya Aç'ı seçin.
- Zaman atlamalı görüntü verilerini içeren dizine gidin. Analiz gerektiren hızlandırılmış görüntüyü bulun (ör. nd2 formatı).
- Dosyayı seçin ve tıklayın Açılış veya tamam görüntüleme ve analiz için yazılıma yüklemek için. Hücre içinde bir ilgi alanı (ROI) tanımlayın (veya ROI olarak hücrenin tamamını kullanın) ve bu bölgedeki her pikselin gri değerini kaydedin.
- Arka plan olarak hücresiz bir alan seçin ve ortalama gri değerini hesaplayın. Hücre ROI'si içindeki her pikselin gri değerinden bu arka plan ortalamasını çıkararak düzeltilmiş görüntüyü oluşturun.
11. FRET kanaması (karışma) eliminasyonu
NOT: Verici emisyonu ve alıcı uyarımı arasındaki spektral örtüşme, FRET verimliliği ve enerji transfer süreci için kritik olan Şekil 3B'de gösterilmiştir. Hızlandırılmış FRET görüntülemede kanama, verici ve alıcı floroforların spektral örtüşmesinden kaynaklanan ve yanlış ölçümlere yol açan önemli bir zorluktur. Karışma doğaldır, çünkü hem verici hem de alıcı floroforların spektrumları bir dereceye kadar örtüşür (Şekil 3C, D). Bu sorun, yüksek florofor konsantrasyonları ve uygun olmayan filtre konfigürasyonları gibi faktörlerle daha da kötüleşir. Sızıntıyı ele almak, FRET ölçümlerinin güvenilirliğini sağlamak için çok önemlidir.
- Sızıntı etkilerini azaltmaya yönelik bir yöntem için önceki bir çalışmaya bakın9.
12. Nicelik ve istatistiksel analiz
- İstatistiksel analiz yazılımı kullanarak istatistiksel analiz gerçekleştirin.
Sonuçlar
HepG2 hücrelerinde Akt aktivasyonunu araştırmak için, hücreler önceden kaplanmış görüntüleme kaplarına ekildi ve Akt fosforilasyonunun gerçek zamanlı izlenmesini sağlamak için tasarlanmış FRET tabanlı biyosensör pEevee-iAkt-NES (Şekil 2A) ile transfekte edildi. Transfeksiyonu takiben, hücreler metabolik durumlarını senkronize etmek ve bazal insülin sinyalini en aza indirmek için serumsuz bir ortamda 4 saat boyunca serum açlığına...
Tartışmalar
HepG2 hücrelerinde Akt fosforilasyonunu izlemek için canlı hücre FRET görüntüleme protokolü, güvenilir ve tekrarlanabilir sonuçlar sağlamak için birkaç temel adım içerir. İlk kritik adım, rutin hücre bakımını, görüntüleme kaplarının kaplanmasını ve hücre tohumlamasını içeren hücre kültürüdür. Uygun kaplama, stabil hücre yapışması sağladığı, ayrılmayı önlediği ve tutarsız verilere yol açabilecek kaymayı en aza indirdiği için hızlandı...
Açıklamalar
Yazarlar hiçbir rekabet çıkarı beyan etmezler.
Teşekkürler
Bu çalışma kısmen Shenzhen Doğa Bilimleri Vakfı (JCYJ20240813113606009), Shenzhen-Hong Kong Teknoloji ve Yenilik İşbirliği Bölgesi (HZQB-KCZYB-2020056), Çin Ulusal Doğa Bilimleri Vakfı (32070681), Çin Ulusal Anahtar Ar-Ge Programı (2019YFA0906002) ve Shenzhen Peacock Plan (KQTD2016053117035204) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin-EDTA | Gibco | Cat#25200-056 | Use ice-cold PBS for cell wash |
| 15 mm glass bottom cell culture dish | NEST | Cat#801001 | |
| 2 mL Nalgene cryogenic vials | Thermo Scientific | Cat#5012-0020 | |
| 5 mL Stripette Serological Pipets | Corning | Cat#4487 | |
| 95% Ethanol | Kermel | Cat#C028005 | |
| A1 HD25/A1R HD25 confocal microscope | Nikon | https://www.nikon.com/ | Magnification: 40×, Numerical Aperture (NA): 1.30, Pixel Dwell Time: 2.4 ms, Pixel Size: 1024 |
| Ampicillin | Sigma-Aldrich | Cat#A9393 | |
| Bovine serum albumin (BSA) | VWR Life Science | Cat#N208-10g | |
| Corning 25 cm2 rectangular culture flasks | Corning | Cat#430639 | |
| Countess 3 automated cell counter | Thermo Scientific | http://www.thermofisher.com/#AMQAX2000 | |
| Countess cell counting chamber slides | Thermo Scientific | http://www.thermofisher.com/#C10228 | |
| Digital vortex mixers | Thermo Scientific | https://www.thermofisher.com/ | |
| Dimethyl sulfoxide | Sigma-Aldrich | Cat#D2650 | |
| Eppendorf Safe-Lock Tubes 1.5 mL | Eppendorf | Cat#022363204 | |
| EZ-PCR mycoplasma detection kit | Biological Industries | Cat# 20-700-20 | |
| Fetal Bovine Serum, qualified, Australia | Gibco | Cat#10099141 | |
| GlutaMAX Supplement | Gibco | Cat#35050061 | |
| GraphPad Prism 9 | GraphPad Software | https://www.graphpad.com/ | |
| HepG2 | National Collection of Authenticated Cell Cultures | #CSTR:19375.09.3101HUMSCSP510 http://www.cellbank.org.cn/ | |
| Immersion Oil Type 37 | Cargille Laboratories | Cat #16237 | |
| Insulin | Sigma-Aldrich | Cat#I5500-50MG | Warm to 37 °C before use |
| LB Broth (1x) | Invitrogen | Cat#10855001 | |
| Minimum Essential Medium (MEM) | Gibco | Cat#11095080 | Warm to 37 °C before use |
| mySPIN 12 mini centrifuge | Thermo Scientific | https://www.thermofisher.com/ | |
| NanoDrop One | Thermo Scientific | https://www.thermofisher.com | |
| Nikon Plan Fluor 40×/1.30 Oil Lens | Nikon | https://www.nikon.com/ | |
| NIS-Elements-AR | Nikon | https://www.nikon.com/ | |
| Non-Essential Amino Acids (NEAA) (100x) | Gibco | Cat#11140050 | |
| One Shot LB Agar Plates | Invitrogen | Cat#A55802 | |
| One Shot Stbl3 chemically competent E. coli | Invitrogen | Cat#C737303 | |
| Parafilm | PARAFILM | Cat#B8R05606 | |
| PBS (phosphate buffered saline) | Gibco | Cat#10010023 | |
| pEevee-iAkt-NES (7,033 bp) | Miura et al31 | https://benchling.com/s/seq-q46zFYCfl0swLAun0t28/edit | |
| Penicillin-streptomycin | Gibco | Cat#15070063 | |
| Plasmocin prophylactic | InvivoGen | Cat#ant-mpp | |
| Poly-L-Lysine Hydrobromide | Sigma-Aldrich | Cat#P4832 | |
| Precision general purpose baths | Thermo Scientific | https://www.thermofisher.com/ | |
| QIAprep spin miniprep kit | QIAGEN | Cat#27106 | |
| SnapGene | SnapGene by Dotmatics | https://www.snapgene.com | |
| Sodium Pyruvate (100 mM) | Gibco | Cat#11360070 | |
| Syringe filter unit, 0.22 μm | Millipore | Cat#SLGP033RS | |
| Tokai Hit stage top incubator | TOKAI HIT | https://www.tokaihit-livecell.com/stagetopincubator | |
| UltraPure DNase/RNase-free distilled water | Invitrogen | Cat#10977015 | |
| Xfect Transfection Reagent | Takara Bio | Cat#631317 |
Referanslar
- GBD 2021 Diabetes Collaborators. Global, regional, and national burden of diabetes from 1990 to 2021, with projections of prevalence to 2050: a systematic analysis for the Global Burden of Disease Study 2021. Lancet. 402 (10397), 203-234 (2023).
- Li, M., et al. Trends in insulin resistance: insights into mechanisms and therapeutic strategy. Signal Transduct Target Ther. 7 (1), 216 (2022).
- Poloz, Y., Stambolic, V. Obesity and cancer, a case for insulin signaling. Cell Death Dis. 6 (12), e2037 (2015).
- Arcidiacono, B., et al. Insulin resistance and cancer risk: an overview of the pathogenetic mechanisms. Exp Diabetes Res. 2012, 789174 (2012).
- Godsland, I. F. Insulin resistance and hyperinsulinaemia in the development and progression of cancer. Clin Sci (Lond). 118 (5), 315-332 (2009).
- Tsugane, S., Inoue, M. Insulin resistance and cancer: epidemiological evidence. Cancer Sci. 101 (5), 1073-1079 (2010).
- Yudhani, R. D., et al. In vitro insulin resistance model: A recent update. J Obes. 2023, 1964732 (2023).
- Akhtar, J., et al. Bistable insulin response: The win-win solution for glycemic control. iScience. 25 (12), 105561 (2022).
- Akhtar, J., Imran, M., Wang, G. Protocol for live-cell Forster resonance energy transfer imaging to reveal the bistable insulin response of single C2C12-derived myotubes. STAR Protoc. 5 (2), 103109 (2024).
- Kamino, K., et al. Optimal inference of molecular interaction dynamics in FRET microscopy. Proc Natl Acad Sci U S A. 120 (15), e2211807120 (2023).
- Kraft, A. E., Nikolaev, V. O. FRET microscopy for real-time visualization of second messengers in living cells. Methods Mol Biol. 1563, 85-90 (2017).
- Veeriah, S., et al. High-throughput time-resolved FRET reveals Akt/PKB activation as a poor prognostic marker in breast cancer. Cancer Res. 74 (18), 4983-4995 (2014).
- Conway, J. R. W., et al. Monitoring AKT activity and targeting in live tissue and disease contexts using a real-time Akt-FRET biosensor mouse. Sci Adv. 9 (17), eadf9063 (2023).
- Chandris, P., Giannouli, C. C., Panayotou, G. Imaging approaches for the study of metabolism in real time using genetically encoded reporters. Front Cell Dev Biol. 9, 725114 (2021).
- Yang, J., et al. Longitudinal FRET imaging of glucose and lactate dynamics and response to therapy in breast cancer cells. Mol Imaging Biol. 24 (1), 144-155 (2022).
- Mandrou, E., et al. A reliable system for quantitative G-protein activation imaging in cancer cells. Cells. 13 (13), 1114 (2024).
- Fang, C., Huang, Y., Zhao, Y. Review of FRET biosensing and its application in biomolecular detection. Am J Transl Res. 15 (2), 694-709 (2023).
- Miller, J. N. Fluorescence energy transfer methods in bioanalysis. Analyst. 130 (3), 265-270 (2005).
- Verveer, P. J., Rocks, O., Harpur, A. G., Bastiaens, P. I. Imaging protein interactions by FRET microscopy: FRET measurements by acceptor photobleaching. CSH Protoc. 2006 (6), (2006).
- Vu, C. Q., Arai, S. Quantitative imaging of genetically encoded fluorescence lifetime biosensors. Biosensors (Basel). 13 (10), 939 (2023).
- Wang, G. A more holistic view of the logarithmic dose-response curve offers greater insights into insulin response. J Biol Chem. 301 (1), 108037 (2025).
- Wang, G. Body mass dynamics is determined by the metabolic Ohm's law and adipocyte-autonomous fat mass homeostasis. iScience. 23 (6), 101176 (2020).
- Wang, G. Raison d'être of insulin resistance: the adjustable threshold hypothesis. J R Soc Interface. 11 (101), 20140892 (2014).
- Wang, G. Optimal homeostasis necessitates bistable control. J R Soc Interface. 9, 2723 (2012).
- Heim, R., Tsien, R. Y. Engineering green fluorescent protein for improved brightness, longer wavelengths and fluorescence resonance energy transfer. Curr Biol. 6 (2), 178-182 (1996).
- Nguyen, A. W., Daugherty, P. S. Evolutionary optimization of fluorescent proteins for intracellular FRET. Nat Biotechnol. 23 (3), 355-360 (2005).
- Broussard, J. A., Rappaz, B., Webb, D. J., Brown, C. M. Fluorescence resonance energy transfer microscopy as demonstrated by measuring the activation of the serine/threonine kinase Akt. Nat Protoc. 8 (2), 265-281 (2013).
- Gordon, G. W., Berry, G., Liang, X. H., Levine, B., Herman, B. Quantitative fluorescence resonance energy transfer measurements using fluorescence microscopy. Biophys J. 74 (5), 2702-2713 (1998).
- Tron, L., et al. Flow cytometric measurement of fluorescence resonance energy transfer on cell surfaces. Quantitative evaluation of the transfer efficiency on a cell-by-cell basis. Biophys J. 45 (5), 939-946 (1984).
- Youvan, D. C., et al. Calibration of fluorescence resonance energy transfer in microscopy. , (2002).
- Miura, H., Matsuda, M., Aoki, K. Development of a FRET biosensor with high specificity for Akt. Cell Struct Funct. 39 (1), 9-20 (2014).
- Liberio, M. S., Sadowski, M. C., Soekmadji, C., Davis, R. A., Nelson, C. C. Differential effects of tissue culture coating substrates on prostate cancer cell adherence, morphology and behavior. PLoS One. 9 (11), e112122 (2014).
- Rani, K., Sengupta, S. Multi-stimuli programmable FRET based RGB absorbing antennae towards ratiometric temperature, pH and multiple metal ion sensing. Chem Sci. 12 (47), 15533-15542 (2021).
- Betolngar, D. B., et al. pH sensitivity of FRET reporters based on cyan and yellow fluorescent proteins. Anal Bioanal Chem. 407 (14), 4183-4193 (2015).
- Salonikidis, P. S., et al. An ion-insensitive cAMP biosensor for long term quantitative ratiometric fluorescence resonance energy transfer (FRET) measurements under variable physiological conditions. J Biol Chem. 286 (26), 23419-23431 (2011).
- Youvan, D. C., et al. Calibration of fluorescence resonance energy transfer in microscopy using genetically engineered GFP derivatives on nickel chelating beads. Biotechnol Alia. 3, 1-18 (1997).
- Menaesse, A., et al. Simplified instrument calibration for wide-field fluorescence resonance energy transfer (FRET) measured by the sensitized emission method. Cytometry A. 99 (4), 407-416 (2021).
- Batta, A., Hajdu, T., Nagy, P. Improved estimation of the ratio of detection efficiencies of excited acceptors and donors for FRET measurements. Cytometry A. 103 (7), 563-574 (2023).
- Coullomb, A., et al. QuanTI-FRET: a framework for quantitative FRET measurements in living cells. Sci Rep. 10 (1), 6504 (2020).
- Hoppe, A., Christensen, K., Swanson, J. A. Fluorescence resonance energy transfer-based stoichiometry in living cells. Biophys J. 83 (6), 3652-3664 (2002).
- Zal, T., Gascoigne, N. R. Photobleaching-corrected FRET efficiency imaging of live cells. Biophys J. 86 (6), 3923-3939 (2004).
- Hochreiter, B., Kunze, M., Moser, B., Schmid, J. A. Advanced FRET normalization allows quantitative analysis of protein interactions including stoichiometries and relative affinities in living cells. Sci Rep. 9 (1), 8233 (2019).
- Liu, H., Zhang, F., Mishra, S. K., Zhou, S., Zheng, J. Knowledge-guided fuzzy logic modeling to infer cellular signaling networks from proteomic data. Sci Rep. 6, 35652 (2016).
- Garrido-Rodriguez, M., Zirngibl, K., Ivanova, O., Lobentanzer, S., Saez-Rodriguez, J. Integrating knowledge and omics to decipher mechanisms via large-scale models of signaling networks. Mol Syst Biol. 18 (7), e11036 (2022).
- Greenwald, E. C., Polanowska-Grabowska, R. K., Saucerman, J. J. Integrating fluorescent biosensor data using computational models. Methods Mol Biol. 1071, 227-248 (2014).
- Zhao, Z., Xia, J. Computational Approaches for Modeling Signal Transduction Networks. Encyclopedia of Bioinformatics and Computational Biology. , (2019).
- Wang, G., Krueger, G. R. Computational analysis of mTOR signaling pathway: bifurcation, carcinogenesis, and drug discovery. Anticancer Res. 30 (7), 2683-2688 (2010).
- Wang, G. Singularity analysis of the AKT signaling pathway reveals connections between cancer and metabolic diseases. Phys Biol. 7 (4), 046015 (2010).
- Chedere, A., Hari, K., Kumar, S., Rangarajan, A., Jolly, M. K. Multi-stability and consequent phenotypic plasticity in AMPK-Akt double negative feedback loop in cancer cells. J Clin Med. 10 (3), 472 (2021).
- Mosca, E., et al. Computational modeling of the metabolic States regulated by the kinase akt. Front Physiol. 3, 418 (2012).
- Liao, J., Madahar, V., Dang, R., Jiang, L. Quantitative FRET (qFRET) technology for the determination of protein-protein interaction affinity in solution. Molecules. 26 (21), 6339 (2021).
- Verma, A. K., Noumani, A., Yadav, A. K., Solanki, P. R. FRET based biosensor: Principle applications recent advances and challenges. Diagnostics (Basel). 13 (8), 1375 (2023).
- Mattheisen, J. M., et al. Application of bioluminescence resonance energy transfer to quantitate cell-surface expression of membrane proteins. Anal Biochem. 684, 115361 (2024).
- Lionetti, M. C., La Porta, C. A. M. FLIM-FRET investigation of heterogeneous huntingtin aggregation in HeLa cells. Methods Mol Biol. 2551, 595-604 (2023).
- Petutschnig, E. K., Pierdzig, L., Mittendorf, J., Niebisch, J. M., Lipka, V. A novel fluorescent protein pair facilitates FLIM-FRET analysis of plant immune receptor interaction under native conditions. J Exp Bot. 75 (3), 746-759 (2024).
- Sprenger, J. U., Perera, R. K., Gotz, K. R., Nikolaev, V. O. FRET microscopy for real-time monitoring of signaling events in live cells using unimolecular biosensors. J Vis Exp. 66, e4081 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır