Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Резонансная визуализация переноса энергии Фёрстера в живых клетках метаболически регулируемой динамики активации Akt в клетках HepG2
В этой статье
Резюме
Здесь мы представляем протокол для количественной оценки пространственно-временной динамики активации Akt и фосфорилирования в живых клетках HepG2. Визуализация резонансного переноса энергии (FRET) компании Förster является мощным инструментом, который позволяет получить ценную информацию о сигнальных путях инсулина и метаболической регуляции в раковых клетках.
Аннотация
Метаболически регулируемая активация Akt является критическим узлом в каскаде передачи сигналов инсулина и дает ценную информацию о взаимосвязи между диабетом и раком. Чтобы точно количественно оценить активность Akt в клетках HepG2, мы разработали надежный, воспроизводимый протокол, использующий резонансный перенос энергии Фёрстера (FRET) с генетически закодированными Akt-специфичными биосенсорами. В этом протоколе подробно описаны этапы культивирования клеток, подготовки чашки для визуализации и трансфекции клеток HepG2 для экспрессии биосенсоров на основе FRET, а также конкретные рекомендации по настройке аппаратного и программного обеспечения лазерного сканирующего конфокального микроскопа. Результаты продемонстрировали уникальные паттерны передачи сигналов инсулина в клетках HepG2, которые демонстрируют необратимое переключение, характеризующееся конститутивной активацией Akt с определенным порогом включения, но без порога выключения. В отличие от них, миотрубки имеют реверсивный переключатель. Персистирующая активация Akt в клетках HepG2 предполагает механизмы, лежащие в основе резистентности к инсулину и метаболической дисрегуляции в клетках печени, с более широкими последствиями для понимания прогрессирования метаболических нарушений и рака. Этот протокол предлагает ценную основу для изучения связанных с Akt сигнальных путей и клеточного поведения в различных контекстах заболевания.
Введение
Сахарный диабет представляет собой серьезную глобальную проблему здравоохранения, характеризующуюся резистентностью к инсулину и нарушением гомеостаза глюкозы1. Всестороннее понимание сигнальных путей инсулина имеет решающее значение для выяснения патофизиологии этого заболевания, поскольку инсулин играет ключевую роль в метаболизме глюкозы, росте клетоки выживаемости. Многочисленные исследования показали, что передача сигналов инсулина значительно влияет на различные виды рака, связывая резистентность к инсулину с прогрессированием опухоли и плохими исходами лечения пациентов 3,4,5,6. Клетки HepG2, широко используемая клеточная линия гепатоцеллюлярной карциномы, служат ценной моделью для изучения резистентности к инсулину и взаимодействия между метаболической дисрегуляциейи развитием рака. Традиционно исследователи рассматривали реакцию инсулина как градуированную; Тем не менее, недавние исследования показали, что отдельные клетки могут проявлять бистабильные ответы, демонстрируя заметные переходы между отсутствием реакции и полным ответом, происходящие при определенных пороговых значениях концентрации инсулина 8,9.
Визуализация резонансного переноса энергии (FRET) Фёрстера является мощным инструментом для изучения пространственно-временного распределения биомолекул в живых клетках10. Извлекая информацию из молекулярной динамики, FRET дает представление о таких процессах, как активация Akt, в режиме реального времени, что делает его бесценным методом для изучения живых клеток11,12. Этот метод визуализации оказался незаменимым в изучении клеточной динамики, особенно при метаболических заболеваниях и раке, где точные молекулярныевзаимодействия имеют решающее значение. FRET также позволяет в режиме реального времени отслеживать молекулярные взаимодействия, проливая свет на такие механизмы, как резистентность к инсулину и прогрессирование опухоли14,15. Биосенсоры FRET имеют решающее значение в исследованиях рака, изучая микроокружение опухоли, устойчивость к лекарствам и метаболические нарушения16. Методы детектирования FRET, такие как сенсибилизированная эмиссия (SE), акцепторное обесцвечивание (AB), флуоресцентная микроскопия в течение жизни (FLIM) и спектроскопия, имеют явные преимущества для количественной оценкимолекулярных взаимодействий. SE измеряет передачу энергии между донорными и акцепторными флуорофорами, что приводит к измеряемому сдвигу в спектрах излучения, который коррелирует с близостью взаимодействующих биомолекул18. AB использует селективное фотообесцвечивание акцепторного флуорофора и отслеживает изменения донорной флуоресценции, что позволяет исследователям оценить кинетику взаимодействия и расстояния19. FLIM оценивает скорость распада флуоресценции донорного флуорофора, на которую непосредственно влияет эффективность FRET, чтобы обеспечить точные наноразмерные измерения молекулярных взаимодействий20.
Используя методы FRET, мы недавно продемонстрировали бистабильные ответы инсулина в миотрубках, полученных из C2C12 8,9,21,22,23,24. Как мы обнаружили, различные пороги включения и выключения активации Akt позволяют предположить, что градуированная доза-реакция всего организма на инсулин противоречит сложности субклеточного сигнального каскада, начинающегося от инсулинового стимула, который достигает кульминации в ответе «все или ничего» на уровне отдельных клеток 21,22,23,24. Чтобы проверить наличие бистабильности в других типах клеток, мы стимулировали клетки HepG2 инсулином и регистрировали их реакцию с помощью одноклеточной FRET-визуализации. Мы стимулировали клетки HepG2 с различной концентрацией инсулина и контролировали активность Akt на уровне отдельных клеток с помощью биосенсора Akt. Биосенсор Akt содержит усиленный голубой флуоресцентный белок (ECFP)25 в качестве донора флуорофора и самый яркий вариант желтого флуоресцентного белка (YPet)26 в качестве акцепторного флуорофора, связанного линкером Eevee, содержащим пептидную последовательность SGRPRTTTFADSCKP. Этот пептид выступает в качестве субстрата для фосфорилированного Akt (pAkt), оптимизированного из киназы гликогенсинтазы человека 3β (GSK3β). В нефосфорилированном состоянии пространственное расстояние между донорным и акцепторным флуорофорами превышает радиус Фёрстера, что препятствует передаче энергии. При стимуляции инсулином происходит фосфорилирование Akt, которое приводит к фосфорилированию SGRPRTTTFADSCKP. Этот процесс вызывает конформационное изменение, в результате которого донор и акцептор попадают в радиус Фёрстера, что позволяет проводить FRET27. В результате интенсивность сигнала FRET коррелирует с количеством фосфорилированных молекул Akt и позволяет количественно оценить инсулин-опосредованные клеточные реакции в режиме реального времени.
Этот протокол, первоначально разработанный для изучения передачи сигналов инсулина в миотрубках, полученных из C2C12, был успешно применен к клеткам HepG2 и использован на различных аппаратных и программных платформах, тем самым продемонстрировав его применимость, адаптивность и универсальность. Клетки HepG2 проявляют конститутивную активность Akt, что делает их идеальной моделью in vitro для изучения специфической для печени передачи сигналов инсулина и метаболических процессов. Ключевые особенности протокола пошагово описаны в разделе протокола.
протокол
Обзор экспериментальных этапов визуализации живых клеток FRET для мониторинга фосфорилирования Akt в одиночных клетках HepG2 показан на рисунке 1.
1. Получение, размножение и очистка плазмид
ПРИМЕЧАНИЕ: В этом разделе описаны основные шаги по получению, амплификации и очистке плазмиды, необходимой для анализа FRET одиночных клеток.
- Используйте плазмиду pEevee-iAkt-NES-YPet (рис. 2A).
ПРИМЕЧАНИЕ: Плазмида была любезно предоставлена профессором Казухиро Аоки из Национального института фундаментальной биологии (NIBB), Япония.Плазмидные карты для биосенсоров FRET, используемых для мониторинга Akt, и их соответствующих элементов управления изображены на рисунке 2. pEevee-iAkt-NES-ECFP (донор; Рисунок 2В) и pEevee-iAkt-NES-Ypet (акцептор; Рисунок 2В) плазмиды используются в качестве калибровочных контрольных во время экспериментов FRET9.
ПРИМЕЧАНИЕ: На рисунке 3 показан состав и механизм работы внутримолекулярного биосенсора FRET. - Чтобы размножить плазмиду, проведите бактериальную трансформацию с использованием химически компетентных клеток E. coli (см. Таблицу материалов). Трансформированные клетки помещают на агар Лурии-Бертани (LB), содержащий ампициллин 100 мкг/мл, и инкубируют в течение ночи при 37 °C. На следующий день выберите устойчивую к ампициллину колонию и культивируйте ее в бульоне LB с добавлением 100 мкг/мл ампициллина для амплификации плазмид.
- Для очистки плазмидной ДНК используйте коммерчески доступный набор для очистки плазмидной ДНК (см. Таблицу материалов) для получения высокой чистоты и выхода. Оцените качество ДНК путем измерения коэффициентов поглощения (A260/A280 и A260/A230) с помощью спектрофотометра (см. Таблицу материалов). Оптимальными считаются соотношения от 1,8-2,0 до 2,0-2,2. Проверьте целостность плазмиды с помощью электрофореза в агарозном геле, чтобы убедиться, что она пригодна для трансфекции.
2. Процедура культивирования клеток
ПРИМЕЧАНИЕ: Выполняйте все процедуры культивирования клеток в ламинарном колпаке для поддержания стерильной среды и предотвращения загрязнения. Рабочий процесс культивирования клеток HepG2 показан на рисунке 4. Полная среда для клеток HepG2 состоит из минимально незаменимой среды (MEM), 10% фетальной бычьей сыворотки (FBS), 1% заменимых аминокислот (NEAA), 1 мМ пирувата натрия, 2 мМ добавки L-глютамина, 100 ЕД/мл пенициллин-стрептомицина и 2,5 мкг/мл антибиотико-антимикотического раствора (см. Таблицу материалов, Таблицу 1).
- Быстро разморозьте замороженные клетки HepG2, поместив флакон в термомиксер с температурой 37 °C или водяную баню до полного оттаивания.
- Перенесите размороженные клетки в коническую пробирку объемом 15 мл, содержащую 10 мл полной питательной среды (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Перед использованием предварительно нагрейте всю питательную среду до 37 °C, чтобы свести к минимуму тепловой удар клеток. - Центрифугируйте пробирку при давлении 200 x g в течение 5 минут, чтобы гранулировать клетки.
- Осторожно отсасывайте надосадочную жидкость с помощью наконечника пипетки с широким отверстием, чтобы не повредить клеточную гранулу.
- Ресуспендируйте гранулу в 10 мл свежей полной питательной среды.
- Перенесите клеточную суспензию в колбу для культуры тканей размером 75 см².
- Инкубируйте колбу при температуре 37 °C во влажной атмосфере с 5%CO2
ПРИМЕЧАНИЕ: Наблюдайте за клетками в течение следующих 24-48 часов, чтобы подтвердить прикрепление и оценить выздоровление. Перед сменой среды не тревожьте клетки в течение как минимум 4 часов, чтобы обеспечить правильное крепление. Избегайте частого открывания инкубатора в течение первых 4 часов, так как это может нарушить прикрепление клеток. Соблюдайте институциональные протоколы биобезопасности и используйте соответствующие средства индивидуальной защиты (СИЗ) для поддержания безопасной рабочей среды во время всех процедур культивирования клеток. Субкультуральные клетки HepG2, когда они достигают 70%-80% конфлюенции для поддержания оптимальных условий роста и предотвращения перенаселенности, что может повлиять на жизнеспособность клеток и потенциал роста. - Для субкультивирования аспирируйте среду и однократно промойте клетки 5 мл фосфатно-солевого буфера (PBS).
- Добавьте 1 мл 0,25% трипсина, чтобы покрыть монослой клеток (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Убедитесь, что трипсин предварительно подогрет до 37 °C для оптимальной активности. Не стоит чрезмерно трипсинизировать клетки, так как это может снизить жизнеспособность. Наблюдайте за клетками под микроскопом, чтобы подтвердить отслойку. - Выдерживать при температуре 37 °C около 5 минут.
- Когда клетки отделятся, добавьте 2 мл готовой среды для нейтрализации трипсина и соберите клетки с помощью пипетирования.
- Аккуратно пипетируйте клеточную суспензию, чтобы разбить комки и получить одноклеточную суспензию.
- Добавьте 3 мл готовой среды в каждую новую колбу, затем перенесите ячейки в соотношении 1:2 в каждую колбу.
ПРИМЕЧАНИЕ: Для ранних отрывков разделите ячейки в соотношении 1:2. После отрывков 4-5 можно проводить разбавления в соотношении 1:4 или 1:5, если это уместно. - Инкубируйте клетки при температуре 37 °C во влажной атмосфере с 5%CO2.
ПРИМЕЧАНИЕ: Проверьте клетки через 24 часа, чтобы подтвердить прикрепление и оценить выздоровление. - Для рутинного посева заменяйте питательную среду каждые 2-3 дня или чаще, если показатель pH меняется с розового на желтый, что указывает на закисление.
ПРИМЕЧАНИЕ: Не допускайте, чтобы среда стала слишком кислой, так как это может нанести вред клеткам. - Регулярно проверяйте морфологию клеток под микроскопом, чтобы убедиться в их здоровье.
ПРИМЕЧАНИЕ: Для кратковременного хранения заморозьте клетки HepG2 при температуре -80 °C; При длительном хранении хранить в жидком азоте. Состав замораживающей среды, использованной в данном эксперименте, приведен в таблице 2.
3. Покрытие посуды для визуализации поли-l-лизином
- Используйте 1 мл 0,1 мг/мл раствора поли-L-лизина на каждый планшет для визуализации, чтобы покрыть всю поверхность (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Отрегулируйте концентрацию поли-L-лизина в зависимости от требований к конкретному типу клеток. - Осторожно покачивайте чашку, чтобы добиться равномерного покрытия поверхности культуры.
ПРИМЕЧАНИЕ: Обеспечьте стерильные условия на протяжении всего процесса, чтобы предотвратить загрязнение. - Инкубируйте посуду в течение ночи при комнатной температуре (RT).
- Аспирируйте избыток раствора поли-L-лизина из посуды путем дозирования.
- Промойте поверхность PBS три раза, отдыхая каждый раз в течение 5 минут (см. Таблицу материалов). Полностью удалите несвязанный поли-L-лизин из чашки для визуализации, чтобы предотвратить ингибирование роста клеток. Осторожно промойте пластины, чтобы не поцарапать или не повредить стеклянное дно.
- Высушите чашки с покрытием при температуре 37 °C на воздухе в течение не менее 3 часов.
- Используйте посуду с покрытием для визуализации сразу или храните ее при температуре 4 °C до 2 недель.
4. Трансфекция клеток HepG2
ПРИМЕЧАНИЕ: Метод трансфекции HepG2 показан на рисунке 5.
- Засейте клетки HepG2 в предварительно покрытых чашках для визуализации за 24-48 ч до трансфекции, чтобы убедиться, что они достигают 70%-90% слияния.
- Разморозьте на льду трансфекционный реагент и плазмиду, кодирующую биосенсор FRET. Тщательно окунитесь в вихрь и выполните короткий отжим (например, 5 000 x g в течение 5 с) перед использованием (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Перед использованием убедитесь, что реагент для трансфекции и плазмида полностью разморожены.
ВНИМАНИЕ: Избегайте повторных циклов замораживания-размораживания, так как это может снизить эффективность реагента для трансфекции. - Добавьте 8 мкг плазмиды, кодирующей биосенсор FRET, с реакционным буфером до конечного объема 100 мкл. Хорошо перемешайте путем вортексирования в течение 5 с с высокой скоростью (примерно 3000-5000 х г).
ПРИМЕЧАНИЕ: Всегда добавляйте плазмиду в буфер перед добавлением реагента для трансфекции на основе полимера. Не менее 50 мкл раствора должно состоять из реакционного буфера (см. Таблицу материалов). - Добавьте 2,4 мкл трансфекционного полимера в пробирку, содержащую разбавленную плазмидную ДНК. Хорошо перемешайте путем вортексирования в течение 15 с на высокой скорости (примерно 3 000-5 000 × г).
ПРИМЕЧАНИЕ: Всегда используйте 0,3 мкл трансфекционного полимера на 1 мкг ДНК.
ВНИМАНИЕ: Убедитесь, что трансфекционный полимер тщательно перемешан с плазмидной ДНК для образования однородных комплексов наночастиц. - Инкубируйте смесь биосенсора и полимера при температуре 37 °C в течение 15 минут, чтобы образовались комплексы наночастиц.
ПРИМЕЧАНИЕ: Избегайте хранения полимера для трансфекции в растворе более 30 минут, так как это может снизить эффективность трансфекции.
ВНИМАНИЕ: Внимательно следите за временем инкубации, чтобы предотвратить чрезмерную инкубацию, которая может привести к снижению эффективности трансфекции. - Поверните пробирку вниз в течение 5 с при 5000 x g, чтобы собрать содержимое на дне, затем добавьте весь 100 мкл раствора комплекса наночастиц по каплям в среду для культивирования клеток. Аккуратно покачивайте тарелку вперед и назад, чтобы перемешать.
ПРИМЕЧАНИЕ: Убедитесь, что раствор комплекса наночастиц добавлен по каплям, чтобы равномерно распределить его по среде клеточной культуры.
ВНИМАНИЕ: Избегайте энергичных раскачиваний, так как это может привести к смещению клеток или неравномерному распределению комплексов. - Инкубируйте планшет при температуре 37 °C от 4 часов до ночи.
ПРИМЕЧАНИЕ: Время инкубации может быть скорректировано в зависимости от экспериментальных потребностей, но обычно достаточно 4 часов для эффективной трансфекции.
ВНИМАНИЕ: Избегайте длительной инкубации (>16 ч), так как это может снизить жизнеспособность клеток. - Удалите комплексы наночастиц из клеток путем аспирации, замените их 2 мл свежей полной питательной среды и верните планшет в инкубатор при температуре 37 °C до момента проведения анализа. Пик экспрессии обычно достигает 48 ч после трансфекции.
- Анализируйте клетки с помощью флуоресцентной микроскопии.
ПРИМЕЧАНИЕ: Убедитесь, что микроскоп правильно откалиброван для флуоресцентной визуализации, чтобы получить точные результаты.
ВНИМАНИЕ: Сведите к минимуму воздействие интенсивного света на клетки во время визуализации, чтобы предотвратить фототоксичность.
5. Голодание клеток HepG2
ПРИМЕЧАНИЕ: После завершения этапа трансфекции заморочьте клетки сывороткой перед стимуляцией инсулином и визуализацией FRET. Это сводит к минимуму активацию пути Akt из-за инсулина, присутствующего в FBS, и обеспечивает стабильный исходный уровень активности Akt. Состав среды для голодания, использованной в данном эксперименте, описан в таблице 3. BSA выпускается в порошкообразной форме. Чтобы приготовить 0,1% (мас./об.) раствор, восстановите 0,1 г BSA в 3 мл DMEM, тщательно перемешав. Стерилизуйте раствор с помощью фильтра 0,45 мкм и отрегулируйте конечный объем до 100 мл путем добавления DMEM.
- Удалите питательную среду и промойте чашки для визуализации 1x PBS дважды в течение 5 минут каждая.
ПРИМЕЧАНИЕ: Два промывания PBS помогают полностью удалить остатки сыворотки и любой инсулин или факторы роста, которые могут помешать эксперименту. - Добавьте 2 мл среды для голодания в чашки для визуализации (см. Таблицу материалов). Аккуратно добавьте среду по краю посуды, чтобы избежать смещения ячеек со стеклянного дна. Выдерживать при 37 °C в течение 4 часов.
ПРИМЕЧАНИЕ: 4-часовая инкубация является оптимальной для синхронизации клеточного метаболизма; Однако продолжительность может быть увеличена в зависимости от экспериментальных потребностей.
6. FRET визуализация живых клеток для клеток HepG2
ПРИМЕЧАНИЕ: В этом разделе приведены инструкции по визуализации живых клеток FRET для мониторинга пространственно-временной динамики фосфорилирования Akt в одиночных клетках HepG2. Важно оптимизировать настройку микроскопа, процедуры работы и условия визуализации живых клеток HepG2, как описано ниже. Настройка микроскопа имеет решающее значение для оптимизации условий визуализации при FRET-визуализации. Для обеспечения стабильной работы выполните пошаговую настройку ПК/конфокальной лазерной сканирующей микроскопии (CLSM) в соответствии с инструкциями производителя. Настраиваемая конфигурация CLSM для визуализации FRET показана на рисунке (Рисунок 6).
- Включите дистанционный переключатель для питания микроскопа, компьютера, сканера, запуска лазера, пьезостолика и эпифлуоресцентного светодиодного источника света. Перед включением убедитесь, что все компоненты правильно подключены, чтобы избежать возможных повреждений.
- Поверните ключ в положение ON на запуске лазера и нажмите кнопки для активации обоих лазеров, необходимых для FRET (лазерные линии 457 нм и 514 нм).
ПРИМЕЧАНИЕ: Убедитесь, что установлены соответствующие фильтры и настройки для оптимального создания образа ладов. Выбор лазерной линии должен основываться на профилях возбуждения и излучения биосенсора. - Включите удлинитель для питания компьютера и монитора, подключенных к микроскопу.
ПРИМЕЧАНИЕ: Перед включением убедитесь, что все соединения надежны, чтобы предотвратить повреждение оборудования. - Войдите в Windows и запустите программное обеспечение для микроскопии.
- Нажмите A1 для захвата, чтобы начать настройку изображения. Выберите подходящие оптические конфигурации в соответствии с требованиями эксперимента FRET.
- При необходимости отрегулируйте мощность лазера и чувствительность детектора для достижения оптимальных условий визуализации. Аккуратно установите микроскоп на столик верхнего инкубатора и закрепите его винтами.
ПРИМЕЧАНИЕ: Не затягивайте винты слишком сильно, чтобы не повредить инкубатор или предметный столик микроскопа. - Наполните внутреннюю водяную баню стерильной водой двойной дистилляции (ddH2O). Надежно установите верхний нагреватель и включите источник питания для нагревателя сцены, нагревателя ванны и обогревателя линз (рис. 7A).
ПРИМЕЧАНИЕ: Не переливайте во избежание попадания в систему. Убедитесь, что все нагреватели работают должным образом, чтобы поддерживать постоянный температурный режим для визуализации живых клеток. - Для получения изображения используйте 40-кратный масляный иммерсивный объектив (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Технические характеристики см. на веб-сайте производителя. - Протрите линзу объектива бумагой для линз, смоченной на 95% этанолом. Нанесите небольшую каплю иммерсионного масла на линзу объектива (рисунок 7B). Поместите чашку для визуализации, содержащую клетки HepG2, на предметный столик микроскопа и закрепите ее держателем (рис. 7C).
ПРИМЕЧАНИЕ: Убедитесь, что чашка для визуализации правильно выровнена и закреплена, чтобы предотвратить любое движение во время визуализации. Избегайте давления на линзу, чтобы не повредить как линзу, так и стеклянное дно посуды. - Закройте камеру и инкубируйте клетки в камере живых клеток в течение 1-2 часов, чтобы они могли сбалансироваться (рисунок 7D).
- Во время цейтраферной визуализации сделайте паузу через определенные промежутки времени и аккуратно удалите среду (рис. 7E), затем добавьте 1 мл свежеприготовленной среды с заданной концентрацией инсулина (рис. 7F, таблица материалов).
ПРИМЕЧАНИЕ: Приготовьте стоковый раствор инсулина в дозе 1 мг/мл, растворив 1 мг инсулина в 1 мл 10 мМ уксусной кислоты. Отфильтруйте раствор через стерильный шприцевой фильтр 0,2 мкм и храните аликвоты при температуре −20 °C. - Откройте окно «Захват ND» в меню «Файл » программного обеспечения для микроскопии.
ПРИМЕЧАНИЕ: Настройка сбора данных ND показана на рисунке 8. - Выберите вкладку Время , чтобы задать интервал, продолжительность и желаемые циклы для цейтраферной съемки. Затем перейдите на вкладку XY и нажмите кнопку + добавить , чтобы включить отдельные клетки HepG2 для визуализации.
- Чтобы добавить несколько ячеек, найдите подходящие ячейки, выполните сканирование, выполните тонкую настройку фокусировки и заблокируйте функцию расширения точки (PSF). Повторяйте этот шаг для каждой новой ячейки, добавленной для визуализации. Сканируйте несколько клеток в разных местах на чашках визуализации, чтобы определить различные клетки-мишени для включения.
- Нажмите на красный значок X, чтобы отменить выбор ячеек. Установите флажок «Z», чтобы установить положение Z. Выбрав все параметры, введите название эксперимента в поле «Имя файла».
- Нажмите «Обзор», чтобы выбрать папку назначения, затем установите флажок «Сохранить в файл». Нажмите на вкладку «Запустить сейчас», чтобы начать сбор ND. В окне сбора данных ND будет отображаться ход выполнения покадровой съемки в режиме реального времени, включая прошедшее и оставшееся время.
- Запись исходных измерений в течение 30 минут без стимуляции клеток инсулином.
- Найдите подходящие ячейки, увеличьте или увеличьте масштаб, чтобы сфокусировать одну ячейку, и выберите ячейки с высокой интенсивностью флуоресценции. Добавляйте ячейки по одной, максимум до 6 ячеек.
ПРИМЕЧАНИЕ: Ограничьте количество ячеек, чтобы предотвратить задержки при получении изображения и зависание окна во время визуализации. - Установите время и частоту визуализации для цейтраферной съемки. Запустите интервальную съемку.
ПРИМЕЧАНИЕ: Перед началом сеанса визуализации убедитесь, что все параметры, включая время экспозиции и мощность лазера, оптимизированы. - Сделайте паузу в визуализации через равные промежутки времени, аккуратно удалите среду из чашки со стеклянным дном и добавьте 1 мл среды, дополненной инсулином соответствующей концентрации.
- Продолжите получение изображения. При необходимости повторите шаг 6.20.
- В конце эксперимента щелкните вкладку Готово, чтобы закрыть. Безопасное резервное копирование и хранение полученных изображений для анализа.
7. Анализ данных
- Корректируйте предварительно обработанные данные покадровой визуализации FRET из контрольных образцов на предмет спектральных перекрестных помех и автофлуоресценции CFP, что приводит к корректировке значений FRET и точной эффективности FRET. Используйте программное обеспечение для визуализации для получения, обработки и анализа изображений FRET, следуя протоколам, изложенным в предыдущих исследованиях 27,28,29,30 (рис. 9).
8. Расчет эффективности FRET
- Чтобы определить эффективность FRET, получите семь изображений: ячейки (IDA(D), IDD(D), IDA(A), IAA(A), IDD, IAA и IDA). Рассчитайте эффективность FRET по следующей формуле:
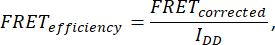
где FRETCorrected получается из уравнения:
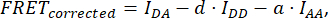
где d и a определяются как:
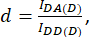
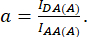
Здесь IDA, IDD и IAA представляют изображения клеток, трансфицированных с помощью биосенсора. IDA(D) и IDD(D)) — контрольные изображения только для донора, а IDA(A) и IAA(A) — только для акцепторных контрольных изображений.
9. Получение изображения
- IDA : Получение изображения путем донорского возбуждения (434 нм) с акцепторным излучением (530 нм).
- IDD : Получение изображения путем донорного возбуждения (434 нм) с донорским излучением (477 нм).
- IAA : Получение изображения путем возбуждения акцептора (517 нм) с излучением акцептора (530 нм).
- IDA(D) и IDA(A) : Получение изображения с использованием того же возбуждения и излучения, что и IDA, но от клеток, экспрессирующих только донора и акцептора соответственно.
- IDD(D) : Получить изображение в тех же условиях, что и IDD для управления только донором.
- IAA(A) : Получить изображение с использованием тех же условий, что и IAA, но специфично для элемента управления только акцептором.
10. Коррекция фона
- Откройте программу для анализа изображений на компьютере. В верхней строке меню откройте меню «Файл ». Выберите « Открыть» или «Открыть файл » в раскрывающемся списке.
- Перейдите в каталог, содержащий данные покадрового изображения. Найдите цейтраферное изображение, которое требует анализа (например, формат nd2).
- Выберите файл и нажмите кнопку «Открыть » или «ОК», чтобы загрузить его в программу для просмотра и анализа. Определите область интереса (ROI) в ячейке (или используйте всю ячейку в качестве ROI) и запишите значение серого для каждого пикселя в этой области.
- Выберите в качестве фона свободную от ячеек область и рассчитайте ее среднее значение серого. Создайте скорректированное изображение, вычтя это среднее значение фона из значения серого каждого пикселя в пределах ROI ячейки.
11. Устранение сквозных помех (перекрестных помех) FRET
ПРИМЕЧАНИЕ: Спектральное перекрытие между излучением донора и возбуждением акцептора показано на рисунке 3B, что имеет решающее значение для эффективности FRET и процесса передачи энергии. Просвечивание при покадровой визуализации FRET является серьезной проблемой, возникающей из-за спектрального перекрытия донорных и акцепторных флуорофоров, что приводит к неточным измерениям. Перекрестные помехи являются врожденными, потому что спектры как донорных, так и акцепторных флуорофоров в некоторой степени перекрываются (рис. 3C, D). Эта проблема усугубляется такими факторами, как высокая концентрация флуорофоров и неправильная конфигурация фильтров. Решение проблемы просачивания имеет решающее значение для обеспечения надежности измерений FRET.
- Обратитесь к предыдущему исследованию для получения информации о методе смягчения эффектов просвечивания9.
12. Количественная оценка и статистический анализ
- Выполняйте статистический анализ с помощью программного обеспечения для статистического анализа.
Результаты
Для исследования активации Akt в клетках HepG2 клетки были помещены на предварительно покрытые чашки для визуализации и трансфицированы с помощью биосенсора pEevee-iAkt-NES на основе FRET (рис. 2A), разработанного для обеспечения мониторинга фосфорилирования Akt в р...
Обсуждение
Протокол визуализации FRET живых клеток для мониторинга фосфорилирования Akt в клетках HepG2 включает в себя несколько ключевых этапов для обеспечения надежных и воспроизводимых результатов. Первым важным этапом является культивирование клеток, которое включает в себя р...
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Эта работа была частично поддержана Фондом естественных наук Шэньчжэня (JCYJ20240813113606009), Шэньчжэньско-гонконгской зоной сотрудничества в области технологий и инноваций (HZQB-KCZYB-2020056), Национальным фондом естественных наук Китая (32070681), Национальной ключевой программой исследований и разработок Китая (2019YFA0906002) и Шэньчжэньским планом павлина (KQTD2016053117035204).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin-EDTA | Gibco | Cat#25200-056 | Use ice-cold PBS for cell wash |
| 15 mm glass bottom cell culture dish | NEST | Cat#801001 | |
| 2 mL Nalgene cryogenic vials | Thermo Scientific | Cat#5012-0020 | |
| 5 mL Stripette Serological Pipets | Corning | Cat#4487 | |
| 95% Ethanol | Kermel | Cat#C028005 | |
| A1 HD25/A1R HD25 confocal microscope | Nikon | https://www.nikon.com/ | Magnification: 40×, Numerical Aperture (NA): 1.30, Pixel Dwell Time: 2.4 ms, Pixel Size: 1024 |
| Ampicillin | Sigma-Aldrich | Cat#A9393 | |
| Bovine serum albumin (BSA) | VWR Life Science | Cat#N208-10g | |
| Corning 25 cm2 rectangular culture flasks | Corning | Cat#430639 | |
| Countess 3 automated cell counter | Thermo Scientific | http://www.thermofisher.com/#AMQAX2000 | |
| Countess cell counting chamber slides | Thermo Scientific | http://www.thermofisher.com/#C10228 | |
| Digital vortex mixers | Thermo Scientific | https://www.thermofisher.com/ | |
| Dimethyl sulfoxide | Sigma-Aldrich | Cat#D2650 | |
| Eppendorf Safe-Lock Tubes 1.5 mL | Eppendorf | Cat#022363204 | |
| EZ-PCR mycoplasma detection kit | Biological Industries | Cat# 20-700-20 | |
| Fetal Bovine Serum, qualified, Australia | Gibco | Cat#10099141 | |
| GlutaMAX Supplement | Gibco | Cat#35050061 | |
| GraphPad Prism 9 | GraphPad Software | https://www.graphpad.com/ | |
| HepG2 | National Collection of Authenticated Cell Cultures | #CSTR:19375.09.3101HUMSCSP510 http://www.cellbank.org.cn/ | |
| Immersion Oil Type 37 | Cargille Laboratories | Cat #16237 | |
| Insulin | Sigma-Aldrich | Cat#I5500-50MG | Warm to 37 °C before use |
| LB Broth (1x) | Invitrogen | Cat#10855001 | |
| Minimum Essential Medium (MEM) | Gibco | Cat#11095080 | Warm to 37 °C before use |
| mySPIN 12 mini centrifuge | Thermo Scientific | https://www.thermofisher.com/ | |
| NanoDrop One | Thermo Scientific | https://www.thermofisher.com | |
| Nikon Plan Fluor 40×/1.30 Oil Lens | Nikon | https://www.nikon.com/ | |
| NIS-Elements-AR | Nikon | https://www.nikon.com/ | |
| Non-Essential Amino Acids (NEAA) (100x) | Gibco | Cat#11140050 | |
| One Shot LB Agar Plates | Invitrogen | Cat#A55802 | |
| One Shot Stbl3 chemically competent E. coli | Invitrogen | Cat#C737303 | |
| Parafilm | PARAFILM | Cat#B8R05606 | |
| PBS (phosphate buffered saline) | Gibco | Cat#10010023 | |
| pEevee-iAkt-NES (7,033 bp) | Miura et al31 | https://benchling.com/s/seq-q46zFYCfl0swLAun0t28/edit | |
| Penicillin-streptomycin | Gibco | Cat#15070063 | |
| Plasmocin prophylactic | InvivoGen | Cat#ant-mpp | |
| Poly-L-Lysine Hydrobromide | Sigma-Aldrich | Cat#P4832 | |
| Precision general purpose baths | Thermo Scientific | https://www.thermofisher.com/ | |
| QIAprep spin miniprep kit | QIAGEN | Cat#27106 | |
| SnapGene | SnapGene by Dotmatics | https://www.snapgene.com | |
| Sodium Pyruvate (100 mM) | Gibco | Cat#11360070 | |
| Syringe filter unit, 0.22 μm | Millipore | Cat#SLGP033RS | |
| Tokai Hit stage top incubator | TOKAI HIT | https://www.tokaihit-livecell.com/stagetopincubator | |
| UltraPure DNase/RNase-free distilled water | Invitrogen | Cat#10977015 | |
| Xfect Transfection Reagent | Takara Bio | Cat#631317 |
Ссылки
- GBD 2021 Diabetes Collaborators. Global, regional, and national burden of diabetes from 1990 to 2021, with projections of prevalence to 2050: a systematic analysis for the Global Burden of Disease Study 2021. Lancet. 402 (10397), 203-234 (2023).
- Li, M., et al. Trends in insulin resistance: insights into mechanisms and therapeutic strategy. Signal Transduct Target Ther. 7 (1), 216 (2022).
- Poloz, Y., Stambolic, V. Obesity and cancer, a case for insulin signaling. Cell Death Dis. 6 (12), e2037 (2015).
- Arcidiacono, B., et al. Insulin resistance and cancer risk: an overview of the pathogenetic mechanisms. Exp Diabetes Res. 2012, 789174 (2012).
- Godsland, I. F. Insulin resistance and hyperinsulinaemia in the development and progression of cancer. Clin Sci (Lond). 118 (5), 315-332 (2009).
- Tsugane, S., Inoue, M. Insulin resistance and cancer: epidemiological evidence. Cancer Sci. 101 (5), 1073-1079 (2010).
- Yudhani, R. D., et al. In vitro insulin resistance model: A recent update. J Obes. 2023, 1964732 (2023).
- Akhtar, J., et al. Bistable insulin response: The win-win solution for glycemic control. iScience. 25 (12), 105561 (2022).
- Akhtar, J., Imran, M., Wang, G. Protocol for live-cell Forster resonance energy transfer imaging to reveal the bistable insulin response of single C2C12-derived myotubes. STAR Protoc. 5 (2), 103109 (2024).
- Kamino, K., et al. Optimal inference of molecular interaction dynamics in FRET microscopy. Proc Natl Acad Sci U S A. 120 (15), e2211807120 (2023).
- Kraft, A. E., Nikolaev, V. O. FRET microscopy for real-time visualization of second messengers in living cells. Methods Mol Biol. 1563, 85-90 (2017).
- Veeriah, S., et al. High-throughput time-resolved FRET reveals Akt/PKB activation as a poor prognostic marker in breast cancer. Cancer Res. 74 (18), 4983-4995 (2014).
- Conway, J. R. W., et al. Monitoring AKT activity and targeting in live tissue and disease contexts using a real-time Akt-FRET biosensor mouse. Sci Adv. 9 (17), eadf9063 (2023).
- Chandris, P., Giannouli, C. C., Panayotou, G. Imaging approaches for the study of metabolism in real time using genetically encoded reporters. Front Cell Dev Biol. 9, 725114 (2021).
- Yang, J., et al. Longitudinal FRET imaging of glucose and lactate dynamics and response to therapy in breast cancer cells. Mol Imaging Biol. 24 (1), 144-155 (2022).
- Mandrou, E., et al. A reliable system for quantitative G-protein activation imaging in cancer cells. Cells. 13 (13), 1114 (2024).
- Fang, C., Huang, Y., Zhao, Y. Review of FRET biosensing and its application in biomolecular detection. Am J Transl Res. 15 (2), 694-709 (2023).
- Miller, J. N. Fluorescence energy transfer methods in bioanalysis. Analyst. 130 (3), 265-270 (2005).
- Verveer, P. J., Rocks, O., Harpur, A. G., Bastiaens, P. I. Imaging protein interactions by FRET microscopy: FRET measurements by acceptor photobleaching. CSH Protoc. 2006 (6), (2006).
- Vu, C. Q., Arai, S. Quantitative imaging of genetically encoded fluorescence lifetime biosensors. Biosensors (Basel). 13 (10), 939 (2023).
- Wang, G. A more holistic view of the logarithmic dose-response curve offers greater insights into insulin response. J Biol Chem. 301 (1), 108037 (2025).
- Wang, G. Body mass dynamics is determined by the metabolic Ohm's law and adipocyte-autonomous fat mass homeostasis. iScience. 23 (6), 101176 (2020).
- Wang, G. Raison d'être of insulin resistance: the adjustable threshold hypothesis. J R Soc Interface. 11 (101), 20140892 (2014).
- Wang, G. Optimal homeostasis necessitates bistable control. J R Soc Interface. 9, 2723 (2012).
- Heim, R., Tsien, R. Y. Engineering green fluorescent protein for improved brightness, longer wavelengths and fluorescence resonance energy transfer. Curr Biol. 6 (2), 178-182 (1996).
- Nguyen, A. W., Daugherty, P. S. Evolutionary optimization of fluorescent proteins for intracellular FRET. Nat Biotechnol. 23 (3), 355-360 (2005).
- Broussard, J. A., Rappaz, B., Webb, D. J., Brown, C. M. Fluorescence resonance energy transfer microscopy as demonstrated by measuring the activation of the serine/threonine kinase Akt. Nat Protoc. 8 (2), 265-281 (2013).
- Gordon, G. W., Berry, G., Liang, X. H., Levine, B., Herman, B. Quantitative fluorescence resonance energy transfer measurements using fluorescence microscopy. Biophys J. 74 (5), 2702-2713 (1998).
- Tron, L., et al. Flow cytometric measurement of fluorescence resonance energy transfer on cell surfaces. Quantitative evaluation of the transfer efficiency on a cell-by-cell basis. Biophys J. 45 (5), 939-946 (1984).
- Youvan, D. C., et al. Calibration of fluorescence resonance energy transfer in microscopy. , (2002).
- Miura, H., Matsuda, M., Aoki, K. Development of a FRET biosensor with high specificity for Akt. Cell Struct Funct. 39 (1), 9-20 (2014).
- Liberio, M. S., Sadowski, M. C., Soekmadji, C., Davis, R. A., Nelson, C. C. Differential effects of tissue culture coating substrates on prostate cancer cell adherence, morphology and behavior. PLoS One. 9 (11), e112122 (2014).
- Rani, K., Sengupta, S. Multi-stimuli programmable FRET based RGB absorbing antennae towards ratiometric temperature, pH and multiple metal ion sensing. Chem Sci. 12 (47), 15533-15542 (2021).
- Betolngar, D. B., et al. pH sensitivity of FRET reporters based on cyan and yellow fluorescent proteins. Anal Bioanal Chem. 407 (14), 4183-4193 (2015).
- Salonikidis, P. S., et al. An ion-insensitive cAMP biosensor for long term quantitative ratiometric fluorescence resonance energy transfer (FRET) measurements under variable physiological conditions. J Biol Chem. 286 (26), 23419-23431 (2011).
- Youvan, D. C., et al. Calibration of fluorescence resonance energy transfer in microscopy using genetically engineered GFP derivatives on nickel chelating beads. Biotechnol Alia. 3, 1-18 (1997).
- Menaesse, A., et al. Simplified instrument calibration for wide-field fluorescence resonance energy transfer (FRET) measured by the sensitized emission method. Cytometry A. 99 (4), 407-416 (2021).
- Batta, A., Hajdu, T., Nagy, P. Improved estimation of the ratio of detection efficiencies of excited acceptors and donors for FRET measurements. Cytometry A. 103 (7), 563-574 (2023).
- Coullomb, A., et al. QuanTI-FRET: a framework for quantitative FRET measurements in living cells. Sci Rep. 10 (1), 6504 (2020).
- Hoppe, A., Christensen, K., Swanson, J. A. Fluorescence resonance energy transfer-based stoichiometry in living cells. Biophys J. 83 (6), 3652-3664 (2002).
- Zal, T., Gascoigne, N. R. Photobleaching-corrected FRET efficiency imaging of live cells. Biophys J. 86 (6), 3923-3939 (2004).
- Hochreiter, B., Kunze, M., Moser, B., Schmid, J. A. Advanced FRET normalization allows quantitative analysis of protein interactions including stoichiometries and relative affinities in living cells. Sci Rep. 9 (1), 8233 (2019).
- Liu, H., Zhang, F., Mishra, S. K., Zhou, S., Zheng, J. Knowledge-guided fuzzy logic modeling to infer cellular signaling networks from proteomic data. Sci Rep. 6, 35652 (2016).
- Garrido-Rodriguez, M., Zirngibl, K., Ivanova, O., Lobentanzer, S., Saez-Rodriguez, J. Integrating knowledge and omics to decipher mechanisms via large-scale models of signaling networks. Mol Syst Biol. 18 (7), e11036 (2022).
- Greenwald, E. C., Polanowska-Grabowska, R. K., Saucerman, J. J. Integrating fluorescent biosensor data using computational models. Methods Mol Biol. 1071, 227-248 (2014).
- Zhao, Z., Xia, J. Computational Approaches for Modeling Signal Transduction Networks. Encyclopedia of Bioinformatics and Computational Biology. , (2019).
- Wang, G., Krueger, G. R. Computational analysis of mTOR signaling pathway: bifurcation, carcinogenesis, and drug discovery. Anticancer Res. 30 (7), 2683-2688 (2010).
- Wang, G. Singularity analysis of the AKT signaling pathway reveals connections between cancer and metabolic diseases. Phys Biol. 7 (4), 046015 (2010).
- Chedere, A., Hari, K., Kumar, S., Rangarajan, A., Jolly, M. K. Multi-stability and consequent phenotypic plasticity in AMPK-Akt double negative feedback loop in cancer cells. J Clin Med. 10 (3), 472 (2021).
- Mosca, E., et al. Computational modeling of the metabolic States regulated by the kinase akt. Front Physiol. 3, 418 (2012).
- Liao, J., Madahar, V., Dang, R., Jiang, L. Quantitative FRET (qFRET) technology for the determination of protein-protein interaction affinity in solution. Molecules. 26 (21), 6339 (2021).
- Verma, A. K., Noumani, A., Yadav, A. K., Solanki, P. R. FRET based biosensor: Principle applications recent advances and challenges. Diagnostics (Basel). 13 (8), 1375 (2023).
- Mattheisen, J. M., et al. Application of bioluminescence resonance energy transfer to quantitate cell-surface expression of membrane proteins. Anal Biochem. 684, 115361 (2024).
- Lionetti, M. C., La Porta, C. A. M. FLIM-FRET investigation of heterogeneous huntingtin aggregation in HeLa cells. Methods Mol Biol. 2551, 595-604 (2023).
- Petutschnig, E. K., Pierdzig, L., Mittendorf, J., Niebisch, J. M., Lipka, V. A novel fluorescent protein pair facilitates FLIM-FRET analysis of plant immune receptor interaction under native conditions. J Exp Bot. 75 (3), 746-759 (2024).
- Sprenger, J. U., Perera, R. K., Gotz, K. R., Nikolaev, V. O. FRET microscopy for real-time monitoring of signaling events in live cells using unimolecular biosensors. J Vis Exp. 66, e4081 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены