È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
In Imaging bioluminescenza in vivo di Dinamica Tumore ipossia di metastasi cerebrali cancro al seno in un modello murino
In questo articolo
Riepilogo
L'imaging bioluminescenza di ipossia-inducibile fattore 1α attività è applicata a monitorare lo sviluppo del tumore ipossia cerebrale in un modello di cancro al seno del mouse metastasi al cervello.
Abstract
È ben noto che l'ipossia tumorale svolge un ruolo importante nel promuovere la progressione maligna e colpisce negativamente la risposta terapeutica. C'è poca conoscenza in situ, in vivo, ipossia tumorale durante lo sviluppo cerebrale dei tumori maligni al cervello a causa della mancanza di mezzi efficaci per il monitoraggio in questi tumori ortotopico profonde. Di imaging bioluminescenza (BLI), basato sul rilevamento della luce emessa dalle cellule viventi che esprimono un gene luciferasi, è stato rapidamente adottato per la ricerca sul cancro, in particolare, per valutare la crescita del tumore o cambiamenti dimensioni del tumore in risposta al trattamento negli studi su animali preclinici. Inoltre, esprimendo un gene reporter sotto il controllo di una sequenza promotore, l'espressione del gene specifico può essere monitorata in modo non invasivo da BLI. Sotto stress ipossico, le risposte di segnalazione sono mediati principalmente attraverso il fattore ipossia-inducibile 1α (HIF-1α) a guidare la trascrizione di vari geni. Pertanto, abbiamo utilizzato un HIF-1α costruire giornalista, 5HRE-ODD-luc, stabilmente transfettate in cancro mammario umano MDA-MB231 cellule (MDA-MB231/5HRE-ODD-luc). In vitro HIF-1α saggio bioluminescenza è eseguita da incubando le cellule transfettate in una camera di ipossia (0,1% O 2) per 24 ore prima di BLI, mentre le cellule in normossia (21% O 2) Come controllo. Significativamente più alto flusso di fotoni osservati per le cellule in ipossia suggerisce un aumento di HIF-1α vincolante per i suoi promotori (elementi HRE), rispetto a quelli normossia. Le cellule vengono iniettate direttamente nel cervello di topo per stabilire un modello di cancro al seno metastasi al cervello. Nell'imaging bioluminescenza in vivo delle dinamiche ipossia tumore è iniziato 2 settimane dopo l'impianto e ripetute una volta alla settimana. BLI rivela sempre più segnali di luce dal cervello come il tumore progredisce, indicando un aumento ipossia intracranica del tumore. Studi istologici ed immunoistochimici sono utilizzati per confermare i risultati di imaging in vivo. Qui, introdurremo approcci in vitro di HIF-1α saggio bioluminescenza, creazione chirurgica di una metastasi cerebrali tumore al seno in un topo nudo e in applicazione della bioluminescenza di imaging in vivo di monitorare ipossia intracranica del tumore.
Protocollo
Tutte le procedure di animali sono stati approvati dalla cura degli animali e del Comitato Istituzionale uso della University of Texas Southwestern Medical Center.
1. In vitro HIF-1α saggio di bioluminescenza
- Materiali e metodi:
- Umano tumore metastatico al seno linea di cellule MDA-MB231 transfettate con un romanzo HIF-1-dipendente gene reporter, 5HRE-ODD-luc è stata generata dal Dr. Harada.
- In condizioni di ipossia, l'espressione di ossigeno-dipendente di degradazione del dominio (ODD)-luciferasi proteina di fusione è guidata da 5 copie di ipossia-risposta elemento (5HRE). La presenza di ODD provoca la degradazione di ODD-Luc proteina con conseguente estremamente bassa attività luciferasi sfondo in condizioni di normossia. Pertanto, questo nuovo sistema può essere utilizzato per rilevare le regioni ipossiche in un tumore da imaging in tempo reale. La costruzione di questo 5HRE-ODD-luc vettore di espressione è stata riportata da 1,2 Harada et al.
- Cellule in coltura normossia o ipossia:
- Mantenere la ricombinante cellule MDA-MB231 nel 10% siero fetale bovino (FBS)-DMEM medio contenente 1% glutamina, antibiotici di 400 mg / ml di G418 e 1% di penicillina / streptomicina.
- In vitro per la HIF-1α saggio bioluminescenza, piatto 3 x 10 5 MDA-MB231 cellule che esprimono 5HRE-ODD-luc vettore in ciascun pozzetto di due sei piatto bene.
- Consentono alle cellule per attaccare la parete piatto dopo incubazione durante la notte e poi trasferire un piatto in una camera di ipossia (Billups-Rothenberg, Inc. Del Mar, CA) per gli studi di ipossia, mentre tenere il piatto di altri in condizioni di normossia (21% O 2).
- Rimontare la camera e la camera a gas con 0,1% O 2, collegando il tubo di ingresso porta con una bombola di gas.
Nota: sia in ingresso e morsetti porta di uscita deve essere aperto durante questa procedura. - Scollegare fonte di gas dopo della camera è stato eliminato e la camera di tenuta chiudendo fascette di plastica.
- Posizionare la camera in un incubatore a 37 ° C con 5% di CO 2.
Nota: La camera deve essere umidificata per evitare l'eccessiva evaporazione delle culture. Questo può essere ottenuto mettendo 10-20 ml di acqua sterile nella camera.
- Bioluminescenza saggio:
- Dopo 24 ore di incubazione, rimuovere il terreno e lavare le cellule in modo rapido con ghiaccio PBS freddo (2X).
- Aggiungere 1 ml di PBS freddo con 100 ml di Luciferin (Biotecnologie Oro, St Louis, MO).
- BL acquisire immagini (sistema Spectrum IVIS, Caliper Life Sciences, Hopkinton, MA) con tempi di esposizione diversi (1, 30, 60, 180 s).
- Misura l'intensità della luce in ciascun pozzetto utilizzando il software immagine vivente (Caliper Life Sciences).
2. Istituzione di un modello di metastasi al seno cancro al cervello
- Preparazione delle cellule MDA-MB231/5HRE-ODD-luc
- Recuperare e coltivare le cellule MDA-MB231/5HRE-ODD-luc nel medio DEME contenente 10% FBS, 1% glutamina e 1% di penicillina / streptomicina.
- Sostituire media ogni 2-3 giorni. Tripsinize e lavare le cellule quando raggiungono l'80% confluenza.
- Contare un numero adeguato di cellule e risospendere in siero medio DEME libero con il 25% Matrigel (BD Biosciences, San Jose, CA) con una concentrazione finale di 10 5 cellule in 4 volumi microlitri.
- Cellule posto sul ghiaccio prima dell'iniezione intracranica.
- Impianto chirurgico
- Topi nudi femminili (BALB / c nu / nu; National Cancer Institute, Bethesda, MD) a 4-6 settimane di età sono utilizzati in questo studio.
- Anestetizzare (3% isoflurano / O2 in una camera di induzione; isoflurano da Baxter International Inc., Deerfield, IL, USA) e mantenere gli animali con isoflurano (1%) in ossigeno (1 dm 3 / min) durante la procedura chirurgica 3.
- La pelle parietale destro deve essere preparata con Betadine e poi il 70% di alcol prima di incisione.
- Utilizzando un trapano ad alta velocità, bava di 1 mm foro nell'emisfero destro del cranio, 1 mm anteriore alla sutura coronale e 2 mm laterali di sutura sagittale.
- Draw 4 miscela microlitri di cellule (10 5 cellule) con un 10 microlitri siringa Hamilton (Hamilton Company, Reno, NV). Iniettare le cellule direttamente nel diritto caudale diencefalo, 1,5 mm sotto la dura madre con una misura 32G ago Hamilton. Tenere l'ago in posizione per circa 30 s prima del ritiro. L'utilizzo di un ago 32G sottile minimizza i danni ai tessuti.
- Riempire il foro con della cera bava osso e chiudere il cuoio capelluto con punti di sutura riassorbibili.
- Preparare la regione incisione con il 70% di alcol.
- Applicare l'analgesia buprenorfina ogni 12 ore per due giorni.
3. Nell'imaging bioluminescenza in vivo del tumore dinamiche ipossia in metastasi cerebrali tumore al seno
- Avviare l'imaging longitudinale bioluminescenza (sistema Spectrum IVIS) due settimane dopo l'impianto intracranica e ripetere una volta a settimana per 8-10 Settimane.
- Anestetizzare tre topi in un periodo (3% isofluorano / O 2 in una camera di induzione)
- Somministrare una soluzione di D-luciferina (120 mg / kg in PBS in un volume totale di 80 microlitri; Biotecnologie Oro) per via sottocutanea nella regione del collo di ogni mouse come descritto in dettaglio in precedenza 4.
D-luciferina non è tossico ed ha dimostrato di essere in grado di penetrare intatta barriera emato-encefalica (BBB) e le membrane delle cellule 3,5.
- Mettere i 3 topi in camera di imaging e mantenuti con isoflurano (1%) in ossigeno (1 dm 3 / min) durante l'imaging.
- Cinque minuti dopo l'iniezione luciferina, BL acquisire immagini con una gamma di tempo di esposizione diversi (1, 30, 60, 180 s).
Le nostre osservazioni mostrano che il tempo di picco di emissione di luce è di circa 5 minuti dopo la somministrazione sottocutanea di luciferina nella regione del collo 3,4.
- Analizzare i dati con il software Imaging Living (Caliper Life Sciences) utilizzando conta assoluta dei fotoni (fotoni / s) in una regione di interesse (ROI), disegnata a mano a delineare il segnale BLI del cervello.
- Tempo curva trama corso della conta fotone per indicare la dinamica ipossia tumorale.
- Immediatamente dopo l'ultima BLI, amministrare pimonidazole, il marcatore ipossia e 1 ora dopo, il sacrificio dei topi e sezionare il cervello. Incorpora il cervello tutto in temperatura ottimale di taglio (OCT), medie e congelare in freezer -80 ° C. Successiva colorazione istologica violetto cresolo e colorazione immunoistochimica contro la luciferasi, marcatore pimonidazole ipossia, e HIF-1α eseguita per convalidare le osservazioni di imaging.
4. Rappresentante dei risultati:
Come mostrato in Fig.1, significativamente più alto segnale BLI è stata osservata dopo che le cellule transfettate incubate nella camera di ipossia (1% O 2) per 24 ore. Emissione di luce debole è stata osservata da parte delle cellule di controllo in normossia. Ciò può derivare da popolazione di cellule sovraffollata cultura dopo 24 ore di 3 x 10 5 cellule, che ha indotto un segnale di stress per le cellule di iperespressione di HIF-1α. Tuttavia, in vivo BLI risultati sono stati convalidati dalla colorazione immunoistochimica mostrando colocalizzazione tra ipossia tumorale ed espressione luciferasi.
Un array automatico dei tempi di esposizione permette di acquisizioni continue di una serie di immagini, che facilita la cattura di un segnale debole con il tempo di esposizione più lunghi e forti segnali con un tempo più breve senza saturare il CCD.
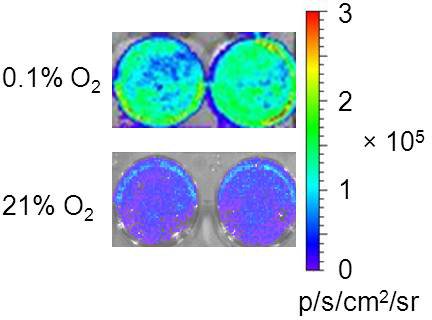
Figura 1 in vitro HIF-1α saggio bioluminescenza Top riga:. 3 x 10 5 cellule MDA-MB231/5HRE-ODD-luc incubate in ciascun pozzetto di una ben-6-piatto in una camera di ipossia (0,1% O 2) per 24 ora prima del mezzo è stato rimosso, lavato e riutilizzato con 1 ml di PBS. Immediatamente dopo 100 luciferina microlitri è stato aggiunto in ciascun pozzetto, BLI è stata acquisita con una serie di tempi di esposizione (1, 30, 60, 180 s). Luminescenza forte è stata osservata da pozzi rappresentante fila in basso:. Come controllo, 3 x 10 5 cellule incubate sotto normossia (21% O 2) emessa luce debole.
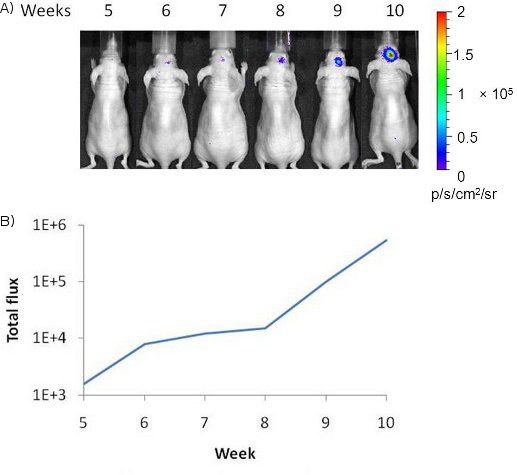
Figura 2 Nell'imaging bioluminescenza in vivo delle dinamiche di ipossia tumorale. A) Un segnale debole luce dalla parte destra del cervello di topo è stato visualizzato 5 settimane dopo l'impianto di cellule intracranica MDA-MB231/5HRE-ODD-luc cancro al seno. Aumento segnale ottico è stato osservato per altre 6 settimane, che indica l'ipossia tumore aumentato. B) La trama ha mostrato la curva di durata di quantitative conta fotone di segnale luminoso.
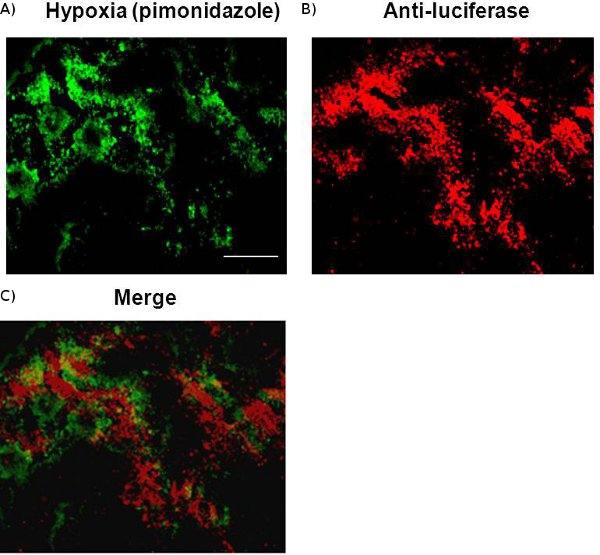
Figura 3 Colocaliztion della luciferasi e ipossia rilevati da immunohisto-chimici della colorazione. Un cervello di topo congelato recanti una metastasi del cancro al seno MDA-MB231/5HRE-ODD-luc incorporato in ottobre è stato sezionato. A 10 micron sezione immunostained con pennarello ipossia, pimonidazole, ha rivelato l'eterogeneità intratumorale di ipossia, che è stato trovato di correlare spazialmente con l'espressione luciferasi rilevato da anti-luciferasi colorazione. Scala grafica, 100 micron.
Discussione
Metastasi del cancro al seno del cervello si verifica nel 30% dei pazienti con carcinoma mammario in stadio IV. E 'associata ad alta morbilità e mortalità ed ha una sopravvivenza mediana di 13 mesi 6. Vi è la necessità di avere modelli animali appropriati per simulare questa malattia clinicamente devastante al fine di facilitare la comprensione della sua iniziazione e la progressione intracranica e profili fisiopatologiche. Qui, abbiamo sviluppato un modello ortotopico tumore al seno metastasi al cerv...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo studio è sostenuto in parte dal premio DOD IDEA Breast Cancer W81XWH-08-1-0583 e NIH / NCI CA141348-01A1 (DZ) e FAMRI premio scienziato clinico (DS). Infrastruttura di imaging è fornito da sud-ovest di piccola Imaging Research Program animali realizzata in collaborazione con U24 CA126608 e Simmons Cancer Center (P30 CA142543) e NIH 1S10RR024757-01.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
|---|---|---|---|
| D-luciferina | Oro Biotecnologie | L-123 | 120 mg / kg in PBS in un volume totale di 80 microlitri per studio in vivo |
| Isoflurano | Baxter International Inc. | 1001936060 | |
| Matrigel | BD Biosciences | 354234 | |
| Hamilton siringa | Hamilton Azienda | 1701 | |
| 32G Hamilton ago | Hamilton Azienda | 7803-04 | |
| Camera di ipossia | Billups-Rothenberg, Inc. | MIC-101 | |
| Bioluminescenza sistema di imaging | Caliper Life Sciences | IVIS Spectrum sistema | |
| G418 | Fisher Scientific | SV3006901 |
Riferimenti
- Harada, H. The combination of hypoxia-response enhancers and an oxygen-dependent proteolytic motif enables real-time imaging of absolute HIF-1 activity in tumor xenografts. Biochem Biophys Res Commun. 360, 791-796 (2007).
- Ou, G. Usefulness of HIF-1 imaging for determining optimal timing of combining bevacizumab and radiotherapy. Int J Radiat Oncol Biol Phys. 75, 463-467 (2009).
- Zhou, H. Dynamic near-infrared optical imaging of 2-deoxyglucose uptake by intracranial glioma of athymic mice. PLoS One. 4, e8051-e8051 (2009).
- Contero, A., Richer, E., Gondim, A., Mason, R. P. High-throughput quantitative bioluminescence imaging for assessing tumor burden. Methods Mol Biol. 574, 37-45 (2009).
- Zhao, D., Richer, E., Antich, P. P., Mason, R. P. Antivascular effects of combretastatin A4 phosphate in breast cancer xenograft assessed using dynamic bioluminescence imaging and confirmed by MRI. FASEB J. 22, 2245-2451 (2008).
- Chang, E. L., Lo, S. Diagnosis and management of central nervous system metastases from breast cancer. Oncologist. 8, 398-410 (2003).
- Palmieri, D. Vorinostat inhibits brain metastatic colonization in a model of triple-negative breast cancer and induces DNA double-strand breaks. Clin Cancer Res. 15, 6148-6157 (2009).
- Mason, R. P. Multimodality imaging of hypoxia in preclinical settings. Q J Nucl Med Mol Imaging. 54, 259-280 (2010).
- Tatum, J. L. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82, 699-757 (2006).
- Moeller, B. J. Pleiotropic effects of HIF-1 blockade on tumor radiosensitivity. Cancer Cell. 8, 99-110 (2005).
- Lu, X. In vivo dynamics and distinct functions of hypoxia in primary tumor growth and organotropic metastasis of breast cancer. Cancer Res. 70, 3905-3914 (2010).
- Zhao, D., Chang, C. H., Kim, J. G., Liu, H., Mason, R. P. In vivo Near-Infrared Spectroscopy and Magnetic Resonance Imaging Monitoring of Tumor Response to Combretastatin A-4-Phosphate Correlated With Therapeutic Outcome. Int J Radiat Oncol Biol Phys. 80, 574-581 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon