Purificazione di composti tramite ricristallizzazione
Panoramica
Fonte: Laboratorio del Dr. Jimmy Franco - Merrimack College
La ricristallizzazione è una tecnica utilizzata per purificare i composti solidi. 1 I solidi tendono ad essere più solubili nei liquidi caldi che nei liquidi freddi. Durante la ricristallizzazione, un composto solido impuro viene sciolto in un liquido caldo fino a quando la soluzione non è satura, quindi il liquido viene lasciato raffreddare. 2 Il composto dovrebbe quindi formare cristalli relativamente puri. Idealmente, eventuali impurità presenti rimarranno nella soluzione e non saranno incorporate nei cristalli in crescita (Figura 1). I cristalli possono quindi essere rimossi dalla soluzione mediante filtrazione. Non tutto il composto è recuperabile: alcuni rimarranno nella soluzione e andranno persi.
La ricristallizzazione non è generalmente considerata una tecnica di separazione; piuttosto, è una tecnica di purificazione in cui una piccola quantità di un'impurità viene rimossa da un composto. Tuttavia, se le proprietà di solubilità di due composti sono sufficientemente diverse, la ricristallizzazione può essere utilizzata per separarli, anche se sono presenti in quantità quasi uguali. La ricristallizzazione funziona meglio quando la maggior parte delle impurità sono già state rimosse con un altro metodo, come l'estrazione o la cromatografia su colonna.
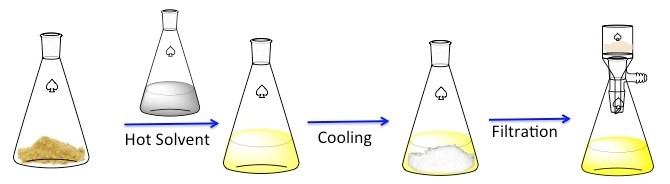
Figura 1. Lo schema generale per la ricristallizzazione.
Principi
Una ricristallizzazione di successo dipende dalla corretta scelta del solvente. Il composto deve essere solubile nel solvente caldo e insolubile nello stesso solvente quando è freddo. Ai fini della ricristallizzazione, si consideri al 3% p/v la linea di demarcazione tra solubile e insolubile: se 3 g di un composto si dissolvono in 100 ml di solvente, è considerato solubile. Nella scelta di un solvente, maggiore è la differenza tra solubilità a caldo e solubilità a freddo, maggiore è il prodotto recuperabile dalla ricristallizzazione.
La velocità di raffreddamento determina la dimensione e la qualità dei cristalli: il raffreddamento rapido favorisce i piccoli cristalli e il raffreddamento lento favorisce la crescita di cristalli grandi e generalmente più puri. Il tasso di ricristallizzazione è generalmente maggiore a circa 50 °C al di sotto del punto di fusione della sostanza; la massima formazione di cristalli avviene a circa 100 °C sotto il punto di fusione.
Sebbene i termini "cristallizzazione" e "ricristallizzazione" siano talvolta usati in modo intercambiabile, tecnicamente si riferiscono a processi diversi. La cristallizzazione si riferisce alla formazione di un nuovo prodotto insolubile da una reazione chimica; questo prodotto precipita quindi fuori dalla soluzione di reazione come un solido amorfo contenente molte impurità intrappolate. La ricristallizzazione non comporta una reazione chimica; il prodotto grezzo viene semplicemente disciolto in soluzione, quindi le condizioni vengono modificate per consentire ai cristalli di ri-formarsi. La ricristallizzazione produce un prodotto finale più puro. Per questo motivo, le procedure sperimentali che producono un prodotto solido per cristallizzazione normalmente includono una fase finale di ricristallizzazione per dare il composto puro.
Procedura
Eseguire tutte le fasi in una cappa aspirante per prevenire l'esposizione ai fumi del solvente.
1. Selezione di un solvente
- Porre 50 mg del campione (N-bromosuccinimide) in un matraccio Erlenmeyer.
- Aggiungere 0,5 ml di solvente bollente (acqua). Se il campione si dissolve completamente, la solubilità nel solvente freddo è troppo alta per essere un buon solvente di ricristallizzazione.
- Se il campione non si dissolve nel solvente freddo, riscaldare la provetta fino a quando il solvente non bolle.
- Se il campione non si è completamente sciolto a questo punto, aggiungere altro solvente bollente a goccia, fino a quando tutto il solido si dissolve. Se ci vogliono più di 3 ml per sciogliere il campione nel solvente caldo, la solubilità in questo solvente è probabilmente troppo bassa per renderlo un buon solvente di ricristallizzazione.
- Se la prima scelta di solvente non è un buon solvente di ricristallizzazione, provane altri. Se non è possibile trovare un singolo solvente che funziona, provare un sistema a due solventi.
- Se non è possibile trovare un singolo sistema a solvente adatto, potrebbe essere necessaria una coppia di solventi. Quando si identifica una coppia di solventi, ci sono diverse considerazioni chiave 1) Il primo solvente dovrebbe facilmente dissolvere il solido. 2) Il secondo solvente deve essere miscibile con il1° solvente, ma avere una solubilità molto più bassa per il soluto.
- Come regola generale "likes dissolve likes", il che significa che i composti polari tendono ad essere solubili in solventi polari e i composti non polari sono spesso composti non polari più solubili.
- Coppie di solventi comuni (Tabella 1)
- Assicurarsi che il solvente abbia un punto di ebollizione di almeno 40 °C, in modo che vi sia una ragionevole differenza di temperatura tra solvente bollente e solvente a temperatura ambiente.
- Assicurarsi che il solvente abbia un punto di ebollizione inferiore a circa 120 °C, in modo che sia più facile rimuovere le ultime tracce di solvente dai cristalli.
- Assicurarsi inoltre che il punto di ebollizione del solvente sia inferiore al punto di fusione del composto, in modo che il composto si formi come cristalli solidi piuttosto che come olio insolubile.
- Confermare che le impurità sono insolubili nel solvente caldo (in modo che possano essere filtrate a caldo, una volta che il composto è disciolto) o solubili nel solvente freddo (in modo che rimangano disciolte durante l'intero processo).
2. Sciogliere il campione in solvente caldo
- Posizionare il composto da ricristallizzare in un matraccio Erlenmeyer. Questa è una scelta migliore di un becher, poiché i lati inclinati aiutano a intrappolare i vapori di solvente e rallentare la velocità di evaporazione.
- Mettere il solvente (acqua) in un matraccio Erlenmeyer separato e aggiungere patatine bollenti o una barra di agitazione per mantenerlo in ebollizione senza intoppi. Riscaldarlo a ebollizione su una piastra elettrica.
- Aggiungere solvente caldo a un matraccio a temperatura ambiente contenente il composto in piccole porzioni, ruotando dopo ogni aggiunta, fino a quando il composto è completamente sciolto.
- Durante il processo di dissoluzione, mantenere la soluzione sempre calda appoggiandola anche sulla piastra di cottura. Non aggiungere più solvente caldo del necessario - quanto basta per sciogliere il campione.
- Se una porzione del solido non sembra dissolversi, anche dopo che è stato aggiunto più solvente caldo, è probabile che sia dovuto alla presenza di impurità molto insolubili. Se ciò accade, interrompere l'aggiunta di solvente ed eseguire una filtrazione a caldo prima di procedere.
- Per eseguire una filtrazione a caldo, piegare un pezzo di carta da filtro in una forma a cono scanalato e posizionarlo in un imbuto senza stelo di vetro.
- Aggiungere un eccesso del 10-20% di solvente caldo alla soluzione calda per consentire l'evaporazione nella procedura.
- Versare la soluzione attraverso la carta. Se i cristalli iniziano a formarsi in qualsiasi momento durante il processo, aggiungere una piccola porzione di solvente caldo per dissolverli.
3. Raffreddamento della soluzione
- Impostare il pallone contenente il composto disciolto su una superficie che non conduca il calore troppo rapidamente, ad esempio un tovagliolo di carta posto su un banco.
- Coprire leggermente il matraccio mentre si raffredda per evitare l'evaporazione e per evitare che la polvere cada nella soluzione.
- Lasciare indisturbato il pallone fino a quando non si raffredda a temperatura ambiente.
- Una volta formati i cristalli, posizionare la soluzione in un bagno di ghiaccio per assicurarsi che si ottiene la massima quantità di cristalli. Le soluzioni devono essere lasciate indisturbate nel bagno di ghiaccio per 30 minuti a 1 ora, o fino a quando il composto sembra essersi completamente cristallizzato fuori soluzione.
- Se non è evidente alcuna formazione cristallina, può essere indotta graffiando le pareti interne del pallone con un'asta di vetro o aggiungendo un piccolo cristallo seme dello stesso composto.
- Se questo non funziona ancora, probabilmente è stato usato troppo solvente. Riscaldare la soluzione, lasciare bollire parte del solvente, quindi raffreddarlo.
4. Isolare e asciugare i cristalli
- Mettere la fiaschetta fredda contenente i cristalli appena formati su un banco.
- Coprire leggermente il matraccio per evitare l'evaporazione e per evitare che la polvere cada nella soluzione.
- Isolare i cristalli mediante filtrazione sotto vuoto, utilizzando un imbuto Büchner o Hirsch (bloccare prima il pallone su un supporto ad anello).
- Risciacquare i cristalli sull'imbuto Büchner con una piccola quantità di solvente fresco e freddo (lo stesso solvente utilizzato per la ricristallizzazione) per rimuovere eventuali impurità che potrebbero attaccarsi ai cristalli.
- Per asciugare i cristalli, lasciarli nell'imbuto del filtro e aspirare l'aria attraverso di essi per diversi minuti. I cristalli possono anche essere essiccati all'aria permettendo loro di rimanere scoperti per diverse ore o giorni. I metodi più efficienti includono l'essiccazione sottovuoto o il posizionamento in un essiccatore.
| Solvente polare | Meno solvente polare |
| Acetato di etile | Esano |
| Metanolo | Diclorometano |
| Acqua | Etanolo |
| Toluene | Esano |
Tabella 1. Coppie di solventi comuni.
Risultati
Un esempio dei risultati della ricristallizzazione è mostrato nella Figura 2. Le impurità gialle presenti nel composto grezzo sono state rimosse e il prodotto puro viene lasciato come un solido bianco sporco. La purezza del composto ricristallizzato può ora essere verificata mediante spettroscopia di risonanza magnetica nucleare (NMR) o, se si tratta di un composto con un punto di fusione pubblicato, da quanto sia simile il suo punto di fusione al punto di fusione in letteratura. Se necessario, è possibile eseguire più ricristallizzazioni fino a quando la purezza non è accettabilemente elevata.

Figura 2. 2a) Un composto grezzo (a sinistra), 2b) prodotto ricristallizzato prima della filtrazione (al centro) e 2c) lo stesso composto dopo la ricristallizzazione (a destra).
Applicazione e Riepilogo
La ricristallizzazione è un metodo per purificare un composto rimuovendo eventuali impurità che potrebbero essere mescolate con esso. Funziona meglio quando il composto è molto solubile in un solvente caldo, ma molto insolubile nella versione fredda dello stesso solvente. Il composto deve essere un solido a temperatura ambiente. La ricristallizzazione viene spesso utilizzata come fase finale di pulizia, dopo altri metodi (come l'estrazione o la cromatografia su colonna) che sono efficaci nel rimuovere grandi quantità di impurità, ma che non aumentano la purezza del composto finale a un livello sufficientemente alto.
La ricristallizzazione è l'unica tecnica in grado di produrre cristalli singoli assolutamente puri e perfetti di un composto. Questi cristalli possono essere utilizzati per l'analisi a raggi X, che è l'autorità ultima nel determinare la struttura e la forma tridimensionale di una molecola. In questi casi, la ricristallizzazione è lasciata procedere molto lentamente, nel corso di settimane o mesi, per consentire al reticolo cristallino di formarsi senza l'inclusione di alcuna impurità. Sono necessari vetreria speciali per consentire al solvente di evaporare il più lentamente possibile durante questo periodo o per consentire al solvente di mescolarsi molto lentamente con un altro solvente in cui il composto è insolubile (chiamato aggiunta antisolvente).
L'industria farmaceutica fa anche un uso pesante della ricristallizzazione, poiché è un mezzo di purificazione più facilmente scalabile rispetto alla cromatografia su colonna. 3 L'importanza della ricristallizzazione nelle applicazioni industriali ha spinto gli educatori a enfatizzare la ricristallizzazione nel curriculum di laboratorio. 4 Ad esempio, il farmaco Stavudina, che viene utilizzato per ridurre gli effetti dell'HIV, è in genere isolato dalla cristallizzazione. 5 Spesso, le molecole hanno più strutture cristalline diverse disponibili, quindi è necessario che la ricerca valuti e capisca quale forma cristallina è isolata in quali condizioni, come la velocità di raffreddamento, la composizione del solvente e così via. Queste diverse forme cristalline potrebbero avere proprietà biologiche diverse o essere assorbite nel corpo a velocità diverse.
Un uso più comune della ricristallizzazione è nella produzione di caramelle rock. Le caramelle di roccia sono fatte sciogliendo lo zucchero in acqua calda fino al punto di saturazione. I bastoncini di legno vengono inseriti nella soluzione e la soluzione viene lasciata raffreddare ed evaporare lentamente. Dopo diversi giorni, grandi cristalli di zucchero sono cresciuti su tutti i bastoncini di legno.
Riferimenti
- Mayo, D. W.; Pike, R. M.; Forbes, D. C., Microscale organic laboratory : with multistep and multiscale syntheses. 5th ed.; J. Wiley & Sons: Hoboken, NJ, p xxi, 681 p (2011).
- Armarego, W. L. F.; Chai, C. L. L., Purification of laboratory chemicals. 5th ed.; Butterworth-Heinemann: Amsterdam ; Boston; p xv, 609 p (2003).
- Ray, P. C.; Tummanapalli, J. M. C.; Gorantla, S. R., Process for the large scale production of Stavudine. Google Patents: (2011).
- Hightower, T. R.; Heeren, J. D., Using a Simulated Industrial Setting for the Development of an Improved Solvent System for the Recrystallization of Benzoic Acid: A Student-Centered Project. Journal of Chemical Education 83 (11), 1663 (2006).
- Rohani, S.; Horne, S.; Murthy, K., Control of Product Quality in Batch Crystallization of Pharmaceuticals and Fine Chemicals. Part 1: Design of the Crystallization Process and the Effect of Solvent. Organic Process Research & Development 9 (6), 858-872 (2005).
Divulgazioni
- Mayo, D. W.; Luccio, R.M.; Forbes, D.C., Laboratorio organico microscala: con sintesi multistep e multiscala. 5a ed.; J. Wiley & Sons: Hoboken, NJ, p xxi, 681 p (2011).
- Armarego, W. L. F.; Chai, C. L. L., Purificazione di prodotti chimici di laboratorio. 5a ed.; Butterworth-Heinemann: Amsterdam ; Boston; p xv, 609 p (2003).
- Raggio, P.C.; Tummanapalli, J.M.C.; Gorantla, S. R., Processo per la produzione su larga scala di Stavudina. Brevetti Google: (2011).
- Torre alta, T. R.; Heeren, J. D., Using a Simulated Industrial Setting for the Development of an Improved Solvent System for the Recrystallization of Benzoic Acid: A Student-Centered Project. Journal of Chemical Education 83 (11), 1663 (2006).
- Rohani, S.; Horne, S.; Murthy, K., Controllo della qualità del prodotto nella cristallizzazione in batch di prodotti farmaceutici e prodotti chimici fini. Parte 1: Progettazione del processo di cristallizzazione e dell'effetto del solvente. Organic Process Research & Development 9 (6), 858-872 (2005).
Tags
Vai a...
Video da questa raccolta:

Now Playing
Purificazione di composti tramite ricristallizzazione
Organic Chemistry
709.2K Visualizzazioni

Introduzione alla catalisi
Organic Chemistry
34.5K Visualizzazioni

Assemblaggio di un sistema a riflusso per reazioni chimiche riscaldate
Organic Chemistry
167.8K Visualizzazioni

Esecuzione di reazioni al di sotto della temperatura ambiente
Organic Chemistry
70.7K Visualizzazioni

Trasferimento di solventi tramite linea Schlenk
Organic Chemistry
41.6K Visualizzazioni

Degasaggio di liquidi con ciclo freeze-pump-thaw
Organic Chemistry
56.3K Visualizzazioni

Preparazione di reagenti anidri e relativa strumentazione
Organic Chemistry
79.4K Visualizzazioni

Separazione di miscele tramite precipitazione
Organic Chemistry
157.8K Visualizzazioni

Estrazione solido-liquido (lisciviazione)
Organic Chemistry
237.9K Visualizzazioni

Rimozione dei solventi con evaporatore rotante
Organic Chemistry
212.9K Visualizzazioni

Distillazione frazionata
Organic Chemistry
334.6K Visualizzazioni

Preparazione di cristalli per l'analisi mediante diffrazione dei raggi X
Organic Chemistry
32.4K Visualizzazioni

Performing 1D Thin Layer Chromatography
Organic Chemistry
289.9K Visualizzazioni

Cromatografia su colonna
Organic Chemistry
360.5K Visualizzazioni

Spettroscopia a risonanza magnetica nucleare (NMR)
Organic Chemistry
248.3K Visualizzazioni