このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
でFACSアシスト細胞型特異的発現プロファイリングを使用して組織と器官特異フィトクロム応答を調査シロイヌナズナ
要約
空間固有のフィトクロム応答の分子基盤は、組織および器官特異的フィトクロムの欠陥を示すトランスジェニック植物を用いて検討されている。マイクロアレイ解析に続いてソート蛍光活性化細胞により誘導されるフィトクロム発色団の枯渇を示す特定の細胞の単離は、空間的な固有のフィトクロム反応に関与する遺伝子を同定するために活用されています。
要約
光を媒介する植物のライフサイクルを通じての発達と適応のプロセスの配列。植物は光受容体が感知し、光に適応するために呼ばれる光吸収分子を利用する。赤色/遠赤色光吸収フィトクロム光受容体が広く研究されている。フィトクロムは、彼らが研究されている、すべての高等植物のシステムで異なると重複する機能を持つ蛋白質の家族として存在
プロトコル
1。植物の成長
- 4(概要は図1参照)と野生型または親の行を説明するように単離した確認UAS - BVR X GAL4 - GFPエンハンサートラップライン、すなわちラインごと〜2000滅菌種子を、土壌に播種されています。
- 植物は、22で100μmolm-2 s -1の白色照明° Cと70%の湿度下での土壌で5週間栽培されている。
2。葉プロトプラスト単離(Deneckeとヴィタール9から適応)
- プロトプラストを単離するために、TEXのバッファを用意する。 - (N -モルホリノ)エタンスルホン酸(MES、2.56 mM)で、0.75 gの塩化カルシウム二水和物(塩化カルシウム2 · 2H 2 O、6.75 3.1グラムGamborgのB5塩、0.5 G 2:1リットルTEXのバッファの場合は、次のコンポーネントを重量を量るmM)を、0.25 gの硝酸アンモニウム(NH 4 NO 3、3.12 mM)で、136.9グラムのショ糖(0.4M)が。脱イオン、蒸留水の〜900ミリリットル(のddH 2 O)でコンポーネントを完全に溶解し、1で5.7にpHをもたらすM KOH。 1リットル、真空ポンプに接続さ0.2μmのボトルトップフィルターと殺菌フィルターに最終的なボリュームをもたらす。
- 植物から緑、健康な葉を(緩くビーカーに充填葉の〜250 ml)を収集し、〜40ミリリットルのddH 2 O 4回で洗い流し、滅菌のddH 2 Oで二回リンスが続く細い短冊状に#20メス、カット葉を使用し、均等に2個の50 mlの滅菌プラスチックチューブに組織を分割する。 10倍の葉の消化のストック溶液を5mlのアリコートを追加することにより、1 ×葉の消化液を調製する(10倍の葉の消化のストック溶液:2%(w / v)のMacerozyme R - 10、4%(w / v)のセルラーゼ"小野塚"TEXバッファでR - 10を、溶解0.2μmのフィルターで滅菌し、45 mlの新鮮なTEXのバッファは-80で5 mlのアリコート° C)を凍結フィルタ。すべての葉組織をカバーし、50 mlチューブあたり1 ×葉の消化ミックスの〜25 mlを加え。
- 穏やかに振盪しながらロッカーに室温で3時間のインキュベーションに続いて水ポンプに接続された真空デシケーターを用いて室温で1時間開いてチューブ内の消化液中の葉組織を浸潤する掃除機。 1X葉の消化ミックスの葉組織を持つキャップチューブは、光への暴露を防止するためにこのプロセスの間にアルミホイルに包んで保存されています。
- 3時間後、プロトプラストを解放するために〜2分間ロッカーの速度を増加させる。残渣を除去し、無菌のガラスビーカーにろ液を収集するために滅菌チーズクロスの二つの層を通して原油プロトプラスト懸濁液をフィルターします。滅菌シャーレに無菌100μmのナイロンメッシュを通してろ液をフィルタします。フロースルーを収集し、新しい滅菌50 mlチューブに移す。滅菌シャーレを洗浄し、表面に付着したプロトプラストを収集するために新鮮なTEXのバッファの15〜20 ml程度使用してください。
- 10で100xgでスイングバケットローターを使用して℃で15分(加速度6、減速0)のためにフロースルーを心する。
- 無菌9"ガラスパスツールピペットは、フローティングプロトプラストの層を乱さないと〜10を離れることなく、蠕動ポンプに接続した状態で、残留してペレット破片が含まれているフローティングプロトプラストの層、下に液体を30ml - - 15mlの体積〜25を削除します。
- 優しくプロトプラストを懸濁させる一方40mlの最終容量に新鮮なTEXのバッファを追加。
- できる限り多くの細胞残渣を除去するステップを2.5から2.7を2回繰り返します。遠心時間は、最初の繰り返しで10分に及び、最終的な繰り返しで5分に短縮されます。
- カット、新しい15mlのチューブに滅菌1 mlの転送ピペットでフローティングプロトプラストを吸引除去する。 4℃で2時間ソートするまでCまでのソートまたは暗所で店舗に直接進む。
3。蛍光活性化細胞選別(FACS)によるソートプロトプラスト
- ソートする前に、プロトプラストの整合性とプロトプラストのプール内のGFP蛍光の有無を確認するために励起用の488 nmのレーザーを使用して共焦点レーザー走査顕微鏡(CLSM)でプロトプラストを調べます。最小限の残骸は、FACSソーティングノズルを目詰まりを避けるために必要です。
- 適応プロトコル10を以下の約9 psiのシステム圧力で、6,000と15,000の間でイベントのレートでマクロソートの頭の上に200μmのノズルを用いてFACS経由TEXバッファー(BD FACSVantage SE、BD Biosciences社)でソート孤立プロトプラスト。
- 野生型非GFPのプロトプラストは、自家蛍光のしきい値を決定するために使用されます。
- GFP陽性プロトプラスト、30分の530バンドを使用してGFP蛍光を識別するために、488 nmのアルゴンラインでの空冷アルゴンレーザー(スペクトラフィジックスモデル177、ニューポート社、カリフォルニア州アーバイン)は100 mWで動作を使用してソートの細胞を収集するにはフィルタを通過する。
- GFP陽性のプロトプラストのコレクションに続いて、ステップ3.1で説明するようにCLSMでソートプロトプラストを調べます。
- キアゲンしたRNeasy植物ミニキットを使用してソートされたプロトプラストからトータルRNAを抽出する。アフィメトリクスGeneChip exprに説明されているようにcDNAをハイブリダイゼーション用に調製することができるession解析技術マニュアル、その後ATH1シロイヌナズナアフィメトリクスの全ゲノム配列にハイブリダイズした。
代表的な結果
我々は、FACSによるGFPのチャネルでGFP陽性細胞(図2)のかなりの数を検出する。血管や皮膚の発現に伴い、J1071は、〜1.4%のGFP陽性プロトプラストを持っていたのに対し、GFPエンハンサートラップの両親、構成的にGFPを発現するライン、J0571、表示された〜17%〜24パーセントのGFP陽性プロトプラストを用いた最適化アッセイで(表1)。 1時間J0571プロトプラストの3 ×500μlの(プロトプラスト懸濁液の約1.5 mlの合計)のソートは〜100,000 GFP陽性プロトプラストを与えた。 1.5時間J1071プロトプラストの3 × 500μlの(〜1.5ミリリットルの合計プロトプラスト懸濁液)のソートは、約3,000 GFP陽性プロトプラストを与えた。ソートが(図3Cと3E)に実施される前に、共焦点画像はJ0571とJ1071の両方のサンプルのプロトプラストの非常に高い収率を示し、ソートされたフラクションは、唯一の明るいGFP蛍光プロトプラストを(図3Gと示されていないデータ)が含まれていました。この発見は、無傷のGFP陽性プロトプラストを確認FACSを経由して並べ替えることができます。非GFPのプロトプラストはまたソートし、別々のチャンネルに集めることができます。非GFPのプロトプラストはholophytochromeレベルの減少によって遺伝子発現の特定の変更を検出するために、その後のマイクロアレイ解析のための理想的なネガティブコントロールとして機能する。分離されたプロトプラストからのRNA抽出(1 ml)をfluorospectrometry(図4)による検出のための十分な量のRNAが得られます。単離されたRNAは、光度計計器(光度計1000、サーモサイエンティフィック)を用いて評価し、光度計3.7.1 RNAの定量のソフトウェアにより定量した。 RNAの収量は、C24野生型プロトプラストまたは事前ソートされたFACSをソートから、GFP陽性のエンハンサートラップのプロトプラストは、マイクロアレイ用のRNAラベリングアッセイ(表2)で使用するために必要な最小20 ngを超えました。
| エンハンサートラップライン | GFP陽性のプロトプラストの% | ソートされたGFPのプロトプラストの数 |
| J0571 | 17.18パーセント〜24.06パーセント | 26400〜36000 |
| J1071 | 〜1.43パーセント | 1,000〜1300 |
ソートおよび蛍光活性化細胞ソーター(FACSVantage、BD)を介してプロトプラスト懸濁液500μLを実行することにより、収集したGFP陽性プロトプラストの数の前に2エンハンサートラップ系統のGFP陽性プロトプラストの表1。割合。
| 工場のライン | RNA収量(NG) |
| C24 WT | 12486.5 |
| J0571 | 60 |
| J1071 | 71.5 |
表2。プロトプラストからのRNA分離からの収量。 RNAは、2つのエンハンサートラップラインから事前にソートされたC24野生型またはソートされたGFP陽性のプロトプラストから分離し、定量した。
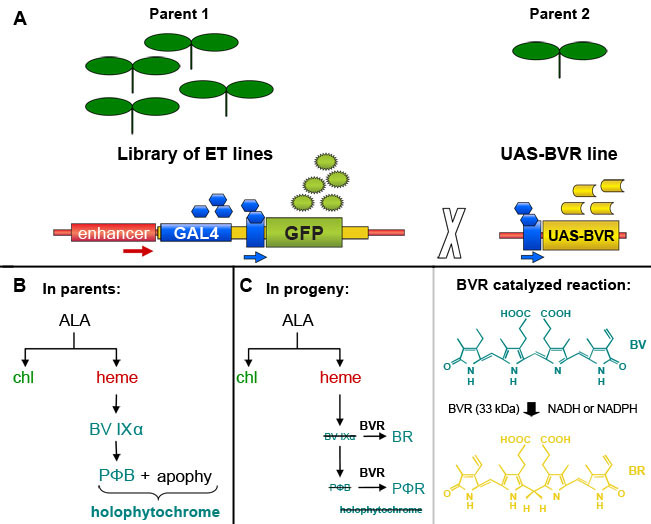
図1。 ビリベルジン還元酵素(BVR)トランスジェニックシロイヌナズナ植物における発現のGAL4エンハンサートラップベースの誘導。 (A)。 GAL4応答性GFPマーカー遺伝子を含むGAL4ベースエンハンサートラップ系統、、のライブラリーから選択された個々のマークGAL4含有細胞で標的遺伝子の発現を誘導するGAL4応答性標的遺伝子を含む系統と交配することができますGFP蛍光による。博士ジムHaseloff(http://www.plantsci.cam.ac.uk/Haseloff/geneControl/GAL4Frame.html)から図に基づいて。親系統におけるフィトクロム発色団、phytochromobilin(PΦB)とholophytochromeの(B)生産。 (C)左、ビリベルジン還元酵素(BVR)BRとPΦRに活動してビリベルジンIXα(BVIXα)とPΦBの削減、それぞれ。 PΦBの枯渇でBVRの活動の結果と光の生産holophytochromeの低下を導く。右、BVRによって触媒される反応が示されています。
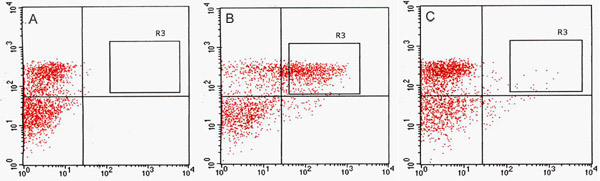
図2。蛍光活性化細胞選別(FACS)取得のドットプロット。 C24野生型()、J0571(B)およびJ1071(C)のソートプロトプラストの細胞の比較。 (A)非GFP蛍光C24野生型プロトプラストの取得ドットプロットでは、488 nmのアルゴンレーザーで励起し、自家蛍光閾値を決定するために使用。 (B)と(C)取得のドットプロットは、488 nmレーザーで励起に応答してGFP陽性であるプロトプラストの比率を示す。 R3は、BとC区切るのゲート蛍光活性化セルソーター(FACSVantage、BD)でソートし、収集されたGFP陽性のターゲットを選別。赤のチャネルには、vを示していますプロトプラストと緑のチャンネルからのクロロフィルの自家蛍光用aluesは、GFP蛍光の値を示します。

図3。細胞選別のために使用される植物プロトプラストの共焦点顕微鏡。共焦点レーザーは、蛍光活性化セルソーター(FACS)を経由して(G)ソートする前に(A、C、E)と後のプロトプラストの画像をスキャン。 B、D、F及びHは、DICイメージです。 C24野生型(A、B)、J1071(C、D)およびJ0571(E、F、G、H)のプロトプラストが表示されます。 488 nmレーザーで励起から得られると自家蛍光(LP 650 nmの) - 画像C、EおよびGは、GFP蛍光(575 nmのBP 505 nm)の画像をマージされます。 Hを介して63x油下4スキャンの平均です。バー= 10μmの。
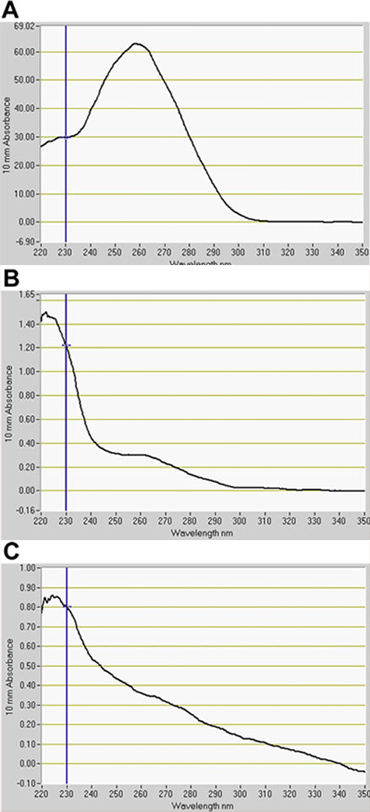
図4。fluorospectrometryによってプロトプラストから単離されたRNAの定量。 RNAは、()C24野生型、(B)J0571、および(C)J1071から抽出。事前にソートされた野生型プロトプラストのためのRNAを示している。 BとCは、蛍光活性化細胞選別(FACS)でソートGFP陽性プロトプラストからRNAを示している。 RNAの定量のソフトウェア、光度計3.7.1、(エルエムエス1000、サーモサイエンティフィック)。
ディスカッション
マイクロアレイ(1)を介して遺伝子発現プロファイリングは、11規制シロイヌナズナ実生の遺伝子の30%以上が光であることが分かっていますし、(2)、13フィトクロムシグナル伝達カスケード12に関与する光シグナル伝達タンパク質をコードする遺伝子の広大なグループを特定している。そのような実験は、光が遺伝子発現の急激かつ長期的変化を誘導することを示...
謝辞
植物のフィトクロム反応にモンゴメリーラボでの作業は、国立科学財団(助成金BLMにない。MCB - 0919100)と化学科学、地球科学およびバイオサイエンス部門、基礎エネルギー科学局、科学局、米国エネルギー省によってサポートされていますエネルギー(BLMへの助成金がない。DE FG02 91ER20021)。我々は共焦点の支援のためのシロイヌナズナプロトプラストの選別と博士メリンダフレームのプロトコルをソート蛍光活性化細胞の開発と最適化を支援するため博士はルイ王、実験的な援助のために、ステファニーコスティガンを撮影中に技術支援のためにメリッサウィテカーを感謝し、批判的に原稿を読んで顕微鏡。我々は編集支援のためのグラフィカルな設計の支援とカレンの鳥のためにマレーネキャメロンに感謝。
資料
| Name | Company | Catalog Number | Comments |
| Anti-BVR antibody | QED Bioscience Inc. | 56257-100 | |
| Cellulase “Onozuka” R-10 | SERVA Electrophoresis | MSPC 0930 | |
| Gamborg’s B5 basal salt mixture | Sigma-Aldrich | G5768 | |
| Macerozyme R-10 | SERVA Electrophoresis | PTC 001 | |
| MES, low moisture content | Sigma-Aldrich | M3671 | |
| Murashige and Skoog salts | Caisson Laboratories | 74904 | |
| Phytablend | Caisson Laboratories | 28302 | |
| RNeasy Plant Minikit | Qiagen | 16419 |
参考文献
- Franklin, K. A., Quail, P. H. Phytochrome functions in Arabidopsis development. J. Exp. Bot. 61, 11-24 (2010).
- Montgomery, B. L. Right place, right time: Spatiotemporal light regulation of plant growth and development. Plant Signal Behav. 3, 1053-1060 (2008).
- Laplaze, L. GAL4-GFP enhancer trap lines for genetic manipulation of lateral root development in Arabidopsis thaliana. J. Exp. Bot. 56, 2433-2442 (2005).
- Costigan, S., Warnasooriya, S. N., Montgomery, B. L. Root-localized phytochrome chromophore synthesis is required for tissue-specific photoregulation of root elongation and impacts sensitivity to jasmonic acid in Arabidopsis thaliana. , .
- Lagarias, D. M., Crepeau, M. W., Maines, M. D., Lagarias, J. C. Regulation of photomorphogenesis by expression of mammalian biliverdin reductase in transgenic Arabidopsis plants. Plant Cell. , 675-688 (1997).
- Montgomery, B. L., Yeh, K. C., Crepeau, M. W., Lagarias, J. C. Modification of distinct aspects of photomorphogenesis via targeted expression of mammalian biliverdin reductase in transgenic Arabidopsis plants. Plant Physiol. 121, 629-639 (1999).
- Warnasooriya, S. N., Montgomery, B. L. Detection of spatial-specific phytochrome responses using targeted expression of biliverdin reductase in Arabidopsis. Plant Physiol. 149, 424-433 (2009).
- Warnasooriya, S. N., Porter, K. J., Montgomery, B. L. Light-dependent anthocyanin accumulation and phytochromes in Arabidopsis thaliana. , .
- Denecke, J., Vitale, A. The use of protoplasts to study protein synthesis and transport by the plant endomembrane system. Methods Cell Biol. 50, 335-348 (1995).
- Birnbaum, K. Cell type-specific expression profiling in plants via cell sorting of protoplasts from fluorescent reporter lines. Nat. Methods. 2, 615-619 (2005).
- Ma, L. Light control of Arabidopsis development entails coordinated regulation of genome expression and cellular pathways. Plant Cell. 13, 2589-2607 (2001).
- Chen, M., Chory, J., Fankhauser, C. Light signal transduction in higher plants. Annu. Rev. Genet. 38, 87-117 (2004).
- Ulm, R., &, N. a. g. y., F, . Signalling and gene regulation in response to ultraviolet light. Curr. Opin. Plant Biol. 8, 477-482 (2005).
- Ma, L. Organ-specific expression of Arabidopsis genome during development. Plant Physiol. 138, 80-91 (2005).
- Neff, M. M., Fankhauser, C., &, C. h. o. r. y., J, . Light: an indicator of time and place. Genes Dev. 14, 257-271 (2000).
- Birnbaum, K. A gene expression map of the Arabidopsis root. Science. 302, 1956-1960 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved