Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hücre tipi Özgül gösterilmeden FACS yardımlı kullanarak Doku ve Organ spesifik Fitokrom Yanıtları incelenmesi Arabidopsis thaliana
Özet
Mekansal özel Fitokrom yanıtlar moleküler temeli, doku ve organ spesifik Fitokrom eksiklikleri gösteren transgenik bitkiler kullanılarak araştırılmaktadır. Belirli hücrelerin izolasyonu mikroarray analizleri takip Sıralama mekansal özel Fitokrom yanıtları yer genleri tanımlamak için kullanılmaktadır Floresan-Aktif Hücre tarafından uyarılan Fitokrom kromofor tükenmesi sergiliyor.
Özet
Işık aracılık gelişimsel ve adaptif süreçler bir bitkinin yaşam döngüsü boyunca bir dizi. Bitkiler kullanan ışık emici fotoreseptörlerin duygusu ve ışık uyum adı verilen moleküller. Uzak-kırmızı / kırmızı ışık emici Fitokrom fotoreseptörlerin yoğun çalışılan edilmiştir. Phytochromes çalışılmıştır olan tüm yüksek bitki sistemleri farklı ve birbiriyle çakışan fonksiyonları ile proteinlerin bir aile olarak var
Protokol
1. Bitki Büyüme
- Izole Onaylandı UAS-BVR X GAL4-GFP arttırıcı tuzak hattı olarak 4 açıklanan (özeti için bkz: Şekil 1) ve vahşi-tip veya ebeveyn hatları toprağa ekilir, yani satır başına ~ 2000 sterilize tohumları.
- Bitkiler 22 100 μmolm -2 s -1 beyaz aydınlatma altında toprak 5 hafta boyunca yetiştirilen ° C ve% 70 nem.
2. Yaprak Protoplast İzolasyonu (Denecke ve Vitale 9 uyarlanmış)
- Protoplast izole etmek için, TEX tampon hazırlamak. (N-morfolino) ethanesulfonic asit (MES, 2.56 mM), 0.75 gr kalsiyum klorür dihidrat (CaCl 2 .2 H 2 O, 6.75 - 3.1 g Gamborg Kullanıcı B5 tuzları, 0.5 g 2: 1 litre TEX tampon için, aşağıdaki bileşenleri dışarı tartmak mM), 0.25 g amonyum nitrat (NH 4 NO 3, 3.12 mM), 136.9 g sakaroz (0.4M). deiyonize, distile su ~ 900 ml (GKD 2 O) tamamen bileşenleri çözülür ve 1 ile 5.7 pH getirmek M KOH. 1 litre ve bir vakum pompasına bağlı bir şişe top 0.2 mikron filtre ile sterilize filtre son hacim kazandırın.
- Bitkilerin yeşil, sağlıklı yaprakları (gevşek bir beherdeki dolu yaprakları ~ 250 ml) toplayın ve ~ 40 ml GKD 2 O 4 kez ile yıkayın, iki kez steril GKD 2 O. ile durulama # 20 bistüri, kesilmiş yapraklar ince şeritler halinde ve eşit iki adet 50 ml steril plastik tüpler içine doku bölmek. 1x 10x yaprak sindirim stok solüsyonu (10x yaprak sindirim stok solüsyonu 5 ml kısım ekleyerek yaprak sindirim karışım hazırlayın: w / v Macerozyme R-10,% 4 w / v TEX tampon selülaz "Onozuka" R-10,% 2 çözülür 45 ml taze TEX tampon 0.2 mm) -80 ° C'de 5 ml alikotları filtre ve dondurma ile sterilize edin filtre. ~ 25 ml 1x tüm yaprak doku kapsayacak şekilde 50 ml tüp başına yaprak sindirim karışımı ekleyin.
- Vakum, nazik sallayarak bir rocker oda sıcaklığında 3 saat inkübasyon takip bir su pompası bağlı bir vakum desikatörde oda sıcaklığında 1 saat süreyle açık tüpler sindirim karışımı yaprak dokusu sızmak. 1x yaprak sindirim karışımı yaprak dokusu ile Kapaklı tüpler Işığa maruz kalmasını önlemek için bu işlem sırasında alüminyum folyo ile sarılı tutulur.
- 3 saat sonra, yaklaşık 2 dakika protoplast serbest için rocker hızını artırmak. Pislikleri temizleyin ve steril bir cam beher süzüntü toplamak için iki kat steril peynir bez ile ham protoplast süspansiyon Filtre. Steril bir Petri kabı içine steril 100 mikron naylon örgü ile süzüntü Filtresi. Üzerinden akış toplayın ve yeni bir steril 50 ml tüp aktarmak. Steril Petri bulaşık yıkama ve yüzeye yapışan herhangi bir protoplast toplamak için 15-20 ml taze TEX tampon kullanın.
- 10 100xg bir salıncak kova rotor kullanarak ° C için 15 dakika (6 Hızlanma, Yavaşlama 0) üzerinden akış santrifüjleyin.
- ~ 25 Kaldır - 30 ml kayan protoplast katman, altında kalan ve pelet enkaz içeren sıvı, kayan protoplast tabakası rahatsız edici ve ~ 10 bırakarak peristaltik bir pompa bağlı steril 9 "cam Pasteur pipeti ile 15 ml.
- Yavaşça protoplast resuspending son hacim 40 ml taze TEX tampon ekleyin.
- Mümkün olduğunca çok hücresel enkaz kaldırmak için adımlar 2,5-2,7 iki kez tekrarlayın. Santrifüj zaman, ilk tekrarından 10 dakika ve son tekrarından 5 dakikaya kadar azalır.
- Kayan protoplast yeni bir 15 ml'lik tüp içine bir kesim, steril 1 ml transfer pipet ile aspire edin. 4 az 2 saat kadar sıralama ya da karanlıkta saklayın ° C sıralama kadar doğrudan geçin.
3. Floresan-Aktif Hücre Ayırma (FACS) Protoplast Sıralama
- Sıralamadan önce, protoplast bütünlüğü ve protoplast havuzu GFP floresan varlığını teyit etmek için bir uyarma için 488 nm lazer kullanarak Konfokal Lazer Tarama Mikroskobu (CLSM) tarafından protoplast inceleyin. Minimal enkaz FACS sıralama memesi tıkanmasını önlemek için gerekli.
- FACS üzerinden TEX tampon (BD FACSVantage SE, BD Biosciences) yaklaşık 9 psi uyarlanmış protokolü 10 aşağıdaki bir sistem basıncı ile 200 mikron memesi kullanarak, 6.000 ve 15.000 arasında olay oranları bir makro sıralama kafasına göre izole protoplast.
- Wild-tip olmayan GFP protoplast otofloresans eşikleri belirlemek için kullanılır.
- GFP pozitif protoplast, GFP floresan 530/30 bir bant kullanarak tanımlamak için bir 488-nm argon hattı kullanarak bir hava soğutmalı argon lazer (Spectra Fizik Model 177, Newport Corporation, Irvine, CA) 100 mW işletilen tür hücreleri toplamak için geçiş filtresi.
- GFP pozitif protoplast toplanmasını takiben, adım 3.1 'de ayrıntılı olarak CLSM göre sıralanmış protoplast inceleyin.
- Qiagen RNeasy Bitki Mini Kit kullanılarak sıralanır protoplast toplam RNA ayıklayın. Affymetrix GeneChip İfade açıklandığı gibi cDNA sonra hibridizasyon için hazırlanmış olabiliression Analizi Teknik Manuel ve sonra AtH1 Arabidopsis Affymetrix tüm genom dizileri melezleşmiştir.
Temsilcisi Sonuçlar
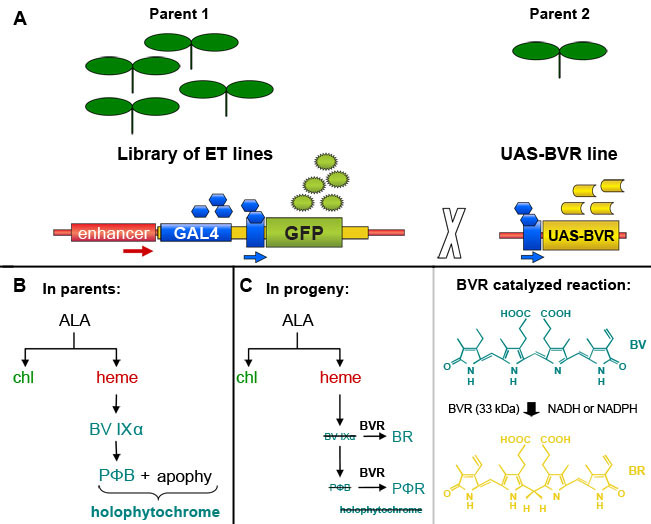
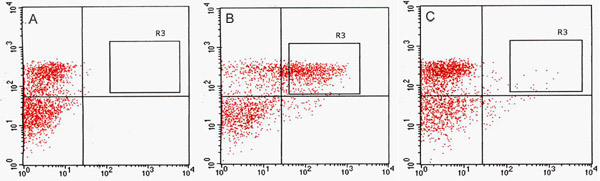
Biz FACS (Şekil 2) GFP kanal GFP pozitif hücrelerin önemli bir numarası algıladı. Vasküler ve dermal ifade ile çizgi, J1071, ~% 1.4, GFP pozitif protoplast sahipken, GFP arttırıcı-trap ebeveynler, yapısal GFP ifade doğrultusunda, J0571 görüntülenir ~% 17 -% 24, GFP pozitif protoplast kullanarak optimizasyon tayinlerde (Tablo 1). 1 saat J0571 protoplast 3 x 500 ul (~ 1.5 ml toplam protoplast süspansiyon) sıralama ~ 100.000 GFP pozitif protoplast verdi. 1,5 saat boyunca J1071 protoplast 3 x 500 ul (~ 1.5 ml toplam protoplast süspansiyon) sıralama ~ 3000 GFP pozitif protoplast verdi. Sıralama (Şekil 3C ve 3E) gerçekleştirildi önce Konfokal görüntüleri hem J0571 ve J1071 örnekleri için çok yüksek bir verim protoplast gösterilir ve sıralaması fraksiyonları tek parlak GFP fluoresan protoplast (Şekil 3G ve veri gösterilmemiştir) yer. Bu bulgu, bu sağlam GFP pozitif protoplast FACS üzerinden düzenlenmiş olabilir onaylar. Olmayan GFP protoplast de sıralanır ve ayrı bir kanal alınabilir. GFP olmayan protoplast holophytochrome düzeylerinin azaltılması üzerinde gen ekspresyonu belirli değişiklikler tespit sonraki mikroarray analizleri için ideal bir negatif kontrol olarak hizmet vermektedir. Izole protoplast (1 ml) fluorospectrometry (Şekil 4) tespiti için yeterli miktarda verim RNA RNA ekstraksiyonu. İzole RNA NanoDrop bir alet kullanarak (NanoDrop 1000, Thermo Scientific) NanoDrop 3.7.1 RNA ölçüm yazılımı tarafından değerlendirilir ve sayısal oldu. RNA verim C24 yabani tip protoplast veya FACS-sıralaması, GFP pozitif arttırıcı tuzak protoplast kullanmak için gerekli olan en az 20 ng aştı önceden sıralanmış RNA etiketleme mikroarray (Tablo 2) testleri.
| Geliştirici Trap Line | % GFP pozitif protoplast | Sıralanmış GFP protoplast sayısı |
| J0571 | 17.18 ~% 24,06% | 26.400 ~ 36.000 |
| J1071 | ~% 1.43 | 1,000 ~ 1,300 |
Tablo 1. sıralama ve Floresan Aktif Hücre Sıralayıcısı (FACSVantage BD) ile 500 mcL protoplast süspansiyon çalışan tarafından toplanan GFP pozitif protoplast sayısı önce iki arttırıcı tuzak hatları GFP pozitif protoplast yüzdesi.
| Bitki Hattı | RNA verimi (ng) |
| C24 WT | 12486,5 |
| J0571 | 60 |
| J1071 | 71,5 |
Tablo 2. protoplast RNA izolasyonu hesaplanmıştır. RNA iki arttırıcı tuzak hatları ön-C24 sıralaması yabani tip ya da sıralanmış GFP pozitif protoplast izole ve sayısal olarak ifade edildi.
Şekil 1 Biliverdin Redüktaz (BVR), transgenik Arabidopsis thaliana bitkilerin ifade GAL4 arttırıcı-trap tabanlı indüksiyon . (A). GAL4 duyarlı bir GFP işaretleyici gen içeren GAL4 tabanlı arttırıcı tuzak hatları, bir kütüphane seçilen bir kişinin hedef genin ifade ikna etmek için bir GAL4 duyarlı hedef geni içeren bir satır GAL4 içeren işaretlenmiş hücreler ile geçilebilir GFP floresan. Dr Jim Haseloff (http://www.plantsci.cam.ac.uk/Haseloff/geneControl/GAL4Frame.html) bir rakam geçerli. (B) üst hatlarında Fitokrom kromofor, phytochromobilin (PΦB) ve holophytochrome üretimi. (C) Sol, biliverdin redüktaz (BVR) BR ve PΦR etkinlik biliverdin IXα (BV IXα) ve PΦB azaltılması, sırasıyla. BVR faaliyet sonuçları PΦB tükenmesi ve holophytochrome fotoaktif üretim azalmasına yol açar. Sağ, BVR tarafından katalizlenen reaksiyon gösterilir.
Şekil 2 Floresan Aktif Hücre Ayırma (FACS) satın alma nokta grafikleri. Protoplast hücre Karşılaştırma C24 vahşi tip (A), J0571 (B) ve J1071 (C) sıralama. (A) 488-nm argon lazer ile heyecanlandım ve otofloresans eşiğini belirlemek için kullanılan non-GFP floresan C24 tipi vahşi protoplast Toplama nokta arsa. (B) ve (C) satın alma nokta araziler, 488 nm lazer uyarma yanıt olumlu GFP protoplast oranlarda göstermektedir. B ve C sınırlarını Floresan-Aktif Hücre Sıralayıcısı göre sıralanır (FACSVantage BD) ve toplanmıştır GFP pozitif hedefler R3 sıralama kapıları. Kırmızı kanalı v gösterirprotoplast ve yeşil kanal klorofil otofloresans alues GFP floresan için değerleri gösterir.

Şekil 3 hücre sıralama için kullanılan bitki protoplast mikroskopisi. Konfokal lazer Floresan-Aktif Hücre Sıralayıcısı (FACS) ile (G) sıralama önce (A, C, E) ve sonra protoplast, taranmış görüntüler. B, D, F ve H DIC görüntüleri. C24 vahşi tip (A, B), J1071 (C, D) ve J0571 (E, F, G, H) protoplast gösterilmiştir. Ve 488 nm lazer ile uyarma elde Otofloresans (LP 650 nm) - Görüntüler C, E ve G GFP floresans (575 nm BP 505 nm) görüntüler birleştirilir. H üzerinden 63x yağ altında 4 taramaları ortalama. Bar = 10 mm.
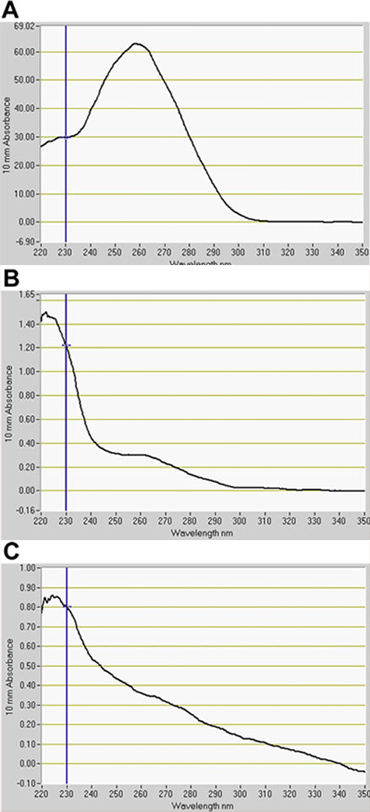
Şekil 4 fluorospectrometry tarafından protoplast izole edilen RNA Niceleme. RNA (A) C24 vahşi tip, (B) J0571, ve (C) J1071 ayıklanır. Öncesi sıralaması vahşi tip protoplast RNA gösterir. B ve C Floresan-Aktif Hücre Ayırma (FACS) göre sıralanır GFP pozitif protoplast RNA göstermektedir. RNA kantitasyonu yazılım, NanoDrop 3.7.1 (NanoDrop 1000, Thermo Scientific).
Tartışmalar
Mikroarray'ler yoluyla gen ekspresyonu (1) Arabidopsis fide genlerinin% 30 daha fazla ışık düzenlenir 11 olduğunu göstermiştir ve (2) Fitokrom sinyalizasyon kaskad 12, 13 yer hafif sinyal iletimi proteinleri kodlayan genlerin büyük bir grup belirlemiştir . Bu tür deneyler ışığın gen ekspresyonu hızlı ve uzun vadeli değişikliklere de neden olduğunu düşündürmektedir. Her havuz phytochromes gelişimsel ve adaptif yanıtlar yalnızca bir alt kümesini kontrol edebilir. Ayr?...
Teşekkürler
Bitkilerde Fitokrom yanıtları Montgomery laboratuarında, Ulusal Bilim Vakfı (hibe BLM hiçbir MCB-0.919.100) ve Kimya Bilimleri, Yerbilimleri ve Biyobilimler Bölümü, Temel Enerjisi Bilimler Bürosu, Fen Dairesi, ABD Dışişleri Bakanlığı tarafından desteklenen Enerji (BLM hibe hiçbir DE FG02 91ER20021). Biz çekimler sırasında Melissa Whitaker teknik yardım için teşekkür ederim ve eleştirel deneysel yardım, gelişmekte olan ve konfokal yardım için Arabidopsis protoplast sıralama ve Dr. Melinda Çerçeve protokoller Sıralama Floresan-Aktif Hücre optimize yardım için Dr Louis King, Stephanie Costigan yazının okuma mikroskopi. Marlene Cameron, grafik tasarım yardım ve editoryal yardım için Karen Kuş için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anti-BVR antibody | QED Bioscience Inc. | 56257-100 | |
| Cellulase “Onozuka” R-10 | SERVA Electrophoresis | MSPC 0930 | |
| Gamborg’s B5 basal salt mixture | Sigma-Aldrich | G5768 | |
| Macerozyme R-10 | SERVA Electrophoresis | PTC 001 | |
| MES, low moisture content | Sigma-Aldrich | M3671 | |
| Murashige and Skoog salts | Caisson Laboratories | 74904 | |
| Phytablend | Caisson Laboratories | 28302 | |
| RNeasy Plant Minikit | Qiagen | 16419 |
Referanslar
- Franklin, K. A., Quail, P. H. Phytochrome functions in Arabidopsis development. J. Exp. Bot. 61, 11-24 (2010).
- Montgomery, B. L. Right place, right time: Spatiotemporal light regulation of plant growth and development. Plant Signal Behav. 3, 1053-1060 (2008).
- Laplaze, L. GAL4-GFP enhancer trap lines for genetic manipulation of lateral root development in Arabidopsis thaliana. J. Exp. Bot. 56, 2433-2442 (2005).
- Costigan, S., Warnasooriya, S. N., Montgomery, B. L. Root-localized phytochrome chromophore synthesis is required for tissue-specific photoregulation of root elongation and impacts sensitivity to jasmonic acid in Arabidopsis thaliana. , .
- Lagarias, D. M., Crepeau, M. W., Maines, M. D., Lagarias, J. C. Regulation of photomorphogenesis by expression of mammalian biliverdin reductase in transgenic Arabidopsis plants. Plant Cell. , 675-688 (1997).
- Montgomery, B. L., Yeh, K. C., Crepeau, M. W., Lagarias, J. C. Modification of distinct aspects of photomorphogenesis via targeted expression of mammalian biliverdin reductase in transgenic Arabidopsis plants. Plant Physiol. 121, 629-639 (1999).
- Warnasooriya, S. N., Montgomery, B. L. Detection of spatial-specific phytochrome responses using targeted expression of biliverdin reductase in Arabidopsis. Plant Physiol. 149, 424-433 (2009).
- Warnasooriya, S. N., Porter, K. J., Montgomery, B. L. Light-dependent anthocyanin accumulation and phytochromes in Arabidopsis thaliana. , .
- Denecke, J., Vitale, A. The use of protoplasts to study protein synthesis and transport by the plant endomembrane system. Methods Cell Biol. 50, 335-348 (1995).
- Birnbaum, K. Cell type-specific expression profiling in plants via cell sorting of protoplasts from fluorescent reporter lines. Nat. Methods. 2, 615-619 (2005).
- Ma, L. Light control of Arabidopsis development entails coordinated regulation of genome expression and cellular pathways. Plant Cell. 13, 2589-2607 (2001).
- Chen, M., Chory, J., Fankhauser, C. Light signal transduction in higher plants. Annu. Rev. Genet. 38, 87-117 (2004).
- Ulm, R., &, N. a. g. y., F, . Signalling and gene regulation in response to ultraviolet light. Curr. Opin. Plant Biol. 8, 477-482 (2005).
- Ma, L. Organ-specific expression of Arabidopsis genome during development. Plant Physiol. 138, 80-91 (2005).
- Neff, M. M., Fankhauser, C., &, C. h. o. r. y., J, . Light: an indicator of time and place. Genes Dev. 14, 257-271 (2000).
- Birnbaum, K. A gene expression map of the Arabidopsis root. Science. 302, 1956-1960 (2003).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır