Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Исследование тканей и органов конкретных Фитохром ответы с помощью FACS-помощь камерного типа Конкретные профилирования выражения в Arabidopsis thaliana
Резюме
Молекулярные основы пространственно-конкретных ответов фитохрома в настоящее время исследованы с помощью трансгенных растений, которые обладают тканей и органов конкретных фитохрома недостатков. Выделение специфических клеток выставке индуцированных фитохрома истощения хромофора по флуоресценции, активированных сортировки клеток следуют анализ микрочипов в настоящее время используется для идентификации генов, вовлеченных в пространственно-конкретных ответных фитохрома.
Аннотация
протокол
1. Роста растений
- Подтвержденные UAS-BVR X GAL4-GFP усилитель ловушку линии выделяли, как описано 4 (для резюме см. рис. 1) и дикого типа или родительских линий и посеянное на почве, т.е. ~ 2000 стерилизованных семян на линии.
- Растения выращиваются в течение 5 недель на почве под белой подсветкой из 100 μmolm -2 с -1 при 22 ° С и влажности 70%.
2. Лист протопластов Изоляция (адаптировано из Денеке и Витале 9)
- Для выделения протопластов, подготовить TEX буфера. За 1 буфера литр TEX, отвешивать следующие компоненты: 3,1 г Gamborg в B5 соли, 0,5 г 2 - (N-морфолино) этансульфоновая кислоты (MES, 2,56 ммоль), 0,75 г дигидрата хлорида кальция (CaCl 2 · 2H 2 O, 6,75 мМ), 0,25 г нитрата аммония (NH 4 NO 3, 3,12 мМ), 136,9 г сахарозы (0,4 М). Растворите компоненты полностью в ~ 900 мл деионизированной, дистиллированной воды (DDH 2 O) и довести рН до 5,7 с 1 М КОН. Принесите конечного объема до 1 литра и фильтр стерилизуют при 0,2 мкм бутылку-топ фильтр связан с вакуумным насосом.
- Сбор зеленый, здоровые листья из растений (~ 250 мл листьев свободно упакованных в стакане) и промойте ~ 40 мл DDH 2 O 4 раза, с последующей промывкой в два раза стерильной DDH 2 O. Использование № 20 скальпеля, нарезать листья на тонкие полоски ткани и разделить поровну на две 50 мл стерильные пробирки, пластик. Приготовьте 1х лист пищеварения смесь, добавив 5 мл аликвоту 10x лист пищеварения маточного раствора (10x лист пищеварения маточного раствора: растворить 2% вес / Macerozyme R-10, 4% вес / Целлюлаза "Onozuka" R-10 в TEX буфера, фильтр стерилизуют при 0,2 мкм и заморозить 5 мл аликвоты при -80 ° C) до 45 мл свежего буфера TEX. Добавить ~ 25 мл 1x лист пищеварения смесь на 50 мл трубку, чтобы охватить все ткани листа.
- Вакуумные проникнуть в ткани листа пищеварения смесь в открытой трубы в течение 1 часа при комнатной температуре, используя вакуум-эксикаторе связано с водяным насосом, затем 3-часовой инкубации при комнатной температуре на рокер с осторожном встряхивании. Capped труб с ткани листа в 1x смесь пищеварения листа хранятся завернутые в алюминиевую фольгу в ходе этого процесса, чтобы предотвратить воздействие света.
- Через 3 часа, увеличение рокер скорость ~ 2 минуты, чтобы освободить протопластов. Фильтры сырой подвески протопласт через два слоя стерильной тканью сыра для удаления мусора и сбор фильтрата в стерильном стакане стекла. Фильтры фильтрата через стерильный 100-мкм нейлоновая сетка в стерильную чашку Петри. Сбор течь через и перенести его на новые стерильные 50 мл трубки. Используйте около 15-20 мл свежего буфера TEX мыть стерильную чашку Петри и собирать протопластов присоединения к поверхности.
- Центрифуга потока за счет использования ротора качели ведро на 100xg при 10 ° С в течение 15 мин (ускорение 6, замедление 0).
- Удалить ~ 25 - 30 мл жидкости ниже плавающий слой протопласта, который содержит остаточные и гранулированного мусора, стерильным 9 "стеклянной пипетки Пастера подключен к перистальтического насоса, не нарушая плавающий слой протопластов и оставив ~ 10 - 15 мл.
- Добавьте свежие буфера TEX до конечного объема 40 мл, мягко ресуспендированием протопластов.
- Повторите шаги с 2,5 до 2,7 раза, чтобы удалить как можно больше продуктов распада клеток, как это возможно. Центрифугирования время сокращается до 10 минут в течение первого повторения и до 5 минут в финале повторения.
- Аспирируйте плавающей протопластов с разрезом, стерильный 1 мл передачи пипетки в новый 15 мл трубки. Перейдем непосредственно к сортировке и хранить в темноте в течение до 2 часов при температуре 4 ° С до сортировки.
3. Протопластов Сортировка по флуоресценции, активированных сортировки клеток (FACS)
- Перед сортировкой, изучить протопластов с помощью конфокальной микроскопии лазерного сканирования (CLSM) с использованием 488-нм лазером для возбуждения для подтверждения целостности протопласта и наличие флуоресценции GFP протопластов бассейн. Минимальная мусора необходимо, чтобы избежать засорения сопла FACS сортировки.
- Сортировать изолированных протопластов в TEX буфера с помощью FACS (BD FACSVantage SE, BD Biosciences) с использованием 200-мкм сопла на макро-глава рода на случай ставок между 6000 и 15000, с системой давление около 9 фунтов на квадратный дюйм следующий адаптированный протокол 10.
- Дикого типа не-GFP протопластов используются для определения аутофлюоресценция порогов.
- Для сбора GFP-положительных протопластов, сортировка клеток с использованием воздушного охлаждения аргоновый лазер (Spectra Physics модели 177, Newport Corporation, Irvine, CA) работает при 100 мВт на 488-нм линий аргона для выявления флуоресценции с помощью GFP 530/30 группы фильтр.
- После сбора GFP-положительных протопластов, изучить отсортированы по CLSM протопластов, как описано в пункте 3.1.
- Извлечение общей РНК из отсортированных протопластов использованием завод Qiagen RNeasy Mini Kit. кДНК могут быть подготовлены для гибридизации, как описано в Affymetrix GeneChip Expression Анализ Техническое руководство и гибридизации с AtH1 Arabidopsis Affymetrix целом массивы генома.
Представитель Результаты
Мы обнаружили значительное количество GFP-положительных клеток в канале GFP по FACS (рис. 2). В анализах оптимизации использования GFP усилитель-ловушки родителей, конститутивно GFP-экспрессирующих линии, J0571, отображается ~ 17% до 24% GFP-положительных протопластов, тогда как линия с сосудистыми и кожными выражения, J1071, был ~ 1,4% GFP-положительных протопластов (табл. 1). Сортировка 3 х 500 мкл (~ 1,5 мл в общей сложности протопластов приостановка) J0571 протопластов в течение 1 ч дали ~ 100000 GFP-положительных протопластов. Сортировка 3 х 500 мкл (~ 1,5 мл полную остановку протопластов) из J1071 протопластов в течение 1,5 ч дали ~ 3000 GFP-положительных протопластов. Конфокальной изображений указано очень высокий выход протопластов как для J0571 и J1071 образцов до сортировка была проведена (рис. 3C и 3E), и отсортированных фракций, содержащихся только яркие GFP-люминесцентные протопластов (рис. 3G и данные не приведены). Это открытие подтверждает, что нетронутые GFP-положительных протопласты могут быть отсортированы по СУИМ. Не-GFP протопластов также можно сортировать и собраны в отдельный канал. Не-GFP протопластов служить идеальным отрицательного контроля для последующего анализа микрочипов для выявления конкретных изменений в экспрессии генов при восстановлении holophytochrome уровнях. РНК извлечения из изолированных протопластов (1 мл) дает РНК в достаточном количестве для обнаружения fluorospectrometry (рис. 4). Изолированные РНК оценивали с помощью NanoDrop инструмента (NanoDrop 1000, Thermo Scientific) и количественно NanoDrop 3.7.1 программного обеспечения количественной РНК. РНК урожайности предварительно отсортированные C24 дикого типа протопластов или FACS-сортируются, GFP-положительных протопластов усилитель ловушку превысил менее 20 нг необходимые для использования в РНК-маркировки анализов для микрочипов (табл. 2).
| Enhancer Ловушка линии | % От GFP-положительных протопластов | Количество отсортированных протопластов GFP |
| J0571 | 17,18% ~ 24,06% | 26400 ~ 36000 |
| J1071 | ~ 1,43% | 1000 ~ 1300 |
Таблица 1. Процент GFP-положительных протопластов из двух усилитель ловушку линии до сортировки и количество GFP-положительных протопластов собранные работает 500 мкл суспензии через протопласт флуоресценции Активированный сотовый Сортировщик (FACSVantage, BD).
| Завод линии | РНК-выход (нг) |
| C24 WT | 12486,5 |
| J0571 | 60 |
| J1071 | 71,5 |
Таблица 2. Выход из РНК изоляции от протопластов. РНК выделяли из предварительно отсортированные C24 дикого типа или отсортировать GFP-положительных протопластов из двух линий усилитель ловушку и количественно.
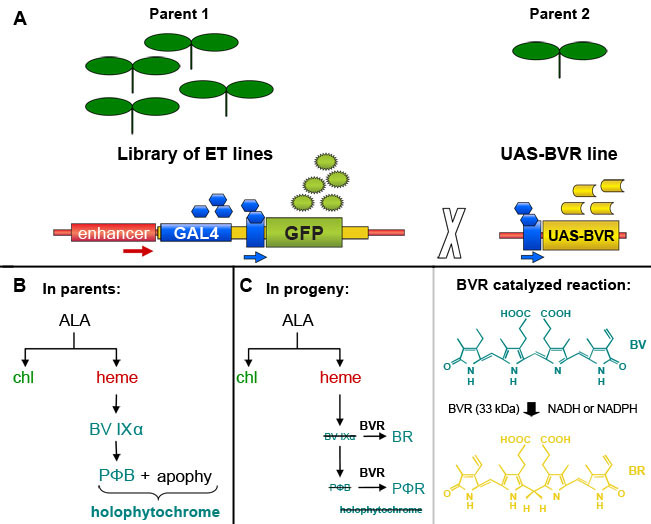
Рисунок 1. GAL4 усилитель-ловушки основе индукции биливердин редуктазы (BVR) экспрессии в трансгенных растений Arabidopsis thaliana. (А). Человек, выбранный из библиотеки GAL4 основе усилитель ловушку линий, которые содержат GAL4 проблематику маркерный ген GFP, могут пересекаться со строки, содержащей GAL4 проблематику гена-мишени, чтобы вызвать экспрессию гена-мишени в GAL4 содержащей ячейки, помеченные GFP по флуоресценции. На основе рисунка из д-р Джим Haseloff (http://www.plantsci.cam.ac.uk/Haseloff/geneControl/GAL4Frame.html). (B) производство фитохрома хромофора, phytochromobilin (PΦB) и holophytochrome в родительских линий. (С) Влево, сокращение биливердин IXα (BV IXα) и PΦB по биливердин редуктазы (BVR) деятельности БР и PΦR, соответственно. BVR активности приводит к истощению PΦB и приводит к сокращению производства фотоактивных holophytochrome. Правильно, реакции, катализируемой BVR показано.
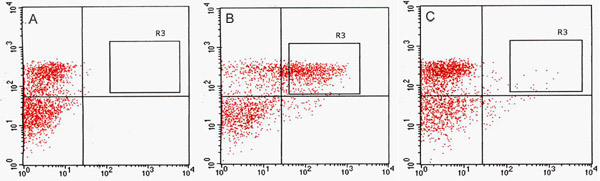
Рисунок 2. Флуоресценция Активированный сортировки клеток (FACS) приобретение участков точка. Сравнение протопластов сортировки клеток для C24 дикого типа (А), J0571 (Б) и J1071 (С). () Приобретение точкой сюжета не-GFP флуоресцентные C24 дикого типа протопластов возбуждаются 488-нм аргонового лазера и используется для определения аутофлюоресценция порога. (B) и (С) участков приобретение точка показать пропорции протопластов, которые являются положительными GFP в ответ на возбуждение 488-нм лазером. R3 сортировки ворота в В и С разграничить GFP-положительных целей, которые были отсортированы по флуоресценции, активированных сотовый Сортировщик (FACSVantage, BD) и собраны. Красный канал указывает гalues для хлорофилла аутофлюоресценция из протопластов и зеленый канал указывает значения для GFP флуоресценции.

Рисунок 3. Конфокальной микроскопии протопластов растений используется для сортировки клеток. Конфокальной лазерной отсканированных изображений протопластов до (А, С, Е) и после (G), сортировка по флуоресценции, активированных сотовый Сортировщик (СУИМ). B, D, F и Н DIC изображений. Протопластов C24 дикого типа (А, В), J1071 (C, D) и J0571 (E, F, G, H) показаны. Изображения С, Е и G были объединены образы GFP флуоресценции (ВР 505 нм - 575 нм) и флуоресценции (LP 650 нм), полученных из возбуждение с 488-нм лазером. Через Н среднем на 4 сканирует под 63x нефти. Bar = 10 мкм.
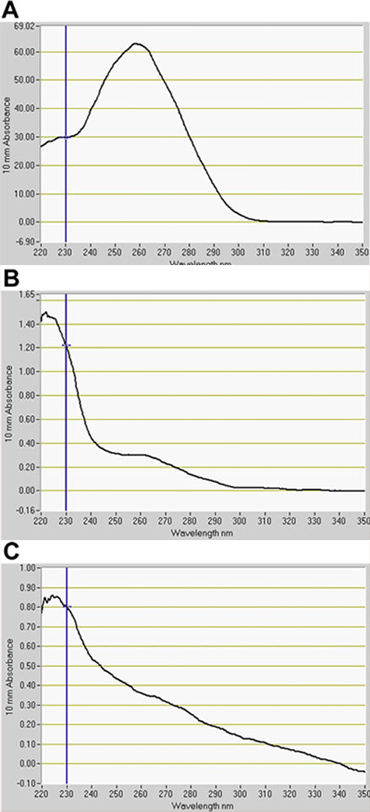
Рисунок 4. Количественная оценка РНК, выделенной из протопластов по fluorospectrometry. РНК, выделенная из (А) C24 дикого типа, (B), J0571, и (C) J1071. Указывает РНК для предварительно отсортированных дикого типа протопластов. B и C указывают на РНК из GFP-положительных протопластов, упорядоченные по флуоресценции, активированных сортировки клеток (FACS). РНК количественного программного обеспечения, NanoDrop 3.7.1, (NanoDrop 1000, Thermo Scientific).
Обсуждение
Экспрессия генов профилирования через микрочипы (1) показал, что более 30% генов Arabidopsis сеянцы света регулируется 11 и (2) выявила обширная группа генов, кодирующих светового сигнала трансдукции белков, участвующих в фитохрома сигнальный каскад 12, 13 . Такие эксперименты позволя?...
Благодарности
Работа в Монтгомери лаборатории на фитохрома ответы в растениях при поддержке Национального научного фонда (грант №. MCB-0919100 с БЛМ) и химических наук, наук о Земле и биологических наук отдела Управления основной энергии наук, Управление по науке департамента США Энергия (грант №. DE FG02 91ER20021 для BLM). Мы благодарим Мелисса Уитакер за техническую помощь во время съемок и критически чтения рукописи, Стефани Костиган для экспериментальных помощи, доктор Louis King за помощь в разработке и оптимизации флуоресценции, активированных сортировки клеток Arabidopsis протоколов для сортировки протопластов и д-р Мелинда Рамка для помощи конфокальной микроскопии. Мы благодарим Марлен Камерон для графического дизайна и помощь Карен птиц за помощь в редактировании.
Материалы
| Name | Company | Catalog Number | Comments |
| Anti-BVR antibody | QED Bioscience Inc. | 56257-100 | |
| Cellulase “Onozuka” R-10 | SERVA Electrophoresis | MSPC 0930 | |
| Gamborg’s B5 basal salt mixture | Sigma-Aldrich | G5768 | |
| Macerozyme R-10 | SERVA Electrophoresis | PTC 001 | |
| MES, low moisture content | Sigma-Aldrich | M3671 | |
| Murashige and Skoog salts | Caisson Laboratories | 74904 | |
| Phytablend | Caisson Laboratories | 28302 | |
| RNeasy Plant Minikit | Qiagen | 16419 |
Ссылки
- Franklin, K. A., Quail, P. H. Phytochrome functions in Arabidopsis development. J. Exp. Bot. 61, 11-24 (2010).
- Montgomery, B. L. Right place, right time: Spatiotemporal light regulation of plant growth and development. Plant Signal Behav. 3, 1053-1060 (2008).
- Laplaze, L. GAL4-GFP enhancer trap lines for genetic manipulation of lateral root development in Arabidopsis thaliana. J. Exp. Bot. 56, 2433-2442 (2005).
- Costigan, S., Warnasooriya, S. N., Montgomery, B. L. Root-localized phytochrome chromophore synthesis is required for tissue-specific photoregulation of root elongation and impacts sensitivity to jasmonic acid in Arabidopsis thaliana. , .
- Lagarias, D. M., Crepeau, M. W., Maines, M. D., Lagarias, J. C. Regulation of photomorphogenesis by expression of mammalian biliverdin reductase in transgenic Arabidopsis plants. Plant Cell. , 675-688 (1997).
- Montgomery, B. L., Yeh, K. C., Crepeau, M. W., Lagarias, J. C. Modification of distinct aspects of photomorphogenesis via targeted expression of mammalian biliverdin reductase in transgenic Arabidopsis plants. Plant Physiol. 121, 629-639 (1999).
- Warnasooriya, S. N., Montgomery, B. L. Detection of spatial-specific phytochrome responses using targeted expression of biliverdin reductase in Arabidopsis. Plant Physiol. 149, 424-433 (2009).
- Warnasooriya, S. N., Porter, K. J., Montgomery, B. L. Light-dependent anthocyanin accumulation and phytochromes in Arabidopsis thaliana. , .
- Denecke, J., Vitale, A. The use of protoplasts to study protein synthesis and transport by the plant endomembrane system. Methods Cell Biol. 50, 335-348 (1995).
- Birnbaum, K. Cell type-specific expression profiling in plants via cell sorting of protoplasts from fluorescent reporter lines. Nat. Methods. 2, 615-619 (2005).
- Ma, L. Light control of Arabidopsis development entails coordinated regulation of genome expression and cellular pathways. Plant Cell. 13, 2589-2607 (2001).
- Chen, M., Chory, J., Fankhauser, C. Light signal transduction in higher plants. Annu. Rev. Genet. 38, 87-117 (2004).
- Ulm, R., &, N. a. g. y., F, . Signalling and gene regulation in response to ultraviolet light. Curr. Opin. Plant Biol. 8, 477-482 (2005).
- Ma, L. Organ-specific expression of Arabidopsis genome during development. Plant Physiol. 138, 80-91 (2005).
- Neff, M. M., Fankhauser, C., &, C. h. o. r. y., J, . Light: an indicator of time and place. Genes Dev. 14, 257-271 (2000).
- Birnbaum, K. A gene expression map of the Arabidopsis root. Science. 302, 1956-1960 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены