このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
原子間力顕微鏡カンチレバーを用いたナノインデンテーション:空気および流体中のナノスケールでの機械的特性測定
要約
原子間力顕微鏡(AFM)プローブチップが試料表面に与える接触面積と力を定量化することで、ナノスケールの機械的特性測定が可能になります。弾性率やその他のナノ機械的特性を測定するために、柔らかいサンプルと硬いサンプルの空気または流体にAFMカンチレバーベースのナノインデンテーションを実装するためのベストプラクティスについて説明します。
要約
原子間力顕微鏡(AFM)は、ナノスケールのAFMプローブ先端とサンプル表面との相互作用を根本的に測定します。プローブ先端によって加えられる力とそのサンプルとの接触面積を定量化できれば、プローブされる表面のナノスケールの機械的特性(弾性率やヤング率など)を決定することができます。ここでは、定量的AFMカンチレバーベースのナノインデンテーション実験を実行するための詳細な手順を、kPaからGPaまでのさまざまなサンプルタイプの弾性率を決定するためにこの手法を適用する方法の代表的な例とともに提供します。これらには、生きた間葉系幹細胞(MSC)と生理学的バッファー中の核、樹脂が埋め込まれた脱水ロブロリーパイン断面、およびさまざまな組成のバッケン頁岩が含まれます。
さらに、AFMカンチレバーベースのナノインデンテーションを使用して、リン脂質二重層の破断強度(すなわち、突破力)を調査します。メソッドの選択と開発、プローブの選択とキャリブレーション、関心領域の識別、サンプルの不均一性、フィーチャーサイズとアスペクト比、チップの摩耗、表面粗さ、データ分析と測定統計などの重要な実用的な考慮事項について説明し、テクニックの適切な実装を支援します。最後に、AFM由来のナノメカニカルマップと、元素組成に関する追加情報を提供する電子顕微鏡技術との共局在化が実証されます。
概要
材料の機械的特性を理解することは、工学における最も基本的で不可欠なタスクの1つです。バルク材料特性の解析には、引張試験1、圧縮試験2、3点または4点曲げ(曲げ)試験3など、材料システムの機械的特性を特徴付けるために利用できる多数の方法があります。これらのマイクロスケール試験は、バルク材料特性に関する貴重な情報を提供できますが、一般的に故障するために実施されるため、破壊的です。さらに、薄膜、生体材料、ナノコンポジットなど、今日注目されている多くの材料システムのマイクロおよびナノスケールの特性を正確に調査するために必要な空間分解能が不足しています。大規模な機械的試験、主にその破壊的な性質のいくつかの問題に対処し始めるために、鉱物学から微小硬度試験が採用されました。硬度は、特定の条件下での塑性変形に対する材料の耐性の尺度です。一般に、微小硬さ試験では、通常は硬化鋼またはダイヤモンドで作られた硬いプローブを使用して、材料にインデントします。結果として生じるくぼみの深さおよび/または面積を使用して、硬度を決定することができます。ビッカース4、ヌープ5、ブリネル6 硬度など、いくつかの方法が開発されています。それぞれがマイクロスケールの材料硬度の尺度を提供しますが、異なる条件と定義の下で、そのため、同じ条件下で実行されたテストと比較できるデータのみを生成します。
計装ナノインデンテーションは、さまざまな微小硬度試験方法で得られた相対値を改善し、機械的特性の分析に可能な空間分解能を向上させ、薄膜の分析を可能にするために開発されました。重要なことに、OliverとPharr7によって最初に開発された方法を利用することにより、サンプル材料の弾性率またはヤング率Eを計装されたナノインデンテーションを介して決定できます。さらに、Berkovich 3面ピラミッド型ナノインデンタープローブ(理想的な先端面積関数がビッカース4面ピラミッド型プローブと一致する)8を採用することで、ナノスケールと従来のマイクロスケール硬度測定を直接比較することができます。AFMの人気が高まるにつれ、AFMカンチレバーベースのナノインデンテーションも、特に柔らかい材料の機械的特性を測定するために注目され始めました。その結果、図1に模式的に示されているように、ナノスケールの機械的特性を調査および定量化するために今日最も一般的に採用されている2つの技術は、計装化されたナノインデンテーション(図1A)とAFMカンチレバーベースのナノインデンテーション(図1B)9であり、後者はこの研究の焦点です。
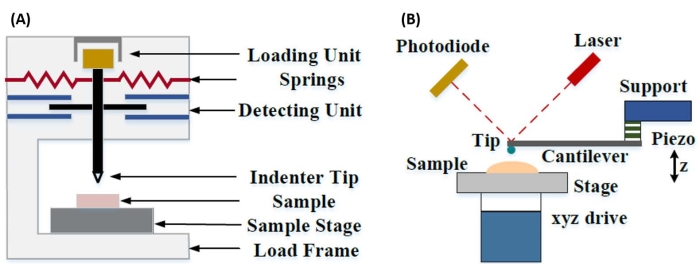
図1:計装システムとAFMカンチレバーベースのナノインデンテーションシステムの比較。 (A)計装ナノインデンテーションおよび(B)AFMカンチレバーベースのナノインデンテーションを実施するための典型的なシステムを示す概略図。この図はQianら51から修正された。略称:AFM =原子間力顕微鏡。 この図の拡大版を表示するには、ここをクリックしてください。
計装およびAFMカンチレバーベースのナノインデンテーションはどちらも、剛性プローブを使用して目的のサンプル表面を変形させ、時間の関数として合力と変位を監視します。通常、所望の荷重(すなわち、力)または(Zピエゾ)変位プロファイルのいずれかがソフトウェアインターフェース を介して ユーザーによって指定され、機器によって直接制御され、他のパラメータが測定される。ナノインデンテーション実験から最も頻繁に得られる機械的特性は、圧力の単位を有するヤング率とも呼ばれる弾性率(E)である。材料の弾性率は、接着剛性に関する基本的な特性であり、塑性変形が始まる前の弾性(可逆的または一時的な)変形中の軸ひずみ(ε、くぼみ軸に沿った比例変形)に対する引張応力または圧縮応力(σ、単位面積あたりの適用力)の比率として定義されます(式[1])。
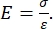 (1)
(1)
多くの材料(特に生体組織)は実際には粘弾性であるため、実際には、(動的または複雑な)弾性率は弾性(貯蔵、位相内)と粘性(損失、位相外)成分の両方からなることに注意する必要があります。実際には、ナノインデンテーション実験で測定されるのは、式(2)に示すように、対象の真のサンプル弾性率Eに関連する還元弾性率E*です。
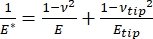 (2)
(2)
ここで、Eチップとνチップはそれぞれナノインデンターチップの弾性率とポアソン比であり、νはサンプルの推定ポアソン比です。ポアソン比は、横ひずみと軸ひずみの負の比であるため、式(3)に示すように、軸ひずみを受けたとき(ナノインデンテーション荷重時など)のサンプルの横方向の伸びの程度を示します。
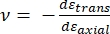 (3)
(3)
a)圧子先端によって与えられる軸ひずみの一部が横ひずみに変換される可能性がある(すなわち、試料が荷重方向に垂直な膨張または収縮によって変形する可能性がある)、およびb)圧子先端が無限に硬くないため、したがって、試料をインデントする行為は、先端のいくらかの(小さな)変形をもたらすので、減少弾性率から実際の弾性率への変換が必要である。EチップがE>>場合(つまり、圧子チップがサンプルよりもはるかに硬い場合、ダイヤモンドプローブを使用する場合によく当てはまります)、減少したサンプル弾性率と実際のサンプル弾性率の関係は、E≈E*(1-v2)に大きく単純化されます。インストルメンテーションされたナノインデンテーションは、正確な力の特性評価とダイナミックレンジの点で優れていますが、AFMカンチレバーベースのナノインデンテーションは高速で、桁違いに大きな力と変位の感度を提供し、より高い解像度のイメージングと改善されたインデンテーションの位置特定を可能にし、ナノスケールの磁気特性と電気的特性を同時にプローブできます9.特に、AFMカンチレバーベースのナノインデンテーションは、柔らかい材料(ポリマー、ゲル、脂質二重層、細胞または他の生物学的材料など)、非常に薄い(サブμm)フィルム(くぼみの深さに応じて基質効果が作用する)10,11、およびグラフェンなどの懸濁された2次元(2D)材料12,13,14のナノスケールでの機械的特性の定量化に優れています15,16、雲母17、六方晶窒化ホウ素(h-BN)18、または遷移金属ダイカルコゲナイド(TMDC;例えば、MoS2)19。これは、その絶妙な力(sub-nN)と変位(sub-nm)感度によるものであり、初期接触点を正確に決定し、弾性変形領域内に留まるために重要です。
AFMカンチレバーベースのナノインデンテーションでは、AFMプローブの試料表面への変位は、較正された圧電素子(図1B)によって作動し、フレキシブルカンチレバーは、試料表面との接触時に受ける抵抗力により最終的に曲がります。カンチレバーのこの曲がりまたはたわみは、通常、カンチレバーの背面から光検出器(位置検出器[PSD])にレーザーを反射することによって監視されます。片持ち梁の剛性(nN/nm)とたわみ感度(nm/V)の知識と組み合わせることで、この測定された片持ち梁のたわみ(V)をサンプルに加えられた力(nN)に変換することができます。接触後、Zピエゾの動きとカンチレバーのたわみの差により、サンプルのくぼみの深さが得られます。チップ面積関数の知識と組み合わせることで、チップとサンプルの接触面積の計算が可能になります。次に、結果として得られる力-距離または力-変位(F-D)曲線の接触部分の傾きを、適切な接触力学モデル(説明の 「データ分析 」セクションを参照)を使用して適合し、サンプルのナノ機械的特性を決定できます。AFMカンチレバーベースのナノインデンテーションは、上記のように計装されたナノインデンテーションに比べていくつかの明確な利点がありますが、ここで説明するキャリブレーション、チップ摩耗、データ分析など、いくつかの実用的な実装上の課題も提示します。AFMカンチレバーベースのナノインデンテーションのもう1つの潜在的な欠点は、接触半径とくぼみ深さが圧子半径よりもはるかに小さくする必要があるため、線形弾性の仮定であり、ナノスケールのAFMプローブや大きな表面粗さを示すサンプルで作業する場合、これを達成するのは難しい場合があります。
従来、ナノインデンテーションは、個々の場所または小さなグリッドインデンテーション実験に限定されており、所望の位置(すなわち、関心領域[ROI])が選択され、単一の制御されたインデント、いくつかの待ち時間で区切られた単一のロケーション内の複数のインデント、および/またはインデントの粗いグリッドがHzのオーダーの速度で実行される。しかし、近年のAFMの進歩により、荷重制御下でkHzの速度で力曲線を伝導し、最大先端サンプル力をイメージング設定値として利用する高速力曲線ベースのイメージングモード(システムメーカーによってさまざまな商品名で呼ばれる)を利用して、機械的特性とトポグラフィーを同時に取得できるようになりました。ポイントアンドシュート法も開発されており、AFMトポグラフィ画像を取得した後、画像内の関心のあるポイントで選択的なナノインデンテーションを可能にし、ナノインデンテーション位置のナノスケール空間制御を可能にします。この研究の主な焦点ではありませんが、力曲線ベースのイメージングとポイントアンドシュートカンチレバーベースのナノインデンテーションの両方の特定の 選択されたアプリケーション例 が代表的な結果に提示されており、採用されている特定のAFMプラットフォームで利用可能な場合は、以下に概説するプロトコルと組み合わせて使用できます。具体的には、この作業では、AFMカンチレバーベースのナノインデンテーションを任意の可能なAFMシステムに実際に実装するための一般化されたプロトコルの概要を説明し、代表的な結果とニュアンス、課題、および技術を成功させるための重要な考慮事項の詳細な議論を含む、技術の4つのユースケース例(空気中2つ、流体中2つ)を提供します。
プロトコル
注:市販のAFMは多種多様であり、カンチレバーベースのナノインデンテーションにはサンプルタイプと用途が多様であるため、以下のプロトコルは、機器やメーカーに関係なく、すべてのカンチレバーベースのナノインデンテーション実験に必要な共有ステップに焦点を当てて、本質的に比較的一般的になるように意図的に設計されています。このため、著者らは、読者がカンチレバーベースのナノインデンテーションを実行するために選択された特定の機器の操作に少なくとも基本的な知識を持っていると想定しています。ただし、以下に概説する一般的なプロトコルに加えて、流体中のサンプルのカンチレバーベースのナノインデンテーションに焦点を当てた、ここで使用するAFMとソフトウェアに固有の詳細なステップバイステップの標準操作手順(SOP)( 材料表を参照)が 補足資料として含まれています。
1. サンプル調製と装置のセットアップ
- 表面粗さ(理想的にはナノメートルスケール、意図したくぼみ深さの~10倍小さい)と汚染の両方を最小限に抑える方法で、目的の領域の機械的特性を変更することなくサンプルを準備します。
- 媒体(空気または流体など)、予想される弾性率、サンプルのトポグラフィー、および関連する特徴サイズに基づいて、目的のサンプルのナノインデンテーションに適したAFMプローブを選択します(説明の プローブ選択の考慮事項 を参照)。プローブをプローブホルダーにロードし( 材料表を参照)、プローブホルダーをAFMスキャンヘッドに取り付けます。
- AFMソフトウェアで適切なナノインデンテーションモードを選択して、個々のランプ(力-変位曲線など)をユーザーが制御できるようにします。
注:特定のモードは、AFMメーカーや個々の機器によって異なります(詳細と具体的な例については、 補足資料 に記載されているSOPを参照してください)。 - レーザーをプローブカンチレバーの背面、プローブ先端の位置の反対側、PSDに合わせます。
注:レーザーを整列させ、流体中でナノインデンテーションを行う際の重要な考慮事項、特にビームを散乱または屈折させる可能性のある浮遊破片や気泡を回避する際の重要な考慮事項の詳細については、間葉系幹細胞 のアプリケーション例 を参照してください。AFM光学系は、流体の屈折率を補正し、表面と噛み合うときにプローブがクラッシュしないように調整する必要がある場合もあります。- 合計電圧を最大化することにより、カンチレバーの背面にレーザービームスポットを中央に配置します(図2A)。
- XとY(つまり、水平および垂直)の偏向信号を可能な限りゼロに近づけるように調整することにより、反射されたレーザービームスポットをPSDの中央に配置し(図2A)、カンチレバーのたわみに比例した出力電圧を生成するための検出可能な最大偏向範囲を提供します。
- サンプルのトポグラフィー、表面粗さ、および/または表面密度(フレークまたは粒子の場合)が不明な場合は、ステップ1.1およびディスカッションのサンプル調製部分で説明されているように、ナノインデンテーション実験の前にAFMトポグラフィー調査スキャンを実行してサンプルの適合性を確認します。
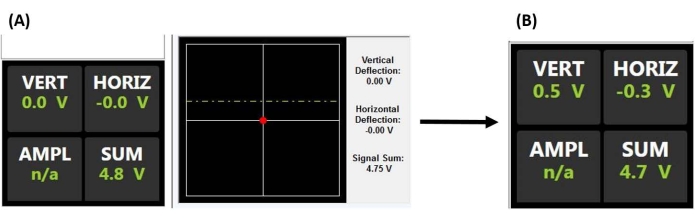
図2:位置感知検出器モニター。 (A)サンプル表面にかみ合う(つまり、プローブがサンプルと接触していない)前に、プローブカンチレバーの背面からPSDの中心に反射する適切に位置合わせされたレーザーを示すPSDディスプレイ(大きな合計電圧と垂直または水平のたわみの欠如によって証明されます)。(B)カンチレバーが偏向すると(プローブがサンプルと接触したときなど)、垂直たわみ電圧が増加します。略語:PSD =位置感知検出器;VERT = 垂直;ホリッツ=水平。アンプル=振幅;N/A = 該当なし。 この図の拡大版を表示するには、ここをクリックしてください。
2. プローブのキャリブレーション
注:カンチレバーベースのナノインデンテーション中に収集されたF-D曲線データを使用してサンプルの機械的特性を定量化するには、カンチレバー/ PSDシステムのたわみ感度(DS) (nm/VまたはV/nm)、 カンチレバースプリング定数 (nN / nm)、および プローブ接触面積の3つの値が必要です(球形プローブの場合、プローブ半径よりも小さい所定のくぼみ深さでの有効プローブ先端半径(nm)で表されることがよくあります先端。
- 非常に硬い材料(サファイア、 E = 345 GPaなど)をランプで覆ってプローブ/AFMシステムのDSを校正し、サンプルの変形を最小限に抑え、チップとサンプルの接触開始後のピエゾの測定されたZ運動がカンチレバーたわみのみに変換されるようにします。
注:DSキャリブレーションは、実験中のシステムのDSを正確に反映するために、計画されたナノインデンテーション実験と同じ条件(つまり、温度、媒体など)で実行する必要があります。熱平衡に達し、安定したレーザー出力パワーとポインティング安定性を確立するために、最大の精度を得るには、長い(30分)レーザーウォームアップ期間が必要になる場合があります。DSは、レーザーの強度とカンチレバーの位置、およびプローブからの反射の品質(つまり、プローブの裏面コーティングの劣化がDSに影響を与える)とPSD20の感度に依存するため、同じプローブを使用する場合でも、レーザーを再調整するたびにDSを再測定する必要があります。- 測定された変位は先端のたわみ角の関数であり、大きなたわみでは非線形になるため、計画されたサンプルのくぼみとほぼ同じプローブのたわみ(Vまたはnm)を達成するために、サファイアに DSキャリブレーションくぼ みを設定して実行します。
- 図3Aに示すように、結果のF-D曲線の最初の接触点後の接触レジームの線形部分の傾きから、DS(nm/V)、または逆光レバー感度(V/nm)を決定します。
- ランプを少なくとも5回繰り返し、各DS値を記録します。精度を最大にするには、値の平均を使用します。測定値の相対標準偏差(RSD)が~1%を超える場合は、最初のいくつかのF-D曲線が最初に接着力を導入するために理想的でない場合があるため、DSを再測定します。
- プローブカンチレバーのばね定数kが工場で校正されていない場合(たとえば、レーザードップラー振動計[LDV]を介して)、ばね定数を校正します。
注意: サーマルチューン法は、k < 10 N / mの比較的柔らかいカンチレバーに最適です(特にk > 10 N / mの硬いカンチレバーの代替方法のリストと説明については、説明のばね定数のセクションを参照してください)。図3B、Cに示すように、サーマルチューニングは通常、AFM制御ソフトウェアに統合されています。
- プローブに工場で校正された先端半径測定 (走査型 電子顕微鏡[SEM]イメージングなど)が付属していない場合は、有効先端半径 Rを測定します。
注: 先端半径 を測定する一般的な方法は2つありますが(対応する説明セクションを参照)、ナノメートルスケールのプローブチップで最も一般的なのは、チップがサンプルをイメージングするのではなく、チップを効果的にイメージングするのに役立つ多数の非常に鋭い(サブnm)特徴を含む粗さ標準( 材料表を参照)を利用するブラインドチップ再構成(BTR)法です。- BTR法を採用する場合は、非常にシャープな特徴の追跡を最適化するために、低速のスキャンレート(<0.5 Hz)と高いフィードバックゲインを使用して粗さ(チップの特性評価)サンプルをイメージングします。予想される先端半径に基づいて画像サイズとピクセル密度(解像度)を選択します(たとえば、3 μm x 3 μmの領域の1024 x 1024ピクセルの画像は、~3 nmの横方向の解像度を持ちます)。
- AFM画像解析ソフトウェア(材料表を参照)を使用してプローブチップをモデル化し、図3D-Fに示すように、予想されるサンプルのくぼみ深さでその端部半径と有効チップ直径を推定します。
- プローブのキャリブレーションが完了したら、図4Aに示すように、DS、k、およびRの値を機器ソフトウェアに入力します。
- サンプルのポアソン比 νの推定値を入力して、測定された還元弾性率を実際のサンプル弾性率9に変換できるようにします。先端形状とくぼみ深さに基づく円錐形または円錐形の接触力学モデルを採用する場合は、先端半角を入力する必要もあります(図4C)。
注:係数は、推定ポアソン比の小さな誤差や不確実性に比較的敏感ではありません。ν = 0.2-0.3の推定値は、多くの材料21の出発点として適しています。
- サンプルのポアソン比 νの推定値を入力して、測定された還元弾性率を実際のサンプル弾性率9に変換できるようにします。先端形状とくぼみ深さに基づく円錐形または円錐形の接触力学モデルを採用する場合は、先端半角を入力する必要もあります(図4C)。

図3:プローブのキャリブレーション。 (A)たわみ感度の決定。反射裏面アルミニウムコーティングを施した標準タッピングモードプローブ(公称k = 42 N/m、材料表を参照)のサファイア基板(E = 345 GPa)で実施した代表的なたわみ感度測定の結果。示されているのは、測定されたアプローチ曲線(青いトレース)と後退または撤退(赤いトレース)曲線です。測定されたたわみ感度59.16 nm/Vは、垂直の赤い点線の間の領域で示されているように、スナップツーコンタクトポイントとターンアラウンドポイントの間のアプローチ曲線をフィッティングすることによって決定されました。表面を引き抜く前の収縮/引き抜き曲線に明らかな負方向のたわみの領域は、チップとサンプルの接着を示しています。(B,C)サーマルチューニング。代表的なカンチレバー熱雑音スペクトル(青色のトレース)と、2つの異なるプローブに対応する適合(赤色のトレース)。(B)公称ばね定数k = 0.4 N / mを最初の推測として使用した標準的な力曲線ベースのAFMイメージングプローブ(材料表を参照)の熱調整セットアップとフィットパラメータ。カンチレバー熱雑音スペクトルの適合により、f 0 = 79.8 kHzの基本共振周波数が得られ、これはf0 = 70 kHzの公称値とかなりよく一致します。測定されたQ係数は58.1です。適合度(R2 = 0.99)は、2本の赤い縦破線の間のデータとの適合度の一致に基づいています。正確な結果を得るには、周囲温度とたわみ感度の両方を把握して入力することが重要です。(C)生細胞および単離された核のナノ機械的測定を実行するために使用される非常に柔らかいカンチレバーについて、カンチレバー熱雑音スペクトルと対応する適合(すなわち、熱調整)と、結果として計算されたばね定数k = 0.105 N / m。固有共振周波数が~2-3kHzと大幅に低いことに注意してください。(D-F)ブラインドチップの再構築。ダイヤモンドチッププローブの代表的なブラインドチップ再構成ワークフロー(公称R = 40 nm、材料表を参照)。(D)AFMプローブの先端を画像化するのに役立つ一連の非常に鋭い(サブnm)チタンスパイクで構成されるチップ特性評価サンプルの5 μm x 5 μmの画像。(E)得られたプローブ先端の再構成モデル(反転高さ画像)。(F)ブラインドチップ再構成フィッティング結果、ユーザーが選択した8nmの高さ(すなわち、くぼみ深さ<A = πr 2 = π(d/2)2) 球面接触力学モデルで使用します。略語:AFM =原子間力顕微鏡;ETD = 有効チップ径。この図の拡大版を表示するには、ここをクリックしてください。

図4:ソフトウェアインターフェース入力。 (A)プローブ校正定数。測定されたたわみ感度、ばね定数、および先端半径を入力するためのソフトウェアユーザーインターフェイス( 材料表を参照)により、定量的なナノメカニカル測定が可能になります。プローブとサンプルの両方のポアソン比は、カンチレバーベースのナノインデンテーション力曲線からサンプルの弾性率またはヤング率を計算するために必要です。(B)ランプコントロールウィンドウ。カンチレバーベースのナノインデンテーション実験を設定するためのソフトウェアユーザーインターフェイス( 材料表を参照)、ランプ自体(つまり、くぼみプロファイル)、機器のトリガー(力対変位制御など)、その後の力分析、および移動制限(Zピエゾの制御とPSDたわみの読み取りにおいてA/Dコンバーターが動作しなければならない範囲を狭めることにより、測定感度を向上させます)。(C)円錐形、ピラミッド型、または円錐形の接触力学モデル(Sneddonなど)を使用する場合、先端半角(プローブの形状または直接測定に基づく)が重要です。 この図の拡大版を表示するには、ここをクリックしてください。
3. 力-変位(F-D)データを収集する
注意: ここに示すパラメータ値( 図4Bを参照)は、特定のサンプルの力とくぼみの範囲によって異なる場合があります。
- AFMヘッドの下でサンプルをナビゲートし、目的の関心領域に移動します。
- 垂直たわみ信号を監視するか(図2B)、小さな初期ランプ(~50-200 nm)を実行して(図4B)、チップとサンプルが接触していることを確認します(図5Aを参照)。
- AFMヘッドの位置を少し上向きに調整し(フルランプサイズの~50%に対応するステップで)、再度ランプします。チップとサンプルがちょうど接触しなくなるまで繰り返し、ほぼ平坦な傾斜角(図5B)とカンチレバーの垂直方向のたわみの最小化(図2A)によって証明されます。
- チップとサンプルの明らかな相互作用が存在しない場合(図2Aと図2Bを比較)、AFMヘッドを手動で動かしながらプローブチップがサンプルに衝突しないように、ランプサイズの~50%-100%に相当する量だけAFMヘッドを下げます。再びランプを、良好な曲線(図5D)または図5Cと同様の曲線が観察されるまで繰り返す。後者の場合、ランプサイズの~20%-50%に等しい小さなAFMヘッド下降調整を1回追加して、良好な接触と図5Dに示すような力曲線を実現します。
- ランプパラメータを調整します(以下で説明し、 図 4B)を使用して、機器、プローブ、およびサンプルを最適化し、に示すようなランプを取得します。 図 5D.
- サンプル(厚さ、期待弾性率、表面粗さなど)と希望のくぼみ深さに応じて、適切なランプサイズ(つまり、1回のランプサイクルでの合計Zピエゾ運動)を選択します。
注:硬いサンプルの場合、サンプルの変形が少ない(したがって、特定のZピエゾの動きに対するプローブのたわみが大きくなる)可能性が高いため、ランプサイズは一般に柔らかいサンプルよりも小さくすることができます。硬いサンプルとカンチレバーの一般的なランプサイズは数十nmですが、柔らかいサンプルとカンチレバーのランプのサイズは数百nmから数μmです。特定の 選択されたアプリケーション例は 、代表的な結果のセクションに示されています。可能な最小および最大ランプサイズは機器に依存することに注意してください。 - 適切なランプレートを選択します(ほとんどのサンプルでは1Hzが適切な開始点です)。
注意: ランプレートは、制御および/または検出の電子速度/帯域幅によって制限される場合があります。ランプサイズと組み合わせて、ランプレートによって先端速度が決まります。先端速度は、粘弾性効果がヒステリシスアーチファクトを引き起こす可能性のある柔らかい材料をインデントするときに考慮することが特に重要です9,22。 - トリガ(負荷制御)または非トリガ(変位制御)ランプのどちらを使用するかを選択します。
注意: トリガーされたランプでは、システムは、目的のトリガーしきい値(つまり、セットポイント力またはカンチレバーたわみ)が検出されるまで、ユーザー定義のステップ(ランプのサイズと分解能またはデータポイントの数に基づいて)でサンプルに近づき、その時点でシステムは元の位置に後退し、F-D曲線を表示します。トリガーなしのランプでは、システムはZピエゾをユーザー定義のランプサイズで指定された距離まで延長し、測定されたF-D曲線を表示するだけです。トリガーランプはほとんどのユースケースに適していますが、トリガーされていないランプは、鋭く簡単に識別できる接触点を示さない柔らかい材料を調査する場合に役立ちます。- トリガーランプを選択した場合は、トリガーしきい値(ユーザー定義の最大許容力またはランプのたわみ)を設定して、サンプルに目的のくぼみを入れます。
注意: トリガーしきい値を使用すると、指定されたフルランプサイズ(Zピエゾ拡張)に達する前にランプが終了する(つまり、プローブが収縮し始める)可能性があります。値は、チップサンプルシステムに応じて、数nNから数μNの範囲であり得る。 - ランプ位置を設定して、ランプの実行に使用されるZピエゾの最大範囲の部分を決定します。ランプサイズの合計範囲が最大Zピエゾ範囲外で開始または終了しないことを確認してください(図6の代表的な例を参照)、そうしないと、F-D曲線の一部が物理的な測定値を表しません(つまり、Zピエゾは完全に伸びたり引っ込められたりし、移動しません)。
- トリガーランプを選択した場合は、トリガーしきい値(ユーザー定義の最大許容力またはランプのたわみ)を設定して、サンプルに目的のくぼみを入れます。
- サンプル/ランプの数(例:512 サンプル/ランプ )を設定して、測定の目的の分解能(つまり、F-D曲線の点密度)を達成します。
注:最大サンプル/ランプは、ソフトウェア(ファイルサイズ)またはハードウェアの制約(ランプレートに応じて、アナログからデジタル[A / D]への変換速度など)によって制限される場合があります。また、許容Zピエゾまたはたわみ範囲( 図4Bの制限パラメータを参照)を制限して、システムのA/Dコンバータの有効分解能を高めることもできます。 - X回転を設定して、プローブをX方向(カンチレバーに平行)にわずかに動かすと同時に、Z方向(カンチレバーに垂直)にインデントすることにより、サンプルとチップにかかるせん断力を低減します。X回転には、表面法線に対するプローブホルダーのオフセット角度に等しい値を使用します(12°が標準です)。
注意: 入射レーザービームがPSDに反射できるように、カンチレバーが表面に対して小さな角度でプローブホルダーに取り付けられているため、X回転が必要です。さらに、プローブ先端の前後の角度は互いに異なる場合があります(つまり、プローブ先端が非対称である可能性があります)。より具体的な情報は、個々のプローブおよびAFMメーカーから入手できます。
- サンプル(厚さ、期待弾性率、表面粗さなど)と希望のくぼみ深さに応じて、適切なランプサイズ(つまり、1回のランプサイクルでの合計Zピエゾ運動)を選択します。
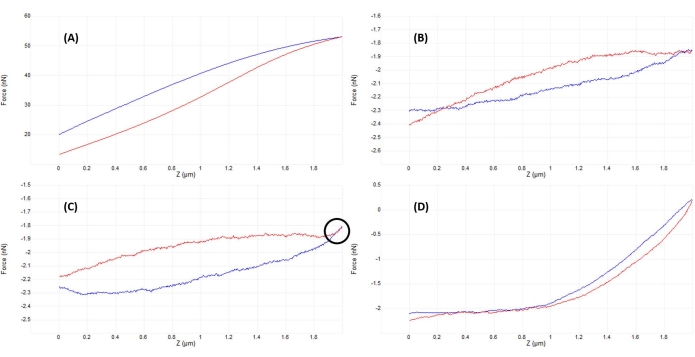
図5:良好な力曲線を得るために、噛み合った後のチップとサンプルの分離を最適化します。 半径5μmの半球状の先端で終わる較正された軟質窒化ケイ素カンチレバー(公称 k = 0.04 N / m)を用いて、生きた間葉系幹細胞核上の流体(リン酸緩衝生理食塩水)にインデントしながら得られた代表的な力-変位曲線の連続例( 材料表を参照)。曲線は、細胞表面を係合し、インデンテーションパラメータを最適化する過程で得られ、プローブアプローチは青色で示され、収縮/撤退は赤色で示されました。(A)ランプを開始する前に、チップがすでにサンプルとかみ合って接触しているため、カンチレバーのたわみと力が大きくなり、接触前のベースラインが平坦ではありません。(B)チップをサンプルから十分に離して手動で移動した後、トリガーなしの2 μmランプにより、F-D曲線はほぼ平坦になります(つまり、力の変化はほとんどありません)。周囲条件では、曲線はより平坦になりますが、流体では、媒体の粘度により、表面が接触していなくても、ここで見られるように、ランプ中にプローブカンチレバーがわずかにたわむ可能性があります。(C)傾斜路の開始前に表面に少し近づいた後、アプローチ曲線とリトラクト曲線は、傾斜路の折り返し点付近でわずかに力が増加する(傾斜が増加する)ことを示します(つまり、アプローチから撤退への移行)。探すべき明らかな兆候は、アプローチ(青)と撤退(赤)の曲線が重なり始め(黒い円で示された領域)、表面との物理的な相互作用を示すことです。(D)ランプパラメータの最適化後に取得され、 C よりもセル表面にわずかに(~1μm)近づくと、プローブはランプの約半分を細胞に接触させ、アプローチ曲線の接触部分に適合するのに十分な変形を可能にし、弾性率を決定します。比較的長く、平坦で、低ノイズのベースラインにより、フィッティングアルゴリズムが接触点を決定しやすくなります。略語:F-D =力変位。 この図の拡大版を表示するには、ここをクリックしてください。
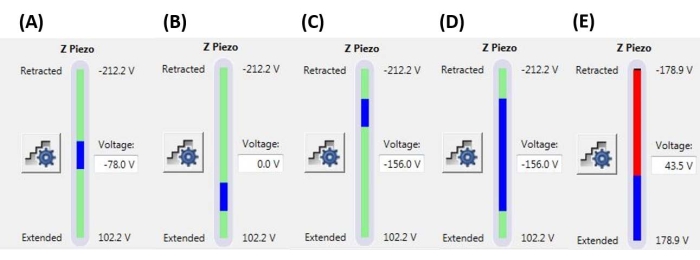
図6:ランプのサイズと位置。 利用可能なZピエゾ移動範囲の合計(緑色のバー)に対するランプ(青いバー)の範囲を示すZピエゾモニター。(A)Zピエゾの位置は、青いバーが緑色のバーのほぼ中央にあり、現在のZピエゾ電圧(-78.0 V)がほぼ完全に収縮した(-212.2 V)値と拡張(+102.2 V)値の間にあることから示されるように、移動範囲の中央近くにあります。(B)ZピエゾはAに対して拡張されており、バイアス電圧は印加されていません。(C)ZピエゾはAとBに対して後退しています。(D)Zピエゾの位置は-156.0VでCと同じですが、Zピエゾの全可動域をより多く活用するために、ランプサイズがA-Cに比べて大きくなっています。€ランプサイズが現在のランプ位置に対して大きすぎるため、Zピエゾがその範囲の終わりまで拡張されます。これにより、システムがZピエゾをさらに拡張できないため、F-D曲線が平坦になります。略語:F-D =力変位。この図の拡大版を表示するには、ここをクリックしてください。
4. F-D カーブ解析
- 適切なデータ分析ソフトウェアパッケージを選択してください。分析するデータを選択してロードします。
注:多くのAFMメーカーとAFM画像処理ソフトウェアプログラムには、F-D曲線分析のサポートが組み込まれています。あるいは、オープンソースのAtomicJソフトウェアパッケージなどの専用のF-D曲線解析パッケージの柔軟性と機能の向上は、特に大規模なデータセットのバッチ処理と統計解析、または複雑な接触力学モデルの実装に有益である可能性があります23。 - ばね定数、DS、プローブ先端半径の校正値を入力し、プローブ先端のヤング率とポアソン比の推定値(材料組成に基づく)、およびサンプルのポアソン比を入力します。
注意: ダイヤモンドチップ圧子を使用する場合、値Eチップ= 1140 GPaおよびνチップ= 0.07は21,24,25,26を使用できます。標準的なシリコンプローブの場合、Eチップ= 170 GPaおよびνチップ= 0.27が典型的に使用されるが、シリコンのヤング率は結晶学的配向に依存する27。 - 先端とサンプルに適したナノインデンテーション接触力学モデルを選択してください。
注:多くの一般的な球面チップモデル(ヘルツ、モージス、DMT、JKRなど)では、サンプルへのくぼみの深さがチップ半径よりも小さいことが不可欠です。そうしないと、プローブ先端の球形の形状が円錐形またはピラミッド形になります(図4C)。円錐形(例えば、Sneddon28)およびピラミッド型モデルの場合、先端半角(すなわち、先端の側壁と先端に垂直な二等分線との間の角度; 図4C)既知である必要があり、通常はプローブの製造元から入手できます。接触力学モデルの詳細については、ディスカッションのデータ 分析 セクションを参照してください。 - フィットアルゴリズムを実行します。F-D曲線の適切なフィッティングを確認します。ユニティに近い平均R2に対応する低い残差誤差(例えば、R2>0.9)は、典型的には、選択されたモデル29、30への良好な適合を示す。必要に応じて、個々の曲線をスポットチェックして、曲線、モデルの適合、および計算された接触点を視覚的に検査します(たとえば、図7および説明のデータ分析セクションを参照)。
結果
力-変位曲線
図7は、樹脂が埋め込まれたロブロリーマツサンプル(図7A)および間葉系幹細胞(MSC)核上の流体(リン酸緩衝生理食塩水[PBS])(図7B)で空気中で行われたナノインデンテーション実験から得られた代表的なほぼ理想的なF-D曲線を示しています。接触力学モデルの使用は、最初のチップとサンプルの接触点の...
ディスカッション
サンプル調製
空気中のナノインデンテーションの場合、一般的な調製方法には、凍結切片(例えば、組織サンプル)、粉砕および/または研磨とそれに続くウルトラミクロトミング(例えば、樹脂包埋生物学的サンプル)、イオンミリングまたは集束イオンビーム調製(例えば、研磨に適さない半導体、多孔質、または混合硬度サンプル)、機械的または電気化学的研磨(例えば、金属?...
開示事項
著者は、開示すべき利益相反はありません。
謝辞
すべてのAFM実験は、ボイシ州立大学表面科学研究所(SSL)で実施されました。SEMの特性評価は、ボイシ州立材料特性評価センター(BSCMC)で実施されました。バイオ燃料原料に関するこの出版物で報告された研究は、原料変換インターフェースコンソーシアム(FCIC)の一部として、米国エネルギー省、エネルギー効率および再生可能エネルギー局、バイオエネルギー技術局、およびDOEアイダホオペレーションオフィス契約DE-AC07-051ID14517。細胞力学研究は、米国国立衛生研究所(米国)の助成金AG059923、AR075803、P20GM109095、および国立科学財団(米国)の助成金1929188および2025505によって支援されました。モデル脂質二重層システムの研究は、助成金R01 EY030067の下で国立衛生研究所(米国)によってサポートされました。著者らは、 図11に示す合成画像を作成したElton Graugnard博士に感謝する。
資料
| Name | Company | Catalog Number | Comments |
| Atomic force microscope | Bruker | Dimension Icon | Uses Nanoscope control software, including PeakForce Quantitative Nanomechanical Mapping (PF-QNM), FastForce Volume (FFV), and Point-and-Shoot Ramping experimental workspaces |
| AtomicJ | American Institute of Physics | https://doi.org/10.1063/1.4881683 | Flexible, powerful, free open source Java-based force curve analysis software package. Supports numerous contact mechanic models, such as Hertz, Sneddon DMT, JKR, Maugis, and cone or pyramid (including blunt and truncated). Also includes a variety of initial contact point estimation methods to choose from. Supports batch processing of data and subsequent statistical analysis (e.g., averages, standard deviations, histograms, goodness of fit, etc.). Literature citation is: P. Hermanowicz, M. Sarna, K. Burda, and H. Gabry , “AtomicJ: An open source software for analysis of force curves” Rev. Sci. Instrum. 85: 063703 (2014), https://doi.org/10.1063/1.4881683 , “AtomicJ: An open source software for analysis of force curves” Rev. Sci. Instrum. 85: 063703 (2014), https://doi.org/10.1063/1.4881683 |
| Buffer solution (PBS) | Fisher Chemical (NaCl), Sigma Aldrich (KCl), Fisher BioReagents (Na2HPO4 and KH2PO4) | S271 (>99% purity NaCl), P9541 (>99% purity KCl), BP332(>99% purity Na2HPO4), BP362 (>99% purity KH2PO4) | Phosphate buffered saline (PBS) was prepared in the laboratory as an aqueous solution consisting of 137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, and 1.8 mM KH2PO4 dissolved in ultrapure water. Reagents were measured out using an analytical balance, and glassware was cleaned with soap and water followed by autoclaving immediately prior to use. |
| Chloroform | |||
| Diamond tip AFM probe | Bruker | PDNISP | Pre-mounted factory-calibrated cube corner diamond (E = 1140 GPa) tip AFM probe (nominal R = 40 nm) with a stainless steel cantilever (nominal k = 225 N/m, f0 = 50 kHz). Spring constant is measured at the factory (k = 256 N/m for the probe, Serial #13435414, used here) and calibration data (including AFM images of indents showing probe geometry) is provided with the probe. |
| Diamond ultramicrotome blade | Diatome | Ultra 35° | 2.1 mm width. Also used a standard glass blade for intial rough cut of sample surface before transitioning to diamond blade for final surface preparation |
| Epoxy | Gorilla Glue | 26853-31-6 | Epoxy resin and hardner were mixed in a 1:1 ratio, a small drop was placed on a stainless steel sample puck (Ted Pella), and V1 grade muscovite mica (Ted Pella) was attached to create an atomically flat surface for preparation of phospholipid membranes. |
| Ethanol | |||
| LR white resin, medium grade (catalyzed) | Electron Microscopy Sciences | 14381 | 500 mL bottle, Lot #150629 |
| Mesenchymal stem cells (MSCs) | N/A | N/A | MSCs for nanomechanical studies were primary cells harvested from 8-10 week old male C57BL/6 mice as described in Goelzer, M. et al. "Lamin A/C Is Dispensable to Mechanical Repression of Adipogenesis" Int J Mol Sci 22: 6580 (2021) doi:10.3390/ijms22126580 and Peister, A. et al. "Adult stem cells from bone marrow (MSCs) isolated from different strains of inbred mice vary in surface epitopes, rates of proliferation, and differentiation potential" Blood 103: 1662-1668 (2004), doi:10.1182/blood-2003-09-3070. |
| Modulus standards | Bruker | PFQNM-SMPKIT-12M | Used HOPG (E = 18 GPa) and PS (E = 2.7 GPa). Also contains 2x PDMS (Tack 0, E = 2.5 MPa; Tack 4, E = 3.5 MPa), PS-LDPE (E = 2.0/0.2 GPa), fused silica (E = 72.9 GPa), sapphire (E - 345 GPa), and tip characterization (titanium roughness) sample. All samples come pre-mounted on a 12 mm diameter steel disc (sample puck). |
| Muscovite mica | Ted Pella | 50-12 | 12 mm diameter, V1 grade muscovite mica |
| Nanscope Analysis | Bruker | Version 2.0 | Free AFM image processing and analysis software package, but designed for, and proprietary/limited to Bruker AFMs; similar functionality is available from free, platform-independent AFM image processing and analysis software packages such as Gwyddion, WSxM, and others. Has built-in capabilities for force curve analysis, but AtomicJ is more flexible/full featured (e.g., more built-in contact mechanics models to choose from, statistical analysis of force curve fitting results, etc.) for force curve analysis and handles batch processing of force curves. |
| Phospholipids: POPC, Cholesterol (ovine) | Avanti Polar Lipids | POPC: CAS # 26853-31-6, Cholesterol: CAS # 57-88-5 | POPC lipid dissolved in chloroform (25 mg/mL) was obtained from vendor and used without further purification. Cholesterol powder from the same vendor was dissolved in chloroform (20 mg/mL). |
| Probe holder (fluid, lipid bilayers) | Bruker | MTFML-V2 | Specific to the particular AFM used; MTFML-V2 is a glass probe holder for scanning in fluid on a MultiMode AFM. |
| Probe holder (fluid, MSCs) | Bruker | FastScan Bio Z-scanner | Used with Dimension FastScan head (XY flexure scanners). Serial number MXYPOM5-1B154. |
| Probe holder (standard, ambient) | Bruker | DAFMCH | Specific to the particular AFM used; DAFMCH is the standard contact and tapping mode probe holder for the Dimension Icon AFM, suitable for nanoindentation (PF-QNM, FFV, and point-and-shoot ramping) |
| Sample Puck | Ted Pella | 16218 | Product number is for 15 mm diameter stainless steel sample puck. Also available in 6 mm, 10 mm, 12 mm, and 20 mm diameters at https://www.tedpella.com/AFM_html/AFM.aspx#anchor842459 |
| Sapphire substrate | Bruker | PFQNM-SMPKIT-12M | Extremely hard surface (E = 345 GPa) for measuring deflection sensitivity of probes (want all of the deflection to come from the probe, not the substrate). Part of the PF-QNM/modulus standards kit. |
| Scanning electron microscope | Hitachi | S-3400N-II | Located at Boise State. Used to perform co-localized SEM/EDS on all samples except additively manufactured (AM) Ti-6Al-4V. |
| Silicon AFM probes (standard) | NuNano | Scout 350 | Standard tapping mode silicon probe with reflective aluminum backside coating; k = 42 N/m (nominal), f0 = 350 kHz. Nominal R = 5 nm. Also available uncoated or with reflective gold backside coating. Probes with similar specifications are available from other manufacturers (e.g., Bruker TESPA-V2). |
| Silicon AFM probes (stiff) | Bruker | RTESPA-525, RTESPA-525-30 | Rotated tip etched silicon probes with reflective aluminum backside coating; k = 200 N/m (nominal), f0 = 525 kHz. Nominal R = 8 nm for RTESPA-525, R = 30 nm for RTESPA-525-30. Spring constant of each RTESPA-525-30 is measured individually at the factory via laser Doppler vibrometry and supplied with the probe. |
| Silicon carbide grit paper (abrasive discs) | Allied | 50-10005 | 120 grit |
| Silicon nitride AFM probes (soft, large radius hemispherical tip) | Bruker | MLCT-SPH-5UM, MLCT-SPH-5UM-DC | Also MLCT-SPH-1UM-DC. New product line of factory-calibrated (probe radius and spring constants of all cantilevers) large radius (R = 1 or 5 mm) hemispherical tip (at the end of a 23 mm long cylindrical shaft) probes. DC = drift compensation coating. 6 cantilevers/probe (A-F). Nominal spring constants: A, k = 0.07 N/m; B, k = 0.02 N/m; C, k = 0.01 N/m; D, k = 0.03 N/m; E, k = 0.1 N/m; F, k = 0.6 N/m. |
| Silicon nitride AFM probes (soft, medium sharp tip) | Bruker | DNP | 4 cantilevers/probe (A-d). Nominal spring constants: A, k = 0.35 N/m; B, k = 0.12 N/m; C, k = 0.24 N/m; D, k = 0.06 N/m. Nominal radii of curvature, R = 10 nm. |
| Silicon nitride AFM probes (soft, sharp tip) | Bruker | ScanAsyst-Air | Nominal values: resonance frequency, f0 = 70 kHz; spring constant, k = 0.4 N/m; radius of curvature, R = 2 nm. Designed for force curve based AFM imaging. |
| Superglue | Henkel | Loctite 495 | Cyanoacrylate based instant adhesive. Lots of roughly equivalent products are readily available. |
| Syringe pump | New Era Pump Systems | NE1000US | One channel syringe pump system with infusion and withdrawal capacity |
| Tip characterization standard | Bruker | PFQNM-SMPKIT-12M | Titanium (Ti) roughness standard. Part of the PF-QNM/modulus standards kit. |
| Ultrahigh purity nitrogen (UHP N2), 99.999% | Norco | SPG TUHPNI - T | T size compressed gas cylinder of ultrahigh purity (99.999%) nitrogen for drying samples |
| Ultramicrotome | Leica | EM UC6 | Equipped with a glass blade (standard, for intial sample preparation) and a diamond blade (for final preparation) |
| Ultrapure water | Thermo Fisher | Barnstead Nanopure Model 7146 | Model has been discontinued, but equivalent products are available. Produces ≥18.2 MΩ*cm ultrapure water with 1-5 ppb TOC (total organic content), per inline UV monitoring. Includes 0.2 µm particulate filter, ion exchange columns, and UV oxidation chamber. |
| Variable Speed Grinder | Buehler | EcoMet 3000 | Used with silicon carbide grit papers during hand polishing. |
| Vibration isolation table (active) | Herzan | TS-140 | Used with Bruker MultiMode AFM. Sits on a TMC 65-531 vibration isolation table. Bruker Dimension Icon AFM utilizes strictly passive vibration isolation (comes from manufacturer with custom acoustic hood, air table, and granite slab). |
| Vibration isolation table (passive) | TMC | 65-531 | 35" x 30" vibration isolation table with optional air damping (disabled). Used with Bruker MultiMode AFM. Herzan TS-140 "Table Stable" active vibration control table is located on top. |
参考文献
- Hart, E. W. Theory of the tensile test. Acta Metallurgica. 15 (2), 351-355 (1967).
- Fell, J. T., Newton, J. M. Determination of tablet strength by the diametral-compression test. Journal of Pharmaceutical Sciences. 59 (5), 688-691 (1970).
- Babiak, M., Gaff, M., Sikora, A., Hysek, &. #. 3. 5. 2. ;. Modulus of elasticity in three- and four-point bending of wood. Composite Structures. 204, 454-465 (2018).
- Song, S., Yovanovich, M. M. Relative contact pressure-Dependence on surface roughness and Vickers microhardness. Journal of Thermophysics and Heat Transfer. 2 (1), 43-47 (1988).
- Hays, C., Kendall, E. G. An analysis of Knoop microhardness. Metallography. 6 (4), 275-282 (1973).
- Hill, R., Storåkers, B., Zdunek, A. B. A theoretical study of the Brinell hardness test. Proceedings of the Royal Society of London. A. Mathematical and Physical Sciences. 423 (1865), 301-330 (1989).
- Oliver, W. C., Pharr, G. M. An improved technique for determining hardness and elastic modulus using load and displacement sensing indentation experiments. Journal of Materials Research. 7 (6), 1564-1583 (1992).
- Sakharova, N. A., Fernandes, J. V., Antunes, J. M., Oliveira, M. C. Comparison between Berkovich, Vickers and conical indentation tests: A three-dimensional numerical simulation study. International Journal of Solids and Structures. 46 (5), 1095-1104 (2009).
- Cohen, S. R., Kalfon-Cohen, E. Dynamic nanoindentation by instrumented nanoindentation and force microscopy: a comparative review. Beilstein Journal of Nanotechnology. 4 (1), 815-833 (2013).
- Saha, R., Nix, W. D. Effects of the substrate on the determination of thin film mechanical properties by nanoindentation. Acta Materialia. 50 (1), 23-38 (2002).
- Tsui, T. Y., Pharr, G. M. Substrate effects on nanoindentation mechanical property measurement of soft films on hard substrates. Journal of Materials Research. 14 (1), 292-301 (1999).
- Cao, G., Gao, H. Mechanical properties characterization of two-dimensional materials via nanoindentation experiments. Progress in Materials Science. 103, 558-595 (2019).
- Castellanos-Gomez, A., Singh, V., vander Zant, H. S. J., Steele, G. A. Mechanics of freely-suspended ultrathin layered materials. Annalen der Physik. 527 (1-2), 27-44 (2015).
- Cao, C., Sun, Y., Filleter, T. Characterizing mechanical behavior of atomically thin films: A review. Journal of Materials Research. 29 (3), 338-347 (2014).
- Lee, C., Wei, X., Kysar, J. W., Hone, J. Measurement of the elastic properties and intrinsic strength of monolayer graphene. Science. 321 (5887), 385-388 (2008).
- Elibol, K., et al. Visualising the strain distribution in suspended two-dimensional materials under local deformation. Scientific Reports. 6 (1), 28485 (2016).
- Castellanos-Gomez, A., et al. Mechanical properties of freely suspended atomically thin dielectric layers of mica. Nano Research. 5 (8), 550-557 (2012).
- Song, L., et al. Large scale growth and characterization of atomic hexagonal boron nitride layers. Nano Letters. 10 (8), 3209-3215 (2010).
- Castellanos-Gomez, A., et al. Elastic properties of freely suspended MoS2 nanosheets. Advanced Materials. 24 (6), 772-775 (2012).
- D'Costa, N. P., Hoh, J. H. Calibration of optical lever sensitivity for atomic force microscopy. Review of Scientific Instruments. 66 (10), 5096-5097 (1995).
- Wu, Y., et al. Evaluation of elastic modulus and hardness of crop stalks cell walls by nano-indentation. Bioresource Technology. 101 (8), 2867-2871 (2010).
- Barns, S., et al. Investigation of red blood cell mechanical properties using AFM indentation and coarse-grained particle method. BioMedical Engineering OnLine. 16 (1), 140 (2017).
- Hermanowicz, P., Sarna, M., Burda, K., Gabryś, H. AtomicJ: An open source software for analysis of force curves. Review of Scientific Instruments. 85 (6), 063703 (2014).
- Broitman, E. Indentation hardness measurements at macro-, micro-, and nanoscale: a critical overview. Tribology Letters. 65 (1), 23 (2016).
- Tiwari, A. . Nanomechanical Analysis of High Performance Materials. , (2015).
- Aggarwal, R. L., Ramdas, A. K. . Physical Properties of Diamond and Sapphire. , (2019).
- Boyd, E. J., Uttamchandani, D. Measurement of the anisotropy of Young's modulus in single-crystal silicon. Journal of Microelectromechanical Systems. 21 (1), 243-249 (2012).
- Harding, J. W., Sneddon, I. N. The elastic stresses produced by the indentation of the plane surface of a semi-infinite elastic solid by a rigid punch. Mathematical Proceedings of the Cambridge Philosophical Society. 41 (1), 16-26 (2008).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis-I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129 (3), 430-440 (2006).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis-II: Adhesion-influenced indentation of soft, elastic materials. Journal of Biomechanical Engineering. 129 (6), 904-912 (2007).
- Haile, S., Palmer, M., Otey, A. Potential of loblolly pine: switchgrass alley cropping for provision of biofuel feedstock. Agroforestry Systems. 90 (5), 763-771 (2016).
- Lu, X., et al. Biomass logistics analysis for large scale biofuel production: Case study of loblolly pine and switchgrass. Bioresource Technology. 183, 1-9 (2015).
- Susaeta, A., Lal, P., Alavalapati, J., Mercer, E., Carter, D. Economics of intercropping loblolly pine and switchgrass for bioenergy markets in the southeastern United States. Agroforestry Systems. 86 (2), 287-298 (2012).
- Garcia, R. Nanomechanical mapping of soft materials with the atomic force microscope: methods, theory and applications. Chemical Society Reviews. 49 (16), 5850-5884 (2020).
- Derjaguin, B. V., Muller, V. M., Toporov, Y. P. Effect of contact deformations on the adhesion of particles. Journal of Colloid and Interface Science. 53 (2), 314-326 (1975).
- Ciesielski, P. N., et al. Engineering plant cell walls: tuning lignin monomer composition for deconstructable biofuel feedstocks or resilient biomaterials. Green Chemistry. 16 (5), 2627-2635 (2014).
- Liu, K., Ostadhassan, M., Zhou, J., Gentzis, T., Rezaee, R. Nanoscale pore structure characterization of the Bakken shale in the USA. Fuel. 209, 567-578 (2017).
- Maryon, O. O., et al. Co-localizing Kelvin probe force microscopy with other microscopies and spectroscopies: selected applications in corrosion characterization of alloys. JoVE. (184), e64102 (2022).
- Eliyahu, M., Emmanuel, S., Day-Stirrat, R. J., Macaulay, C. I. Mechanical properties of organic matter in shales mapped at the nanometer scale. Marine and Petroleum Geology. 59, 294-304 (2015).
- Li, C., et al. Nanomechanical characterization of organic matter in the Bakken formation by microscopy-based method. Marine and Petroleum Geology. 96, 128-138 (2018).
- Bouzid, T., et al. The LINC complex, mechanotransduction, and mesenchymal stem cell function and fate. Journal of Biological Engineering. 13 (1), 68 (2019).
- Dupont, S., et al. Role of YAP/TAZ in mechanotransduction. Nature. 474 (7350), 179-183 (2011).
- Wang, S., et al. CCM3 is a gatekeeper in focal adhesions regulating mechanotransduction and YAP/TAZ signalling. Nature Cell Biology. 23 (7), 758-770 (2021).
- Sen, B., et al. Mechanical strain inhibits adipogenesis in mesenchymal stem cells by stimulating a durable β-catenin signal. Endocrinology. 149 (12), 6065-6075 (2008).
- Sen, B., et al. mTORC2 regulates mechanically induced cytoskeletal reorganization and lineage selection in marrow-derived mesenchymal stem cells. Journal of Bone and Mineral Research. 29 (1), 78-89 (2014).
- Sen, B., et al. Mechanically induced nuclear shuttling of β-catenin requires co-transfer of actin. Stem Cells. 40 (4), 423-434 (2022).
- Newberg, J., et al. Isolated nuclei stiffen in response to low intensity vibration. Journal of Biomechanics. 111, 110012 (2020).
- Ding, Y., Xu, G. -. K., Wang, G. -. F. On the determination of elastic moduli of cells by AFM based indentation. Scientific Reports. 7 (1), 45575 (2017).
- Khadka, N. K., Timsina, R., Rowe, E., O'Dell, M., Mainali, L. Mechanical properties of the high cholesterol-containing membrane: An AFM study. Biochimica et Biophysica Acta. Biomembranes. 1863 (8), 183625 (2021).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surface Science Reports. 61 (10), 429-444 (2006).
- Qian, L., Zhao, H. Nanoindentation of soft biological materials. Micromachines. 9 (12), 654 (2018).
- Pittenger, B., Yablon, D. Improving the accuracy of nanomechanical measurements with force-curve-based AFM techniques. Bruker Application Notes. 149, (2017).
- Vorselen, D., Kooreman, E. S., Wuite, G. J. L., Roos, W. H. Controlled tip wear on high roughness surfaces yields gradual broadening and rounding of cantilever tips. Scientific Reports. 6 (1), 36972 (2016).
- Bhaskaran, H., et al. Ultralow nanoscale wear through atom-by-atom attrition in silicon-containing diamond-like carbon. Nature Nanotechnology. 5 (3), 181-185 (2010).
- Giannazzo, F., Schilirò, E., Greco, G., Roccaforte, F. Conductive atomic force microscopy of semiconducting transition metal dichalcogenides and heterostructures. Nanomaterials. 10 (4), 803 (2020).
- Melitz, W., Shen, J., Kummel, A. C., Lee, S. Kelvin probe force microscopy and its application. Surface Science Reports. 66 (1), 1-27 (2011).
- Kazakova, O., et al. Frontiers of magnetic force microscopy. Journal of Applied Physics. 125 (6), 060901 (2019).
- Kim, H. -. J., Yoo, S. -. S., Kim, D. -. E. Nano-scale wear: A review. International Journal of Precision Engineering and Manufacturing. 13 (9), 1709-1718 (2012).
- Heath, G. R., et al. Localization atomic force microscopy. Nature. 594 (7863), 385-390 (2021).
- Strahlendorff, T., Dai, G., Bergmann, D., Tutsch, R. Tip wear and tip breakage in high-speed atomic force microscopes. Ultramicroscopy. 201, 28-37 (2019).
- Lantz, M. A., et al. Wear-resistant nanoscale silicon carbide tips for scanning probe applications. Advanced Functional Materials. 22 (8), 1639-1645 (2012).
- Khurshudov, A. G., Kato, K., Koide, H. Wear of the AFM diamond tip sliding against silicon. Wear. 203, 22-27 (1997).
- Villarrubia, J. S. Algorithms for scanned probe microscope image simulation, surface reconstruction, and tip estimation. Journal of Research of the National Institute of Standards and Technology. 102 (4), 425 (1997).
- Kain, L., et al. Calibration of colloidal probes with atomic force microscopy for micromechanical assessment. Journal of the Mechanical Behavior of Biomedical Materials. 85, 225-236 (2018).
- Slattery, A. D., Blanch, A. J., Quinton, J. S., Gibson, C. T. Accurate measurement of Atomic Force Microscope cantilever deflection excluding tip-surface contact with application to force calibration. Ultramicroscopy. 131, 46-55 (2013).
- Dobrovinskaya, E. R., Lytvynov, L. A., Pishchik, V. . Sapphire: Material, Manufacturing, Applications. , (2009).
- te Riet, J., et al. Interlaboratory round robin on cantilever calibration for AFM force spectroscopy. Ultramicroscopy. 111 (12), 1659-1669 (2011).
- Pratt, J. R., Shaw, G. A., Kumanchik, L., Burnham, N. A. Quantitative assessment of sample stiffness and sliding friction from force curves in atomic force microscopy. Journal of Applied Physics. 107 (4), 044305 (2010).
- Slattery, A. D., Blanch, A. J., Quinton, J. S., Gibson, C. T. Calibration of atomic force microscope cantilevers using standard and inverted static methods assisted by FIB-milled spatial markers. Nanotechnology. 24 (1), 015710 (2012).
- Higgins, M. J., et al. Noninvasive determination of optical lever sensitivity in atomic force microscopy. Review of Scientific Instruments. 77 (1), 013701 (2006).
- Lévy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13 (1), 33-37 (2001).
- Sikora, A. Quantitative normal force measurements by means of atomic force microscopy towards the accurate and easy spring constant determination. Nanoscience and Nanometrology. 2 (1), 8-29 (2016).
- Ohler, B. Cantilever spring constant calibration using laser Doppler vibrometry. Review of Scientific Instruments. 78 (6), 063701 (2007).
- Gates, R. S., Pratt, J. R. Accurate and precise calibration of AFM cantilever spring constants using laser Doppler vibrometry. Nanotechnology. 23 (37), 375702 (2012).
- Cleveland, J. P., Manne, S., Bocek, D., Hansma, P. K. A nondestructive method for determining the spring constant of cantilevers for scanning force microscopy. Review of Scientific Instruments. 64 (2), 403-405 (1993).
- Sader, J. E., Chon, J. W. M., Mulvaney, P. Calibration of rectangular atomic force microscope cantilevers. Review of Scientific Instruments. 70 (10), 3967-3969 (1999).
- Sader, J. E., et al. Spring constant calibration of atomic force microscope cantilevers of arbitrary shape. Review of Scientific Instruments. 83 (10), 103705 (2012).
- Sader, J. E. Frequency response of cantilever beams immersed in viscous fluids with applications to the atomic force microscope. Journal of Applied Physics. 84 (1), 64-76 (1998).
- Sader, J. E., Pacifico, J., Green, C. P., Mulvaney, P. General scaling law for stiffness measurement of small bodies with applications to the atomic force microscope. Journal of Applied Physics. 97 (12), 124903 (2005).
- Mendels, D. -. A., et al. Dynamic properties of AFM cantilevers and the calibration of their spring constants. Journal of Micromechanics and Microengineering. 16 (8), 1720-1733 (2006).
- Gao, S., Brand, U. In-situ nondestructive characterization of the normal spring constant of AFM cantilevers. Measurement Science and Technology. 25 (4), 044014 (2014).
- Gibson, C. T., Watson, G. S., Myhra, S. Determination of the spring constants of probes for force microscopy/spectroscopy. Nanotechnology. 7 (3), 259-262 (1996).
- Gates, R. S., Pratt, J. R. Prototype cantilevers for SI-traceable nanonewton force calibration. Measurement Science and Technology. 17 (10), 2852-2860 (2006).
- Neumeister, J. M., Ducker, W. A. Lateral, normal, and longitudinal spring constants of atomic force microscopy cantilevers. Review of Scientific Instruments. 65 (8), 2527-2531 (1994).
- Kim, M. S., Choi, I. M., Park, Y. K., Kang, D. I. Atomic force microscope probe calibration by use of a commercial precision balance. Measurement. 40 (7), 741-745 (2007).
- Kim, M. -. S., Choi, J. -. H., Park, Y. -. K., Kim, J. -. H. Atomic force microscope cantilever calibration device for quantified force metrology at micro- or nano-scale regime: the nano force calibrator (NFC). Metrologia. 43 (5), 389-395 (2006).
- Tian, Y., et al. A novel method and system for calibrating the spring constant of atomic force microscope cantilever based on electromagnetic actuation. Review of Scientific Instruments. 89 (12), 125119 (2018).
- Clifford, C. A., Seah, M. P. The determination of atomic force microscope cantilever spring constants via dimensional methods for nanomechanical analysis. Nanotechnology. 16 (9), 1666-1680 (2005).
- Chen, B. -. Y., Yeh, M. -. K., Tai, N. -. H. Accuracy of the spring constant of atomic force microscopy cantilevers by finite element method. Analytical Chemistry. 79 (4), 1333-1338 (2007).
- Mick, U., Eichhorn, V., Wortmann, T., Diederichs, C., Fatikow, S. Combined nanorobotic AFM/SEM system as novel toolbox for automated hybrid analysis and manipulation of nanoscale objects. 2010 IEEE International Conference on Robotics and Automation. , 4088-4093 (2010).
- Kim, M. -. S., Choi, J. -. H., Kim, J. -. H., Park, Y. -. K. Accurate determination of spring constant of atomic force microscope cantilevers and comparison with other methods. Measurement. 43 (4), 520 (2010).
- Zhang, G., Wei, Z., Ferrell, R. E. Elastic modulus and hardness of muscovite and rectorite determined by nanoindentation. Applied Clay Science. 43 (2), 271-281 (2009).
- Bobko, C. P., Ortega, J. A., Ulm, F. -. J. Comment on "Elastic modulus and hardness of muscovite and rectorite determined by nanoindentation by G. Zhang, Z. Wei and R.E. Ferrell. Applied Clay Science. 46 (4), 425-428 (2009).
- Zhang, G., Wei, Z., Ferrell, R. E. Reply to the Comment on "Elastic modulus and hardness of muscovite and rectorite determined by nanoindentation" by G. Zhang, Z. Wei and R. E. Ferrell. Applied Clay Science. 46 (4), 429-432 (2009).
- Jin, D. W., et al. Thermal stability and Young's modulus of mechanically exfoliated flexible mica. Current Applied Physics. 18 (12), 1486-1491 (2018).
- Xiao, J., et al. Anisotropic friction behaviour of highly oriented pyrolytic graphite. Carbon. 65, 53-62 (2013).
- Hertz, H. Ueber die Berührung fester elastischer Körper. Journal für die reine und angewandte Mathematik. 1882 (92), 156-171 (1882).
- Johnson, K. L., Kendall, K., Roberts, A. D., Tabor, D. Surface energy and the contact of elastic solids. Proceedings of the Royal Society of London. A. Mathematical and Physical Sciences. 324 (1558), 301-313 (1971).
- Muller, V. M., Derjaguin, B. V., Toporov, Y. P. On two methods of calculation of the force of sticking of an elastic sphere to a rigid plane. Colloids and Surfaces. 7 (3), 251-259 (1983).
- Maugis, D. Adhesion of spheres: The JKR-DMT transition using a dugdale model. Journal of Colloid and Interface Science. 150 (1), 243-269 (1992).
- Muller, V. M., Yushchenko, V. S., Derjaguin, B. V. On the influence of molecular forces on the deformation of an elastic sphere and its sticking to a rigid plane. Journal of Colloid and Interface Science. 77 (1), 91-101 (1980).
- Muller, V. M., Yushchenko, V. S., Derjaguin, B. V. General theoretical consideration of the influence of surface forces on contact deformations and the reciprocal adhesion of elastic spherical particles. Journal of Colloid and Interface Science. 92 (1), 92-101 (1983).
- Johnson, K. L., Greenwood, J. A. An adhesion map for the contact of elastic spheres. Journal of Colloid and Interface Science. 192 (2), 326-333 (1997).
- Shi, X., Zhao, Y. -. P. Comparison of various adhesion contact theories and the influence of dimensionless load parameter. Journal of Adhesion Science and Technology. 18 (1), 55-68 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved