Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Microscopie à force atomique Nanoindentation basée sur le porte-à-faux: mesures des propriétés mécaniques à l’échelle nanométrique dans l’air et les fluides
Dans cet article
Résumé
La quantification de la zone de contact et de la force appliquée par la pointe d’une sonde de microscope à force atomique (AFM) à une surface d’échantillon permet de déterminer les propriétés mécaniques à l’échelle nanométrique. Les meilleures pratiques pour mettre en œuvre la nanoindentation à base de porte-à-faux AFM dans l’air ou le fluide sur des échantillons mous et durs pour mesurer le module d’élasticité ou d’autres propriétés nanomécaniques sont discutées.
Résumé
Un microscope à force atomique (AFM) mesure fondamentalement l’interaction entre la pointe d’une sonde AFM à l’échelle nanométrique et la surface de l’échantillon. Si la force appliquée par la pointe de la sonde et sa zone de contact avec l’échantillon peuvent être quantifiées, il est possible de déterminer les propriétés mécaniques à l’échelle nanométrique (par exemple, élastique ou module de Young) de la surface sondée. Une procédure détaillée pour effectuer des expériences quantitatives de nanoindentation AFM basées sur le porte-à-faux est fournie ici, avec des exemples représentatifs de la façon dont la technique peut être appliquée pour déterminer les modules élastiques d’une grande variété de types d’échantillons, allant de kPa à GPa. Il s’agit notamment de cellules souches mésenchymateuses vivantes (CSM) et de noyaux dans un tampon physiologique, de sections transversales de pin loblolly déshydraté incorporées dans la résine et de schistes de Bakken de composition variable.
De plus, la nanoindentation en porte-à-faux AFM est utilisée pour sonder la résistance à la rupture (c’est-à-dire la force de percée) des bicouches phospholipidiques. D’importantes considérations pratiques telles que le choix et le développement de la méthode, la sélection et l’étalonnage de la sonde, l’identification de la région d’intérêt, l’hétérogénéité de l’échantillon, la taille et le rapport d’aspect des caractéristiques, l’usure de la pointe, la rugosité de surface et l’analyse des données et les statistiques de mesure sont discutées pour faciliter la mise en œuvre correcte de la technique. Enfin, la colocalisation de cartes nanomécaniques dérivées de l’AFM avec des techniques de microscopie électronique qui fournissent des informations supplémentaires sur la composition élémentaire est démontrée.
Introduction
Comprendre les propriétés mécaniques des matériaux est l’une des tâches les plus fondamentales et essentielles de l’ingénierie. Pour l’analyse des propriétés des matériaux en vrac, il existe de nombreuses méthodes pour caractériser les propriétés mécaniques des systèmes de matériaux, y compris les essais de traction1, les essais de compression2 et les essais de flexion à trois ou quatre points (flexion)3. Bien que ces tests à l’échelle microscopique puissent fournir des informations précieuses sur les propriétés des matériaux en vrac, ils sont généralement effectués jusqu’à la défaillance et sont donc destructeurs. De plus, ils n’ont pas la résolution spatiale nécessaire pour étudier avec précision les propriétés à l’échelle micro et nanométrique de nombreux systèmes de matériaux qui présentent un intérêt aujourd’hui, tels que les couches minces, les matériaux biologiques et les nanocomposites. Pour commencer à résoudre certains des problèmes liés aux essais mécaniques à grande échelle, principalement sa nature destructive, les essais de microdureté ont été adoptés à partir de la minéralogie. La dureté est une mesure de la résistance d’un matériau à la déformation plastique dans des conditions spécifiques. En général, les tests de microdureté utilisent une sonde rigide, généralement en acier trempé ou en diamant, pour s’indenter dans un matériau. La profondeur et/ou la surface d’indentation résultante peuvent ensuite être utilisées pour déterminer la dureté. Plusieurs méthodes ont été développées, y compris la dureté Vickers4, Knoop5 et Brinell6 ; Chacun fournit une mesure de la dureté du matériau à l’échelle microscopique, mais dans des conditions et des définitions différentes, et ne produit donc que des données qui peuvent être comparées à des essais effectués dans les mêmes conditions.
La nanoindentation instrumentée a été développée pour améliorer les valeurs relatives obtenues via les différentes méthodes d’essai de microdureté, améliorer la résolution spatiale possible pour l’analyse des propriétés mécaniques et permettre l’analyse des couches minces. Il est important de noter qu’en utilisant la méthode développée pour la première fois par Oliver et Pharr7, l’élastique ou le module de Young, E, d’un matériau échantillon peut être déterminé par nanoindentation instrumentée. En outre, en utilisant une sonde de nanopénétrateur pyramidal à trois côtés Berkovich (dont la fonction d’aire de pointe idéale correspond à celle de la sonde pyramidale à quatre côtés Vickers)8, il est possible d’effectuer une comparaison directe entre les mesures de dureté à l’échelle nanométrique et à l’échelle microscopique plus traditionnelles. Avec la popularité croissante de l’AFM, la nanoindentation à base de porte-à-faux AFM a également commencé à attirer l’attention, en particulier pour mesurer les propriétés mécaniques des matériaux plus mous. En conséquence, comme illustré schématiquement à la figure 1, les deux techniques les plus couramment utilisées aujourd’hui pour interroger et quantifier les propriétés mécaniques à l’échelle nanométrique sont la nanoindentation instrumentée (Figure 1A) et la nanoindentation en porte-à-faux AFM (Figure 1B)9, cette dernière étant au centre de ce travail.
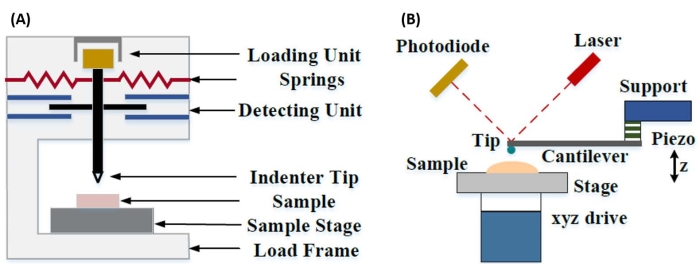
Figure 1 : Comparaison des systèmes instrumentés et des systèmes de nanoindentation en porte-à-faux AFM. Diagrammes schématiques illustrant des systèmes typiques pour la conduite (A) de nanoindentation instrumentée et (B) de nanoindentation en porte-à-faux AFM. Ce chiffre a été modifié à partir de Qian et al.51. Abréviation : AFM = microscopie à force atomique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La nanoindentation instrumentée et la nanoindentation en porte-à-faux AFM utilisent une sonde rigide pour déformer une surface d’échantillon d’intérêt et surveiller la force et le déplacement résultants en fonction du temps. En règle générale, le profil de déplacement de la charge souhaitée (c’est-à-dire la force) ou le profil de déplacement (Z-piézo) est spécifié par l’utilisateur via l’interface du logiciel et directement contrôlé par l’instrument, tandis que l’autre paramètre est mesuré. La propriété mécanique la plus souvent obtenue à partir d’expériences de nanoindentation est le module élastique (E), également appelé module de Young, qui a des unités de pression. Le module d’élasticité d’un matériau est une propriété fondamentale relative à la rigidité de liaison et est défini comme le rapport de la contrainte de traction ou de compression (σ, la force appliquée par unité de surface) à la déformation axiale (ε, la déformation proportionnelle le long de l’axe d’indentation) pendant la déformation élastique (c’est-à-dire réversible ou temporaire) avant le début de la déformation plastique (équation [1]):
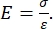 (1)
(1)
Il convient de noter que, parce que de nombreux matériaux (en particulier les tissus biologiques) sont en fait viscoélastiques, en réalité, le module (dynamique ou complexe) est constitué à la fois de composants élastiques (stockage, en phase) et visqueux (perte, déphasés). Dans la pratique, ce qui est mesuré dans une expérience de nanoindentation est le module réduit, E *, qui est lié au véritable module d’intérêt de l’échantillon, E, comme le montre l’équation (2):
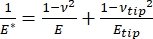 (2)
(2)
Où E pointe et ν pointe sont respectivement le module d’élasticité et le rapport de Poisson de la pointe nanopénétreur, et ν est le rapport de Poisson estimé de l’échantillon. Le rapport de Poisson est le rapport négatif de la déformation transversale à la déformation axiale, et indique donc le degré d’allongement transversal d’un échantillon lorsqu’il est soumis à une déformation axiale (par exemple, pendant la charge de nanoindentation), comme le montre l’équation (3):
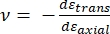 (3)
(3)
La conversion du module réduit au module réel est nécessaire parce que a) une partie de la déformation axiale conférée par la pointe du pénétrateur peut être convertie en déformation transversale (c’est-à-dire que l’échantillon peut se déformer par expansion ou contraction perpendiculairement à la direction de chargement), et b) la pointe du pénétrateur n’est pas infiniment dure, et donc l’acte d’indenter l’échantillon entraîne une certaine (petite) déformation de la pointe. Notez que dans le cas où la pointe E >> E (c’est-à-dire que la pointe du pénétrateur est beaucoup plus dure que l’échantillon, ce qui est souvent vrai lors de l’utilisation d’une sonde en diamant), la relation entre le module d’échantillon réduit et réel se simplifie grandement à E ≈ E*(1 - v2). Alors que la nanoindentation instrumentée est supérieure en termes de caractérisation précise de la force et de plage dynamique, la nanoindentation en porte-à-faux AFM est plus rapide, fournit des ordres de grandeur plus de force et de sensibilité au déplacement, permet une imagerie à plus haute résolution et une localisation améliorée de l’indentation, et peut sonder simultanément les propriétés magnétiques et électriques à l’échelle nanométrique9. En particulier, la nanoindentation à base de porte-à-faux AFM est supérieure pour la quantification des propriétés mécaniques à l’échelle nanométrique des matériaux mous (par exemple, polymères, gels, bicouches lipidiques et cellules ou autres matériaux biologiques), des films extrêmement minces (sub-μm) (où les effets du substrat peuvent entrer en jeu en fonction de la profondeur d’indentation)10,11 et des matériaux bidimensionnels (2D) en suspension12,13,14 tels que le graphène 15,16, mica17, nitrure de bore hexagonal (h-BN)18 ou dichalcogénures de métaux de transition (TMDC; p. ex. MoS2)19. Cela est dû à sa force exquise (sub-nN) et à sa sensibilité au déplacement (sub-nm), ce qui est important pour déterminer avec précision le point de contact initial et rester dans la région de déformation élastique.
Dans la nanoindentation en porte-à-faux AFM, le déplacement d’une sonde AFM vers la surface de l’échantillon est actionné par un élément piézoélectrique étalonné (Figure 1B), le porte-à-faux flexible finissant par se plier en raison de la force résistive ressentie au contact de la surface de l’échantillon. Cette flexion ou déviation du porte-à-faux est généralement surveillée en réfléchissant un laser à l’arrière du porte-à-faux et dans un photodétecteur (détecteur sensible à la position [PSD]). Couplé à la connaissance de la rigidité en porte-à-faux (en nN/nm) et de la sensibilité à la déflexion (en nm/V), il est possible de convertir cette déformation en porte-à-faux mesurée (en V) en force (en nN) appliquée à l’échantillon. Après contact, la différence entre le mouvement Z-piézo et la déviation en porte-à-faux donne la profondeur d’indentation de l’échantillon. Combiné à la connaissance de la fonction de zone de pointe, cela permet de calculer la surface de contact de l’échantillon de pointe. La pente des parties en contact des courbes force-distance ou force-déplacement (F-D) résultantes peut ensuite être ajustée à l’aide d’un modèle de mécanique de contact approprié (voir la section Analyse des données de la discussion) pour déterminer les propriétés nanomécaniques de l’échantillon. Bien que la nanoindentation en porte-à-faux AFM présente certains avantages distincts par rapport à la nanoindentation instrumentée décrite ci-dessus, elle présente également plusieurs défis pratiques de mise en œuvre, tels que l’étalonnage, l’usure des pointes et l’analyse des données, qui seront discutés ici. Un autre inconvénient potentiel de la nanoindentation en porte-à-faux AFM est l’hypothèse d’élasticité linéaire, car le rayon de contact et les profondeurs d’indentation doivent être beaucoup plus petits que le rayon de pénétration, ce qui peut être difficile à réaliser lorsque vous travaillez avec des sondes AFM à l’échelle nanométrique et / ou des échantillons présentant une rugosité de surface importante.
Traditionnellement, la nanoindentation a été limitée à des emplacements individuels ou à de petites expériences d’indentation de grille, dans lesquelles un emplacement souhaité (c’est-à-dire une région d’intérêt [ROI]) est sélectionné et un seul retrait contrôlé, plusieurs retraits dans un seul endroit séparés par un certain temps d’attente et / ou une grille grossière de retraits sont effectués à une vitesse de l’ordre de Hz. Cependant, les progrès récents de l’AFM permettent l’acquisition simultanée des propriétés mécaniques et de la topographie grâce à l’utilisation de modes d’imagerie basés sur des courbes de force à grande vitesse (désignés par divers noms commerciaux selon le fabricant du système), dans lesquels les courbes de force sont conduites à une vitesse de kHz sous contrôle de charge, la force maximale de l’échantillon de pointe étant utilisée comme point de consigne d’imagerie. Des méthodes point-and-shoot ont également été développées, permettant l’acquisition d’une image topographique AFM suivie d’une nanoindentation sélective ultérieure aux points d’intérêt de l’image, permettant un contrôle spatial à l’échelle nanométrique sur l’emplacement de la nanoindentation. Bien que ce ne soit pas l’objectif principal de ce travail, des exemples d’application spécifiques sélectionnés de l’imagerie basée sur la courbe de force et de la nanoindentation en porte-à-faux point-and-shoot sont présentés dans les résultats représentatifs et peuvent être utilisés conjointement avec le protocole décrit ci-dessous s’il est disponible sur la plate-forme AFM particulière utilisée. Plus précisément, ce travail décrit un protocole généralisé pour la mise en œuvre pratique de la nanoindentation AFM basée sur le porte-à-faux sur tout système AFM capable et fournit quatre exemples de cas d’utilisation (deux dans l’air, deux dans le fluide) de la technique, y compris des résultats représentatifs et une discussion approfondie des nuances, des défis et des considérations importantes pour utiliser avec succès la technique.
Protocole
REMARQUE: En raison de la grande variété de MFA disponibles dans le commerce et de la diversité des types d’échantillons et des applications qui existent pour la nanoindentation en porte-à-faux, le protocole qui suit est intentionnellement conçu pour être de nature relativement générale, en se concentrant sur les étapes partagées nécessaires pour toutes les expériences de nanoindentation basées sur le porte-à-faux, quel que soit l’instrument ou le fabricant. Pour cette raison, les auteurs supposent que le lecteur possède au moins une familiarité de base avec l’utilisation de l’instrument spécifique choisi pour effectuer une nanoindentation basée sur un porte-à-faux. Cependant, en plus du protocole général décrit ci-dessous, une procédure opérationnelle normalisée (PON) détaillée étape par étape spécifique à l’AFM et au logiciel utilisé ici (voir le tableau des matériaux), axée sur la nanoindentation en porte-à-faux d’échantillons dans un fluide, est incluse en tant que matériel supplémentaire.
1. Préparation des échantillons et configuration des instruments
- Préparez l’échantillon de manière à minimiser à la fois la rugosité de surface (idéalement à l’échelle nanométrique, ~10x moins que la profondeur d’indentation prévue) et la contamination sans altérer les propriétés mécaniques de la ou des zones d’intérêt.
- Choisir une sonde AFM appropriée pour la nanoindentation de l’échantillon prévu en fonction du milieu (c.-à-d. air ou fluide), du module attendu, de la topographie de l’échantillon et de la taille des caractéristiques pertinentes (voir les considérations relatives à la sélection de la sonde dans la discussion). Chargez la sonde sur le support de sonde (voir Tableau des matériaux) et fixez le porte-sonde à la tête de balayage AFM.
- Sélectionnez un mode de nanoindentation approprié dans le logiciel AFM qui permet à l’utilisateur de contrôler les rampes individuelles (c.-à-d. les courbes force-déplacement).
REMARQUE: Le mode spécifique diffère selon les fabricants AFM et les instruments individuels (voir les SOP fournies dans le matériel supplémentaire pour plus de détails et un exemple spécifique). - Alignez le laser à l’arrière du porte-à-faux de la sonde, à l’opposé de l’emplacement de la pointe de la sonde et dans le PSD.
REMARQUE: Voir l’exemple d’application de cellules souches mésenchymateuses pour plus de détails sur les considérations importantes lors de l’alignement du laser et de la nanoindentation dans le fluide, en particulier, éviter les débris flottants et / ou les bulles d’air, qui peuvent disperser ou réfracter le faisceau. L’optique AFM peut également devoir être ajustée pour compenser l’indice de réfraction du fluide et éviter de faire tomber la sonde lors de l’engagement de la surface.- Centrez le point de faisceau laser à l’arrière du porte-à-faux en maximisant la tension totale (Figure 2A).
- Centrer le point de faisceau laser réfléchi sur le PSD en ajustant les signaux de déviation X et Y (c.-à-d. horizontaux et verticaux) pour qu’ils soient aussi proches de zéro que possible (Figure 2A), fournissant ainsi la plage de déflexion détectable maximale pour produire une tension de sortie proportionnelle à la déviation en porte-à-faux.
- Si vous n’êtes pas certain de la topographie de l’échantillon, de la rugosité de la surface et/ou de la densité de surface (dans le cas des flocons ou des particules), effectuez une analyse topographique AFM avant toute expérience de nanoindentation pour confirmer la pertinence de l’échantillon, comme décrit à l’étape 1.1 et dans la partie de la discussion consacrée à la préparation de l’échantillon.
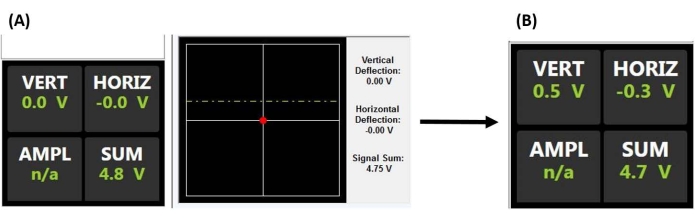
Figure 2 : Moniteur de détecteur sensible à la position. (A) Affichage PSD indiquant un laser correctement aligné se réfléchissant à l’arrière du porte-à-faux de la sonde et au centre du PSD (comme en témoignent la tension de somme élevée et l’absence de déviation verticale ou horizontale) avant de s’engager sur la surface de l’échantillon (c.-à-d. sonde hors de contact avec l’échantillon). (B) La tension de déviation verticale augmente lorsque le porte-à-faux est dévié (par exemple, lorsque la sonde entre en contact avec l’échantillon). Abréviations : PSD = détecteur sensible à la position; VERT = vertical; HORIZ = horizontal; AMPL = amplitude; s.o. = sans objet. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Calibrage de la sonde
NOTE: Trois valeurs sont nécessaires pour quantifier les propriétés mécaniques d’un échantillon à l’aide des données de courbe F-D recueillies au cours de la nanoindentation en porte-à-faux: la sensibilité à la déviation (DS) du système cantilever/PSD (nm/V ou V/nm), la constante du ressort en porte-à-faux (nN/nm) et la surface de contact de la sonde, souvent exprimée en termes de rayon effectif de pointe de la sonde (nm) à une profondeur d’indentation donnée inférieure au rayon de la sonde dans le cas d’une sonde sphérique. pourboire.
- Calibrer le DS du système sonde/AFM en rampant sur un matériau extrêmement dur (par exemple, saphir, E = 345 GPa) de sorte que la déformation de l’échantillon soit minimisée et que le mouvement Z mesuré du piézo après le début du contact pointe-échantillon soit converti uniquement en déviation en porte-à-faux.
REMARQUE: L’étalonnage DS doit être effectué dans les mêmes conditions que les expériences de nanoindentation prévues (c’est-à-dire la température, le milieu, etc.) pour refléter avec précision le DS du système pendant les expériences. Une longue période de réchauffement laser (30 minutes) peut être nécessaire pour une précision maximale permettant d’atteindre l’équilibre thermique et d’établir une puissance de sortie laser stable et une stabilité de pointage. Le DS doit être remesuré chaque fois que le laser est réaligné, même si la même sonde est utilisée, car la DS dépend de l’intensité et de la position du laser sur le porte-à-faux, ainsi que de la qualité de la réflexion de la sonde (c’est-à-dire que la dégradation du revêtement arrière de la sonde affectera la DS) et de la sensibilité du PSD20.- Configurez et effectuez les retraits d’étalonnage DS sur le saphir pour obtenir approximativement la même déviation de la sonde (en V ou nm) que les retraits d’échantillon prévus, car le déplacement mesuré est fonction de l’angle de déviation de la pointe et devient non linéaire pour les grandes flèches.
- Déterminer le DS (en nm/V), ou bien la sensibilité inverse du levier optique (en V/nm), à partir de la pente de la partie linéaire du régime en contact après le point de contact initial dans la courbe F-D résultante, comme indiqué à la figure 3A.
- Répétez la rampe au moins 5x, en enregistrant chaque valeur DS. Utilisez la moyenne des valeurs pour une précision maximale. Si l’écart type relatif (DSR) des mesures dépasse ~1%, remesurez le DS, car parfois les premières courbes F-D ne sont pas idéales en raison de l’introduction initiale des forces adhésives.
- Si la constante de ressort du porte-à-faux, k, n’est pas étalonnée en usine (par exemple, via la vibrométrie Doppler laser [LDV]), étalonnez la constante du ressort.
NOTE: La méthode de réglage thermique est optimale pour les porte-à-faux relativement mous avec k < 10 N/m (voir la section constante de ressort de la discussion pour une liste et une description des méthodes alternatives, en particulier pour les porte-à-faux rigides avec k > 10 N/m). Comme le montre la figure 3B, C, le réglage thermique est généralement intégré au logiciel de contrôle AFM.
- Si la sonde n’est pas livrée avec une mesure du rayon de pointe étalonnée en usine (par exemple, via l’imagerie au microscope électronique à balayage [MEB]), mesurez le rayon de pointe effectif, R.
REMARQUE: Il existe deux méthodes courantes pour mesurer le rayon de la pointe (voir la section de discussion correspondante), mais la plus courante pour les pointes de sonde à l’échelle nanométrique est la méthode de reconstruction de la pointe aveugle (BTR), qui utilise une norme de rugosité (voir le tableau des matériaux) contenant de nombreuses caractéristiques extrêmement nettes (sub-nm) qui servent à imager efficacement la pointe, plutôt que la pointe imageant l’échantillon.- Si vous utilisez la méthode BTR, imagez l’échantillon de rugosité (caractérisation de la pointe) en utilisant une vitesse de balayage lente (<0,5 Hz) et des gains de rétroaction élevés pour aider à optimiser le suivi des caractéristiques très nettes. Choisissez une taille d’image et une densité de pixels (résolution) en fonction du rayon de pointe attendu (par exemple, une image de 1024 x 1024 pixels d’une zone de 3 μm x 3 μm aura une résolution latérale de ~3 nm).
- Utilisez le logiciel d’analyse d’images AFM (voir le tableau des matériaux) pour modéliser la pointe de la sonde et estimer son rayon d’extrémité et son diamètre effectif à la profondeur d’indentation prévue de l’échantillon, comme illustré à la figure 3D-F.
- Une fois l’étalonnage de la sonde terminé, entrez les valeurs DS, k et R dans le logiciel de l’instrument, comme illustré à la figure 4A.
- Entrez une estimation du rapport de Poisson de l’échantillon, ν, pour permettre la conversion du module réduit mesuré en module réel de l’échantillon9. Si vous utilisez un modèle de mécanique de contact conique ou conisphérique basé sur la forme de la pointe et la profondeur d’indentation, il est également nécessaire d’entrer le demi-angle de la pointe (Figure 4C).
REMARQUE : Le module est relativement insensible aux petites erreurs ou incertitudes dans le ratio de Poisson estimé. Une estimation de ν = 0,2-0,3 est un bon point de départ pour de nombreux matériaux21.
- Entrez une estimation du rapport de Poisson de l’échantillon, ν, pour permettre la conversion du module réduit mesuré en module réel de l’échantillon9. Si vous utilisez un modèle de mécanique de contact conique ou conisphérique basé sur la forme de la pointe et la profondeur d’indentation, il est également nécessaire d’entrer le demi-angle de la pointe (Figure 4C).

Figure 3 : Calibrage de la sonde. (A) Détermination de la sensibilité à la déflexion. Résultat d’une mesure représentative de la sensibilité à la déflexion effectuée sur un substrat saphir (E = 345 GPa) pour une sonde standard en mode de taraudage (nominal k = 42 N/m ; voir tableau des matériaux) avec un revêtement en aluminium réfléchissant à l’arrière. Les courbes d’approche mesurée (trace bleue) et de retrait (trace rouge) sont représentées. La sensibilité de déviation mesurée de 59,16 nm/V a été déterminée en ajustant la courbe d’approche entre les points d’encliquetage au contact et de retournement, comme l’indique la région située entre les lignes rouges pointillées verticales. La région de déformation négative évidente dans la courbe de retrait/retrait avant le retrait de la surface indique l’adhérence de l’échantillon de pointe. (B,C) Réglage thermique. Spectres de bruit thermique en porte-à-faux représentatifs (traces bleues) avec ajustements correspondants (traces rouges) pour deux sondes différentes. (B) Paramètres de réglage thermique et d’ajustement pour une sonde d’imagerie AFM basée sur une courbe de force standard (voir le tableau des matériaux) avec sa constante nominale de ressort k = 0,4 N/m utilisée comme estimation initiale. L’ajustement du spectre de bruit thermique en porte-à-faux donne une fréquence de résonance fondamentale de f 0 = 79,8 kHz, ce qui est raisonnablement en accord avec la valeur nominale de f0 = 70 kHz. Le facteur Q mesuré est de 58,1. La qualité de l’ajustement (R2 = 0,99) est basée sur l’accord de l’ajustement avec les données entre les deux lignes rouges pointillées verticales. Notez qu’il est important de connaître et d’entrer à la fois la température ambiante et la sensibilité à la déflexion pour des résultats précis. (C) Spectre de bruit thermique en porte-à-faux et ajustement correspondant (c’est-à-dire réglage thermique) avec constante de ressort calculée résultante k = 0,105 N/m pour un porte-à-faux extrêmement mou utilisé pour effectuer des mesures nanomécaniques sur des cellules vivantes et des noyaux isolés. Notez la fréquence de résonance naturelle significativement plus faible de ~2-3 kHz. (D-F) Reconstruction de l’extrémité aveugle. Flux de travail représentatif de reconstruction de l’extrémité aveugle pour une sonde à pointe diamantée (nominal R = 40 nm; voir Tableau des matériaux). (D) Image de 5 μm x 5 μm d’un échantillon de caractérisation de la pointe constitué d’une série de pointes de titane extrêmement nettes (inférieures au nm) qui servent à imager l’extrémité de la sonde AFM. (E) Modèle reconstruit résultant (image de hauteur inversée) de la pointe de la sonde. (F) Résultats de l’ajustement de la reconstruction de l’extrémité aveugle, y compris un rayon d’extrémité estimé de R = 29 nm et un diamètre effectif de l’extrémité de 40 nm à une hauteur choisie par l’utilisateur de 8 nm (c.-à-d. profondeur d’indentation << R) à partir du sommet de la pointe, calculés en convertissant la zone de contact de l’échantillon de pointe à cette hauteur en un diamètre effectif en supposant un profil circulaire (c.-à-d. A = πr 2 = π(d/2)2) pour une utilisation avec des modèles de mécanique de contact sphérique. Abréviations : AFM = microscopie à force atomique; ETD = diamètre effectif de la pointe. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Entrées de l’interface logicielle. (A) Constantes d’étalonnage de la sonde. Interface utilisateur du logiciel (voir Tableau des matériaux) pour entrer la sensibilité de déflexion mesurée, la constante de ressort et le rayon de pointe pour permettre des mesures nanomécaniques quantitatives. Le rapport de Poisson de la sonde et de l’échantillon est nécessaire pour calculer l’élasticité ou le module de Young de l’échantillon à partir des courbes de force de nanoindentation basées sur le porte-à-faux. (B) Fenêtre de contrôle de la rampe. Interface utilisateur du logiciel (voir le tableau des matériaux) pour la mise en place d’expériences de nanoindentation basées sur le porte-à-faux, organisées en paramètres décrivant la rampe elle-même (c.-à-d. profil d’indentation), déclenchement de l’instrument (par exemple, contrôle de la force par rapport au déplacement), analyse de force ultérieure et limites de mouvement (pour améliorer la sensibilité de mesure en réduisant la plage sur laquelle le convertisseur A/N doit fonctionner pour contrôler le piézo Z et lire la déviation PSD). (C) Le demi-angle de pointe (basé sur la géométrie de la sonde ou la mesure directe) est important si un modèle de mécanique de contact conique, pyramidale ou conishérique (par exemple, Sneddon) est utilisé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Recueillir des données sur le déplacement de force (F-D)
REMARQUE : Les valeurs des paramètres présentées ici (voir la figure 4B) peuvent varier en fonction de la force et de la plage d’indentation pour un échantillon donné.
- Parcourez l’échantillon sous la tête AFM et engagez-vous sur la région d’intérêt souhaitée.
- Surveillez le signal de déviation verticale (figure 2B) ou effectuez une petite rampe initiale (~50-200 nm) (figure 4B) pour vérifier que la pointe et l’échantillon sont en contact (voir la figure 5A).
- Ajustez la position de la tête AFM légèrement vers le haut (par pas correspondant à ~50% de la taille totale de la rampe) et rampez à nouveau. Répéter l’opération jusqu’à ce que la pointe et l’échantillon soient juste hors de contact, comme en témoignent une rampe presque plate (figure 5B) et une déviation verticale minimale du porte-à-faux (figure 2A).
- Lorsqu’aucune interaction évidente entre la pointe et l’échantillon n’est présente (comparer la figure 2A et la figure 2B), abaissez la tête AFM d’une quantité correspondant à ~50%-100% de la taille de la rampe pour vous assurer que la pointe de la sonde ne s’écrasera pas dans l’échantillon lors du déplacement manuel de la tête AFM. Ramper à nouveau, en répétant jusqu’à ce qu’on observe une bonne courbe (figure 5D) ou une courbe semblable à la figure 5C. Dans ce dernier cas, effectuez un petit réglage supplémentaire de la hauteur AFM égal à ~20%-50% de la taille de la rampe pour obtenir un bon contact et une courbe de force similaire à celle illustrée à la figure 5D.
- Ajustez les paramètres de rampe (comme décrit ci-dessous et illustré dans Graphique 4B) afin d’optimiser l’instrument, la sonde et l’échantillon, et d’obtenir des rampes semblables à celles illustrées dans Graphique 5D.
- Choisir une taille de rampe appropriée (c.-à-d. mouvement Z-piézo total à travers un cycle de rampe) en fonction de l’échantillon (p. ex. épaisseur, module prévu, rugosité de surface) et de la profondeur d’indentation souhaitée.
NOTE: Pour les échantillons plus rigides, moins de déformation de l’échantillon (et donc plus de déviation de la sonde pour un mouvement Z-piézo donné) est susceptible de se produire, de sorte que la taille de la rampe peut généralement être plus petite que pour les échantillons plus mous. La taille typique des rampes pour les échantillons rigides et les porte-à-faux peut être de plusieurs dizaines de nm, tandis que pour les échantillons mous et les porte-à-faux, les rampes peuvent être de plusieurs centaines de nm à quelques μm; Des exemples d’application spécifiques sélectionnés sont présentés dans la section Résultats représentatifs. Notez que les tailles de rampe minimales et maximales possibles dépendent des instruments. - Sélectionnez un taux de rampe approprié (1 Hz est un bon point de départ pour la plupart des échantillons).
NOTA : Le taux de rampe peut être limité par les vitesses et les largeurs de bande électroniques de contrôle et/ou de détection. En combinaison avec la taille de la rampe, le taux de rampe détermine la vitesse de pointe. La vitesse de pointe est particulièrement importante à prendre en compte lors de l’indentation de matériaux mous où des effets viscoélastiques peuvent provoquer des artefacts d’hystérésis 9,22. - Choisissez d’utiliser une rampe déclenchée (à charge contrôlée) ou non déclenchée (à déplacement contrôlé).
REMARQUE : Dans une rampe déclenchée, le système s’approche de l’échantillon par étapes définies par l’utilisateur (en fonction de la taille et de la résolution de la rampe ou du nombre de points de données) jusqu’à ce que le seuil de déclenchement souhaité (c.-à-d. force de consigne ou déviation en porte-à-faux) soit détecté, après quoi le système se rétracte à sa position initiale et affiche la courbe F-D. Dans une rampe non déclenchée, le système étend simplement le Z-piézo la distance spécifiée par la taille de rampe définie par l’utilisateur et affiche la courbe F-D mesurée. Les rampes déclenchées sont préférées pour la plupart des cas d’utilisation, mais les rampes non déclenchées peuvent être utiles lors de l’étude de matériaux mous qui ne présentent pas de point de contact pointu et facilement identifiable.- Si une rampe déclenchée est choisie, définissez le seuil de déclenchement (force maximale autorisée définie par l’utilisateur ou déviation de la rampe) pour obtenir l’indentation souhaitée dans l’échantillon.
REMARQUE : L’utilisation d’un seuil de déclenchement signifie qu’une rampe peut se terminer (c.-à-d. que la sonde peut commencer à se rétracter) avant d’atteindre la taille complète de la rampe (extension Z-piézo) spécifiée. Les valeurs peuvent varier de quelques nN à quelques μN, selon le système d’échantillonnage de pointe. - Définissez la position de la rampe pour déterminer la partie de la portée maximale du Z-piézo qui sera utilisée pour exécuter la rampe. S’assurer que la plage totale de la taille de la rampe ne commence pas ou ne se termine pas en dehors de la plage Z-piézo maximale (voir les exemples représentatifs à la figure 6), sinon une partie de la courbe F-D ne représentera aucune mesure physique (c.-à-d. que le Z-piézo sera complètement étendu ou rétracté, sans bouger).
- Si une rampe déclenchée est choisie, définissez le seuil de déclenchement (force maximale autorisée définie par l’utilisateur ou déviation de la rampe) pour obtenir l’indentation souhaitée dans l’échantillon.
- Définir le nombre d’échantillons/rampe (p. ex., 512 échantillons/rampe ) pour obtenir la résolution souhaitée de la mesure (c.-à-d. densité ponctuelle de la courbe F-D).
REMARQUE : Le nombre maximal d’échantillons/rampes peut être limité par des contraintes logicielles (taille du fichier) ou matérielles (p. ex., vitesse de conversion analogique-numérique, selon le taux de rampe). Il est également possible de limiter la plage Z-piézo ou de déviation admissible (voir les paramètres limites à la figure 4B) pour augmenter la résolution effective du convertisseur A/N du système. - Réglez la rotation X pour réduire les forces de cisaillement sur l’échantillon et la pointe en déplaçant simultanément la sonde légèrement dans la direction X (parallèle au porte-à-faux) tout en indentant dans la direction Z (perpendiculaire au porte-à-faux). Utilisez une valeur pour la rotation X égale à l’angle de décalage du porte-sonde par rapport à la normale de surface (12° est typique).
REMARQUE: La rotation X est nécessaire car le porte-à-faux est monté dans le support de sonde à un petit angle par rapport à la surface pour permettre au faisceau laser incident de se réfléchir dans le PSD. De plus, les angles avant et arrière de la pointe de la sonde peuvent différer les uns des autres (c.-à-d. que la pointe de la sonde peut être asymétrique). Des informations plus spécifiques peuvent être obtenues auprès des fabricants individuels de sondes et d’AFM.
- Choisir une taille de rampe appropriée (c.-à-d. mouvement Z-piézo total à travers un cycle de rampe) en fonction de l’échantillon (p. ex. épaisseur, module prévu, rugosité de surface) et de la profondeur d’indentation souhaitée.
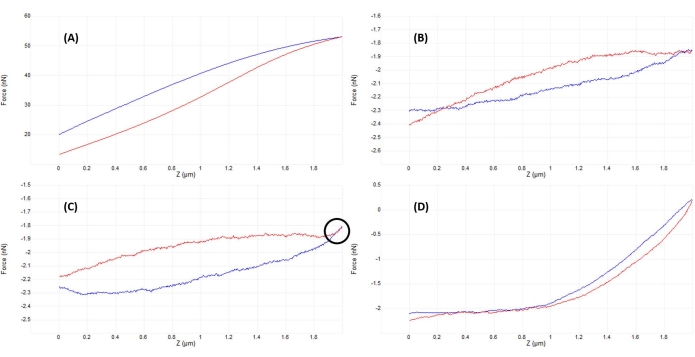
Figure 5 : Optimisation de la séparation pointe-échantillon après engagement pour obtenir de bonnes courbes de force. Exemples séquentiels de courbes représentatives force-déplacement obtenues lors de l’indentation dans un fluide (solution saline tamponnée au phosphate) sur un noyau de cellules souches mésenchymateuses vivantes avec un cantilever étalonné en nitrure de silicium mou étalonné (nominal k = 0,04 N/m) se terminant par une pointe hémisphérique de rayon de 5 μm (voir le tableau des matériaux). Des courbes ont été obtenues dans le processus d’engagement de la surface de la cellule et d’optimisation des paramètres d’indentation, avec l’approche de la sonde indiquée en bleu et la rétraction/retrait en rouge. (A) La pointe est déjà engagée et en contact avec l’échantillon avant le début de la rampe, ce qui entraîne une déviation et des forces en porte-à-faux importantes, sans ligne de base plate avant contact. (B) Après avoir éloigné manuellement l’extrémité suffisamment loin de l’échantillon, une rampe non déclenchée de 2 μm donne une courbe F-D presque plate (c.-à-d. pratiquement aucun changement de force). Dans des conditions ambiantes, la courbe serait plus plate, mais dans un fluide, la viscosité du milieu peut provoquer de légères déviations du porte-à-faux de la sonde lors d’une rampe comme on le voit ici, même sans contact de surface. (C) Après s’être approché un peu plus près de la surface avant le début de la rampe, les courbes d’approche et de retrait montrent une légère augmentation de la force (pente accrue) près du point de retournement de la rampe (c.-à-d. transition de l’approche à la retrait). Le signe révélateur à rechercher est que les courbes d’approche (bleu) et de retrait (rouge) commencent à se chevaucher (région indiquée par le cercle noir), ce qui indique une interaction physique avec la surface. (D) Courbe F-D idéale acquise après optimisation des paramètres de rampe et s’approchant légèrement (~1 μm) plus près de la surface de la cellule qu’en C de sorte que la sonde passe environ la moitié de la rampe en contact avec la cellule, permettant une déformation suffisante pour s’adapter à la partie de contact de la courbe d’approche et déterminer le module d’élasticité. La ligne de base relativement longue, plate et peu bruyante facilite la détermination du point de contact par l’algorithme d’ajustement. Abréviation : F-D = force-déplacement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
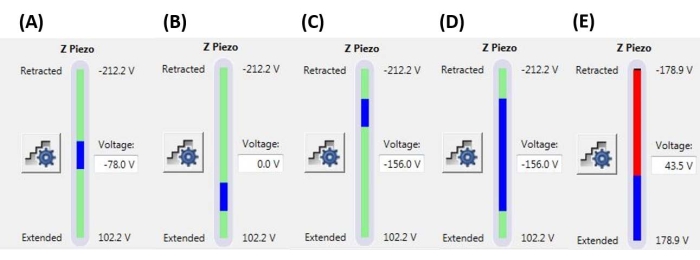
Figure 6 : Taille et position de la rampe. Moniteur Z-piézo montrant l’étendue de la rampe (barre bleue) par rapport à la plage totale de mouvement Z-piézo disponible (barre verte). (A) La position Z-piézo est proche du milieu de son amplitude de mouvement, comme l’indique à la fois la barre bleue située approximativement au milieu de la barre verte et la tension Z-piézo actuelle (-78,0 V) se situant approximativement entre ses valeurs complètement rétractées (-212,2 V) et étendues (+102,2 V). (B) Z-piézo est étendu par rapport à A, sans tension de polarisation appliquée. (C) Z-piézo est rétracté par rapport à A et B. (D) La position Z-piézo est la même qu’en C à -156,0 V, mais la taille de la rampe a été augmentée par rapport à A-C pour tirer parti d’une plus grande partie de l’amplitude de mouvement complète du Z-piézo. € La taille de la rampe est trop grande pour la position actuelle de la rampe, ce qui entraîne l’extension du Z-piézo jusqu’à la fin de sa gamme. Cela entraînera l’aplatissement de la courbe F-D car le système ne peut pas étendre davantage le piézo Z. Abréviation : F-D = force-déplacement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Analyse de la courbe F-D
- Choisissez un progiciel d’analyse de données approprié. Sélectionnez et chargez les données à analyser.
REMARQUE: De nombreux fabricants AFM et logiciels de traitement d’images AFM ont une prise en charge intégrée pour l’analyse de courbe F-D. Alternativement, la flexibilité et les fonctionnalités accrues d’un progiciel d’analyse de courbe F-D dédié, tel que le progiciel open source AtomicJ, peuvent être bénéfiques23, en particulier pour le traitement par lots et l’analyse statistique de grands ensembles de données ou la mise en œuvre de modèles complexes de mécanique de contact. - Valeurs étalonnées d’entrée pour la constante de ressort, DS et le rayon de pointe de la sonde, ainsi que des estimations du module de Young et du rapport de Poisson pour la pointe de la sonde (en fonction de sa composition matérielle) et du rapport de Poisson de l’échantillon.
REMARQUE: Si vous utilisez un pénétrateur à pointe de diamant, les valeurs E tip = 1140 GPa et ν tip = 0.07 peuvent être utilisées21,24,25,26. Pour une sonde de silicium standard, la pointe E = 170 GPa et lapointe ν = 0,27 peuvent généralement être utilisées, bien que le module de Young du silicium varie en fonction de l’orientation cristallographique27. - Choisissez un modèle de mécanique de contact de nanoindentation approprié pour la pointe et l’échantillon.
REMARQUE : Pour les nombreux modèles de pointes sphériques courants (par exemple, Hertz, Maugis, DMT, JKR), il est impératif que la profondeur d’indentation dans l’échantillon soit inférieure au rayon de la pointe; sinon la géométrie sphérique de la pointe de la sonde cède la place à une forme conique ou pyramidale (Figure 4C). Pour les modèles coniques (p. ex., Sneddon28) et pyramidaux, le demi-angle de la pointe (c.-à-d. l’angle entre la paroi latérale de la pointe et une ligne bissectaire perpendiculaire à l’extrémité de la pointe; Figure 4C) doit être connu et est généralement disponible auprès du fabricant de la sonde. Pour plus d’informations sur les modèles de mécanique de contact, veuillez consulter la section Analyse des données de thedDiscussion. - Exécutez l’algorithme d’ajustement. Vérifier le bon ajustement des courbes F-D; une faible erreur résiduelle correspondant à une moyenne deR2 proche de l’unité (par exemple, R2 > 0,9) indique généralement un bon ajustement au modèle choisi29,30. Vérifiez ponctuellement les courbes individuelles pour inspecter visuellement la courbe, l’ajustement du modèle et les points de contact calculés si vous le souhaitez (p. ex., voir la figure 7 et la section Analyse des données de la discussion).
Résultats
Courbes force-déplacement
La figure 7 montre des courbes F-D représentatives et presque idéales obtenues à partir d’expériences de nanoindentation réalisées dans l’air sur des échantillons de pin loblolly incorporés dans de la résine (figure 7A) et dans un fluide (solution saline tamponnée au phosphate [PBS]) sur des noyaux de cellules souches mésenchymateuses (CSM) (figure 7B). L’utilisation de...
Discussion
Préparation des échantillons
Pour la nanoindentation dans l’air, les méthodes de préparation courantes comprennent la cryosectionnement (p. ex., échantillons de tissus), le broyage et/ou le polissage suivi d’un ultramicrotoming (p. ex., échantillons biologiques incorporés dans la résine), le broyage ionique ou la préparation par faisceau d’ions focalisés (p. ex. échantillons semi-conducteurs, poreux ou de dureté mixte ne se prêtant pas au polissage), le polissage mécanique ou élec...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Toutes les expériences AFM ont été réalisées au Boise State University Surface Science Laboratory (SSL). La caractérisation SEM a été réalisée au Boise State Center for Materials Characterization (BSCMC). Les recherches rapportées dans cette publication concernant les matières premières de biocarburants ont été soutenues en partie par le Département de l’énergie des États-Unis, l’Office of Energy Efficiency and Renewable Energy, le Bioenergy Technologies Office dans le cadre du Feedstock Conversion Interface Consortium (FCIC) et dans le cadre du contrat DE-AC07-051ID14517 du Bureau des opérations du DOE de l’Idaho. Les études sur la mécanique cellulaire ont été financées par les National Institutes of Health (États-Unis) dans le cadre de subventions AG059923, AR075803 et P20GM109095, et par des subventions de la National Science Foundation (États-Unis) 1929188 et 2025505. Les travaux sur les systèmes bicouches lipidiques modèles ont été soutenus par les National Institutes of Health (États-Unis) dans le cadre de la subvention R01 EY030067. Les auteurs remercient le Dr Elton Graugnard d’avoir produit l’image composite illustrée à la figure 11.
matériels
| Name | Company | Catalog Number | Comments |
| Atomic force microscope | Bruker | Dimension Icon | Uses Nanoscope control software, including PeakForce Quantitative Nanomechanical Mapping (PF-QNM), FastForce Volume (FFV), and Point-and-Shoot Ramping experimental workspaces |
| AtomicJ | American Institute of Physics | https://doi.org/10.1063/1.4881683 | Flexible, powerful, free open source Java-based force curve analysis software package. Supports numerous contact mechanic models, such as Hertz, Sneddon DMT, JKR, Maugis, and cone or pyramid (including blunt and truncated). Also includes a variety of initial contact point estimation methods to choose from. Supports batch processing of data and subsequent statistical analysis (e.g., averages, standard deviations, histograms, goodness of fit, etc.). Literature citation is: P. Hermanowicz, M. Sarna, K. Burda, and H. Gabry , “AtomicJ: An open source software for analysis of force curves” Rev. Sci. Instrum. 85: 063703 (2014), https://doi.org/10.1063/1.4881683 , “AtomicJ: An open source software for analysis of force curves” Rev. Sci. Instrum. 85: 063703 (2014), https://doi.org/10.1063/1.4881683 |
| Buffer solution (PBS) | Fisher Chemical (NaCl), Sigma Aldrich (KCl), Fisher BioReagents (Na2HPO4 and KH2PO4) | S271 (>99% purity NaCl), P9541 (>99% purity KCl), BP332(>99% purity Na2HPO4), BP362 (>99% purity KH2PO4) | Phosphate buffered saline (PBS) was prepared in the laboratory as an aqueous solution consisting of 137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, and 1.8 mM KH2PO4 dissolved in ultrapure water. Reagents were measured out using an analytical balance, and glassware was cleaned with soap and water followed by autoclaving immediately prior to use. |
| Chloroform | |||
| Diamond tip AFM probe | Bruker | PDNISP | Pre-mounted factory-calibrated cube corner diamond (E = 1140 GPa) tip AFM probe (nominal R = 40 nm) with a stainless steel cantilever (nominal k = 225 N/m, f0 = 50 kHz). Spring constant is measured at the factory (k = 256 N/m for the probe, Serial #13435414, used here) and calibration data (including AFM images of indents showing probe geometry) is provided with the probe. |
| Diamond ultramicrotome blade | Diatome | Ultra 35° | 2.1 mm width. Also used a standard glass blade for intial rough cut of sample surface before transitioning to diamond blade for final surface preparation |
| Epoxy | Gorilla Glue | 26853-31-6 | Epoxy resin and hardner were mixed in a 1:1 ratio, a small drop was placed on a stainless steel sample puck (Ted Pella), and V1 grade muscovite mica (Ted Pella) was attached to create an atomically flat surface for preparation of phospholipid membranes. |
| Ethanol | |||
| LR white resin, medium grade (catalyzed) | Electron Microscopy Sciences | 14381 | 500 mL bottle, Lot #150629 |
| Mesenchymal stem cells (MSCs) | N/A | N/A | MSCs for nanomechanical studies were primary cells harvested from 8-10 week old male C57BL/6 mice as described in Goelzer, M. et al. "Lamin A/C Is Dispensable to Mechanical Repression of Adipogenesis" Int J Mol Sci 22: 6580 (2021) doi:10.3390/ijms22126580 and Peister, A. et al. "Adult stem cells from bone marrow (MSCs) isolated from different strains of inbred mice vary in surface epitopes, rates of proliferation, and differentiation potential" Blood 103: 1662-1668 (2004), doi:10.1182/blood-2003-09-3070. |
| Modulus standards | Bruker | PFQNM-SMPKIT-12M | Used HOPG (E = 18 GPa) and PS (E = 2.7 GPa). Also contains 2x PDMS (Tack 0, E = 2.5 MPa; Tack 4, E = 3.5 MPa), PS-LDPE (E = 2.0/0.2 GPa), fused silica (E = 72.9 GPa), sapphire (E - 345 GPa), and tip characterization (titanium roughness) sample. All samples come pre-mounted on a 12 mm diameter steel disc (sample puck). |
| Muscovite mica | Ted Pella | 50-12 | 12 mm diameter, V1 grade muscovite mica |
| Nanscope Analysis | Bruker | Version 2.0 | Free AFM image processing and analysis software package, but designed for, and proprietary/limited to Bruker AFMs; similar functionality is available from free, platform-independent AFM image processing and analysis software packages such as Gwyddion, WSxM, and others. Has built-in capabilities for force curve analysis, but AtomicJ is more flexible/full featured (e.g., more built-in contact mechanics models to choose from, statistical analysis of force curve fitting results, etc.) for force curve analysis and handles batch processing of force curves. |
| Phospholipids: POPC, Cholesterol (ovine) | Avanti Polar Lipids | POPC: CAS # 26853-31-6, Cholesterol: CAS # 57-88-5 | POPC lipid dissolved in chloroform (25 mg/mL) was obtained from vendor and used without further purification. Cholesterol powder from the same vendor was dissolved in chloroform (20 mg/mL). |
| Probe holder (fluid, lipid bilayers) | Bruker | MTFML-V2 | Specific to the particular AFM used; MTFML-V2 is a glass probe holder for scanning in fluid on a MultiMode AFM. |
| Probe holder (fluid, MSCs) | Bruker | FastScan Bio Z-scanner | Used with Dimension FastScan head (XY flexure scanners). Serial number MXYPOM5-1B154. |
| Probe holder (standard, ambient) | Bruker | DAFMCH | Specific to the particular AFM used; DAFMCH is the standard contact and tapping mode probe holder for the Dimension Icon AFM, suitable for nanoindentation (PF-QNM, FFV, and point-and-shoot ramping) |
| Sample Puck | Ted Pella | 16218 | Product number is for 15 mm diameter stainless steel sample puck. Also available in 6 mm, 10 mm, 12 mm, and 20 mm diameters at https://www.tedpella.com/AFM_html/AFM.aspx#anchor842459 |
| Sapphire substrate | Bruker | PFQNM-SMPKIT-12M | Extremely hard surface (E = 345 GPa) for measuring deflection sensitivity of probes (want all of the deflection to come from the probe, not the substrate). Part of the PF-QNM/modulus standards kit. |
| Scanning electron microscope | Hitachi | S-3400N-II | Located at Boise State. Used to perform co-localized SEM/EDS on all samples except additively manufactured (AM) Ti-6Al-4V. |
| Silicon AFM probes (standard) | NuNano | Scout 350 | Standard tapping mode silicon probe with reflective aluminum backside coating; k = 42 N/m (nominal), f0 = 350 kHz. Nominal R = 5 nm. Also available uncoated or with reflective gold backside coating. Probes with similar specifications are available from other manufacturers (e.g., Bruker TESPA-V2). |
| Silicon AFM probes (stiff) | Bruker | RTESPA-525, RTESPA-525-30 | Rotated tip etched silicon probes with reflective aluminum backside coating; k = 200 N/m (nominal), f0 = 525 kHz. Nominal R = 8 nm for RTESPA-525, R = 30 nm for RTESPA-525-30. Spring constant of each RTESPA-525-30 is measured individually at the factory via laser Doppler vibrometry and supplied with the probe. |
| Silicon carbide grit paper (abrasive discs) | Allied | 50-10005 | 120 grit |
| Silicon nitride AFM probes (soft, large radius hemispherical tip) | Bruker | MLCT-SPH-5UM, MLCT-SPH-5UM-DC | Also MLCT-SPH-1UM-DC. New product line of factory-calibrated (probe radius and spring constants of all cantilevers) large radius (R = 1 or 5 mm) hemispherical tip (at the end of a 23 mm long cylindrical shaft) probes. DC = drift compensation coating. 6 cantilevers/probe (A-F). Nominal spring constants: A, k = 0.07 N/m; B, k = 0.02 N/m; C, k = 0.01 N/m; D, k = 0.03 N/m; E, k = 0.1 N/m; F, k = 0.6 N/m. |
| Silicon nitride AFM probes (soft, medium sharp tip) | Bruker | DNP | 4 cantilevers/probe (A-d). Nominal spring constants: A, k = 0.35 N/m; B, k = 0.12 N/m; C, k = 0.24 N/m; D, k = 0.06 N/m. Nominal radii of curvature, R = 10 nm. |
| Silicon nitride AFM probes (soft, sharp tip) | Bruker | ScanAsyst-Air | Nominal values: resonance frequency, f0 = 70 kHz; spring constant, k = 0.4 N/m; radius of curvature, R = 2 nm. Designed for force curve based AFM imaging. |
| Superglue | Henkel | Loctite 495 | Cyanoacrylate based instant adhesive. Lots of roughly equivalent products are readily available. |
| Syringe pump | New Era Pump Systems | NE1000US | One channel syringe pump system with infusion and withdrawal capacity |
| Tip characterization standard | Bruker | PFQNM-SMPKIT-12M | Titanium (Ti) roughness standard. Part of the PF-QNM/modulus standards kit. |
| Ultrahigh purity nitrogen (UHP N2), 99.999% | Norco | SPG TUHPNI - T | T size compressed gas cylinder of ultrahigh purity (99.999%) nitrogen for drying samples |
| Ultramicrotome | Leica | EM UC6 | Equipped with a glass blade (standard, for intial sample preparation) and a diamond blade (for final preparation) |
| Ultrapure water | Thermo Fisher | Barnstead Nanopure Model 7146 | Model has been discontinued, but equivalent products are available. Produces ≥18.2 MΩ*cm ultrapure water with 1-5 ppb TOC (total organic content), per inline UV monitoring. Includes 0.2 µm particulate filter, ion exchange columns, and UV oxidation chamber. |
| Variable Speed Grinder | Buehler | EcoMet 3000 | Used with silicon carbide grit papers during hand polishing. |
| Vibration isolation table (active) | Herzan | TS-140 | Used with Bruker MultiMode AFM. Sits on a TMC 65-531 vibration isolation table. Bruker Dimension Icon AFM utilizes strictly passive vibration isolation (comes from manufacturer with custom acoustic hood, air table, and granite slab). |
| Vibration isolation table (passive) | TMC | 65-531 | 35" x 30" vibration isolation table with optional air damping (disabled). Used with Bruker MultiMode AFM. Herzan TS-140 "Table Stable" active vibration control table is located on top. |
Références
- Hart, E. W. Theory of the tensile test. Acta Metallurgica. 15 (2), 351-355 (1967).
- Fell, J. T., Newton, J. M. Determination of tablet strength by the diametral-compression test. Journal of Pharmaceutical Sciences. 59 (5), 688-691 (1970).
- Babiak, M., Gaff, M., Sikora, A., Hysek, &. #. 3. 5. 2. ;. Modulus of elasticity in three- and four-point bending of wood. Composite Structures. 204, 454-465 (2018).
- Song, S., Yovanovich, M. M. Relative contact pressure-Dependence on surface roughness and Vickers microhardness. Journal of Thermophysics and Heat Transfer. 2 (1), 43-47 (1988).
- Hays, C., Kendall, E. G. An analysis of Knoop microhardness. Metallography. 6 (4), 275-282 (1973).
- Hill, R., Storåkers, B., Zdunek, A. B. A theoretical study of the Brinell hardness test. Proceedings of the Royal Society of London. A. Mathematical and Physical Sciences. 423 (1865), 301-330 (1989).
- Oliver, W. C., Pharr, G. M. An improved technique for determining hardness and elastic modulus using load and displacement sensing indentation experiments. Journal of Materials Research. 7 (6), 1564-1583 (1992).
- Sakharova, N. A., Fernandes, J. V., Antunes, J. M., Oliveira, M. C. Comparison between Berkovich, Vickers and conical indentation tests: A three-dimensional numerical simulation study. International Journal of Solids and Structures. 46 (5), 1095-1104 (2009).
- Cohen, S. R., Kalfon-Cohen, E. Dynamic nanoindentation by instrumented nanoindentation and force microscopy: a comparative review. Beilstein Journal of Nanotechnology. 4 (1), 815-833 (2013).
- Saha, R., Nix, W. D. Effects of the substrate on the determination of thin film mechanical properties by nanoindentation. Acta Materialia. 50 (1), 23-38 (2002).
- Tsui, T. Y., Pharr, G. M. Substrate effects on nanoindentation mechanical property measurement of soft films on hard substrates. Journal of Materials Research. 14 (1), 292-301 (1999).
- Cao, G., Gao, H. Mechanical properties characterization of two-dimensional materials via nanoindentation experiments. Progress in Materials Science. 103, 558-595 (2019).
- Castellanos-Gomez, A., Singh, V., vander Zant, H. S. J., Steele, G. A. Mechanics of freely-suspended ultrathin layered materials. Annalen der Physik. 527 (1-2), 27-44 (2015).
- Cao, C., Sun, Y., Filleter, T. Characterizing mechanical behavior of atomically thin films: A review. Journal of Materials Research. 29 (3), 338-347 (2014).
- Lee, C., Wei, X., Kysar, J. W., Hone, J. Measurement of the elastic properties and intrinsic strength of monolayer graphene. Science. 321 (5887), 385-388 (2008).
- Elibol, K., et al. Visualising the strain distribution in suspended two-dimensional materials under local deformation. Scientific Reports. 6 (1), 28485 (2016).
- Castellanos-Gomez, A., et al. Mechanical properties of freely suspended atomically thin dielectric layers of mica. Nano Research. 5 (8), 550-557 (2012).
- Song, L., et al. Large scale growth and characterization of atomic hexagonal boron nitride layers. Nano Letters. 10 (8), 3209-3215 (2010).
- Castellanos-Gomez, A., et al. Elastic properties of freely suspended MoS2 nanosheets. Advanced Materials. 24 (6), 772-775 (2012).
- D'Costa, N. P., Hoh, J. H. Calibration of optical lever sensitivity for atomic force microscopy. Review of Scientific Instruments. 66 (10), 5096-5097 (1995).
- Wu, Y., et al. Evaluation of elastic modulus and hardness of crop stalks cell walls by nano-indentation. Bioresource Technology. 101 (8), 2867-2871 (2010).
- Barns, S., et al. Investigation of red blood cell mechanical properties using AFM indentation and coarse-grained particle method. BioMedical Engineering OnLine. 16 (1), 140 (2017).
- Hermanowicz, P., Sarna, M., Burda, K., Gabryś, H. AtomicJ: An open source software for analysis of force curves. Review of Scientific Instruments. 85 (6), 063703 (2014).
- Broitman, E. Indentation hardness measurements at macro-, micro-, and nanoscale: a critical overview. Tribology Letters. 65 (1), 23 (2016).
- Tiwari, A. . Nanomechanical Analysis of High Performance Materials. , (2015).
- Aggarwal, R. L., Ramdas, A. K. . Physical Properties of Diamond and Sapphire. , (2019).
- Boyd, E. J., Uttamchandani, D. Measurement of the anisotropy of Young's modulus in single-crystal silicon. Journal of Microelectromechanical Systems. 21 (1), 243-249 (2012).
- Harding, J. W., Sneddon, I. N. The elastic stresses produced by the indentation of the plane surface of a semi-infinite elastic solid by a rigid punch. Mathematical Proceedings of the Cambridge Philosophical Society. 41 (1), 16-26 (2008).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis-I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129 (3), 430-440 (2006).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis-II: Adhesion-influenced indentation of soft, elastic materials. Journal of Biomechanical Engineering. 129 (6), 904-912 (2007).
- Haile, S., Palmer, M., Otey, A. Potential of loblolly pine: switchgrass alley cropping for provision of biofuel feedstock. Agroforestry Systems. 90 (5), 763-771 (2016).
- Lu, X., et al. Biomass logistics analysis for large scale biofuel production: Case study of loblolly pine and switchgrass. Bioresource Technology. 183, 1-9 (2015).
- Susaeta, A., Lal, P., Alavalapati, J., Mercer, E., Carter, D. Economics of intercropping loblolly pine and switchgrass for bioenergy markets in the southeastern United States. Agroforestry Systems. 86 (2), 287-298 (2012).
- Garcia, R. Nanomechanical mapping of soft materials with the atomic force microscope: methods, theory and applications. Chemical Society Reviews. 49 (16), 5850-5884 (2020).
- Derjaguin, B. V., Muller, V. M., Toporov, Y. P. Effect of contact deformations on the adhesion of particles. Journal of Colloid and Interface Science. 53 (2), 314-326 (1975).
- Ciesielski, P. N., et al. Engineering plant cell walls: tuning lignin monomer composition for deconstructable biofuel feedstocks or resilient biomaterials. Green Chemistry. 16 (5), 2627-2635 (2014).
- Liu, K., Ostadhassan, M., Zhou, J., Gentzis, T., Rezaee, R. Nanoscale pore structure characterization of the Bakken shale in the USA. Fuel. 209, 567-578 (2017).
- Maryon, O. O., et al. Co-localizing Kelvin probe force microscopy with other microscopies and spectroscopies: selected applications in corrosion characterization of alloys. JoVE. (184), e64102 (2022).
- Eliyahu, M., Emmanuel, S., Day-Stirrat, R. J., Macaulay, C. I. Mechanical properties of organic matter in shales mapped at the nanometer scale. Marine and Petroleum Geology. 59, 294-304 (2015).
- Li, C., et al. Nanomechanical characterization of organic matter in the Bakken formation by microscopy-based method. Marine and Petroleum Geology. 96, 128-138 (2018).
- Bouzid, T., et al. The LINC complex, mechanotransduction, and mesenchymal stem cell function and fate. Journal of Biological Engineering. 13 (1), 68 (2019).
- Dupont, S., et al. Role of YAP/TAZ in mechanotransduction. Nature. 474 (7350), 179-183 (2011).
- Wang, S., et al. CCM3 is a gatekeeper in focal adhesions regulating mechanotransduction and YAP/TAZ signalling. Nature Cell Biology. 23 (7), 758-770 (2021).
- Sen, B., et al. Mechanical strain inhibits adipogenesis in mesenchymal stem cells by stimulating a durable β-catenin signal. Endocrinology. 149 (12), 6065-6075 (2008).
- Sen, B., et al. mTORC2 regulates mechanically induced cytoskeletal reorganization and lineage selection in marrow-derived mesenchymal stem cells. Journal of Bone and Mineral Research. 29 (1), 78-89 (2014).
- Sen, B., et al. Mechanically induced nuclear shuttling of β-catenin requires co-transfer of actin. Stem Cells. 40 (4), 423-434 (2022).
- Newberg, J., et al. Isolated nuclei stiffen in response to low intensity vibration. Journal of Biomechanics. 111, 110012 (2020).
- Ding, Y., Xu, G. -. K., Wang, G. -. F. On the determination of elastic moduli of cells by AFM based indentation. Scientific Reports. 7 (1), 45575 (2017).
- Khadka, N. K., Timsina, R., Rowe, E., O'Dell, M., Mainali, L. Mechanical properties of the high cholesterol-containing membrane: An AFM study. Biochimica et Biophysica Acta. Biomembranes. 1863 (8), 183625 (2021).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surface Science Reports. 61 (10), 429-444 (2006).
- Qian, L., Zhao, H. Nanoindentation of soft biological materials. Micromachines. 9 (12), 654 (2018).
- Pittenger, B., Yablon, D. Improving the accuracy of nanomechanical measurements with force-curve-based AFM techniques. Bruker Application Notes. 149, (2017).
- Vorselen, D., Kooreman, E. S., Wuite, G. J. L., Roos, W. H. Controlled tip wear on high roughness surfaces yields gradual broadening and rounding of cantilever tips. Scientific Reports. 6 (1), 36972 (2016).
- Bhaskaran, H., et al. Ultralow nanoscale wear through atom-by-atom attrition in silicon-containing diamond-like carbon. Nature Nanotechnology. 5 (3), 181-185 (2010).
- Giannazzo, F., Schilirò, E., Greco, G., Roccaforte, F. Conductive atomic force microscopy of semiconducting transition metal dichalcogenides and heterostructures. Nanomaterials. 10 (4), 803 (2020).
- Melitz, W., Shen, J., Kummel, A. C., Lee, S. Kelvin probe force microscopy and its application. Surface Science Reports. 66 (1), 1-27 (2011).
- Kazakova, O., et al. Frontiers of magnetic force microscopy. Journal of Applied Physics. 125 (6), 060901 (2019).
- Kim, H. -. J., Yoo, S. -. S., Kim, D. -. E. Nano-scale wear: A review. International Journal of Precision Engineering and Manufacturing. 13 (9), 1709-1718 (2012).
- Heath, G. R., et al. Localization atomic force microscopy. Nature. 594 (7863), 385-390 (2021).
- Strahlendorff, T., Dai, G., Bergmann, D., Tutsch, R. Tip wear and tip breakage in high-speed atomic force microscopes. Ultramicroscopy. 201, 28-37 (2019).
- Lantz, M. A., et al. Wear-resistant nanoscale silicon carbide tips for scanning probe applications. Advanced Functional Materials. 22 (8), 1639-1645 (2012).
- Khurshudov, A. G., Kato, K., Koide, H. Wear of the AFM diamond tip sliding against silicon. Wear. 203, 22-27 (1997).
- Villarrubia, J. S. Algorithms for scanned probe microscope image simulation, surface reconstruction, and tip estimation. Journal of Research of the National Institute of Standards and Technology. 102 (4), 425 (1997).
- Kain, L., et al. Calibration of colloidal probes with atomic force microscopy for micromechanical assessment. Journal of the Mechanical Behavior of Biomedical Materials. 85, 225-236 (2018).
- Slattery, A. D., Blanch, A. J., Quinton, J. S., Gibson, C. T. Accurate measurement of Atomic Force Microscope cantilever deflection excluding tip-surface contact with application to force calibration. Ultramicroscopy. 131, 46-55 (2013).
- Dobrovinskaya, E. R., Lytvynov, L. A., Pishchik, V. . Sapphire: Material, Manufacturing, Applications. , (2009).
- te Riet, J., et al. Interlaboratory round robin on cantilever calibration for AFM force spectroscopy. Ultramicroscopy. 111 (12), 1659-1669 (2011).
- Pratt, J. R., Shaw, G. A., Kumanchik, L., Burnham, N. A. Quantitative assessment of sample stiffness and sliding friction from force curves in atomic force microscopy. Journal of Applied Physics. 107 (4), 044305 (2010).
- Slattery, A. D., Blanch, A. J., Quinton, J. S., Gibson, C. T. Calibration of atomic force microscope cantilevers using standard and inverted static methods assisted by FIB-milled spatial markers. Nanotechnology. 24 (1), 015710 (2012).
- Higgins, M. J., et al. Noninvasive determination of optical lever sensitivity in atomic force microscopy. Review of Scientific Instruments. 77 (1), 013701 (2006).
- Lévy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13 (1), 33-37 (2001).
- Sikora, A. Quantitative normal force measurements by means of atomic force microscopy towards the accurate and easy spring constant determination. Nanoscience and Nanometrology. 2 (1), 8-29 (2016).
- Ohler, B. Cantilever spring constant calibration using laser Doppler vibrometry. Review of Scientific Instruments. 78 (6), 063701 (2007).
- Gates, R. S., Pratt, J. R. Accurate and precise calibration of AFM cantilever spring constants using laser Doppler vibrometry. Nanotechnology. 23 (37), 375702 (2012).
- Cleveland, J. P., Manne, S., Bocek, D., Hansma, P. K. A nondestructive method for determining the spring constant of cantilevers for scanning force microscopy. Review of Scientific Instruments. 64 (2), 403-405 (1993).
- Sader, J. E., Chon, J. W. M., Mulvaney, P. Calibration of rectangular atomic force microscope cantilevers. Review of Scientific Instruments. 70 (10), 3967-3969 (1999).
- Sader, J. E., et al. Spring constant calibration of atomic force microscope cantilevers of arbitrary shape. Review of Scientific Instruments. 83 (10), 103705 (2012).
- Sader, J. E. Frequency response of cantilever beams immersed in viscous fluids with applications to the atomic force microscope. Journal of Applied Physics. 84 (1), 64-76 (1998).
- Sader, J. E., Pacifico, J., Green, C. P., Mulvaney, P. General scaling law for stiffness measurement of small bodies with applications to the atomic force microscope. Journal of Applied Physics. 97 (12), 124903 (2005).
- Mendels, D. -. A., et al. Dynamic properties of AFM cantilevers and the calibration of their spring constants. Journal of Micromechanics and Microengineering. 16 (8), 1720-1733 (2006).
- Gao, S., Brand, U. In-situ nondestructive characterization of the normal spring constant of AFM cantilevers. Measurement Science and Technology. 25 (4), 044014 (2014).
- Gibson, C. T., Watson, G. S., Myhra, S. Determination of the spring constants of probes for force microscopy/spectroscopy. Nanotechnology. 7 (3), 259-262 (1996).
- Gates, R. S., Pratt, J. R. Prototype cantilevers for SI-traceable nanonewton force calibration. Measurement Science and Technology. 17 (10), 2852-2860 (2006).
- Neumeister, J. M., Ducker, W. A. Lateral, normal, and longitudinal spring constants of atomic force microscopy cantilevers. Review of Scientific Instruments. 65 (8), 2527-2531 (1994).
- Kim, M. S., Choi, I. M., Park, Y. K., Kang, D. I. Atomic force microscope probe calibration by use of a commercial precision balance. Measurement. 40 (7), 741-745 (2007).
- Kim, M. -. S., Choi, J. -. H., Park, Y. -. K., Kim, J. -. H. Atomic force microscope cantilever calibration device for quantified force metrology at micro- or nano-scale regime: the nano force calibrator (NFC). Metrologia. 43 (5), 389-395 (2006).
- Tian, Y., et al. A novel method and system for calibrating the spring constant of atomic force microscope cantilever based on electromagnetic actuation. Review of Scientific Instruments. 89 (12), 125119 (2018).
- Clifford, C. A., Seah, M. P. The determination of atomic force microscope cantilever spring constants via dimensional methods for nanomechanical analysis. Nanotechnology. 16 (9), 1666-1680 (2005).
- Chen, B. -. Y., Yeh, M. -. K., Tai, N. -. H. Accuracy of the spring constant of atomic force microscopy cantilevers by finite element method. Analytical Chemistry. 79 (4), 1333-1338 (2007).
- Mick, U., Eichhorn, V., Wortmann, T., Diederichs, C., Fatikow, S. Combined nanorobotic AFM/SEM system as novel toolbox for automated hybrid analysis and manipulation of nanoscale objects. 2010 IEEE International Conference on Robotics and Automation. , 4088-4093 (2010).
- Kim, M. -. S., Choi, J. -. H., Kim, J. -. H., Park, Y. -. K. Accurate determination of spring constant of atomic force microscope cantilevers and comparison with other methods. Measurement. 43 (4), 520 (2010).
- Zhang, G., Wei, Z., Ferrell, R. E. Elastic modulus and hardness of muscovite and rectorite determined by nanoindentation. Applied Clay Science. 43 (2), 271-281 (2009).
- Bobko, C. P., Ortega, J. A., Ulm, F. -. J. Comment on "Elastic modulus and hardness of muscovite and rectorite determined by nanoindentation by G. Zhang, Z. Wei and R.E. Ferrell. Applied Clay Science. 46 (4), 425-428 (2009).
- Zhang, G., Wei, Z., Ferrell, R. E. Reply to the Comment on "Elastic modulus and hardness of muscovite and rectorite determined by nanoindentation" by G. Zhang, Z. Wei and R. E. Ferrell. Applied Clay Science. 46 (4), 429-432 (2009).
- Jin, D. W., et al. Thermal stability and Young's modulus of mechanically exfoliated flexible mica. Current Applied Physics. 18 (12), 1486-1491 (2018).
- Xiao, J., et al. Anisotropic friction behaviour of highly oriented pyrolytic graphite. Carbon. 65, 53-62 (2013).
- Hertz, H. Ueber die Berührung fester elastischer Körper. Journal für die reine und angewandte Mathematik. 1882 (92), 156-171 (1882).
- Johnson, K. L., Kendall, K., Roberts, A. D., Tabor, D. Surface energy and the contact of elastic solids. Proceedings of the Royal Society of London. A. Mathematical and Physical Sciences. 324 (1558), 301-313 (1971).
- Muller, V. M., Derjaguin, B. V., Toporov, Y. P. On two methods of calculation of the force of sticking of an elastic sphere to a rigid plane. Colloids and Surfaces. 7 (3), 251-259 (1983).
- Maugis, D. Adhesion of spheres: The JKR-DMT transition using a dugdale model. Journal of Colloid and Interface Science. 150 (1), 243-269 (1992).
- Muller, V. M., Yushchenko, V. S., Derjaguin, B. V. On the influence of molecular forces on the deformation of an elastic sphere and its sticking to a rigid plane. Journal of Colloid and Interface Science. 77 (1), 91-101 (1980).
- Muller, V. M., Yushchenko, V. S., Derjaguin, B. V. General theoretical consideration of the influence of surface forces on contact deformations and the reciprocal adhesion of elastic spherical particles. Journal of Colloid and Interface Science. 92 (1), 92-101 (1983).
- Johnson, K. L., Greenwood, J. A. An adhesion map for the contact of elastic spheres. Journal of Colloid and Interface Science. 192 (2), 326-333 (1997).
- Shi, X., Zhao, Y. -. P. Comparison of various adhesion contact theories and the influence of dimensionless load parameter. Journal of Adhesion Science and Technology. 18 (1), 55-68 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon