Method Article
개별 다기능성 세포의 동시 및 순차적 사이토카인 분비를 해결하기 위한 미세유체 접근법
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 개별 인간 말초 혈액 단핵 세포의 사이토카인 분비 역학을 정량적으로 측정하기 위한 고급 미세유체 플랫폼을 설명합니다. 이 플랫폼은 예를 들어 지질다당류로 자극된 각 개별 세포에 대해 최대 3개의 사이토카인(IL-6, TNFα 및 IL-1β)을 병렬로 측정합니다.
초록
감염, 자가면역 질환, 치료에 대한 바람직하거나 불리한 면역학적 반응은 in vivo에서 복잡하고 동적인 사이토카인 반응으로 이어질 수 있습니다. 이 반응은 면역 반응을 조율하기 위해 다양한 사이토카인을 분비하는 수많은 면역 세포를 포함합니다. 그러나 다양한 세포 아형에 의한 다양한 사이토카인의 분비 역학, 양 및 동시 발생은 이를 연구할 수 있는 적절한 도구가 없기 때문에 잘 이해되지 않고 있습니다. 여기에서는 단일 세포 수준에서 병렬로 여러 사이토카인에 대한 분비 역학의 시간 분해 정량 측정을 허용하는 미세유체 액적 플랫폼을 사용하는 프로토콜에 대해 설명합니다. 이는 사이토카인 농도의 병렬 정량화를 위한 다중 면역분석과 함께 개별 세포를 미세유체 방울로 캡슐화하고, 동적 형광 이미징을 위한 고정화, 분비량과 역학을 도출하기 위한 각 이미지의 분석을 통해 가능합니다. 이 프로토콜은 기능성 자성 나노입자의 준비, 보정 실험, 세포 준비, 형광 이미징을 위해 세포와 나노입자를 액적에 캡슐화하는 방법, 지질다당류 자극 인간 말초 혈액 단핵 세포의 예를 사용하여 후속 이미지 및 데이터 분석을 설명합니다. 제시된 플랫폼은 단일 및 공동 분비 세포에 대한 뚜렷한 사이토카인 분비 행동을 식별하여 측정된 세포 샘플에서 예상되는 표현형 이질성을 특성화했습니다. 또한 분석의 모듈식 특성을 통해 다양한 단백질, 사이토카인 및 세포 샘플을 연구하기 위한 적응 및 응용이 가능하여 다양한 면역 세포 유형 간의 상호 작용과 엄격하게 조절되는 면역 반응을 형성하기 위해 동적으로 분비되는 다양한 사이토카인의 역할에 대한 더 깊은 이해로 이어질 수 있습니다. 이러한 새로운 통찰력은 면역 조절 장애에 대한 연구나 치료 및 약물 개발에서 표적 집단을 식별하는 데 특히 흥미로울 수 있습니다.
서문
감염은 종종 선천면역계와 후천면역계를 포함하는 복잡한 숙주 반응을 일으킵니다 1,2. 감염 또는 감염원의 인식에 따라, 숙주 세포는 다양한 범위의 화학요법 및 사이토카인을 생산할 수 있으며, 이는 중요한 전달자(critical communicator)로 알려진 작은 단백질이며 면역 체계의 조절제(modulatory of immune system)로 알려져 있다3. 전염증성 사이토카인은 감염 시 조기에 분비되어 면역 반응을 시작하고, 이후 항염증성 사이토카인이 분비되는데, 이는 조직 손상과 그에 따른 만성 또는 자가염증성 질환을 예방하는 데 중요합니다. 위협 제거와 조직 보호 사이의 이러한 균형은 감염 중에 다양한 기능을 발휘하는 사이토카인의 광범위한 레퍼토리로 나타나 반응을 미세 조정할 수 있습니다 4,5. 이 혼합물 내에서는 병원체와 병원체가 유도하는 신호, 조직 위치 및 병원체가 발생하는 면역 세포에 따라 고유한 서명을 관찰할 수 있습니다. 그러나 사이토카인 방출은 또한 분비 역학 및 개별 반응이 다양한 각 세포 집단에 고유한 다기능 생물학적 과정을 구성하는 것으로 보입니다. 이러한 이질성은 수년 동안 문헌에 기술되어 왔으며, 예를 들어 T세포 하위집단(T-cellsubpopulations)6,7에서 자가염증성 질환 및 중증 COVID-19 감염에 대한 조사에서 환자 내 및 환자 간 염증 마커의 기능적 다양성이 큰 것으로 나타났습니다 8,9. 최근에는 단세포 염기서열분석(single-cell sequencing)의 출현으로 이전에는 나타나지 않았던 면역 미세환경 내 하위 집단 간의 높은 가소성과 누화(crosstalk)가 부각되었으며, 이는 이러한 이질성을 포착하기 위해 단세포 분석법이 필요하다는 것을 나타냅니다10,11. 전사체를 분석하기 위한 새로운 방법이 개발되고 있지만, 단일 세포 수준에서 단백질 분비에 대한 동시, 정량 및 시간 분해 측정이 필요하기 때문에 표현형 분석은 여전히 어려운 과제입니다. 이러한 측정을 통해 레퍼토리 또는 사이토카인 패널에 대한 분비 세포 정체성, 역학 및 분비 패턴(느림/빠름, 초기/늦음, 동시/순차)을 조사할 수 있습니다. 면역 반응 중 사이토카인 방출의 역학을 정량적 및 시간적 해상도로 연구할 수 있게 함으로써 도출된 통찰력을 통해 세포 앙상블과 유도 반응을 이해할 수 있습니다.
표준 프로토콜에서 사이토카인은 일반적으로 효소 결합 면역 흡착 분석법(ELISA)을 사용하여 세포 현탁액 및 혈청의 상층액에서 검출되어 대량 분비량을 생성합니다. 벌크 측정은 각 세포에서 생성되는 사이토카인 양의 정량화를 허용하지 않으며, 이는 특히 이질적인 세포 샘플에서 두드러지는 문제입니다. 세포 내 사이토카인 염색, 효소 결합 면역스팟(ELISpot) 분석 또는 마이크로 조각 분석(예: Isoplexis)과 같은 대체 방법은 개별 세포에서 발현되는 사이토카인을 검출하지만 종말점 측정만 제공합니다12,13. 이는 배양 시간 동안 세포 분비 패턴에서 발생할 수 있는 분비 역학 및 변화가 무시된다는 것을 의미합니다. 또한 종말점 측정은 동시 사이토카인 분비와 순차적 사이토카인 분비를 구별할 수 없기 때문에 이러한 방법을 사용하여 사이토카인 분비에서 면역 세포의 동시 다기능성의 실제 범위는 불분명합니다.
단일 세포 수준14,15에서 고유한 사이토카인 분비 표현형에 대한 면역 세포를 연구하기 위해 액적 미세유체역학을 사용하여 피코리터 크기의 물리적 구획을 생성하고 처리하여 단일 세포 분리능을 달성할 수 있습니다. 이러한 구획은 수중유 에멀젼으로 구성되며 미세유체 칩(16,17)을 사용하여 생성할 수 있습니다. 실제로, 액적 기반 미세유체 분석은 단일 세포 수준에서 다양한 생물학적 시료 및 레퍼토리를 분석하고 업스트림(세포 및 시약 처리) 및 다운스트림 프로세스(단일 세포 분류, 단백질체학 또는 시퀀싱)와의 통합을 가능하게 하는 데 있어 매우 다재다능함을 보여주었습니다18,19,20,21,22. 특히, 액적 고정화를 허용하는 설정을 통해 시간 경과에 따른 단일 세포 기능을 측정할 수 있으며, 이는 단백질 분비 분석에 유용합니다18. 또한, 다중화된 정량 분석을 통합하면 이전에는 접근할 수 없었던 차원에서 공동 분비 및 다기능 면역 세포의 식별과 같은 프로세스에 대한 추가 조사를 용이하게 할 수 있습니다23,24.
이 프로토콜에서는 개별 세포에서 병렬로 최대 3개의 사이토카인의 분비를 검출, 정량화 및 시간적으로 측정하기 위한 고정화된 액적 기반 단일 세포 워크플로우를 설명합니다(17,23). 이 기술은 20,000개 이상의 세포에서 사이토카인 반응을 병렬로 모니터링할 수 있는 기능을 제공합니다.
제시된 워크플로우는 단일 면역 세포와 기능성 나노입자를 60pL 유중수(water-in-oil) 방울로 미세유체 캡슐화로 구성합니다. 관찰 챔버에서 >100,000개의 액적을 고정화하고 시간 분해 형광 현미경을 통해 각 액적과 각 사이토카인 내에서 사이토카인 분비 역학을 측정할 수 있습니다(그림 1A). 액적 내의 각 개별 세포에 대해 사이토카인 분비는 샌드위치 면역분석법으로 측정되며, 여기서 특정 포획 항체로 기능화된 자성 나노입자가 분비된 사이토카인과 결합하여 형광 표지된 검출 항체의 후속 재배치 및 결합을 유도합니다(그림 1B, C). 비드라인은 자성 나노입자를 정렬하여 형성되며, 사이토카인의 존재 하에 형광 재배치를 정량화할 수 있습니다. 여기서, 형광 재배치는 비드라인에서 발견되는 평균 형광 강도를 나머지 액적의 평균 형광 강도로 나눈 값으로 정의됩니다. 이 분석은 서로 다른 기능화된 나노입자 배치와 서로 다른 형광 채널(23)에서 표지된 각각의 검출 항체를 혼합하여 여러 사이토카인에 대해 다중화할 수 있으며, 그 결과 서로 다른 채널에서 특정 형광 재배치가 발생합니다. 맞춤형 분석 스크립트의 도움으로 형광 재배치 값을 추출할 수 있으며, 이미지를 모든 개별 세포 및 사이토카인에 대한 분비 동적 프로파일로 변환할 수 있습니다. 따라서 결과 데이터 세트는 시간 경과에 따른 정량적 분비 측정, 공동 분비 하위 집단의 식별, 분비된 양, 속도 및 사이토카인의 조합에 따른 세포 분포와 같은 수많은 판독값을 제공합니다.
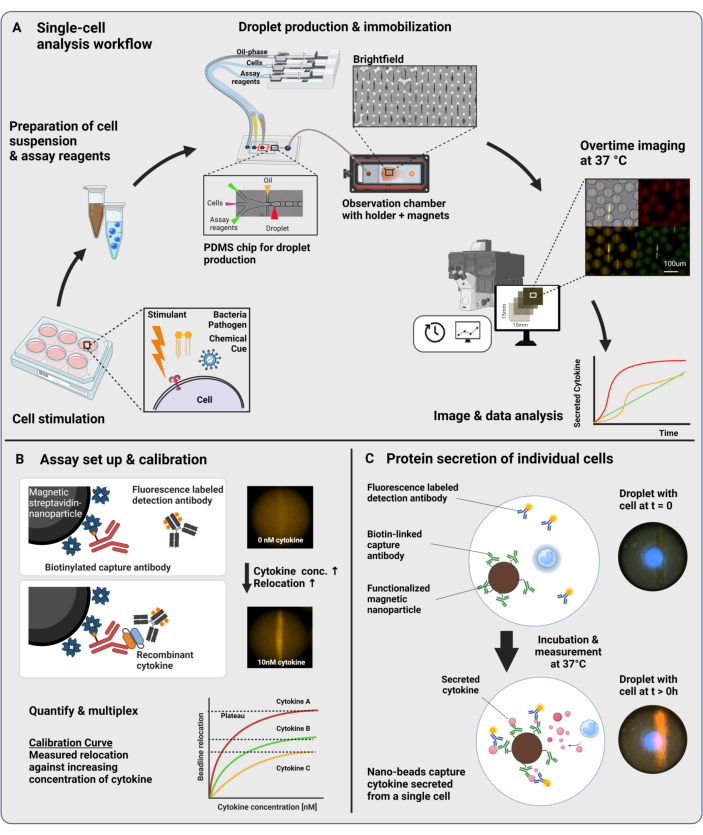
그림 1: 워크플로우 및 분석 원리. (A) 자극 후 사이토카인 분비 세포를 분석하기 위한 워크플로우 개요. 단일 세포 현탁액 및 자성 나노 입자를 준비하고 60pL 용량의 오일/물 에멀젼(액적)으로 캡슐화합니다. 액적을 고정하고 나노 입자를 자기장 내부에 정렬한 후 30분마다 최대 4시간 동안 측정합니다. 마지막으로, 이미지를 분석하고 모든 액적, 타임포인트 및 형광 채널에 대한 파라미터를 추출합니다. 이 수치는17에서 수정되었습니다. (B) 액적 샌드위치 생물학적 검정의 원리. 기능화된 나노입자는 분비된 사이토카인(cytokine)과 결합하여 형광 표지된 검출 항체를 나노입자로 재배치합니다. 이러한 형광의 재배치는 재조합 사이토카인(recombinant cytokines)으로 수행된 보정 실험을 통해 정량화되고 검증됩니다. 서로 다른 기능성 나노입자를 혼합하면 최대 3개의 사이토카인을 동시에 다중 측정할 수 있습니다. (C) 세포 기반 실험에서는 측정 시간 동안 액적을 추적하고 나노 입자에 대한 형광 재배치의 시간이 지남에 따라 증가하여 세포를 분비하는 것을 식별합니다. 회로도는 규모에 맞지 않습니다. BioRender.com 로 만든 그림입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
모든 실험은 윤리 협약 EK202-N-56에 따라 수행되었으며 ETH 취리히 윤리 위원회의 승인을 받았습니다. 인간 세포의 처리는 생물 안전 레벨 2 실험실에 포함 된 층류 캐비닛에서 수행되었습니다.
참고: 다음 섹션에서는 단일 세포 수준에서 시간 분해 사이토카인 분비를 측정하기 위한 프로토콜에 대해 자세히 설명합니다. 여기에 설명된 절차는 지질다당류(LPS)를 사용한 말초 혈액 단핵 세포(PBMC)의 자극과 사이토카인 IL-6, TNFα 및 IL-1β의 병렬 측정에 적용됩니다. 그러나 필요한 경우 프로토콜은 다른 세포 유형, 자극제 및 사이토카인에 적용할 수 있습니다.
1. 관찰 챔버 제작
참고: 이미징 중 액적의 움직임을 방지하기 위해 관찰 챔버는 액적 직경보다 약 10% 더 작은 높이로 준비됩니다.
- 절단 양면 테이프 및 상단 유리 슬라이드의 준비
- 절단 소프트웨어의 Design 탭에서 챔버 컷아웃의 원하는 디자인을 그리거나 로드합니다. 여기에 사용된 특정 치수는 그림 2E를 참조하십시오.
- 32μm 두께의 양면 접착 테이프를 테이프를 사용하여 접착 절단 매트에 고정하고 절단 매트를 자동 절단기에 넣습니다.
- 1.3단계에서 더 쉽게 분리할 수 있도록 챔버의 긴 가장자리를 같은 방향으로 자르는 데 주의하면서 테이프에서 챔버 디자인을 잘라냅니다.
- 테이프 컷아웃은 장기간 보관할 수 있도록 실온에서 보관하십시오. 단기 보관의 경우 -20 °C에서 보관하고 1.3단계 직전에 제거하십시오. 더 쉽게 다룰 수 있습니다.
- 하나의 표준 현미경 슬라이드(76mm x 26mm x 1mm) 중앙에 약 1cm 직경의 구멍 두 개를 뚫고 두 구멍 사이의 거리를 약 3.5cm로 뚫습니다.
- 유리 슬라이드의 세척 및 플라즈마 활성화
- 비누를 사용하여 구멍이 있는 유리 슬라이드와 구멍이 없는 유리 슬라이드를 청소합니다. 증류수로 잘 헹구고 보푸라기가 없는 정밀 물티슈로 말리십시오.
- 유리 슬라이드를 플라즈마 클리너에 넣고 상단 표면을 55W에서 10분 동안 플라즈마 처리합니다. 유리 슬라이드를 제거하고 1.3단계로 진행합니다.
- 챔버 어셈블리
- 플라즈마가 활성화된 면이 활성화된 표면을 건드리지 않고 깨끗한 표면에 구멍이 있는 유리 슬라이드를 놓습니다.
- 양면 접착 테이프의 한쪽 면에서 절단 방향과 동일한 방향으로 보호층을 제거합니다. 테이프 컷아웃을 유리 슬라이드의 가장자리와 드릴 구멍에 맞추지 않고 테이프를 짧은 가장자리부터 시작하여 유리 슬라이드에 천천히 접촉시킵니다.
알림: 테이프에 늘어나거나 접힌 부분이 생기면 챔버 높이가 잘못될 수 있으므로 주의하십시오. 이 단계는 오류가 발생하기 쉽고 약간의 실제 경험이 필요하므로 여러 개의 유리 슬라이드를 병렬로 준비하는 것이 좋습니다. - 테이프에서 두 번째 보호 층을 다시 절단 방향으로 제거하고 활성화된 표면이 아래를 향하도록 구멍이 없는 두 번째 유리 슬라이드를 놓습니다. 두 개의 유리 슬라이드의 전체 표면을 함께 눌러 평평한 보드를 위에 놓고 상체의 힘으로 약 10초 동안 누릅니다.
- 두 개의 유리 슬라이드를 조립한 후 두 개의 구멍이 사용자를 향하도록 챔버를 뒤집습니다. 포트 아래의 링에 소량의 UV 경화 접착제를 넣고 유리 슬라이드의 구멍 위에 포트를 배치하여 나노포트를 두 개의 구멍에 붙입니다. 포트 주위에 UV 경화형 접착제 링을 추가하고 UV 램프로 접착제를 경화시킵니다. 이제 챔버가 그림 2E와 같이 보여야 합니다. 즉시 1.4단계로 진행합니다.
알림: 자외선은 눈과 피부를 손상시킬 수 있습니다. 적절한 보호 장비를 착용하십시오.
- 챔버 표면의 Fluorophilic coating
알림: 이 단계는 우수한 코팅 효율을 보장하기 위해 유리 슬라이드의 플라즈마 처리(단계 1.2.2) 후 1시간 이내에 수행해야 합니다.- 불소화유(HFE-1)에 1% 플루오로실란 용액(1H,1H,2H,2H-perfluorodecyltrichlorosilane) 1mL를 갓 준비하고 주사기에 채웁니다. PTFE 주사기 필터와 0.3mm x 0.76mm PTFE 마이크로튜빙에 연결된 27G x 0.75인치 바늘을 통해 코팅 용액을 관찰실로 밀어 넣습니다.
- 1분 배양 후 흄 후드 아래의 질소 압력을 사용하여 코팅 용액을 챔버 밖으로 씻어냅니다. 다른 주사기 어셈블리를 사용하여 불소화유(HFE-7500만 해당)로 챔버를 헹굽니다.
- 입구가 닫힌 불소화유로 채워진 챔버를 실온(RT)에서 보관하십시오. 각 실험 후에는 코팅이 잘 보존되도록 세포와 방울을 직접 씻어냅니다.
참고: 프로토콜은 여기에서 일시 중지할 수 있으며 챔버는 몇 달 동안 보관 및 재사용할 수 있습니다.
- 자석이 있는 챔버 홀더
- 자성 나노입자의 정렬을 위해 액적 캡슐화 및 이미징 중에 관찰 챔버에 정적 자기장을 적용합니다. 이를 위해 챔버의 긴 면을 따라 두 개의 네오디뮴 자석을 고정하는 맞춤형 3D 프린팅 현미경 홀더( 그림 2D 및 Bounab et al.17 Supplementary Data 4에 있는 파일 참조)에 챔버를 놓습니다.
2. 나노 입자 기능화
참고: 나노입자 기능화 과정은 각 사이토카인마다 유사하며, 유일한 차이점은 사이토카인 특이적 포획 항체가 추가된다는 것입니다. 각 사이토카인에 대한 기능화는 서로 다른 개별 반응 튜브에서 병렬로 수행됩니다. 이 프로토콜에 앞서 TNFα 포획 항체와 IL-1β 검출 항체는 각각 biotin 및 Alexa Fluor 647로 사내에서 라벨링되었습니다. 접합은 공급업체의 웹사이트( 재료 표의 링크 참조)에 있는 제조업체의 프로토콜에 따라 수행되었으며 항체는 -20°C에서 분주하여 보관했습니다.
- TNFα 검출을 위한 튜브에 50μL의 스트렙타비딘 기능성 나노입자(직경 (Ø) 300nm)를 추가하고, IL-1β의 경우 50μL, IL-6의 경우 100μL를 추가합니다. 나노 입자 용액을 인산염 완충 식염수(PBS)에 1:1(v/v)로 희석합니다.
- 각 튜브에 비오틴화 포획 항체(스톡 농도 0.5mg/mL)의 각 부피의 1/20(v/v)을 추가하고 RT에서 30분 동안 배양합니다.
참고: 나노 입자 용액에 소량을 추가할 때 튜브 상단에 부피를 증착하고 대량의 용액으로 여러 번 세척하십시오. 이는 적절한 혼합을 보장하고 응집체의 형성을 방지합니다. - 1mM D-비오틴 용액의 1/100(v/v)을 튜브에 추가하고 RT에서 5분 동안 배양합니다. 그 결과 최종 비오틴 농도는 10μM가 됩니다.
참고: 과도한 비오틴은 나노 입자의 자유 결합면을 차단하고 원치 않는 응집체 형성을 줄입니다. - 네오디뮴 자석을 튜브 가까이에 대고 입자를 수집합니다. 상층액이 맑아질 때까지 기다렸다가 상층액을 버립니다.
알림: 분석 전반에 걸쳐 사용되는 자석은 매우 강한 인력을 나타내므로 두 개의 자석이 실수로 결합될 경우 물리적 손상을 일으킬 수 있습니다. - 나노 입자 표면에 대한 비특이적 흡착을 줄이기 위해 Pluronic F-127 단계 2.1의 최종 부피의 0.5배(10%) 및 부피 PBS의 0.5배로 나노 입자를 즉시 재현탁시킵니다. RT에서 30분 동안 용액을 배양합니다.
- 자석을 사용하여 입자를 수집하고, 상층액을 버리고, 저장 버퍼 부피의 1배에 재현탁합니다(RPMI 1640, 5% 녹아웃 혈청 대체, 1% 펜/연쇄상구균, 1% 재조합 인간 혈청 알부민(HSA), 25mM HEPES, 0.1% Pluronic F-127). RT에서 30분 동안 용액을 배양합니다.
참고: 여기서 프로토콜을 일시 중지할 수 있으며 이제 입자를 4°C에서 최대 1주일 동안 보관할 수 있습니다. - 캡슐화 직전에 피펫팅으로 입자를 재현탁하고 IL-6:TNFα:IL-1β에 대해 각각 2:1:1(v/v)의 비율로 복합 나노입자를 혼합합니다.
참고: 기능성 나노입자의 다양한 비율은 각 사이토카인에 사용된 항체 쌍에 따라 달라지며 최적의 동적 범위를 얻기 위해 보정 샘플을 통해 실험적으로 결정되었습니다. - 자석으로 입자를 모으고 상층액을 버리고 재현탁하여 완전한 매체(RPMI 1640, 10% FBS, 1% Pen/Strep, 25mM HEPES)로 세척합니다. 이 단계를 반복하되 2.7단계에서 전체 미디어 볼륨의 0.5배까지만 일시 중단합니다.
- 다르게 라벨링된 IL-6, TNFα 및 IL-1β 검출 항체를 용액에 추가하여 각각 10nM의 최종 농도에 도달합니다. 이제 용액을 액적 실험에 사용할 준비가 되었습니다.
3. 세포 준비
참고: PBMC는 취리히 혈액 은행에서 받은 담황색 코트에서 분리되었습니다. 세포를 동결하여 액체 질소의 극저온 (1 x 10,7 cells/vial)에 수개월 동안 보관했습니다.
- 세포 해동
- 실험을 시작하기 1시간 전에 전체 배지와 MACS 완충액(2mM EDTA, DPBS의 0.5% BSA, 멸균 여과)을 RT에서 예열하도록 둡니다. 9mL의 완전한 배지를 15mL 튜브에 넣고 37°C의 수조에 보관하여 세포가 들어 있는 튜브를 준비합니다.
- 액체 질소에 보관된 PBMC cryovial(~1 x 107 셀 포함)을 검색합니다. 소량의 얼음만 남을 때까지 37°C의 수조에서 극저온을 소용돌이칩니다.
- 70% EtOH로 튜브를 닦고 층류 캐비닛으로 옮깁니다. 사전 예열된 전체 배지 1mL를 cryovial에 추가하고 부드럽게 혼합한 다음 모든 세포를 따뜻한 완전한 배지가 들어 있는 튜브로 옮깁니다. 극저온은 최대 세포 수를 회수하기 위해 1mL의 따뜻한 완전한 매체로 세척할 수 있습니다.
- 500 x g 에서 RT에서 5분 동안 세포를 회전시키고 상층액을 버리고 피펫으로 세포 펠릿에 1mL의 완전한 배지를 부드럽게 재현탁합니다. 9mL의 완전한 배지를 추가합니다.
- RT에서 5분 동안 500 x g 에서 세포를 회전시킵니다. 상층액을 버리고 이전과 같이 1mL의 완전한 배지에 다시 현탁시킵니다.
- 사용 가능한 셀 카운터를 사용하여 셀 수를 세십시오. 이 경우 자동 셀 카운터가 사용되었습니다. 세포 현탁액 10μL를 트리판 블루 10μL와 혼합하고 혼합물 10μL를 세포 계수 슬라이드에 전달하여 세포를 계수했습니다.
- 염색 및 FcR 차단
- 2 x 106 살아있는 세포/mL에서 세포를 재현탁하는 데 필요한 총 세포 수와 부피를 계산합니다. 스톡(5mM)을 PBS(작업 농도 5μM)에 1000배 희석하여 세포 염색 용액(CellTrace Violet)을 준비합니다.
- RT에서 500 x g 에서 5분 동안 세포를 회전시킵니다. 상층액을 버리고 3.2.1단계에서 준비한 계산된 부피의 세포 염색 용액에 세포를 재현탁시킵니다. 37°C에서 5분 동안 세포를 배양합니다.
- 배양이 끝나면 완전한 매체(염료 용액 부피의 최소 2배)를 추가하여 용액에 남아 있는 염료를 담금질합니다. RT에서 5분 동안 500 x g 에서 셀을 회전시킵니다.
- 상층액을 버리고, 세포 펠릿을 60μL의 MACS 완충액에 재현탁시키고, 1 x 107 세포당 20μL의 human FcR 블록을 추가합니다. RT에서 10분 동안 세포를 배양합니다.
- MACS 버퍼로 튜브를 10mL까지 채우고 RT에서 5분 동안 500 x g 에서 세포를 회전시킵니다.
- 상층액을 버리고 완전한 배지 1mL에 세포를 재현탁시킵니다. 3.1.6단계에서 설명한 대로 세포를 계산합니다.
- LPS를 이용한 세포 자극
- 세포 수를 사용하여 세포를 1 x 106 cells/mL로 희석하고 2mL의 세포를 초저 결합 6웰 플레이트의 각 웰로 옮깁니다.
- 완전한 매체에 LPS를 희석하고 세포가 들어있는 웰에 추가하여 LPS의 최종 농도 1μg/mL를 만듭니다. 37 °C에서 6 시간 동안 세포를 배양합니다.
- 캡슐화 준비
- 자극 시간이 끝나면 세포 현탁액을 새 15mL 튜브로 옮깁니다.
- 빈 웰에 1mL의 완전한 배지를 추가합니다. 셀 스크레이퍼를 사용하여 나머지 셀을 분리합니다. 세포를 새 15mL 튜브에 옮깁니다. 1mL의 완전한 배지로 웰을 세척하고 다른 15mL 튜브로 옮깁니다.
- 두 개의 튜브를 500 x g 에서 RT에서 5분 동안 회전시키고 희석되지 않은 상층액 용액 1mL(세척되지 않은 세포가 포함된 첫 번째 튜브에서)를 필요한 경우 추가 분석을 위해 새 튜브(예: ELISA)로 옮깁니다.
- 나머지 상층액은 버립니다.
- 펠릿을 0.5mL의 완전한 배지에 재현탁시키고 동일한 웰의 세포를 결합한 다음 원심분리 튜브로 옮깁니다. 3.1.6단계에 설명된 대로 셀을 계산합니다.
- RT에서 500 x g 에서 5분 동안 세포를 회전시키고 대부분의 상층액을 버립니다(약 100μL 남음). 펠릿을 재현탁하지 않고 200 μL의 완전한 매체를 매우 조심스럽게 첨가하십시오.
- 상층액을 버립니다. 6.6 - 13.3 x 106 cells/mL의 농도로 완전한 배지에 세포를 재현탁시켜 캡슐화의 경우 λ = 0.2-0.4의 액적당 평균 세포 수를 달성합니다.
참고: 3.4.6 및 3.4.7 단계는 상층액으로의 사이토카인 분비를 방지하기 위해 캡슐화 직전에 수행해야 합니다. 액적당 세포 수는 푸아송 분포를 따릅니다.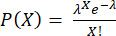 여기서 P는 X 세포를 포함하는 방울의 비율을 나타내고 λ는 방울당 평균 세포 수를 나타냅니다.
여기서 P는 X 세포를 포함하는 방울의 비율을 나타내고 λ는 방울당 평균 세포 수를 나타냅니다.
4. 캡슐에 넣기와 작은 물방울 생산
참고: 액적에서 세포의 캡슐화는 미세유체 액적 발생기 칩에 의해 가능하며, 이에 대한 제조는 다른 곳에서 매우 자세히 설명되어 있습니다17. 대안은 상업적으로 이용 가능합니다( 재료 표의 예 참조). 적합한 액적 발생기 칩 설계에는 수성상에 대한 두 개의 입구, 오일 상에 대한 하나의 입구 및 생성된 입자를 위한 하나의 출구가 있습니다. 또한, 적합한 상업용 액적 발생기 칩은 40-60pL 부피의 불소화 오일 방울에서 물을 생산할 수 있어야 합니다. 여기에 설명된 프로토콜은 직경이 50μm인 물/오일 에멀젼(액적)을 생성합니다. 프로토콜을 변경하기 위해 다양한 옵션을 사용하면 더 크거나 작은 방울이 생성될 수 있습니다.
- 주사기 펌프의 준비(그림 2A)
- HFE-7500 플루오르화 오일의 2% 008-플루오로 계면활성제로 구성된 500μL의 연속상으로 1mL 주사기를 채웁니다. 27G x 0.75인치 바늘을 0.30mm x 0.76mm PTFE 마이크로튜빙에 연결하고 어셈블리를 주사기에 장착한 다음 주사기 펌프에 장착합니다.
알림: 일관된 유속을 방해하므로 주사기나 캐뉼라에 공기가 남아 있지 않은지 확인하십시오. - 수성상을 위한 두 개의 맞춤형 피펫 팁 커넥터를 준비합니다(그림 2B): Ø0.75mm 생검 펀치로 Ø6mm의 ~5mm 높이의 PDMS 컷아웃 중앙에 구멍을 뚫습니다. PDMS 컷아웃의 구멍을 통해 ~3cm의 PTFE 튜브(내경 0.56mm, 외경 1.07mm)를 당기고 어셈블리를 200μL 피펫 팁 상단으로 밀어 넣습니다. 튜브의 다른 쪽을 23Gx 1.25인치 바늘에 연결합니다. 피펫 위에 UV 경화 접착제를 펴 바른 후 커넥터를 밀봉하고 UV 광선으로 경화시킵니다.
주의: 자외선은 눈에 해롭기 때문에 보호를 위해 자외선 차단 고글을 착용하십시오. - 1mL 주사기 2개에 500μL의 경유를 채우고 23G 바늘 2개를 맞춤형 부착물로 부착한 다음 둘 다 주사기 펌프에 장착합니다.
- 주사기 펌프 제어 소프트웨어를 사용하여 30μL의 나노 입자와 30μL의 세포 용액을 수성의 피펫 팁에 흡입합니다.
- 표면을 물로 청소하여 먼지와 먼지를 제거하고 정밀 물티슈로 건조시켜 관찰실을 준비합니다. Clamp 챔버를 두 개의 네오디뮴 자석이 장착된 인쇄된 챔버 홀더에 넣습니다.
알림: 자석이 길쭉한 응집체를 형성하기 위해 올바른 방향(서로를 끌어당기는)을 가리키는지 확인하십시오. - 챔버의 각도를 약간 조정합니다(30°). 두 포트를 모두 열고 상단 포트에 종이 타월을 꽂아 채우는 동안 과도한 외부 단계를 흡수합니다.
- HFE-7500 플루오르화 오일의 2% 008-플루오로 계면활성제로 구성된 500μL의 연속상으로 1mL 주사기를 채웁니다. 27G x 0.75인치 바늘을 0.30mm x 0.76mm PTFE 마이크로튜빙에 연결하고 어셈블리를 주사기에 장착한 다음 주사기 펌프에 장착합니다.
- 액적 생산 및 챔버 충진
- 튜브를 통해 연속상을 미세유체 칩의 상단 입구에 연결합니다(그림 2A,C,F). 1800μL/h의 유속을 사용하여 연속 위상으로 약 30초 동안 칩을 플러시합니다.
- 수용액의 피펫 팁을 두 개의 중간 입구에 연결합니다(그림 2A,C,F).
- 각각 200 μL/h로 수용액의 흐름을 시작하고 채널과 배출구를 액체로 채웁니다. 자성 나노 입자를 사용할 때 균일 한 갈색-적색 용액이 칩 출구에서 흘러 나와야합니다.
- 액체가 배출구에 나타나면 800μL/h에서 불소화 오일상 흐름을 시작하고 배출구에서 균일하고 회색이며 반짝이는 용액의 유출로 확인되는 안정적인 액적 생성이 확립될 때까지 기다립니다.
- 액적의 안정적인 생산이 확립되면 PTFE 미세관(내경 0.3mm x 외경 0.76mm)을 배출 포트에 연결하여 생성된 액적을 수집하고 손가락으로 조이는 일체형 피팅의 페룰 모듈을 통해 마이크로튜빙을 통과시켜 관찰 챔버로 보냅니다(그림 2A).
- 적절한 액적 생성이 이루어지면 균일하고 반짝이는 액체가 아래에서 위로 직선으로 챔버를 채워야 합니다.
- 챔버가 채워지면 흐름을 멈추고 손가락으로 꽉 조이는 압력을 사용하여 포트 플러그로 포트를 닫습니다.
알림: 챔버를 너무 세게 닫지 않도록 주의하십시오. 공기가 갇히거나 유입되면 액적의 움직임이 발생하여 측정 중 추적이 손상될 수 있습니다. - 액적 생성 후에는 칩을 불소화 오일로 세척하고 질소가 포함된 유체를 불어내어 기능을 보존합니다. 칩은 여러 번 재사용할 수 있으며 막히지 않는 한 몇 달 동안 보관할 수 있습니다.
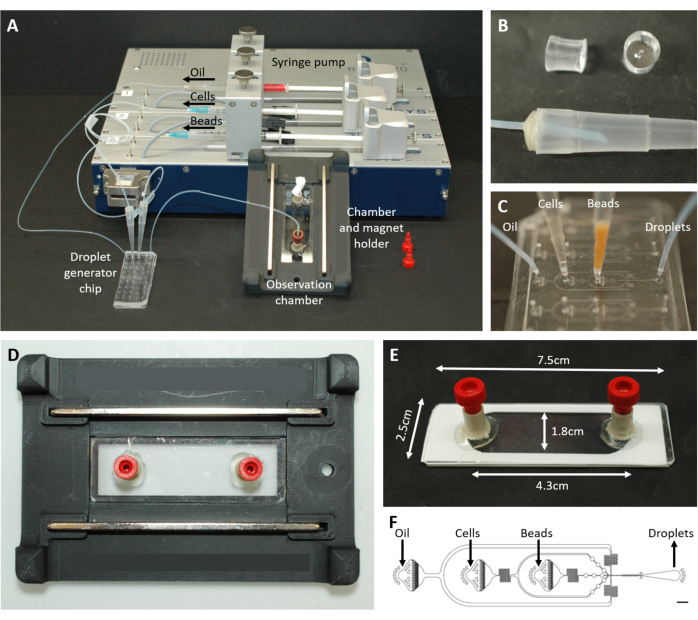
그림 2: 미세유체 설정 개요. (A) 주사기 펌프, 액적 생성 칩, 관찰 챔버 및 현미경 홀더를 사용한 액적 캡슐화를 위한 설정. (B) 프로토콜 단계 4.1.2에 설명된 대로 200μL 피펫 팁(하단)에 대한 커넥터를 형성하기 위한 천공된 PDMS 플러그(상단)의 그림. (C) 튜빙 및 피펫 팁과 액적 생성 칩의 연결 이미지. (D) 상단과 하단에 두 개의 자석이 있는 맞춤형 3D 프린팅 현미경 홀더 내부에 배치된 챔버의 사진. (E) 관찰실 사진(이해를 돕기 위해 흰색 테이프 포함). (F) 액적 생성을 위한 미세유체 칩의 레이아웃(스케일 바: 750μm). 이 수치는17에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 이미지 획득 및 측정
참고: 이미지 획득은 인큐베이터에 둘러싸인 표준 도립 epi-fluorescence 현미경에서 수행되며 37°C에서 측정할 수 있습니다. 여기에 설명된 설정은 Orca Fusion 카메라가 장착된 NIS Elements 소프트웨어(V. 5.30.04)와 함께 실행되는 Nikon Eclipse Ti2 현미경에만 해당되지만 일반적으로 다른 형광 현미경 및 카메라에도 적용할 수 있습니다.
- 측정 파라미터 설정
- 이미지 크기를 설정하려면 10 x 10 이미지의 배열 크기를 선택합니다. 이 어레이에는 약 50,000-70,000개의 물방울이 포함됩니다. 1% 오버랩을 사용하고 이미지 스티칭을 위해 블렌딩을 활성화합니다.
- 측정된 채널 수를 설정하려면 세포 검출을 위한 DAPI 채널, 사이토카인 검출(비드라인)을 위한 FITC, TRITC, Cy5 채널 및 액적 검출을 위한 BF 채널을 선택합니다. 비트 심도에 대해 픽셀 비닝, 2 x 2 및 16비트를 사용합니다. 모든 형광 채널에 대해 카메라의 최대값에 도달하지 않는 액적 내 강도 픽셀 값을 달성하도록 카메라 설정을 조정합니다.
알림: 정확한 노출 시간과 램프 모든 채널의 강도는 사용된 모델과 시약에 따라 다르며 보정 곡선을 생성하기 전에 설정됩니다(7단계). 정확한 정량화를 위해서는 보정 및 세포 측정에서 동일한 수집 설정을 사용하는 것이 중요합니다. - 시간 분해 측정을 설정하려면 총 9번의 측정에 대해 30분마다 측정을 선택하십시오.
참고: 측정 매개변수는 사용된 세포, 자극제, 시약, 측정된 사이토카인, 배양 온도 및 현미경 모델에 따라 다를 수 있습니다.
- 측정 시작
- 웰 플레이트 형식 스테이지(그림 2D)를 사용하여 챔버 홀더를 현미경에 장착하고 10x 대물렌즈를 사용하여 명시야(BF) 채널로 전환합니다.
- BF의 고정된 액적에 초점을 맞추고 필요한 경우 주변을 이동하고 조정하여 어셈블리가 완벽한 평면에 장착되었는지 확인합니다. 후속 단계를 위해 챔버 중앙으로 이동합니다.
- 자동 초점 시스템(PFS)을 활성화하고 BF 채널에서 최적의 측정 평면으로 설정하여 액적 가장자리가 오일 위상 및 배경과 쉽게 구별할 수 있는 검은색의 날카로운 원으로 나타나도록 합니다.
알림: 자동 초점 시스템 없이도 측정이 가능하지만 현미경에 자동 초점 시스템이 장착되어 있는 경우 사용하는 것이 좋습니다. 이렇게 하면 크고 심하게 스티칭된 이미지의 측정 품질이 향상됩니다. - 모든 형광 채널을 살펴보고 각각에 대한 최적의 측정 평면을 설정합니다. FITC, TRITC 및 Cy5 채널에 대한 재배치 측정의 경우 나노입자 응집체의 초점이 완벽하게 맞춰져 있는지 확인하고, DAPI 채널의 경우 셀의 초점이 맞춰져 있는지 확인합니다.
참고: 최적의 초점면과 z 값은 측정된 모든 채널에 대해 다를 수 있습니다. 모든 채널에 대해 개별 PFS 오프셋을 저장해야 합니다. - 측정을 시작하기 전에 모든 채널을 통해 개별 초점을 다시 확인하고 용액이 예열되는 동안 처음에 움직임이 발생할 수 있으므로 평형을 이룰 때까지 5분 동안 기다립니다.
- 측정을 시작합니다. 첫 번째 이미지를 생성한 후 불규칙성(초점, 움직이는 물방울, 잘못된 채널 등)이 있는지 확인합니다. 필요한 경우 획득을 다시 시작하거나 공기의 경우 챔버를 다시 채우십시오(4.1.4단계에서 시작). 4시간 동안 물방울을 이미지화하기 위해 어셈블리를 그대로 두십시오.
6. 이미지 분석
- MatLab(https://github.com/ESPCI-LCMD/MiMB)에 이미지 분석 소프트웨어(DropMap Analyzer App v 4.023)를 설치하고 실험에서 생성된 .nd2 파일을 분석 컴퓨터로 전송합니다.
- 응용 프로그램을 엽니다. 지정된 설정을 선택하고, 그렇지 않으면 기본값을 그대로 둡니다: CH1: DAPI, WD(전체 드롭릿)가 선택됨; CH2: FITC, BL(비드라인) 선택됨; CH3: TRITC, BL 선택됨; CH4: Cy5, BL 선택됨; 최대 낙하 직경 (μm) : 70; 낙하 감지: 전체; 추적: 예. 시작 버튼(과일 아이콘)을 눌러 .nd2 파일 위치를 선택하고 분석을 시작합니다.
- 몇 분 후 프로그램은 ex를 보여줍니다.amp이미지의 섹션(그림 3A). 물방울 감지에 적합한 항목을 찾을 때까지 Space 를 누른 다음 Enter 키를 누릅니다. 동일한 이미지 섹션에서 물방울을 감지하기 위한 임계값 매개변수를 찾기 위해 대표 영역에 사각형을 그립니다.
- 몇 분 후 DAPI 채널의 강도 분포를 보여주는 다른 창이 열립니다. 슬라이더를 드래그 앤 드롭하여 염색된 셀의 신호만 감지하고 오른쪽 상단 모서리에 있는 완료 를 클릭합니다.
- 이미지를 최대 입자 직경(μm)보다 작은 직경을 가진 단일 입자로 분할한 후 프로그램은 이제 추가 사용자 입력 없이 각 방울, 시점 및 형광 채널에 대해 다음 단계를 수행합니다( 그림 3 참조).
- 소프트웨어는 시점 사이에 물방울의 이동된 픽셀을 계산합니다(40픽셀 이상 이동하는 물방울은 자동으로 제외됨).
- 이 소프트웨어는 전체 액적의 평균 형광 값을 측정하며, 수평선에서 가장 밝은 픽셀을 찾고 액적의 위에서 아래로 수직선의 모든 픽셀 강도를 평균화하여 평균 비드선 강도를 감지 및 측정합니다. 이 작업은 자동으로 수행되며 다음 방정식에 따라 평균 비드라인 재배치 값(그림 3B)을 계산하는 데 사용됩니다.
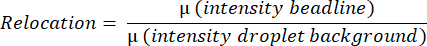
- 소프트웨어는 DAPI 채널에 설정된 임계값을 초과하는 액적 영역의 총 픽셀 백분율을 계산합니다.
- 결과 .xslx 파일에는 추가 분석을 위해 DropIdX(시간 경과에 따라 추적된 액적의 ID), TrueCentroid_ t*2-1 및 t+2(각각 타임포인트 t에 대한 액적 중심의 x 및 y 좌표), DiameterMicrons(μm 단위의 액적 직경), TrackingMove(전체 측정 시간 동안 이동된 픽셀 수), FluoChannel_BL_Ratio_t(시점 t에서 FluoChannel의 재배치 값) DAPI_WD_PosPxlCount_t(시점 t에서 DAPI 채널의 전체 드롭릿에서 임계값을 초과하는 픽셀 수)입니다.
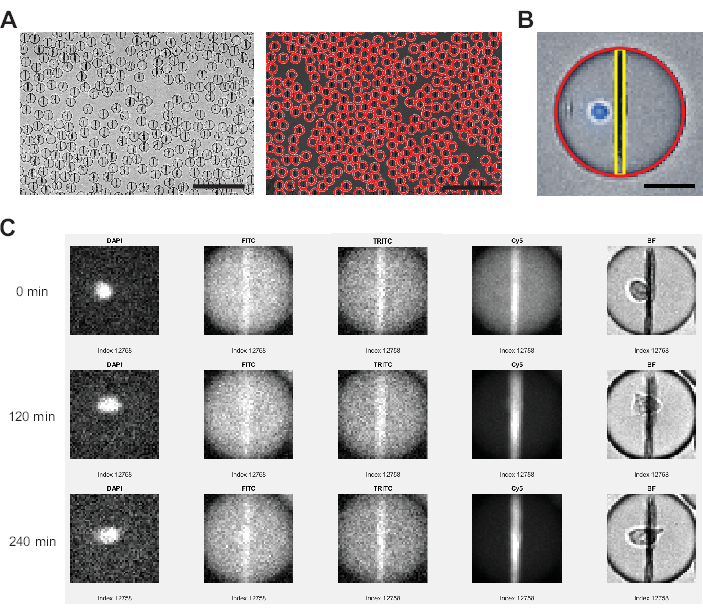
그림 3: 이미지 분석 소프트웨어에 의해 수행된 이미지 분석. (A) Hough 변환을 사용하여 명시야(BF) 채널에서 액적을 감지하고 각 액적을 빨간색 원으로 표시합니다. 스케일 바: 200 μm. (B) 각 액적 내에서 나노입자 비드라인은 수평면에서 가장 밝은 픽셀을 통해 식별되고 액적의 상단에서 하단에 걸쳐 있는 모든 픽셀에 대해 평균화된 형광 강도를 통해 식별됩니다. 또한 세포는 전체 액적 영역에 대해 임계값보다 >0 높은 픽셀 백분율을 통해 식별됩니다. 스케일 바: 20 μm. (C) 분석기 소프트웨어는 모든 개별 액적에 대해 측정된 모든 시점에 걸쳐 나노 입자의 형광 강도를 FITC, TRITC 및 Cy5 채널의 액적 배경과 비교합니다. 0, 4(120분) 및 9(240분)의 타임포인트가 표시됩니다. 올바른 액적 및 세포 검출을 수동으로 확인하기 위해 DAPI 및 BF 채널도 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7. 캘리브레이션
참고: 정량적 판독의 경우, 서로 다른 실험 설정 간에 차이가 발생할 수 있으므로 형광 재배치 값에 대한 사이토카인 농도 보정을 한 번 수행해야 합니다. 필요한 모든 단계는 참조한 이전 프로토콜 섹션에 자세히 설명되어 있습니다.
- 2단계에서 설명한 대로 나노입자를 준비합니다.
- 제조업체의 지침에 따라 인간 IL-6, TNFα 및 IL-1β 재조합 단백질을 재구성합니다.
알림: 냉동 부분 표본은 한 번만 해동하고 즉시 사용하십시오. - 시작 농도가 80nM에서 0.625nM인 완전한 배지(10% FBS, 1% Pen/Strep, 25mM HEPES)를 사용하여 3가지 단백질 모두에 대한 2배 희석 시리즈를 준비합니다.
- 4단계에서 설명한 대로 첫 번째 수성 상에서는 기능성 나노 입자를 사용하고 두 번째 수성 상에서만 RPMI를 사용하여 캡슐화를 수행합니다. 이 측정은 블랭크 역할을 하며 측정된 표준 편차는 나중에 데이터 분석에 사용됩니다.
- 5분 동안 기다렸다가 5단계에서 설명한 대로 물방울을 이미지화합니다. 각 형광 채널에서 2 x 2 배열 크기의 이미지 3개를 촬영합니다.
- 준비된 모든 보정 용액에 대해 7.4 및 7.5 단계를 가장 낮은 농도에서 시작하여 가장 높은 농도로 끝냅니다.
- 6단계에서 설명한 대로 이미지를 분석합니다. DAPI 채널에 대해 WD 옵션을 사용하지 말고 추적을 아니요로 설정하십시오.
- 이 분석은 하나의 이미지에서 측정된 모든 액적에 대한 형광 재배치 값을 출력합니다. 모든 형광 채널에 대한 중앙값과 표준편차를 추출합니다. 농도당 측정된 모든 이미지에 대한 중앙값 및 표준 편차의 평균을 구합니다.
- 각 재조합 단백질의 측정된 농도에 대해 평균 중앙값 재배치를 플로팅하여 보정 곡선을 생성합니다.
- 단상 연결을 사용하여 곡선을 맞춥니다:
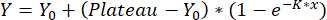 ,
,
Y = x에서의 재배치, Y0 = 블랭크 측정의 재배치, x는 사용된 농도입니다. 얻어진 검량선은 8단계에서 설명한 대로 재배치 값을 정량화하는 데 사용됩니다.
알림: 측정된 가장 높은 재배치까지의 값만 맞추고 측정된 재배치가 더 낮은 더 높은 농도의 값을 제외합니다. 더 높은 농도에서 측정된 재배치 값의 감소가 예상되며 나노 입자의 Hook 효과 및 제한된 결합 용량으로 인해 발생합니다.
8. 데이터 분석
- TrackingMove 값이 10보다 큰 물방울, 즉 측정 시간 동안 10픽셀 이상 이동한 물방울은 제외합니다.
- 열 DAPI_WD_PosPxlPercent_1에서 값이 0보다 큰 액적을 정렬하여 첫 번째 시점에 염색된 세포(DAPI 채널)가 포함된 액적을 식별합니다.
- 모든 형광 채널(FluoChannel_BL_Ratio_t 컬럼)의 형광 재배치에 다음 3가지 기준을 적용하여 분비 세포를 포함하는 액적을 식별합니다.
- 재배치 값이 증가하는 액적을 식별하고, 측정 시간 동안 양의 기울기를 정렬합니다.
- 재배치 값이 검출 한계(LOD)에 도달한 액적을 식별합니다. 액적은 측정 시간 동안의 최대 형광 재배치가 다른 문헌25에 설명된 바와 같이 계산된 LOD보다 우수할 때 선택된다:
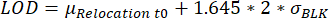 여기서 μ재배치 t0는 시점 0에서의 모든 재배치 값의 중앙값이고 BLK 는 보정 중에 측정된 블랭크의 표준 편차σ, 각각은 사이토카인 특이적이다.
여기서 μ재배치 t0는 시점 0에서의 모든 재배치 값의 중앙값이고 BLK 는 보정 중에 측정된 블랭크의 표준 편차σ, 각각은 사이토카인 특이적이다. - 측정 시간 동안 최대 및 최소 측정된 형광 재배치 간의 변화가 다음보다
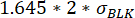 우수한지 확인하여 재배치 값의 증가가 유의한지 확인합니다.
우수한지 확인하여 재배치 값의 증가가 유의한지 확인합니다.
- 8.3단계에서 설명한 기준을 충족하여 공동 분비 세포를 식별합니다. 두 개 이상의 형광 채널을 동시에 사용할 수 있습니다.
- 8.3단계를 반복합니다. 셀이 없는 모든 물방울에 대해(DAPI_WD_PosPxlPercent_1 = 0). 이러한 드롭릿을 사용하여 거짓 긍정 백분율을 계산합니다.
- 200 - 500개의 액적을 무작위로 선택하고 이미지 분석 소프트웨어의 검증 및 정렬 기능으로 검사하여 측정의 정확한 λ 값을 결정합니다. 이 방울의 세포 수를 세고 다음을 계산합니다.
λ = 계수된 세포 수 / 분석된 액적 수 - 측정을 위해 캡슐화된 셀의 총 수를 다음과 같이 계산합니다.
총 세포 수 = λ × 분석된 액적 수 - 결정된 세포 수를 사용하여 분비 세포의 백분율을 계산합니다. 또한 모든 사이토카인에 대한 위양성 비율(일반적으로 채널당 실제 양성 수에 비해 3%-5% 미만)을 계산하고 이를 실험의 일관성과 재현성을 위한 내부 통제로 사용합니다.
- 분비된 사이토카인 농도를 계산하려면 7.10단계에서 확립된 보정 방정식을 사용하여 재배치 값을 농도로 변환합니다.
- 다음 방정식을 사용하여 시점 간의 분비율(SR)을 계산합니다.
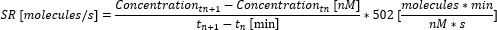
- 시점 간의 개별 분비 속도를 평균하여 측정에 대한 평균 분비율을 계산합니다. 측정이 끝나기 전에 최대 측정 가능한 재배치에 도달한 경우 농도를 최대 측정 가능한 농도(이 값은 사이토카인 특이적이며 6.10단계의 보정 곡선에서 측정 및 사용된 최대 농도에 해당)로 설정하고 추가 농도를 계산하지 않습니다. 이 시점까지만 분비율과 평균을 계산합니다.
참고: 하나의 형광 채널에서 50개 미만의 분비 세포가 검출되는 경우 검증 및 분류 기능을 통해 액적을 육안으로 검사해야 하며 형광 또는 나노 입자 응집체가 있는 액적은 분석에서 제외할 수 있습니다. - 각 단일 세포의 분비 곡선에서 추가 파라미터를 추출하려면 사용자 지정 Python 스크립트(요청 시 제공)를 사용하여 각 세포 및 사이토카인에 대한 시간-농도 곡선에 최소 제곱 맞춤을 수행합니다. 적합 함수는 아래에 설명된 공식을 따르는 시그모이드 곡선입니다(R2<0.95에 대한 적합치는 다음 단계에서 제외됨).
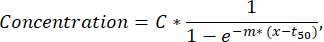
여기서 C는 농도 고원[nM]에 해당하고, t50 은 절반 최대값[s]의 이동에 해당하며, m은 언덕 경사[min-1]에 해당합니다. 이러한 매개변수에서 다음 곡선 설명자가 아래 설명된 대로 추출됩니다.- Cmax [nM]: 최대 측정 농도.
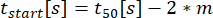 : 분비가 시작되는 시간으로, 밀착력이 C의 10%에 이릅니다.
: 분비가 시작되는 시간으로, 밀착력이 C의 10%에 이릅니다.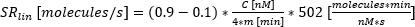 : 시간-집중 곡선의 10%와 90% 사이의 곡선의 근사화된 선형 기울기로서의 분비율.
: 시간-집중 곡선의 10%와 90% 사이의 곡선의 근사화된 선형 기울기로서의 분비율.
결과
제시된 기능적 단일 셀 플랫폼을 통해 여러 매개변수를 측정할 수 있었습니다. 첫째, 표준 기법과 유사하게, 세포 분비 빈도는 측정이 끝날 때 표시됩니다(그림 4A). 말초혈액 단핵세포(PBMC) 6시간에 대해 1μg/mL의 지질다당류(LPS)를 자극한 후 세포의 5.81%에서 IL-6(n=1270), 4.55% TNFα(n=995) 및 6.06% IL-1β(n=1326)가 분비되었습니다.
사이토카인 분비를 정량화하기 위해 알려진 농도의 재조합 사이토카인으로 보정 곡선을 생성했습니다(그림 4B). 이러한 보정 곡선을 통해 시간 경과에 따른 액적 내 사이토카인 농도를 정량화할 수 있습니다. 예를 들어, LPS 자극 PBMC의 경우 평균 액적 내 IL-6 농도가 90분 후 안정기에 도달한 반면, 평균 액적 내 IL-1β는 90분에서 더 빠르게 증가하여 플랫폼의 동적 분해능과 특정 사이토카인을 분비하는 세포 하위 집단을 추출할 수 있는 가능성을 표시했습니다(그림 4C). 측정 지점 간에 농도가 변함에 따라 사이토카인당 동적 분비 속도를 계산할 수 있습니다. 각 사이토카인(cytokine)의 평균 분비 속도를 살펴보면(그림 4D), IL-6 분비 세포는 평균 분비 속도가 지속적으로 감소하는 반면, TNFα 및 IL-1β 분비 세포는 모두 90분 측정 시간 후 분비 속도가 증가하고 150분 후 두 번째 감소를 보였습니다.
또한, 분비된 사이토카인(cytokine)과 함께 분비된 사이토카인(co-secreted cytokine)에 따라 세포를 부분집단(subpopulation)으로 군집화할 수 있습니다(그림 4E). 여기서 IL-6 또는 TNFα를 분비하는 세포는 각각 30.2%와 26.4%가 IL-6 및 TNFα를 단일분비하는 반면, 단일 분비 IL-1β 세포는 전체 IL-1β 분비세포의 68.8%를 차지합니다. 또한, 분비 농도 및 분비 속도에 대한 공동 분비의 효과를 해결할 수 있습니다(그림 4F). IL-6 분비 세포를 관찰한 결과, 세포가 TNFα 또는 IL-1β를 추가로 생산할 경우 다른 양의 IL-6가 분비되었습니다. 마찬가지로, 측정 시 평균 분비율의 분포는 IL-6만 분비하는 세포 또는 IL-6를 분비하는 세포와 TNFα(높은 분비율) 및 IL-1β(낮은 IL-6 분비율)와 함께 통계적으로 차이를 보였습니다.
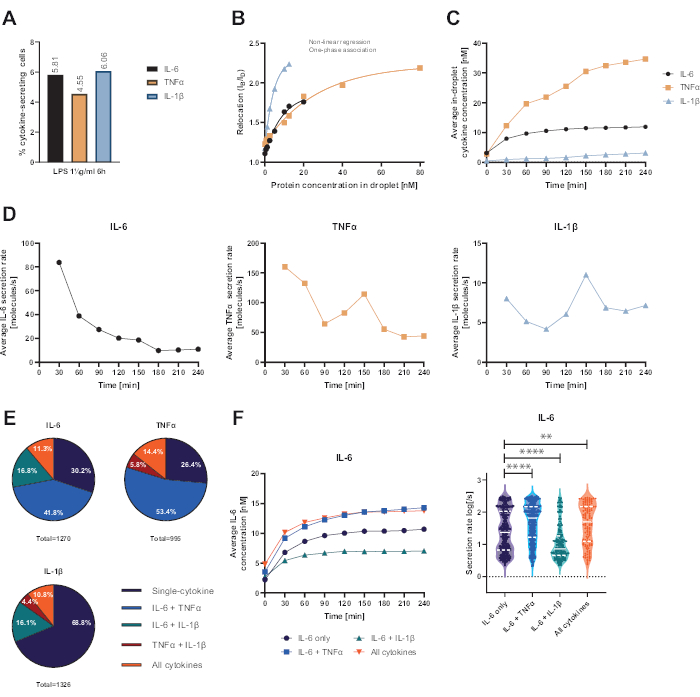
그림 4: 1 μg/mL LPS로 6시간 자극 후 IL-6, TNFα 및 IL-1β가 PBMC를 분비하는 대표적인 결과. (A) 4시간 측정 종료 시 IL-6, TNFα 및 IL-1β를 분비하는 PBMC의 백분율. (B) 다중화된 사이토카인 보정 곡선은 알려진 농도의 재조합 사이토카인으로 생성됩니다. 이를 통해 재배치 값에서 액적 내 사이토카인 농도를 계산하여 세포 실험을 정량화할 수 있습니다. 점은 비선형 단상 연관 곡선 적합치, r2=0.9926(IL-6), 0.9901(TNFα), 0.9990(IL-1β)을 사용하여 적합되었습니다. (C) 4시간 측정 시간 동안 PBMC를 분비하여 방출되는 IL-6, TNFα 및 IL-1β의 평균 분비 농도. (D) 4시간 측정 시간 동안 IL-6, TNFα 및 IL-1β의 평균 분비율. (E) IL-6, TNFα 또는 IL-1β를 분비하는 공동 분비 세포 및 이들의 조합의 상대적 백분율. 각 사이토카인에 대해 검출된 모든 분비 세포로 정규화됩니다. (F) 동시 분비 분해능을 가진 IL-6 분비 세포에 대한 측정 시간 동안의 평균 IL-6 농도 및 평균 분비 속도(log) 분포(IL-6 전용 n=383, IL-6 + TNFα의 경우 n=531, IL-6 + IL-1β의 경우 n=213, IL-6+TNFα+IL-1β의 경우 n=143). 분비 속도 분포의 통계적 차이는 95% 신뢰도로 양측, 쌍을 이루지 않은, 비모수 Kolmogorov-Smirnov 테스트를 사용하여 평가되었으며 p-값이 표시됩니다. ** (p <0.002) 및 **** (p <0.0001). 전체 선은 중앙값을 나타내고 점선은 사분위수를 나타냅니다. n총 셀 = 21 866. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
단일 세포 수준에 대한 추가 정보를 추출하기 위해 시그모이드 기능을 각 세포와 사이토카인의 농도-시간 지점에 맞출 수 있습니다(그림 5). 한 세포에 대한 시간 경과에 따른 농도 데이터 세트와 해당 시그모이드 적합도가 그림 5A에 표시되어 있습니다. 여기서 최소 제곱 피팅 절차는 곡선의 상한 고원 값에 해당하는 C, 0에서 곡선의 시간별 이동을 정량화하는 t50 , 측정 전반에 걸쳐 10% 및 90% 농도 값에 도달한 시그모이드 곡선의 상승 부분의 경사도를 설명하는 언덕 기울기 m을 생성합니다. 이러한 맞춤 매개변수에서 7.12단계에서 설명한 대로 일부 곡선 설명자를 추출할 수 있습니다. 데이터의 가장 높은 농도 값인 Cmax, 상부 고원 농도 값의 10%에 도달하는 것으로 정의되는 분비 시작 시간인 t 시작, 곡선의 상승 부분 동안의 분비 속도인 SRlin을 산출합니다.
세포 하위 집단을 분류하기 위해, 모든 단일 세포 적합에서 얻은 곡선 설명자는 각각 세 가지 범주로 분류되었습니다: Cmax 값은 t에 대해 낮음, 중간 및 높음으로 그룹화되었으며, t는 초기, 중간 및 후기로 시작되고 SRlin은 느림, 중간 및 빠른 분비기로 그룹화되었습니다. 이러한 분류를 설명하기 위해, 4개의 예시적인 단세포 분비 곡선 및 그에 상응하는 곡선 설명자가 나타나 있으며(그림 5A-D), 여기서 곡선 A는 중간 속도의 초기 낮은 분비인자, 곡선 B는 초기, 느리고 높은 분비자, 곡선 C는 초기의 빠른 높은 분비인자, 곡선 D는 후기의 낮은 분비물을 나타냅니다. 이러한 기준에 대한 컷오프는 세포, 사이토카인 및 분석 매개변수에 따라 다르며 각 연구 질문에 맞게 조정해야 한다는 점에 유의해야 합니다. 또한, 6시간 동안 1μg/mL LPS 자극 후 PBMC의 IL-6 분비만 고려되었는데, 이는 대부분의 세포가 각각 80%와 79%로 초기 및 고분 분비자임을 의미합니다(그림 5E-F). 분비 속도와 관련하여, IL-6 분비 세포의 55%는 느린 분비인자, 39%는 빠른 분비 인자로 양극성 반응이 관찰되었습니다(그림 5G).
분비 거동을 더욱 특성화하기 위해 각 세포에 대한 곡선 설명자를 서로에 대해 표시하고 서로 다른 클러스터를 추출했습니다(그림 5H-J). tstart와 Cmax 사이에는 명확한 상관관계가 없습니다(그림 5H): 가장 큰 두 집단은 분비 시작과 무관한 초기의 낮은 분비자와 높은 분비자였습니다. tstart와 SRlin 사이의 관계를 고려할 때(그림 5I), 대부분의 세포는 초기에 높은 분비인자와 소수의 느린/중간에서 늦은 분비인자를 가진 초기의 느린 분비인자였습니다. SRlin 및 Cmax(그림 5J) 상관관계와 관련하여, 빠른 저분비인자는 거의 없었으며, 빠른 저분비인자의 모집단만이 더 많았다. 또한, 최대 측정 농도에 의존하지 않는 빠른 분비인자의 집단이 많았고, 고분비인자의 두 집단은 느리거나 빠르게 분비되었습니다. 요약하면, 개별 세포에 대한 곡선 설명자 간의 관계를 조사하면 훨씬 더 자세한 분석이 가능하며 단일 세포 분비 측정에서 새로운 생물학적 결과를 추출할 수 있다는 결론을 내릴 수 있습니다.
위에서 소개한 분석을 통해 공동 분비 세포의 분비 역학을 추출했습니다(그림 6). 두 개의 예시 곡선은 두 개의 단일 세포에서 IL-6 및 TNFα에 대한 동시 분비의 서로 다른 역학을 보여주며, 두 사이토카인이 동시에 시작되거나(그림 6A) IL-6가 먼저 분비되는 순차적 분비 시작을 보여줍니다. 모든 동시 분비 세포를 분류하기 위해 60분의 분비 지연을 정의했으며, 이 범위 내에서 분비를 시작하는 모든 세포는 동시 분비인자로 간주하고 더 긴 지연을 가진 모든 세포는 순차적 분비인자로 간주합니다. 이 분석을 통해 어떤 사이토카인이 먼저 분비되는지 관찰할 수도 있었습니다. IL-6 및 TNFα의 경우 세포의 76%에서 주로 동시 동시 분비가 관찰되었으며(그림 6C), IL-6 및 IL-1β의 경우 세포의 86%에서 순차적 동시 분비가 관찰되었으며 대부분의 경우 IL-6가 첫 번째로 분비되는 사이토카인이었습니다(그림 6D).
모든 개별 공동 분비 세포에 대해 서로 다른 사이토카인에 대한 분비 시작 시간을 살펴보면, 수행된 실험에서 분비 시작 시간 간의 명확한 상관 관계가 관찰되지 않았습니다. IL-6 및 TNFα 동시 분비(그림 6E)의 경우, IL-6부터 시작하여 공동 분비 세포가 더 많이 발생하는 0분 부근의 더 큰 수직 클러스터가 존재했습니다. IL-6 및 IL-1β 동시 분비(그림 6F)의 경우, 대부분의 세포는 측정 시작 무렵에 IL-6를 분비하기 시작한 반면, IL-1β는 주로 나중에 분비되었습니다. 요약하면, 여기에 제시된 분석을 통해 다양한 분비물 하위 집단과 복잡한 사이토카인 공동 분비 역학을 식별할 수 있었습니다.
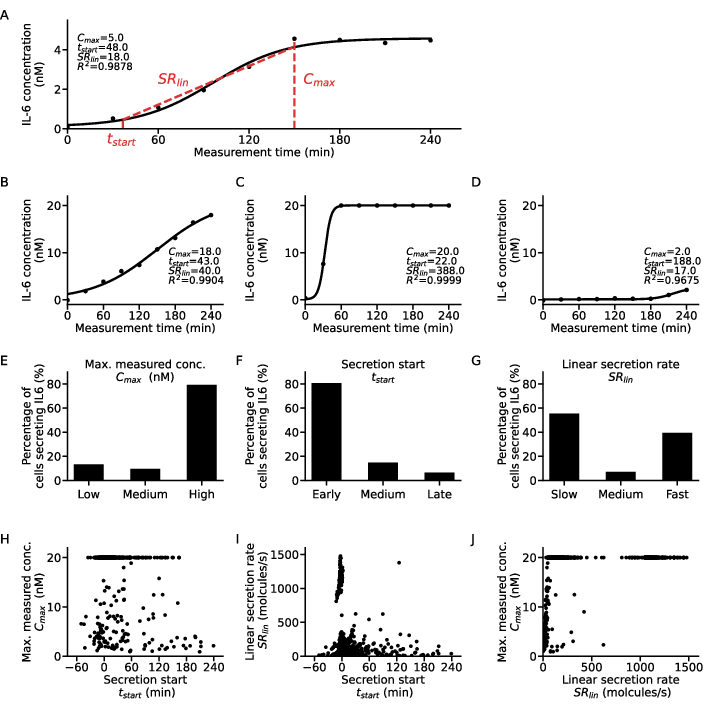
그림 5: 단일 IL-6 분비 세포 곡선에 대한 다양한 분비 동적 패턴의 상세 분석. (A) 피팅된 시그모이드 곡선 및 추출된 매개변수를 사용한 측정 시간 동안의 대표적인 단일 세포 사이토카인 농도 데이터. (비-디) LPS 자극 후 IL-6 분비에 대해 발견된 다양한 사이토카인 분비자 유형에 대한 3개의 예시적인 단세포 사이토카인 농도 곡선. (E-G) 다음 기준에 따라 다양한 분비체 유형으로 분류된 IL-6 분비 세포의 비율(n=633): E. C최대: 낮은 <5 nM, 높은 >19.5 nM, F. t시작: 이른 <30분, 늦은 >120분, G. SRlin: 느린 <250 molecules/s, 빠른 >750 molecules/s. (H-J) 세 개의 분비 곡선 설명자 사이의 관계 Cmax, t시작 및 SRlin 은 각 개별 셀에 대해 다음과 같습니다(n=633). Cmax=20nM에서의 큰 모집단은 분석의 검출 상한에 도달한 결과입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
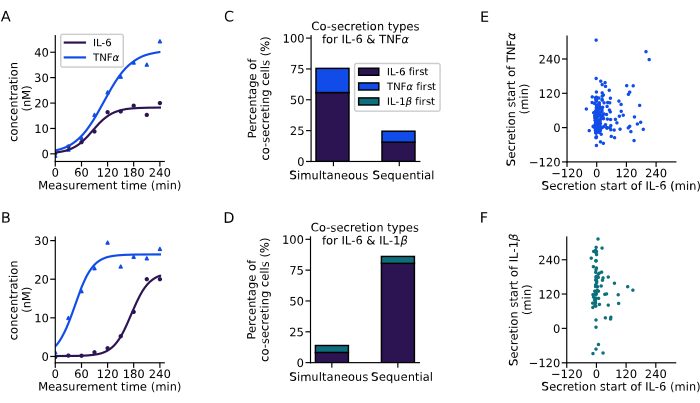
그림 6: single-cell concentration curve에서 co-secretion patterns의 추출. (A-B) IL-6와 TNFα를 동시에 (A) 및 (B)를 순차적으로 동시 분비하는 단일 세포의 대표적인 농도 곡선. (C-D) IL-6 및 TNFα(n=249) 또는 IL-6 및 IL-1β(n=72)의 동시 및 순차적 동시 분비를 나타내는 세포의 비율. 순차적 분비는 사이토카인 분비 시작 사이의 60분 이상의 지연을 통해 정의됩니다. 색상은 어떤 사이토카인이 먼저 분비를 시작했는지를 나타냅니다. (E-F) 각 분비 세포에 대한 서로 다른 사이토카인에 대한 분비 시작 시간 간의 관계(nIL6-TNFα=249, nIL6-IL1β=72). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
사이토카인 방출 및 분비는 면역학 및 임상 의학에서 자주 연구되고 있습니다3. 불균형한 사이토카인 분비는 감염뿐만 아니라 신경 질환, 염증 또는 암으로 고통받는 환자에게 해로운 영향을 미칠 수 있습니다 26,27,28. 건강과 질병에 대한 사이토카인의 중요성은 잘 확립되어 있지만, 현재의 방법론으로는 단일 세포에서 유래한 사이토카인을 시간 분해 방식으로 정확하게 검출하고 정량화할 수 없기 때문에 사이토카인과 그 분비 세포를 연구하는 것은 여전히 어려운 과제입니다. 여기에 제시된 워크플로우를 위해 PBMC와 함께 확립된 자극 프로토콜을 사용하고 IL-6, TNF-α 및 IL-1β의 분비를 측정했습니다. 개별적이고 정제된 하위 집단 대신 PBMC를 사용하기로 한 선택은 IL-6, TNF-α 및 IL-1β29를 포함한 전염증성 사이토카인의 혈장 농도가 매우 높아지는 것을 특징으로 하는 상태인 사이토카인 방출 증후군(CRS)23을 조사하기 위한 이전 응용 프로그램에서 비롯되었습니다. CRS는 일반적으로 하나의 집단에만 연결되어 있지 않기 때문에 생체 내에 존재할 수 있는 PBMC를 사용했습니다. 그러나 과학적 질문에 따라 이 단계가 필요한 경우 세포 하위 집단을 개별적으로 정제하고 평가할 수 있습니다. 배양 시간, 자극 조건 및 동적 분석 범위는 관심 있는 3가지 사이토카인의 분비를 측정하기 위해 최적화되었습니다. 여기에 제시된 워크플로우 및 데이터는 여러 사이토카인의 시간 분해 단일 세포 분비를 설정, 보정, 정량화, 측정 및 분석하는 방법을 보여줍니다. 이 프로토콜은 사이토카인 분비의 다기능 분석이 어떻게 환자에서 분비되는 사이토카인의 큰 기능적, 동적 다양성을 가능하게 할 수 있는지에 대한 청사진을 제공합니다.
설명된 분석 프로토콜의 몇 가지 중요한 측면은 고유한 생물학적 판독을 가능하게 합니다. 첫째, 미세유체 방울의 단일 세포 캡슐화를 통해 각 개별 세포에 대한 데이터를 추출할 수 있었습니다. 여러 세포 캡슐화의 이벤트는 연구 질문에 따라 이미지 분석을 통해 감지하고 분류할 수 있습니다. 둘째, 여러 개의 독립적인 액적 내 형광 면역분석법을 포함하고 기능화된 나노입자를 정렬하여 최대 3개의 사이토카인 농도를 병렬로 정량적으로 측정할 수 있었습니다. 이 다중화를 통해 단일 세포 수준에서 사이토카인 공동 분비 패턴을 분석할 수 있었습니다. 셋째, 액적의 고정화는 각 분비 세포에 대한 사이토카인 분비의 시간별 측정 및 상관 관계를 가능하게 하고 동시 분비와 순차적 분비를 구별할 수 있게 했습니다. 시간 분해능은 분비 패턴과 다양한 분비체 유형의 하위 집단에 대한 데이터를 고유하게 제공했습니다. 마지막으로, 병렬화된 이미지 분석을 통해 20,000개 이상의 개별 셀로 측정한 대량의 데이터를 효율적으로 추출하고 추적할 수 있었습니다. 단일 분비 곡선에서 추출하면 표현형 하위 집단과 기능을 추가로 발견할 수 있었습니다.
고유한 판독 외에도 이 분석은 표준 사이토카인 분석에 비해 기술적 이점이 있습니다. 약 60pL의 작은 캡슐화 구획 덕분에 세포 분비에 맞는 검출 한계로 생물학적 소스에서 분비되는 사이토카인의 절대 양을 직접 검출할 수 있습니다. 또한 분석 소형화는 소량의 고가의 바이오 시약을 사용합니다. 또한 이 설정에는 생물학 및 생명 공학 실험실에서 이미 사용할 수 있는 특수 장비가 거의 필요하지 않습니다. 형광 현미경은 널리 사용되고 있으며, 주사기 펌프는 생명 공학 실험실에서 자주 사용되거나 비교적 저렴한 비용으로 구입할 수 있습니다. 세포 배양이 있는 경우 실험을 실행하는 데 필요한 전체 장비 비용은 약 148,000유로이며, 대부분은 자동 epifluorescent microscope(130,000유로)가 부담합니다. 그러나 이러한 기기는 종종 생물학 실험실에서 찾을 수 있으며 나머지 비용은 주사기 펌프(13,000유로, 더 저렴한 대안을 사용할 수 있음) 및 더 작은 장비에 분배됩니다. 액적 칩 및 관찰 챔버의 제조는 매우 잘 설명되어 있으며(17 ), 대부분의 생명공학 실험실에 존재하는 오븐 및 플라즈마 세척기와 같은 필요한 인프라가 있는 클린룸 환경 외부에서 수행될 수 있다. 또는 관심 있는 실험실에 액적 발생기 칩을 공급할 수 있는 다양한 공급업체를 사용할 수 있습니다. 필요한 부피가 작기 때문에 분석은 비용 효율적이고 설정이 간단합니다.
최고 수준의 재현성을 보장하기 위해 프로토콜의 성공을 위한 몇 가지 중요한 단계를 식별했습니다. 처음 사용하는 사용자의 일반적인 문제는 측정 중 액적 이동입니다. 분석 소프트웨어는 개별 액적을 어느 정도 추적할 수 있지만, 과도한 이동은 단일 세포 분리능의 손실과 부정확한 결과를 초래합니다. 적절하게 밀폐된 측정 챔버, 올바른 액적 크기 및 챔버 크기, 측정 시작 전 짧은 평형 기간 및 적절한 계면활성제 농도를 사용하여 움직임을 피할 수 있습니다. 또 다른 중요한 단계는 측정을 시작하기 전에 정확하게 초점을 맞추는 것입니다. 부적절한 초점은 형광 재배치 값을 현저히 낮추고 분비되는 사이토카인의 양을 과소평가하게 합니다. 마지막으로, 당면한 질문과 프로토콜에 따라 서로 다른 단계 간의 올바른 타이밍이 재현성을 위해 가장 중요합니다. 특히 챔버 충전과 측정 시작 사이의 대기 시간이 일정해야 하며, 그렇지 않으면 분비된 사이토카인의 측정 창을 놓칠 수 있습니다.
제시된 기술의 한계는 캡슐화 후 세포를 추가로 조작할 수 있는 제한된 능력을 포함한다. 따라서 현재로서는 각성제, 항체 또는 추가 시약을 추가하거나 제거할 수 없습니다. 또한 세포가 분리된 생물반응기에 캡슐화되어 있기 때문에 측정 중에 세포 간의 상호 작용(접촉 기반 또는 파라크린 신호)이 발생할 수 없습니다. 이 한계는 사전에 대량 배양을 통해 부분적으로 극복할 수 있습니다. 또한, 분비된 사이토카인에 의한 자가분비 효과 향상도 가능하며, 항체 검출된 분비된 사이토카인만 측정되기 때문에 이러한 효과를 확실하게 정량화하거나 배제할 수 없습니다. 따라서 사이토카인 분비에 대한 고립된 견해는 항상 해당 질문 및 적용의 맥락에서 설명되어야 합니다. 그러나 이 제한 사항은 관심 있는 경우 캡슐화된 배수, 이중선 및 삼중항에 대한 자세한 연구에도 사용할 수 있습니다. 이것은 세포 간 접촉 또는 분비 기반 질문을 조사하는 데 유용한 흥미로운 설정을 제공할 것입니다. 마지막으로, 분석의 동적 범위도 제한되어 있으며 특정 응용 분야에 맞게 조정해야 합니다. 여기에서는 측정된 사이토카인의 예상 분비량에 맞게 분석의 동적 범위를 조정했습니다.
분석의 능력과 적용 가능성을 더욱 발전시키기 위해 생물학적, 기술적 및 데이터 분석 측면에서 향후 몇 가지 개발을 해결할 수 있습니다. 생물학적 측면에서는 추가 사이토카인, 기타 분비된 단백질, 대사 또는 세포 표면 마커의 측정을 어세이를 조정하여 통합할 수 있습니다. 또한 이 분석은 다른 세포 기반 분석과 함께 워크플로우에 통합되어 판독 범위를 넓힐 수 있습니다(예: 유세포 분석 염색 또는 염기서열분석). 또한 분석의 유용성은 예를 들어 액적 생성 및 관찰을 위한 통합 미세유체 칩을 생성하여 단순화할 수 있으며, 이를 통해 임상 환경에서 생명 공학 실험실 외부의 더 넓은 응용 분야를 가능하게 할 수 있습니다. 데이터 분석과 관련하여, 자동화를 강화하고 머신 러닝 접근 방식을 사용하여 이미지에서 정보를 추출하고 추적할 수 있습니다(예: 형광 라벨링 없이 각 액적에서 세포 및 비드라인의 존재와 위치를 감지). 이렇게 하면 면역 분석에 사용할 수 있는 추가 형광 채널이 열리므로 훨씬 더 많은 사이토카인을 병렬로 측정할 수 있습니다.
제시된 분석법과 관련 프로토콜 및 분석은 사이토카인 분비 역학과 관련된 다양한 잠재적 사용 사례에 적용할 수 있습니다. 보다 구체적으로, 이 분석은 세포 유형 및 활성화 특이적 사이토카인 분비 프로파일 식별, 사이토카인 분비 세포의 다기능성 또는 사이토카인 균형의 시간성 및 유지 메커니즘과 같은 근본적인 면역학적 질문을 잠재적으로 해결할 수 있습니다. 또한, 임상 응용 분야에서 이 플랫폼은 COVID-1930에서 관찰된 바와 같이 활동성 또는 만성 염증 반응 중 사이토카인의 역할을 밝히는 데 도움이 될 수 있으며, 자가염증31과 같은 고유한 서명에 따라 환자를 계층화하고 치료를 개인화하는 도구를 제공할 수 있습니다. 결론적으로, 단일 세포에서 사이토카인 분비에 대한 정량적 시간 분해 평가는 특정 약물, 감염, 유전자 변형 또는 생체 외 자극이 특정 반응을 유도하는 방법을 규명하기 때문에 매우 필요한 방법입니다.
공개
세포의 비드라인 측정과 같은 특정 측면은 특허를 받았습니다.
감사의 말
이 프로젝트는 ETH 도메인(스위스 연방 공과 대학)의 전략적 중점 분야 개인화된 건강 및 관련 기술(PHRT)의 보조금 #2021-349, 유럽 연구 위원회 시작 보조금(보조금 #803,336) 및 스위스 국립 과학 재단(보조금 #310030_197619)의 지원을 받았습니다. 또한 Guilhem Chenon과 Jean Baudry의 초기 DropMap 분석기 개발 및 노고에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 008-FluoroSurfactant | RAN Biotechnologies | 008-FluoroSurfactant-10G | |
| 2-Stream flow-focusing droplet maker, 30 µm nozzle, PFOS hydrophobic surface treatment | Wunderli chips | ||
| Alexa Fluor 647 NHS Ester | ThermoFisher | A20006 | https://www.thermofisher.com/ch/en/home/references/protocols/cell-and-tissue-analysis/labeling-chemistry-protocols/fluorescent-amine-reactive-alexa-fluor-dye-labeling-of-igm-antibodies.html |
| Anti-Human IL-1β (Monoclonal Mouse), AF647 labelled in-house | PeproTech | 500-M01B | |
| ARcare92524 double-sided adhesive tape | Adhesvies Reasearch | ARcare92524 | |
| Bio-Adembeads Streptavidin plus 300nm | Ademtech | Cat#03233 | |
| Biotinylated Goat Anti-Human IL-1β | PeproTech | 500-P21BGBT | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A3059 | |
| Cell Scraper | TPP | 99002 | |
| CellTrace Violet Cell Proliferation Kit | Invitrogen | C34557 | Cell staining solution |
| Chromafil Xtra PTFE-45/25 syringe filters | Macherey-Nagel | 729205 | |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3471 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10283 | |
| D-Biotin | Fluorochem | M02926 | |
| DPBS, no calcium, no magnesium | Gibco | 14196-094 | |
| epT.I.P.S. Standard 2-200 µl | Eppendorf | 30000889 | |
| Ethylenediaminetetraacetic acid disodium salt solution | Sigma-Aldrich | 3690 | |
| EZ-LINK-NHS-PEG4-Biotin | ThermoFisher | A39259 | https://www.thermofisher.com/order/catalog/product/20217 |
| FcR Blocking Reagent, human | Miltenyi Biotec | 130-059-901 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| Handy dish soap | Migros | 5.01002E+11 | |
| HEPES (1 M) | Gibco | 15630-080 | |
| HFE-7500 Oil 3M TM Novec | Fluorochem | B40045191 | |
| Idex F-120 Fingertight One-Piece Fitting, Standard Knurl, Natural PEEK, 1/16" OD Tubing, 10-32 Coned | Cole-Parmer | GZ-02014-15 | |
| IL-6 Monoclonal Antibody (MQ2-13A5 - Rat), FITC | ThermoFisher | 11-7069-81 | |
| IL-6 Monoclonal Antibody (MQ2-39C3), Biotin | ThermoFisher | 13-7068-85 | |
| KnockOut Serum Replacement | ThermoFisher | 10828-010 | |
| Loctite AA 3491 curable UV glue | Henkel AG & Co | 3491 | |
| Microscope slides (76x26x1mm, clear white) | Menzel Gläser | ||
| Mineral oil light | Sigma-Aldrich | 330779 | |
| NanoPort Assembly Headless, 10-32 Coned, for 1/16" OD | Idex | N-333 | |
| Neodymium block magnet | K&J Magnetics | BZX082 | |
| Omnifix-F Spritze, 1 ml, LS | Braun | 9161406V | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | |
| Phosphate buffered saline | Sigma-Aldrich | P4417 | |
| Pluronic F-127, 0.2 µm filtered (10% Solution in Water) | ThermoFisher | P6866 | |
| Precision wipes | Kimtech Science | 5511 | |
| PTFE microtubing 0.30 × 0.76 mm | FisherScientific | 1191-9445 | |
| PTFE microtubing 0.56 × 1.07 mm | FisherScientific | 1192-9445 | |
| Recombinant Human IL-1β | Peprotech | Cat#200-01B | |
| Recombinant Human IL-6 | Peprotech | Cat#200-06 | |
| Recombinant human serum albumine (HSA) | Sigma-Aldrich | A9731 | |
| Recombinant Human TNF-α | Peprotech | Cat#300-01A | |
| Reusable biopsy punch diameter 0.75 mm and 6 mm | Stiefel | 504529 and 504532 | |
| RPMI 1640 Medium, no phenol red | Gibco | 11835-030 | |
| Standard LPS, E. coli K12 | InvivoGen | tlrl-eklps | |
| Sterican needles 23 G for 0.56 mm diameter microtubing | FisherScientific | 15351547 | |
| Sterican needles 27 G for 0.30mm diameter microtubing | FisherScientific | 15341557 | |
| TNF alpha Monoclonal Antibody (MAb11), PE | ThermoFisher | 12-7349-81 | |
| TNF-alpha Monoclonal Antibody (MAb1), biotinylated in-house | ThermoFisher | 14-7348-85 | |
| Trypan Blue Stain (0.4%) for use with the Countess Automated Cell Counter | Invitrogen | T10282 | |
| Vacuum Filtration "rapid"-Filtermax | TPP | 99500 | |
| Devices | |||
| Cameo 4 automatic cutting machine | Silhouette | ||
| Cetoni Base 120 + 3x NEMESYS Low Pressure Syringe Pumps | Cetoni | NEM-B101-03 A | |
| Countess II Automated Cell Counter | ThermoFisher | ||
| Inverted Epi-fluorescence microscope Ti2 | Nikon | ECLIPSE Ti2-E, Ti2-E/B*1 | |
| OKO Lab Cage Incubator, dark panels | OKO Lab | ||
| ORCA-Fusion Digital CMOS camera | Hammatsu | C14440 | |
| SOLA Light Engine | Lumencor | sola 80-10247 |
참고문헌
- Chen, L., et al. Inflammatory responses and inflammation-associated diseases in organs. Oncotarget. 9 (6), 7204-7218 (2017).
- Cicchese, J. M., et al. Dynamic balance of pro- and anti-inflammatory signals controls disease and limits pathology. Immunol Rev. 285 (1), 147-167 (2018).
- Liu, C., et al. Cytokines: From clinical significance to quantification. Adv Sci. 8 (15), e2004433 (2021).
- Rojas, J. M., Avia, M., Martín, V., Sevilla, N. IL-10: A multifunctional cytokine in viral infections. J Immunol Res. 2017, 6104054 (2017).
- Kohanawa, Y. M. A regulatory effect of the balance between TNF-α and IL-6 in the granulomatous and inflammatory response to Rhodococcus aurantiacus infection in mice. J Immunol. 177 (1), 642-650 (2006).
- Geginat, J., et al. Plasticity of human CD4 T cell subsets. Front Immunol. 5, 630 (2014).
- Sallusto, F. Heterogeneity of human CD4+ T cells against microbes. Ann Rev Immunol. 34 (1), 317-334 (2016).
- Chetaille Nézondet, A. L., Poubelle, P. E., Pelletier, M. The evaluation of cytokines to help establish diagnosis and guide treatment of autoinflammatory and autoimmune diseases. J Leukocyte Biol. 108 (2), 647-657 (2020).
- Sims, J. T., et al. Characterization of the cytokine storm reflects hyperinflammatory endothelial dysfunction in COVID-19. J Allergy Clin Immunol. 147 (1), 107-111 (2021).
- Yasen, A., et al. Single-cell RNA sequencing reveals the heterogeneity of infiltrating immune cell profiles in the hepatic cystic echinococcosis microenvironment. Infection and Immunity. 89 (12), (2021).
- Jiang, Y., et al. Single-cell RNA sequencing highlights intratumor heterogeneity and intercellular network featured in adamantinomatous craniopharyngioma. Sci Adv. 9 (15), (2023).
- Tanguay, S., Killion, J. J. Direct comparison of ELISPOT and ELISA-based assays for detection of individual cytokine-secreting cells. Lymphokine Cytokine Res. 13 (4), 259-263 (1994).
- Bucheli, O. T. M., Sigvaldadóttir, I., Eyer, K. Measuring single-cell protein secretion in immunology: Technologies, advances, and applications. Eur J Immunol. 51 (6), 1334-1347 (2021).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab Chip. 20 (12), 2062-2074 (2020).
- Brower, K. K., et al. Double emulsion picoreactors for high-throughput single-cell encapsulation and phenotyping via FACS. Anal Chem. 92 (19), 13262-13270 (2020).
- Luo, X., Chen, J. Y., Ataei, M., Lee, A. Microfluidic compartmentalization platforms for single cell analysis. Biosensors. 12 (2), 58 (2022).
- Bounab, Y., et al. Dynamic single-cell phenotyping of immune cells using the microfluidic platform DropMap. Nat Protoc. 15 (9), 2920-2955 (2020).
- Eyer, K., et al. Single-cell deep phenotyping of IgG-secreting cells for high-resolution immune monitoring. Nat Biotechnol. 35 (10), 977-982 (2017).
- Gaa, R., et al. Versatile and rapid microfluidics-assisted antibody discovery. mAbs. 13 (1), 198130 (2021).
- Gerard, A., et al. High-throughput single-cell activity-based screening and sequencing of antibodies using droplet microfluidics. Nat Biotechnol. 38 (6), 715-721 (2020).
- De Jonghe, J., et al. spinDrop: a droplet microfluidic platform to maximise single-cell sequencing information content. Nat Comm. 14 (1), 4788 (2023).
- Wheeler, M. A., et al. Droplet-based forward genetic screening of astrocyte-microglia cross-talk. Science. 379 (6636), 1023-1030 (2023).
- Portmann, K., Linder, A., Oelgarth, N., Eyer, K. Single-cell deep phenotyping of cytokine release unmasks stimulation-specific biological signatures and distinct secretion dynamics. Cell Rep Meth. 3 (7), 100502 (2023).
- Portmann, K., Linder, A., Eyer, K. Stimulation-induced cytokine polyfunctionality as a dynamic concept. eLife. 12, 89781 (2023).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. Clin Biochem Rev. 29, S49-S52 (2008).
- Yang, J., et al. New insight into neurological degeneration: Inflammatory cytokines and blood-brain barrier. Front Mol Neurosci. 15, 1013933 (2022).
- Kim, P. S., Ahmed, R. Features of responding T cells in cancer and chronic infection. Curr Opin Immunol. 22 (2), 223-230 (2010).
- Becher, B., Spath, S., Goverman, J. Cytokine networks in neuroinflammation. Nat Rev Immunol. 17 (1), 49-59 (2017).
- Cosenza, M., Sacchi, S., Pozzi, S. Cytokine release syndrome associated with T-cell-based therapies for hematological malignancies: Pathophysiology, clinical presentation, and treatment. Int J Mol Sci. 22 (14), 7652 (2021).
- Hu, B., Huang, S., Yin, L. The cytokine storm and COVID-19. J Med Virol. 93 (1), 250-256 (2021).
- Marcuzzi, A., et al. Autoinflammatory diseases and cytokine storms-Imbalances of innate and adaptative immunity. Int J Mol Sci. 22 (20), 11241 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유