É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Rápido e sensível Colloidal Coomassie G-250 coloração para proteínas em gel de poliacrilamida
Neste Artigo
Resumo
Este vídeo é popularizar uma coloidal Coomassie G-250 protocolo de coloração de acordo com Kang Et al. Para a detecção de proteínas ng média de 4 em géis. A coloração é concluída dentro de duas horas e sem qualquer esforço. Rotineiramente utilizam o protocolo Kang para fins analíticos, de gel com base em proteômica.
Resumo
Coomassie Brilliant Blue (CBB) é um corante comumente usado para a visualização de proteínas separadas por SDS-PAGE, oferecendo um processo de coloração simples e quantificação de altura. Além disso, é totalmente compatível com identificação de proteínas espectrometria de massa. Mas, apesar dessas vantagens, a CBB é considerado para ser menos sensível do que a prata ou colorações de fluorescência e, portanto, raramente usado para a detecção de proteínas em gel analítica abordagens baseadas em proteômica.
Várias melhorias do original Coomassie protocolo 1 foram feitas para aumentar a sensibilidade da CBB. Duas grandes modificações foram introduzidas para aumentar a detecção de proteínas de baixa abundância, convertendo as moléculas de corante em partículas coloidais: Em 1988, Neuhoff e colegas aplicaram 20% de metanol e maiores concentrações de sulfato de amônio no G-250 CBB solução corante com base 2, e em 2004 Candiano et al. estabelecida Prata Azul usando CBB G-250 com ácido fosfórico na presença de sulfato de amônio e metanol 3. No entanto, todas estas modificações apenas permitem uma detecção de aproximadamente 10 ng de proteína. Um protocolo muito obscuro para a coloração Coomassie coloidal foi publicado por Kang et al. Em 2002, onde eles modificaram Neuhoff protocolo de coloração coloidal CBB sobre as substâncias complexantes. Em vez de sulfato de amônio que usaram sulfato de alumínio e metanol foi substituído pelo 4 etanol menos tóxicos. A base de alumínio romance coloração em estudo Kang mostrou sensibilidade superior que detecta tão baixos como 1 ng / banda (fosforilase b) com variação pouca sensibilidade dependendo proteínas.
Aqui, nós demonstrar a aplicação do protocolo de Kang para rápido e sensível coloração Coomassie coloidal de proteínas em fins analíticos. Vamos ilustrar o protocolo rápido e fácil usando géis bi-dimensional realizada rotineiramente em nosso grupo de trabalho.
Protocolo
Parte 1: Two-dimensional eletroforese em gel (2-D), utilizando taça de carregamento
- IPG strip-reidratação e focalização isoelétrica (IEF)
- Reidratar géis DryStrip Immobiline, pH 6-11 (7 cm) em 125 mL de solução de reidratação [7 M uréia, 2 M tiouréia, 4% CHAPS, 50 hydroxyethyldisulfide mM e 2% IPG tampão pH 6-11] usando a bandeja DryStrip Immobiline Reswelling para pelo menos 10 horas.
- Dissolver amostra de proteína precipitado em IEF tampão de amostra [7 M uréia, tiouréia 2 M, CHAPS 2%, 2% ASB-14, hydroxyethyldisulfide mM 50 e 2% IPG tampão pH 6-11] correspondente a 60-100 mg de proteína por 100 ml .
- Após solubilização (pelo menos 30 minutos em temperatura ambiente), aplicar amostra de proteína via anódica xícara de carga, utilizando copos de amostras. O volume do copo é de 100 l (cups Manifold permitem até 150 mL).
Nota: você pode carregar grandes quantidades de amostra, se você inserir um passo de baixa tensão no início do protocolo de foco e encher os copos enquanto ainda há uma película de líquido no copo! - Realizar focalização isoelétrica para 11,1 KVH no modo gradiente na Unidade de Eletroforese Multiphor II.
- Equilíbrio e SDS-PAGE
- Depois IEF, as tiras IPG foram submetidos a uma redução e alquilação, cada tempo de 15 minutos em um agitador, usando ditiotreitol 1% e 2,5% respectivamente iodoacetamida em solução de equilíbrio [50 mM Tris-HCl/pH 8.8, 6 M de uréia, glicerol 30% e 2% SDS].
- Lave as tiras equilibrada com H 2 O e exterminá-los em papel Whatman para remover excesso de tampão de equilíbrio. Depois mergulhar as tiras em SDS-tampão de corrida (1X).
- Segunda dimensão é realizada por SDS-PAGE em um sistemas de eletroforese vertical, com uma concentração de acrilamida total de 12%. As tiras IPG foram equilibradas colocados no topo dos géis de separação e fixados com solução de agarose quente [agarose 0,5% em tampão de corrida contendo azul de bromofenol].
- Proteínas foram separadas por 2,5 horas, a partir de 80 V por 15 minutos, seguida de 120 V até a frente de corante atinge o fundo da gaveta gel.
Parte 2: coloração Coomassie coloidal com CBB G-250
1. Soluções de coloração
Nota: para a preparação das soluções de coloração, utilize produtos químicos com alta qualidade, tais como grau analítico (pa) e água de alta pureza como você começa a partir Millipore sistemas (água Milli-Q).
| Solução de Coomassie: | ad 2000 ml H 2 O | |
| 0,02% (w / v) | CBB G-250 | 0,4 g |
| 5% (w / v) | sulfato de alumínio (14-18)-hidrato | 100 g |
| 10% (v / v) | etanol (96%) | 200 ml |
| 2% (v / v) | ácido ortofosfórico (85%) | 47 ml |
Nota: para a preparação da solução de coloração, a adição seqüencial dos componentes na seguinte ordem tem de ser mantido:
- dissolver primeiro sulfato de alumínio em água Milli-Q
- depois adicionar etanol, homogeneizar e mix CBB G-250 para a solução
- recentemente, a solução é totalmente dissolvido, acrescentar ácido fosfórico (a incorporação do ácido para a mídia alcoólicas permite que as moléculas de Coomassie agregar em seu estado coloidal)
- finalmente, encher com água Milli-Q
Nota: a solução de coloração final tem uma aparência verde-azulado escuro e está cheio de partículas de natação ao redor:
- Não filtrado esta solução!
- Se você alterou a ordem de preparação, você teria uma solução mais violeta-azulada que é menos sensível.
| Descoloração solução: | ad 2000 ml H 2 O | |
| 10% (v / v) | etanol (96%) | 200 ml |
| 2% (v / v) | ácido ortofosfórico (85%) | 47 ml |
2. Processo de coloração
- Após a separação segunda dimensão, remova cuidadosamente os géis das placas de vidro e transferi-los para um prato cheio de coloração água Milli-Q.
- Lave o gel três vezes com água Milli-Q por 10 minutos em um agitador horizontal (lavagem insuficiente causa sensibilidade pobres porque a SDS restante no gel perturba o delimitadora do corante à proteína).
- Agitar a solução Coomassie antes do uso para dispersar as partículas coloidais uniformemente.
- Incubar o gel bem coberto com a solução de Coomassie por agitação em um agitador de 12/02 horas. Esta coloração gera marginais de fundo para que você possa observar o progresso coloração no meio.
Nota: após 10 minutos você pode ver manchas primeira proteína que aparece, dentro de 2 horas de incubação de cerca de 80% da coloração a elas nível máximo é concluída. Por quase 100% de coloração, a incubação durante a noite é recomendado. Em alguns casos, quando a quantidade de proteína a ser manchado é enorme ea solução se transforma em um azul brilhante, uma atualização da solução de coloração é necessário. - Após o procedimento de coloração remover a solução Coomassie e lavar o gel duas vezes com água Milli-Q.
Nota: você pode reutilizar a solução de coloração, desde que as partículas são ainda remanescentes, caso contrário, descarte-o (lembre-se que o seu laboratório pode ter regras especiais para a eliminação de resíduos). - Remover partículas de corante degola do prato com uma coloração que não solte fiapos toalha de papel e destain para 10-60 minutos.
Nota: Você também pode lavar o gel apenas com água Milli-Q, mas isso recomendamos apenas para preparativa géis porque não vai durar um irregular, o filme de Coomassie fraco no gel que irão surgir durante o processo de digitalização. - Finalmente lavar o gel duas vezes com água Milli-Q: o gel chegará a sua espessura original (a mídia álcool-ácido faz o encolhimento géis) e neutralização em água, adicionalmente, aumenta a intensidade de cor Coomassie.
Parte 3: Os resultados representativos
Se você seguir o protocolo descrito acima, você receberá em seu gel 2-D distintas e bem resolvida manchado manchas escuras proteína azul. Mesmo comparado a um gel 2-D corados com prata de acordo com Shevchenko et al. 5, um protocolo alegando boa sensibilidade e compatibilidade com espectrometria de massa, conseguimos resultados de coloração igual.
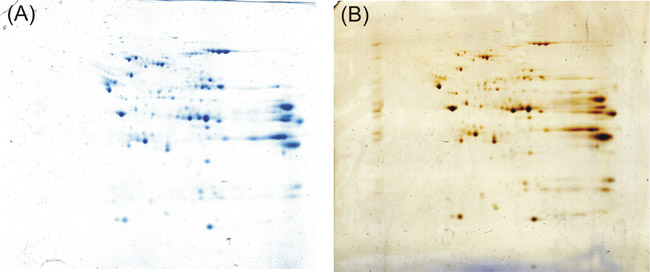
Figura 1: Resultado das experiências descritas acima. Coomassie Kang protocolo (A) realiza fortemente como a coloração pela prata de acordo com Shevchenko et al. (B) na detecção de proteínas após o 2-D eletroforese em gel.
Parte 4: Dicas e truques
- Executar algumas colorações teste antes de processar suas próprias amostras. Por razões inexplicáveis, por vezes, nós informamos que uma proteína de interesse não pode ser detectado com sucesso, mesmo quando miligramas foram aplicados. Neste caso, recomendamos a preparar algumas séries de diluição para teste de sensibilidade.
- Se você tem baixa em gel de detecção da proteína (s) na transferência, em geral mal sucedidas do empilhamento para o gel de separação durante a SDS-PAGE será possivelmente a razão. Você pode verificar essas proteínas adesivas através da coloração do gel completo, incluindo a área de empilhamento.
- Para uma verificação rápida dos seus resultados com foco isoelétrico, você pode diretamente mancha as tiras IPG, sem qualquer separação outra dimensão segundo.
- Ocasionalmente, por sua vez o gel durante o procedimento de coloração para que eles sejam manchadas por igual de ambos os lados (se você manter o gel imóvel, o corante liga-se a apenas um lado do gel).
- Fizemos a experiência de que o armazenamento da solução de coloração em uma garrafa escura aumenta sua vida útil (em garrafas transparentes até 4 meses).
- Após a coloração e documentar você pode manter o gel na geladeira por vários anos (se você adicionar solução ácida a evitar contaminações por fungos).
- Descoloração de plugues gel para uma digestão tríptica pode ser acelerado pelo aquecimento em um aquecedor de bloco.
Discussão
Inovadora ou apenas outro protocolo Coomassie?
No momento existem vários protocolos para a coloração de procedimentos com Coomassie Brilliant Blue. A maioria deles o resultado de modificações maiores ou menores de um dos protocolos mais comumente usados por Neuhoff e colegas 2. Também protocolo Kang é baseado na fórmula de Neuhoff. Mas é realmente um método de coloração Coomassie alternativa para a pesquisa proteômica? Vamos imagem duas questões principais, lim...
Divulgações
Agradecimentos
Agradecemos ao Dr. Nicola Wiethölter para a preparação e coloração de 1-D gels.
Este trabalho foi financiado por uma doação da Deutsche Forschungsgemeinschaft (GRK 1089/project 5 a ND e SM) e apoiado por uma bolsa de pesquisa do Manchot Jürgen Stiftung para ND.
Materiais
| Nome do produto | Companhia | No. de catálogo | Comentários |
| Para IEF e SDS-PAGE: | |||
| Immobiline DryStrip géis | GE Healthcare | 17-6001-94 | Pode até ser usado dois anos após a data expirar. |
| Immobiline DryStrip Bandeja Reswelling | GE Healthcare | 80-6371-84 | Não devem ser limpos com solventes orgânicos. Projetado para 7-18 centímetros IPG-tiras. |
| Immobiline DryStrip Kit | GE Healthcare | 18-1004-30 | Inclui uma bandeja, porta-eletrodo anodo e catodo de eletrodos, alinhador e bar copo de amostra e copos de amostra. |
| EPS 3501 Alimentação XL | GE Healthcare | 18-1130-05 | Fontes de tensão até 3500 V. |
| Multiphor Unidade II Eletroforese | GE Healthcare | 18-1018-06 | Eletrodos móveis permitem IEF em tiras IPG de todo o comprimento (7-24 centímetros IPG strips) |
| Perfectblue gel sistema Twin S | Peqlab | 45-1010-C | SDS-PAGE em formato 10x10 cm mini-gel. Gel câmara inclui um sistema de refrigeração. |
| Para coloidal Coomassie G-250 coloração: | |||
| coloração pratos com tampas | VWR | 216-3412 | Se encaixa para mini-géis. Empilhável em shaker. |
| sulfato de alumínio-18-hidrato | Merck | 1.01102.5000 | Fizemos melhor experiência com a Merck. Apenas disponível em 5 pacote kg. |
| ácido ortofosfórico | Prolabo | 20 624.295 | Vendidas em garrafas de vidro. |
Referências
- Fazekas de St Groth, S., Webster, S. R. G., Datyner, A. Two new staining procedures for quantitative estimation of proteins on electrophoretic strips. Biochim. Biophys. Acta. 71, 377-391 (1963).
- Neuhoff, V., Arold, N., Taube, D., Ehrhardt, W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 9, 255-262 (1988).
- Candiano, G., Bruschi, M., Musante, L., Santucci, L., Ghiggeri, G. M., Carnemolla, B., Orecchia, P., Zardi, L., Rigetti, P. G. Blue Silver: A very sensitive colloidal Coomassie G-250 staining for proteome analysis. Electrophoresis. 25, 1327-1333 (2004).
- Kang, D., Gho, S. G., Suh, M., Kang, C. Highly Sensitive and Fast Protein Detection with Coomassie Brilliant Blue in Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis. Bull. Korean Chem. Soc. 11, 1511-1512 (2002).
- Shevchenko, A., Wilm, M., Vorm, O., Mann, M. Mass spectrometric sequencing of proteins silver-stained polyacrylamide gels. Anal. Chem. 68, 850-858 (1996).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados