È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Veloce e sensibile colloidale Coomassie G-250 colorazione per le proteine in gel di poliacrilammide
In questo articolo
Riepilogo
Questo video è diffondere una colloidale Coomassie G-250 protocollo di colorazione a seconda Kang Et al. Per la rilevazione di media 4 ng proteine in gel. La colorazione è completata entro 2 ore e senza alcuno sforzo. Noi abitualmente utilizzano il protocollo di Kang per scopi di analisi in gel a base di proteomica.
Abstract
Coomassie Brilliant Blue (CBB) è un colorante comunemente utilizzato per la visualizzazione di proteine separate mediante SDS-PAGE, offrendo una procedura semplice colorazione e quantificazione alto. Inoltre, è completamente compatibile con l'identificazione delle proteine spettrometria di massa. Ma nonostante questi vantaggi, CBB è considerato essere meno sensibile di colorazioni argento o fluorescenza e quindi raramente utilizzato per la rilevazione di proteine in gel analitici approcci basati sulla proteomica.
Diversi miglioramenti del protocollo originale Coomassie 1 sono stati fatti per aumentare la sensibilità della CBB. Due importanti modifiche sono state introdotte per migliorare la rilevazione di proteine a bassa abbondanza convertendo le molecole di colorante in particelle colloidali: Nel 1988, Neuhoff e colleghi hanno applicato il 20% metanolo e concentrazioni più elevate di solfato di ammonio nel G-250 CBB soluzione colorante a base 2, e nel 2004 Candiano et al. stabilito Blue Silver con CBB G-250 con acido fosforico in presenza di solfato di ammonio e metanolo 3. Tuttavia, tutte queste modifiche solo permettono una rilevazione di circa 10 proteine ng. Un protocollo ampiamente fameless per la colorazione Coomassie colloidale è stato pubblicato da Kang et al. Nel 2002 dove si è modificato Neuhoff colloidale protocollo di colorazione CBB per quanto riguarda le sostanze complessanti. Invece di solfato di ammonio hanno usato solfato di alluminio e il metanolo è stato sostituito dal 4 etanolo meno tossici. Il romanzo a base di alluminio colorazione in studio Kang ha dimostrato una sensibilità superiore che rileva fino a 1 ng / banda (fosforilasi b) con variazione scarsa sensibilità in funzione delle proteine.
In questo studio dimostriamo applicazione del protocollo di Kang per una rapida e sensibile colorazione Coomassie colloidale di proteine per scopi di analisi. Ci illustrerà il protocollo veloce e semplice utilizzando bidimensionali gel eseguita di routine nel nostro gruppo di lavoro.
Protocollo
Parte 1: bidimensionale (2-D), elettroforesi su gel con coppa di carico
- IPG-strip reidratazione e concentrandosi isoelettrico (IEF)
- Reidratare gel DryStrip Immobiline, pH 6-11 (7 cm) in 125 microlitri soluzione di reidratazione [7 M urea, 2 M tiourea, 4% CHAPS, 50 hydroxyethyldisulfide mM e 2% IPG tampone pH 6-11] usa il cassetto Immobiline DryStrip Reswelling per almeno 10 ore.
- Sciogliere campione precipitato proteine in un tampone campione IEF [7 M urea, 2 M tiourea, 2% CHAPS, 2% ASB-14, 50 hydroxyethyldisulfide mM e 2% IPG tampone pH 6-11] corrispondente a 60-100 mg di proteine per 100 l .
- Dopo solubilizzazione (almeno 30 minuti a temperatura ambiente), si applicano campione di proteine tramite anodica coppa carico con coppe campioni. Il volume della tazza è 100 l (tazze Collettore permette fino a 150 microlitri).
Nota: è possibile caricare quantità di campione più grande se si inserisce una bassa tensione passo all'inizio del protocollo di messa a fuoco e riempire le tazze mentre c'è ancora un film liquido nella tazza! - Eseguire isoelettrofocusing per 11,1 KVH in modalità gradiente nell'Unità Multiphor elettroforesi II.
- Equilibrazione e SDS-PAGE
- Dopo IEF, le strisce IPG sono stati sottoposti a riduzione e alchilazione, ogni volta 15 minuti su uno shaker, con l'1% e al 2,5% ditiotreitolo Iodoacetamide rispettivamente in soluzione di equilibrio [50 mM Tris-HCl/pH 8.8, 6 M urea, 30% glicerolo e il 2% SDS].
- Lavare le strisce equilibrata con H 2 O e asciugare su carta Whatman loro di rimuovere il tampone in eccesso equilibrio. Successivamente immergere le strisce in SDS-running buffer (1X).
- Seconda dimensione è effettuata mediante SDS-PAGE su sistemi di elettroforesi verticale con una concentrazione di acrilamide totale di 12%. Le strisce IPG equilibrati sono stati collocati sulla parte superiore del gel di separazione e fissato con una soluzione calda agarosio [0,5% di agarosio nella gestione di tampone contenente bromofenolo blu].
- Le proteine sono state separate per 2,5 ore, a partire da 80 V per 15 minuti seguito da 120 V fino a quando il fronte del colorante raggiunge il fondo della cassetta gel.
Parte 2: colorazione Coomassie Colloidale con CBB G-250
1. Soluzioni coloranti
Nota: per la preparazione delle soluzioni colorazione, usare prodotti chimici di alta qualità come puri per analisi (pa) e di acqua di elevata purezza, come si ottiene da sistemi Millipore (Milli-Q acqua).
| Coomassie soluzione: | AD 2000 ml H 2 O | |
| 0,02% (w / v) | CBB G-250 | 0,4 g |
| 5% (w / v) | solfato di alluminio (14-18)-idrato | 100 g |
| 10% (v / v) | etanolo (96%) | 200 ml |
| 2% (v / v) | Acido ortofosforico (85%) | 47 ml |
Nota: per la preparazione della soluzione colorante, l'aggiunta sequenziale dei componenti nel seguente ordine deve essere mantenuta:
- prima sciogliere solfato di alluminio in acqua Milli-Q
- successivamente aggiungere etanolo, omogeneizzare e miscelare CBB G-250 alla soluzione
- di recente, la soluzione è completamente sciolto, aggiungere l'acido fosforico (l'incorporazione dell'acido ai media alcolica lascia le molecole si aggregano in Coomassie loro stato colloidale)
- infine si riempiono di acqua Milli-Q
Nota: la soluzione finale ha una colorazione verde scuro-bluastro aspetto ed è piena di particelle di nuoto in giro:
- Non filtrato questa soluzione!
- Se hai cambiato l'ordine di preparazione, si otterrebbe una soluzione più violetto-bluastro che è meno sensibile.
| Decolorazione soluzione: | AD 2000 ml H 2 O | |
| 10% (v / v) | etanolo (96%) | 200 ml |
| 2% (v / v) | Acido ortofosforico (85%) | 47 ml |
2. Procedura di colorazione
- Dopo la separazione seconda dimensione, rimuovere con attenzione i gel dalle lastre di vetro e trasferirli in un piatto colorazione piena di acqua Milli-Q.
- Lavare il gel tre volte con acqua Milli-Q per 10 minuti su un agitatore orizzontale (lavaggio insufficiente provoca scarsa sensibilità perché il restante SDS sul gel disturba la delimitazione del colorante alle proteine).
- Agitare la soluzione di Coomassie prima dell'uso per disperdere le particelle colloidali in modo uniforme.
- Incubare il gel ben coperto con la soluzione di Coomassie di agitazione su un agitatore per 2-12 ore. Questo genera colorazione di fondo marginali in modo da poter osservare i progressi colorazione in mezzo.
Nota: dopo 10 minuti si possono vedere macchie di proteine prima apparizione, entro 2 ore di incubazione di circa l'80% colorazione ad essolivello massimo s è stato completato. Per quasi 100 colorazione%, notte di incubazione è raccomandato. In alcuni casi, quando la quantità di proteine ad essere macchiato è enorme e la soluzione si trasforma in un azzurro brillante, un aggiornamento della soluzione di colorazione è necessario. - Dopo la procedura di colorazione Coomassie rimuovere la soluzione e sciacquare il gel due volte con acqua Milli-Q.
Nota: è possibile riutilizzare la soluzione colorante fino a quando le particelle sono ancora presenti, altrimenti scartare (tenere a mente che il vostro laboratorio può avere norme speciali per lo smaltimento dei rifiuti). - Rimuovere attaccare le particelle del colorante dal piatto colorazione con un panno privo di tovagliolo di carta e Decolorare per 10 - 60 minuti.
Nota: è anche possibile lavare il gel solo con acqua Milli-Q, ma questo si consiglia solo per preparativa gel perché durerà un irregolare, debole film di Coomassie il gel che si presentano durante la procedura di scansione. - Infine risciacquare il gel due volte con acqua Milli-Q: il gel raggiungeranno il loro spessore originale (l'alcool-acido multimediali rende la contrazione gel) e neutralizzazione in acqua aumenta ulteriormente l'intensità del colore di Coomassie.
Parte 3: I risultati rappresentativi
Se si segue il protocollo sopra descritto si ottengono sul 2-D gel distintivi risolto e ben colorati macchie scure proteina blu. Anche rispetto ad un 2-D gel colorato con l'argento secondo Shevchenko et al. 5, un protocollo sostenendo buona sensibilità e la compatibilità con la spettrometria di massa, otteniamo risultati della colorazione uguale.
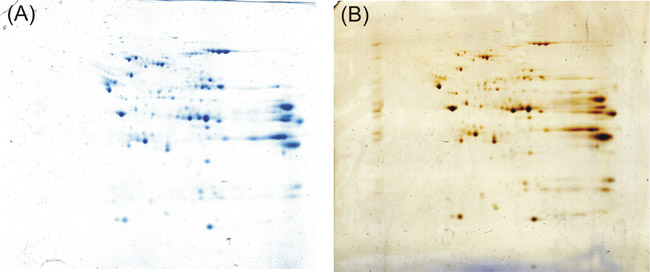
Figura 1: risultato finale della sperimentazione di cui sopra. Kang Coomassie protocollo (A) esegue con forza come la colorazione argento secondo Shevchenko et al. (B) a individuare le proteine dopo 2-D elettroforesi su gel.
Parte 4: Suggerimenti
- Eseguire alcune colorazioni di prova prima di elaborare i propri campioni. Per motivi inspiegabili abbiamo riportato qualche volta che una proteina di interesse non è stato possibile rilevare con successo anche quando milligrammi sono state applicate. In questo caso si consiglia di preparare alcune serie di diluizioni per testare la sensibilità.
- Se avete a basso contenuto di gel di rilevazione della proteina (s) in generale, il trasferimento senza successo dal accatastamento al gel di separazione durante la SDS-PAGE sarà eventualmente il motivo. È possibile verificare tali proteine adesive dalla colorazione il gel compresa l'area di sovrapposizione.
- Per una rapida verifica dei risultati isoelettrofocusing, è possibile direttamente macchiare la IPG-strip senza alcun ulteriore separazione seconda dimensione.
- Di tanto in tanto girare il gel durante la procedura di colorazione in modo che siano macchiati uniformemente da entrambi i lati (se si mantiene il gel immobile, il colorante si lega solo per una parte del gel).
- Abbiamo sperimentato che lo stoccaggio della soluzione colorante in una bottiglia scura aumenta la sua durata (in bottiglia trasparente fino a 4 mesi).
- Dopo la colorazione e la documentazione è possibile mantenere il gel in frigorifero per diversi anni (se si aggiunge soluzione acida di evitare contaminazioni da funghi).
- Decolorazione di spine gel per un trittico digerire può essere accelerata dal riscaldamento in un riscaldatore blocco.
Discussione
Innovativi o solo un altro protocollo Coomassie?
Al momento esistono diversi protocolli per le procedure di colorazione con Coomassie Brilliant Blue. La maggior parte di loro il risultato di modifiche minori o maggiori di uno dei protocolli più comunemente utilizzati dai Neuhoff e colleghi 2. Anche il protocollo di Kang basato sulla formula di Neuhoff. Ma è davvero un'alternativa metodo di colorazione Coomassie per la ricerca proteomica? Noi immagine due questioni principali...
Divulgazioni
Riconoscimenti
Ringraziamo il Dott. Nicola Wiethölter per la preparazione e colorazione di 1-D gel.
Questo lavoro è stato finanziato da una sovvenzione della Deutsche Forschungsgemeinschaft (GRK 1089/project 5 a ND e SM) e sostenuto da una borsa di ricerca dal Manchot Jürgen Stiftung di ND.
Materiali
| Nome del prodotto | Azienda | Catalogo No. | Commenti |
| Per IEF e SDS-PAGE: | |||
| Immobiline DryStrip gel | GE Healthcare | 17-6001-94 | Può essere utilizzato anche 2 anni dopo la data di scadenza. |
| Immobiline DryStrip Reswelling Vassoio | GE Healthcare | 80-6371-84 | Non pulire con solventi organici. Progettato per 7-18 centimetri IPG-strisce. |
| Immobiline DryStrip Kit | GE Healthcare | 18-1004-30 | Include un vassoio di elettrodi, portaelettrodi, anodo e catodo, allineatore e coppa campioni bar e coppe campioni. |
| EPS 3501 XL Alimentazione | GE Healthcare | 18-1130-05 | Forniture di tensione fino a 3500 V. |
| Multiphor II elettroforesi Unità | GE Healthcare | 18-1018-06 | Elettrodi mobili consentono IEF in strisce IPG di ogni lunghezza (7-24 centimetri IPG strisce) |
| PerfectBlue gel sistema Doppia S | Peqlab | 45-1010-C | SDS-PAGE in 10x10 cm mini-gel formato. Gel da camera comprende un sistema di raffreddamento. |
| Per colloidale Coomassie G-250 colorazione: | |||
| colorazione piatti con coperchi | VWR | 216-3412 | Adatto per mini-gel. Sovrapposte a shaker. |
| solfato di alluminio-18-idrato | Merck | 1.01102.5000 | Abbiamo fatto migliore esperienza con Merck. Appena disponibile in 5 pacchetti kg. |
| ortofosforico | Prolabo | 20 624.295 | Venduto in bottiglie di vetro. |
Riferimenti
- Fazekas de St Groth, S., Webster, S. R. G., Datyner, A. Two new staining procedures for quantitative estimation of proteins on electrophoretic strips. Biochim. Biophys. Acta. 71, 377-391 (1963).
- Neuhoff, V., Arold, N., Taube, D., Ehrhardt, W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 9, 255-262 (1988).
- Candiano, G., Bruschi, M., Musante, L., Santucci, L., Ghiggeri, G. M., Carnemolla, B., Orecchia, P., Zardi, L., Rigetti, P. G. Blue Silver: A very sensitive colloidal Coomassie G-250 staining for proteome analysis. Electrophoresis. 25, 1327-1333 (2004).
- Kang, D., Gho, S. G., Suh, M., Kang, C. Highly Sensitive and Fast Protein Detection with Coomassie Brilliant Blue in Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis. Bull. Korean Chem. Soc. 11, 1511-1512 (2002).
- Shevchenko, A., Wilm, M., Vorm, O., Mann, M. Mass spectrometric sequencing of proteins silver-stained polyacrylamide gels. Anal. Chem. 68, 850-858 (1996).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon