Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Быстро и чувствительной Коллоидное Кумасси G-250 для окрашивания белков в полиакриламидном геле
В этой статье
Резюме
Это видео должно популяризировать коллоидных Кумасси G-250 окрашивания протокол в соответствии с Кан Соавт. Для обнаружения среднем 4 нг белка в гелях. Окрашивание выполняется в течение 2 часов и без каких-либо усилий. Мы регулярно использовать протокол Канга для аналитических целей в основе геля протеомики.
Аннотация
Кумасси бриллиантовый синий (CBB) является красителя обычно используется для визуализации белков, разделенных SDS-PAGE, предлагая простой процедуры окрашивания и высокий количественный. Кроме того, она полностью совместима с масс-спектрометрического идентификации белков. Но, несмотря на эти преимущества, CBB считается, менее чувствительны, чем серебро или флуоресценции окрашивания и поэтому редко используется для обнаружения белка в аналитической гель подходов протеомных.
Несколько улучшений оригинальной Кумасси протокол 1 были внесены повысить чувствительность CBB. Два основных изменения были внесены для повышения вероятности обнаружения низкого обильные белки путем преобразования молекул красителя в коллоидных частиц: В 1988 году Neuhoff и коллеги применяется 20% метанола и более высокие концентрации сульфата аммония в CBB G-250 решение на базе окрашивания 2, а в 2004 году Candiano и соавт. создана Blue Silver использованием CBB G-250 с фосфорной кислотой в присутствии сульфата аммония и метанола 3. Тем не менее, все эти изменения просто позволить обнаружения приблизительно 10 нг белка. Широко неизвестный протокол для коллоидного окрашивания Кумасси был опубликован Кан и соавт. В 2002 году, где они изменение коллоидного окрашивания CBB Neuhoff в протокол о комплексообразующих веществ. Вместо того, сульфат аммония они использовали сульфат алюминия и метанола была заменена менее токсичны этанола 4. Роман на основе алюминия, окрашивание в исследовании Кан показал высокую чувствительность, которая обнаруживает, даже в 1 нг / полоса (фосфорилазы б) с небольшим изменением чувствительности в зависимости от белков.
Здесь мы демонстрируем применение протокола Канга для быстрого и чувствительного коллоидного окрашивания Кумасси белков в аналитических целях. Мы проиллюстрируем быстрый и легкий протокол, используя двумерный гель регулярно проводится в нашей рабочей группы.
протокол
Часть 1: двумерные (2-D) гель-электрофореза использованием чашки загрузкой
- IPG-полосы регидратации и изоэлектрической фокусировки (МЭФ)
- Увлажняет Immobiline DryStrip гели, рН 6-11 (7 см) в 125 мкл раствора регидратации [7 М мочевины, 2 М тиомочевины, 4% CHAPS, 50 hydroxyethyldisulfide мм и 2% IPG буфера рН 6-11] с помощью Immobiline DryStrip Reswelling лоток для по крайней мере 10 часов.
- Растворите осажденный образец белка в буфере образца ИЭФ [7 М мочевины, тиомочевины 2 M, 2% CHAPS, 2% АСБ-14, 50 hydroxyethyldisulfide мм и 2% IPG буфера рН 6-11], соответствующие 60-100 мкг белка на 100 мкл .
- После растворения (не менее 30 минут при комнатной температуре), нанесите белок образца через анодный чашку загрузкой использованием образца чашки. Объем чаши составляет 100 мкл (многообразие чашки позволяют до 150 мкл).
Обратите внимание: вы можете загрузить большее количество образцов, если Вы вставите низковольтных шаг в начале фокусировки протокол и пополнить чашки, пока еще есть пленки жидкости в чашке! - Выполните изоэлектрической фокусировки для 11,1 KVH в градиентном режиме в Электрофорез Группа Multiphor II.
- Уравновешивание и SDS-PAGE
- После МЭФ, IPG полосы были подвергнуты сокращению и алкилирования, каждый раз 15 минут на шейкере, используя 1% дитиотреитол и 2,5% соответственно, в iodoacetamide равновесия решение [50 мМ Tris-HCl/pH 8,8, 6 М мочевина, глицерин 30% и 2% SDS].
- Промыть уравновешенной полосы с Н 2 О и промокните их на ватмане, чтобы удалить излишки буфера уравновешивания. После падения полос в SDS-работает буфером (1х).
- Второе измерение производится SDS-PAGE на вертикальные системы электрофорез с общей концентрации акриламида в 12%. Уравновешенной полосы IPG были размещены на верхней части разделения гели и фиксируется с горячим раствором агарозы [0,5% агарозном в управлении буфер, содержащий бромфенола синий].
- Белки были разделены в течение 2,5 часов, начиная с 80 В в течение 15 минут, затем 120 В до красителя фронт достигнет нижней части геля кассету.
Часть 2: Коллоидное окрашивание Кумасси с CBB G-250
1. Окрашивание решения
Примечание: для подготовки окрашивания решений, использование химических веществ с высоким качеством, таких как аналитические класса (в год) и водой высокого качества, как вы получите от Millipore систем (Milli-Q воды).
| Кумасси решение: | объявление 2000 мл H 2 O | |
| 0,02% (м / о) | CBB G-250 | 0,4 г |
| 5% (м / о) | сульфата алюминия-(14-18)-гидрат | 100 г |
| 10% (объем / объем) | этанол (96%) | 200 мл |
| 2% (об. / об) | ортофосфорной кислоты (85%) | 47 мл |
Примечание: для подготовки красящим раствором, последовательного добавления компонентов в следующем порядке должна быть сохранена:
- первый растворяются сульфата алюминия в Milli-Q воды
- после этого добавить этанол, гомогенизации, и соединение CBB G-250 для решения
- не далее как решение полностью не растворится, добавляют фосфорную кислоту (включение кислоты спиртовых средах позволяет Кумасси молекул в их совокупности коллоидное состояние)
- наконец пополнить с Milli-Q воды
Примечание: окончательное решение окрашивания имеет темно-зеленые, голубоватые внешний вид и полное частиц плавание вокруг:
- Не фильтрата это решение!
- Если вы изменили порядок подготовки, вы получите более фиолетово-голубоватого решение, которое является менее чувствительной.
| Destaining решение: | объявление 2000 мл H 2 O | |
| 10% (объем / объем) | этанол (96%) | 200 мл |
| 2% (об. / об) | ортофосфорной кислоты (85%) | 47 мл |
2. Процедура окраски
- После второго разделения измерение, осторожно удалить гель из стеклянных пластин и передача их в сосуд для окрашивания заполнены Milli-Q воды.
- Вымойте гели три раза Milli-Q воде в течение 10 минут на горизонтальной шейкере (недостаточное мытье причины низкой чувствительности, так как остальные SDS на гели нарушает ограничивающий из красителя с белком).
- Встряхните решение Кумасси перед использованием, чтобы разогнать коллоидные частицы равномерно.
- Инкубируйте гели хорошо покрыты решение Кумасси по агитации на шейкере в течение 2-12 часов. Это окрашивание создает маргинальные фоновом режиме, поэтому вы можете наблюдать окрашивание прогресса между ними.
Примечание: через 10 минут вы можете увидеть первые пятна появляются белок, в течение 2 часов инкубации около 80% окрашивания к немус максимальным уровнем завершена. В течение почти 100% окрашивание, ночной инкубации рекомендуется. В некоторых случаях, когда количество белка, чтобы быть окрашены огромен и решение превращается в ярко-синий, обновления красящим раствором необходимо. - После окрашивания процедуру удаления решение Кумасси и ополосните гели дважды Milli-Q воды.
Обратите внимание: вы можете использовать красящим раствором тех пор, пока частицы оставаясь, в противном случае отказаться от него (имейте в виду, что ваша лаборатория может иметь специальные правила по утилизации отходов). - Удалить прилипания частиц красителя от окрашивания блюдо с безворсовой бумажным полотенцем и destain на 10 - 60 минут.
Примечание: Вы также можете мыть гели только с Milli-Q воду, но этого мы рекомендуем только для препаративного гели, потому что будет длиться нерегулярный, слабый фильм Кумасси на гели, которые будут возникать во время процедуры сканирования. - Наконец полоскание гели дважды Milli-Q воды: гели достигнет своей первоначальной толщины (алкоголя, кислых средах делает гели сокращение) и нейтрализации в воде дополнительно усиливает интенсивность цвета в Кумасси.
Часть 3: Представитель результаты
Если вы будете следовать протоколу, описанных выше, вы получите на свой 2-D геле отличительные решен и хорошо окрашенные темно синие пятна белка. Даже по сравнению с 2-D гель окрашивали серебром в соответствии с Шевченко и соавт. 5, протокол утверждая, хорошую чувствительность и совместимость с масс-спектрометрии, мы достигаем равные результаты окрашивания.
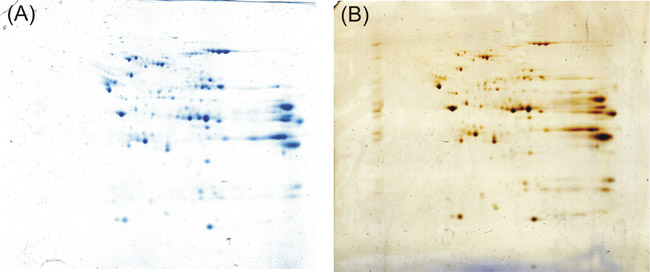
Рисунок 1: Окончательный результат экспериментов, описанных выше. Канга Кумасси протокол () выполняет сильно, как окрашивания серебром в соответствии с Шевченко и соавт. (B) для выявления белков после 2-D электрофореза геля.
Часть 4: Советы и рекомендации
- Выполните несколько пробных окрашивания перед обработкой собственных образцов. Для необъяснимым причинам мы сообщали, что иногда белок не был обнаружен успешно, даже если миллиграмм были применены. В этом случае мы рекомендуем подготовить некоторые серии разведений для проверки чувствительности.
- Если у вас низкий в-гель обнаружения белка (ы) в общем, неудачный трансфер из укладки на разделяющей геля во время SDS-PAGE, возможно, будет причина. Вы можете проверить наличие таких липких белков окрашиванием полный геля в том числе укладки области.
- Для быстрой проверки вашей изоэлектрофокусировки результатов, вы можете напрямую пятно IPG-посадочных полос без дальнейшего разделения второе измерение.
- Изредка в свою очередь, гели во время окрашивания процедуры, чтобы они равномерно окрашенный с обеих сторон (если вы продолжаете гели равнодушным, краска просто связывается с одной стороны гель).
- Мы испытали, что хранение окрашивание раствора в темную бутылку увеличивает ее срок службы (в прозрачных бутылках до 4 месяцев).
- После окрашивания и документирования вы можете хранить гель в холодильнике в течение нескольких лет (если добавить кислого раствора вам избежать загрязнений грибами).
- Destaining геля зажигания для триптического переварить можно ускорить потепление в нагревательный блок.
Обсуждение
Инновационные или просто еще один протокол Кумасси?
На данный момент существует множество протоколов для окрашивания процедуры Кумасси бриллиантовый синий. Большинство из них возникают незначительные или значительные изменения одного из наиболее широко используемы?...
Раскрытие информации
Благодарности
Мы благодарим доктора Никола Wiethölter для подготовки и окрашивания 1-D гелей.
Эта работа финансировалась за счет гранта Deutsche Forschungsgemeinschaft (ГРК 1089/project 5 до Н. Д. и С. М.) и при поддержке исследований общении с Юргеном Manchot Stiftung в НД.
Материалы
| Наименование продукта | Компания | Каталог Нет. | Комментарии |
| Для МЭФ и SDS-PAGE: | |||
| Immobiline DryStrip гели | GE Healthcare | 17-6001-94 | Может использоваться даже спустя 2 года после срока годности. |
| Immobiline DryStrip Reswelling лоток | GE Healthcare | 80-6371-84 | Не чистите с органическими растворителями. Предназначен для 7-18 см IPG-полосок. |
| Immobiline DryStrip Kit | GE Healthcare | 18-1004-30 | Включает в себя поднос, держатель электрода, анода и катода электродов, выравниватель и бар образец чашки и стаканы образца. |
| EPS 3501 XL питания | GE Healthcare | 18-1130-05 | Поставки напряжением до 3500 В. |
| Multiphor II группы Электрофорез | GE Healthcare | 18-1018-06 | Подвижные электроды позволяют МЭФ в IPG полос всей длине (7-24 см IPG полос) |
| PerfectBlue гелевой системы Твин S | Peqlab | 45-1010-C | SDS-PAGE в 10х10 см мини-гель формате. Гель камера включает в себя системы охлаждения. |
| Для коллоидных Кумасси G-250 окрашивания: | |||
| окрашивание блюда с крышками | VWR | 216-3412 | Подходит для мини-гелей. Стекируемые на шейкере. |
| сульфата алюминия-18-гидрат | Merck | 1.01102.5000 | Мы сделали лучший опыт Merck. Просто доступен в 5-килограммовой упаковки. |
| ортофосфорная кислота | Prolabo | 20 624.295 | Продается в стеклянных бутылках. |
Ссылки
- Fazekas de St Groth, S., Webster, S. R. G., Datyner, A. Two new staining procedures for quantitative estimation of proteins on electrophoretic strips. Biochim. Biophys. Acta. 71, 377-391 (1963).
- Neuhoff, V., Arold, N., Taube, D., Ehrhardt, W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 9, 255-262 (1988).
- Candiano, G., Bruschi, M., Musante, L., Santucci, L., Ghiggeri, G. M., Carnemolla, B., Orecchia, P., Zardi, L., Rigetti, P. G. Blue Silver: A very sensitive colloidal Coomassie G-250 staining for proteome analysis. Electrophoresis. 25, 1327-1333 (2004).
- Kang, D., Gho, S. G., Suh, M., Kang, C. Highly Sensitive and Fast Protein Detection with Coomassie Brilliant Blue in Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis. Bull. Korean Chem. Soc. 11, 1511-1512 (2002).
- Shevchenko, A., Wilm, M., Vorm, O., Mann, M. Mass spectrometric sequencing of proteins silver-stained polyacrylamide gels. Anal. Chem. 68, 850-858 (1996).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены