Method Article
Localizando alvos específicos da função para estimulação magnética transcraniana na ausência de equipamento de navegação
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este artigo descreve como localizar alvos específicos de função para intervenções ou tratamentos repetitivos de estimulação magnética transcraniana quando o equipamento de navegação não está disponível.
Resumo
A estimulação magnética transcraniana repetitiva (EMTr) é uma técnica não invasiva que modula a atividade neural no cérebro. Estudos mostraram que a EMTr pode regular a plasticidade neural, promover a reorganização da rede neural e tem sido amplamente aplicada a distúrbios neuropsiquiátricos, como o acidente vascular cerebral. Embora alguns estudos sugiram que a EMTr pode ajudar na reabilitação do AVC, sua eficácia permanece incerta, possivelmente devido a limitações na localização tradicional do hotspot motor da mão.
O hotspot motor da mão é determinado por potenciais evocados motores (MEPs), que refletem a condutividade do trato corticoespinhal ou piramidal, representando o movimento não voluntário. Em contraste, os pontos de ativação da ressonância magnética funcional (fMRI) de uma tarefa motora definem alvos específicos da função, que envolvem percepção e execução motora, representando o movimento voluntário. Com base nisso, propomos o conceito de alvos específicos de função - alvos identificados por meio de técnicas de imagem cerebral voltadas para funções específicas. Alvos específicos de função exibem conectividade funcional mais forte e extensa com regiões cerebrais relacionadas à cognição motora, potencialmente oferecendo efeitos regulatórios mais eficazes do que os hotspots.
Exploramos e validamos os efeitos modulatórios de alvos específicos de função em estudos anteriores. No entanto, instituições sem equipamento de navegação não podem utilizar esses alvos específicos da função. Portanto, desenvolvemos um método de localização não navegado para alvos específicos de função, projetado especificamente para definir e localizar alvos de rTMS no hemisfério ipsilateral pós-AVC, abordando os desafios enfrentados por instituições que não possuem equipamento de navegação ao aplicar rTMS direcionado específico para função.
Introdução
A estimulação magnética transcraniana repetitiva (EMTr) é uma técnica de neuromodulação não invasiva que pode regular a atividade cerebral e tem sido amplamente utilizada no tratamento de distúrbios neuropsiquiátricos, como na reabilitação da disfunção motora da mão em pacientes com AVC. Alguns estudos mostraram que a EMTr tem efeitos terapêuticos nas sequelas pós-AVC 1,2,3, mas sua eficácia permanece incerta. Uma das principais razões para essa incerteza é a dificuldade em identificar alvos de estimulação precisos. Os estudos de EMT direcionados à função motora geralmente dependem do sistema internacional de eletroencefalograma 10-20 para localização, usando C3 / C4 como alvos de estimulação, ou empregam alvos individualizados, como o ponto de acesso motor da mão. No entanto, esses métodos não podem determinar com precisão as áreas corticais afetadas pela EMT. A EMTr direcionada guiada por ressonância magnética funcional (fMRI) tem sido amplamente utilizada no tratamento da depressão.
Nossa pesquisa anterior também explorou sua aplicação no tratamento da síndrome de Tourette, estimulando a área motora suplementar4, mas ainda não foi aplicada à área motora primária (M1). Para rTMS, M1 é distinto de outras regiões do cérebro porque contém o hotspot motor da mão. As contrações musculares induzidas pela EMT representam movimentos involuntários, refletindo a condução de cima para baixo através dos tratos corticoespinhal ou piramidal. Em contraste, os voxels de pico de ativação definidos por fMRI durante as tarefas de toque com os dedos estão mais funcionalmente conectados às regiões cerebrais envolvidas na cognição motora, representando movimentos voluntários5. Portanto, ao tratar distúrbios do movimento, usar a "ativação" relacionada à tarefa definida pela fMRI como alvos específicos da funçãopode levar a melhores resultados terapêuticos 5,6. Em nosso trabalho anterior, comparamos os padrões de ativação cerebral entre a tarefa guiada visualmente e a tarefa autoiniciada usando fMRI e determinamos que a tarefa autoiniciada se alinha mais de perto com os requisitos do treinamento de reabilitação ativa6. Confirmamos esse achado reanalisando um subconjunto de dados do estudo original (Figura 1).
Direcionar com precisão áreas específicas da função cerebral requer ferramentas de navegação precisas. No entanto, os sistemas atuais não são apenas complicados de operar e limitados em funcionalidade, mas os calibradores montados no cabeçote muitas vezes não conseguem permanecer estáveis durante os procedimentos, são propensos a mudanças e são caros - às vezes custando até um milhão de yuans chineses (CNY), aproximadamente 140.000 dólares dos Estados Unidos (USD). De acordo com uma pesquisa sobre os padrões de uso entre as instituições membros do Consórcio de Medicina de Precisão para Terapia de Estimulação Magnética Transcraniana Guiada por Imagem (PRECISE), essas desvantagens levaram as tecnologias de navegação a serem usadas em menos de 5% da pesquisa e prática clínica da EMT na China, apesar de seus benefícios potenciais. Mais importante, no entanto, é que esses sistemas se concentram apenas em "localizar" locais de estimulação sem abordar a questão crítica de "definir" o alvo, ou seja, selecionar a área mais apropriada para estimulação. Dados os altos custos, complexidade operacional e demandas de tempo, é por isso que esses dispositivos ainda não alcançaram ampla adoção clínica.
Para enfrentar o desafio de usar alvos específicos de função sem dispositivos de navegação, exploramos o método de rTMS direcionado e não navegado. Usando fMRI, identificamos alvos específicos da função no córtex motor e os projetamos na superfície do couro cabeludo, permitindo a definição e localização do alvo sem a necessidade de equipamento de navegação7. Embora o rTMS não navegado não forneça monitoramento em tempo real durante todo o processo, ele aborda as questões de precisão na localização do alvo em condições clínicas em que os dispositivos de navegação não estão disponíveis. Este artigo elabora a lógica geral do estudo e descreve o processo experimental completo, com foco particular na comparação dos efeitos de alvos específicos da função na função cerebral em condições navegadas e não navegadas. Para verificar a viabilidade da EMTr direcionada à função específica, o estudo atual incluiu apenas indivíduos saudáveis.
Protocolo
Este trabalho foi aprovado pelo Comitê de Ética da Universidade de Esportes de Chengdu e todos os participantes forneceram consentimento informado por escrito (Figura 2). Este protocolo descreve rTMS direcionado específico de função não navegada versus navegada.
1. Recrutamento de participantes
- Recrute 10 participantes adultos destros saudáveis (de 22 a 29 anos, com 5 mulheres e 5 homens; idade média de 24 ± 2 anos). Exclua um participante devido ao movimento da cabeça superior a 2,5 mm na translação ou 2,5 ° na rotação. Por fim, inclua 9 participantes na análise estatística.
- Critérios de inclusão
- Recrute participantes com idades entre 18 e 30 anos, que sejam destros, passem por exames de segurança de ressonância magnética e EMT e não tenham histórico de epilepsia ou outros distúrbios neurológicos ou psiquiátricos.
- Certifique-se de que os participantes atendam a critérios adicionais, como nenhuma contra-indicação para ressonância magnética, nenhum histórico de lesão cerebral ou doença cardíaca grave e que não estejam tomando medicamentos antiepilépticos ou anticoagulantes.
- Recrute participantes que não tenham distúrbios de consciência, objetos metálicos em seu corpo (como marca-passos, implantes dentários metálicos ou dispositivo intrauterino), nenhuma claustrofobia grave ou gravidez e cuja visão seja normal ou corrigida para normal.
- Critérios de inclusão
- Critérios de exclusão de dados pós-experimento
- Exclua dados de participantes que não conseguem concluir o experimento ou cujo movimento da cabeça durante a varredura de fMRI excede 2,5 mm de translação ou 2,5° de rotação.
- Diretrizes para participantes pré-experimento
- Certifique-se de que todos os participantes assinaram o termo de consentimento informado, que explica o objetivo da pesquisa, os procedimentos experimentais e os possíveis efeitos colaterais e riscos envolvidos.
- Realize exames de segurança para os participantes.
- Explique os procedimentos experimentais e precauções para garantir a execução tranquila do experimento.
- Aconselhe os participantes a evitar álcool, café ou exercícios vigorosos antes do experimento.
- Lembre os participantes de dormir o suficiente e evitar ficar acordados até tarde.
2. Aquisição de dados de fMRI
NOTA: Todos os participantes são submetidos a ressonância magnética no Centro de Imagens Cerebrais de Ressonância Magnética no Campus Qingshuihe da Universidade de Ciência e Tecnologia Eletrônica da China, usando um scanner 3T GE MR750. Cada sessão de varredura inclui uma imagem estrutural ponderada em T1, uma fMRI em estado de repouso de 8 min (RS-fMRI) e uma Task-fMRI de 4 min. Os participantes recebem duas intervenções de EMTr: uma com navegação e outra sem, com intervalo de 1 semana entre as sessões para eliminar os efeitos residuais. Realizar exames de ressonância magnética antes e depois de cada intervenção, totalizando quatro exames.
NOTA: Contrabalanceie a sequência das condições navegadas e não navegadas entre os participantes.
- Procedimentos de verificação
- Antes de entrar na sala de ressonância magnética, coloque tampões de ouvido nos participantes para reduzir o ruído e garantir que todos os objetos de metal sejam removidos.
- Explique as tarefas que os participantes precisam realizar durante a varredura.
- Certifique-se de que os participantes estejam deitados em decúbito dorsal na cama de digitalização, com a cabeça firmemente fixada usando almofadas de espuma para minimizar o movimento da cabeça.
- Durante a varredura RS-fMRI, instrua os participantes a fechar os olhos, evitar pensamentos deliberados e permanecer acordados para evitar adormecer.
- Exporte manualmente as imagens para a unidade de rede ou dispositivo de armazenamento externo designado.
- Parâmetros de digitalização
- Use os seguintes parâmetros de varredura RS-fMRI: tempo de repetição (TR) = 2.000 ms, tempo de eco (TE) = 30 ms, ângulo de inversão (FA) = 90°, campo de visão (FOV) = 220 mm × 220 mm, matriz = 64 x 64, espessura/intervalo do corte = 3,4 mm/0 mm, com 41 cortes no total, cobrindo todo o cérebro e 240 pontos de tempo coletados.
- Use os seguintes parâmetros de varredura de imagens estruturais ponderadas em T1: sequência Spoiled Gradient Rerecall Echo (SPRG), varredura sagital TR/TE = 8,2 ms/2,98 ms, FA = 8°, FOV = 256 mm x 256 mm, matriz = 256 x 256, espessura/lacuna do corte = 1 mm/0 mm, com 166 cortes cobrindo todo o cérebro.
- Use parâmetros de varredura task-fMRI idênticos aos do RS-fMRI, exceto que apenas 120 pontos de tempo são coletados.
- Detalhes da execução da tarefa
- Posicione os participantes com as palmas das mãos voltadas para cima e segurando uma caixa de botões.
- Coloque toalhas entre as cabeças dos participantes e a bobina para estabilizar suas cabeças e minimizar o movimento.
- Design de blocos, tarefa autoiniciada (4 min): Quando uma imagem de um "+" aparecer na tela, peça aos participantes que descansem. Quando uma imagem de um relógio aparecer na tela, instrua o participante a pressionar o botão com o polegar direito a cada 2 s, cronometrando ele mesmo (Figura Suplementar S1).
3. Medição do limiar do motor em repouso (RMT)
NOTA: Use eletromiografia de superfície (EMG) para registrar a amplitude do potencial evocado motor (MEP) do músculo abdutor curto do polegar direito (APB), usando uma bobina em forma de oito de 70 mm conectada ao estimulador Magstim Super Rapid2 para medir o RMT com estimulação de pulso único.
- Remova todos os objetos metálicos antes do teste para evitar interferência e garantir a segurança.
- Peça aos participantes que se sentem em uma cadeira e relaxem completamente.
- Aplique esfoliante e álcool 75% nas mãos dos participantes.
- Coloque eletrodos de superfície de prata/cloreto de prata (Ag/AgCl) na barriga do músculo.
- Posicione o eletrodo de referência na articulação metacarpofalângica, garantindo que a distância entre eletrodos esteja entre 20 mm e 30 mm.
NOTA: Parâmetros relevantes: Use eletrodos com diâmetro de 9 mm para as medições. O sinal EMG do músculo APB é amplificado 1.000 vezes, passa-banda filtrado entre 20 Hz e 2,5 kHz e, em seguida, digitalizado por meio de uma interface microdigital a uma taxa de amostragem de 5 kHz. Os dados são então armazenados em um computador e exibidos em uma tela. - Carregue a imagem estrutural T1 do indivíduo. Coloque a bobina sobre a área motora primária contralateral, especificamente no "joelho médio" do sulco central, também conhecido como "botão da mão", que representa a área da mão no córtex motor primário.
NOTA: Confirme o relaxamento muscular visualmente e por meio do monitoramento EMG. - Mova a bobina ao redor do "botão manual" em incrementos de 0.5 cm.
- Posicione a alça em um ângulo de 45° em relação ao plano sagital médio para medir o MEP.
- Comece com a intensidade de estimulação subliminar, aumentando-a em 5% da saída máxima de estímulo a cada vez. Quando a amplitude pico a pico do MEP exceder 50 μV, diminua a intensidade da estimulação gradualmente em 1% da saída máxima.
- Registre a intensidade mínima de estimulação que evoca pelo menos cinco MEPs maiores ou iguais a 50 μV em 10 estímulos consecutivos de pulso único como o RMT, com este local identificado como o ponto quente. Se um ponto de acesso não puder ser determinado após seis estimulações, mova a bobina para o próximo local.
4. EMTr direcionada específica da função individualizada
- Defina o destino específico da função individualizada.
- Depois de abrir o software de pré-processamento, clique em DPARSF 5.4 e selecione DPARSF Advanced Edition para pré-processar os dados de estado da tarefa usando os parâmetros específicos mostrados no Arquivo Suplementar 1. Execute correções de tempo de corte e movimento da cabeça. Registre as imagens funcionais em imagens estruturais e aplique a suavização espacial com uma largura total na metade máxima (FWHM) de 6 mm.
NOTA: Ajuste os parâmetros específicos de acordo com o modelo da máquina ou a tarefa de digitalização. - Abra o SPM12 e clique em Estimativa de Co-registro. Para a imagem de referência, selecione o arquivo chamado "sub*crop_1.nii" na pasta T1Img. Para a imagem de origem, escolha o arquivo "mean*.nii" na pasta RealignParameter. Para a Outra imagem, selecione o arquivo "ra*.nii" na pasta FunImgAR.
NOTA: Use o arquivo de imagem funcional gerado após a correção de movimento e a correção de tempo de fatia como a "Outra imagem". Arquivos alternativos podem ser selecionados dependendo do objetivo da pesquisa. - Clique em Segmentar | Volumes e selecione o arquivo chamado "sub*crop_1.nii" na pasta T1Img. Para Campos de deformação, selecione Inverso + Avançar e clique em Executar. Repita esse processo para segmentar o arquivo "sub*.nii" da pasta T1Img.
NOTA: Segmente "sub*crop_1.nii" para calcular o ponto de ativação da tarefa individual. Segmente "sub*.nii" para transformar a máscara de espaço padrão em espaço individual. - Clique em Smooth, selecione os arquivos "ra*.nii" da pasta FunImgAR para a opção Image to Smooth e digite 6 6 6 no campo FWHM .
- Realize análises de primeiro nível para obter mapas de ativação individuais e identificar o pico de voxel de ativação como o alvo de estimulação. Inclua as três etapas a seguir:
- Crie uma nova pasta chamada "indiv_act" e clique em Especificar 1º nível. No campo Diretório , selecione a pasta "indiv_act", clique em Unidades para design, escolha Digitalizações e digite 2 para o intervalo de interdigitalização. Na seção Dados e Design , selecione os arquivos "sra*.nii" em Varreduras; na seção Condição , defina o Nome como toque (nome personalizado), insira 0 30 60 90 para o Início e defina as Durações como 15. Clique em Vários regressores e selecione o arquivo "rp_a*.txt" no RealignParameters.
NOTA: Preencha as informações de Início e Duração de acordo com o projeto experimental real. - Estimativa: Em "Selecionar SPM.mat", escolha o arquivo "SPM.mat" na pasta "indiv_act" e gere o mapa de ativação de tarefas individuais, "spmT_0001".
- Clique em Resultados, selecione o arquivo "SPM.mat" na pasta "indiv_act", marque t-contrast e clique em Definir novo contraste. Digite um nome personalizado no campo de nome, insira 1 0 no campo de contraste , clique em Enviar | ESTÁ BEM | Feito. Em Aplicar mascaramento, selecione Nenhum; em p value adjustment to control, escolha None, com um valor de 0,001; Defina o valor do limite & extend como 0.
- Crie uma nova pasta chamada "indiv_act" e clique em Especificar 1º nível. No campo Diretório , selecione a pasta "indiv_act", clique em Unidades para design, escolha Digitalizações e digite 2 para o intervalo de interdigitalização. Na seção Dados e Design , selecione os arquivos "sra*.nii" em Varreduras; na seção Condição , defina o Nome como toque (nome personalizado), insira 0 30 60 90 para o Início e defina as Durações como 15. Clique em Vários regressores e selecione o arquivo "rp_a*.txt" no RealignParameters.
- Clique em Normalizar (Escrever) | Dados. Em Campos de deformação, selecione o arquivo "iy_Crop_1" na pasta T1Img. Para Imagem a ser gravada, escolha a máscara da região cerebral M1. Insira os tamanhos individuais de caixa delimitadora e voxel.
NOTA: Insira os tamanhos da caixa delimitadora e do voxel com base nas características específicas dos dados. - Clique em Coregistrar (Reslice) e selecione spmT_0001 na pasta "indiv_act" para Espaço de definição de imagem. Para Image to Reslice, escolha o arquivo "w*.nii" gerado na etapa 4.1.6.
- Calcule o pico de ativação da tarefa individual: No MATLAB, execute o código de classificação positiva . Para InputName1, selecione o caminho do arquivo "rw*.nii" gerado na etapa 4.1.7; para InputName2, selecione o caminho do arquivo "spmT_0001" na pasta "indiv_act"; para InputName3, selecione o caminho da pasta de saída. A primeira coordenada X com um valor negativo (o hemisfério esquerdo) nos resultados classificados é o pico de ativação da tarefa individual; registre as coordenadas deste ponto.
- Depois de abrir o software de pré-processamento, clique em DPARSF 5.4 e selecione DPARSF Advanced Edition para pré-processar os dados de estado da tarefa usando os parâmetros específicos mostrados no Arquivo Suplementar 1. Execute correções de tempo de corte e movimento da cabeça. Registre as imagens funcionais em imagens estruturais e aplique a suavização espacial com uma largura total na metade máxima (FWHM) de 6 mm.
- Localize o destino específico da função individualizada (navegado).
- Determine a intensidade de saída do estimulador com base no TMR do participante.
- Empregue um sistema de neuronavegação de rastreamento óptico estereotáxico sem moldura, com o participante sentado confortavelmente e usando um calibrador montado na cabeça.
- Clique na opção anatômica : Importe as imagens estruturais ponderadas em T1 do participante para o sistema de navegação para modelagem de cabeça.
- Clique na opção Reconstrução : Reconstrua a pele na imagem.
- Clique na opção Pontos de referência : Use a ferramenta localizador para marcar quatro pontos de referência (o násio, a ponta do nariz e os pontos pré-auriculares em ambos os lados) na cabeça.
- Clique na opção Alvo : Identifique e estabeleça a trajetória alvo na região do cérebro. Localize o alvo de estimulação nas imagens individuais do participante. Após o posicionamento, mova o alvo para alinhá-lo com a mira. Localização completa do TMS.
NOTA: Faça a bobina tangente ao couro cabeludo e alinhe o foco de estimulação com o alvo.
- Localize o destino específico da função individualizado (não navegado).
NOTA: Todo o código para localização do alvo do couro cabeludo é fornecido em Arquivo suplementar 2.- Use o SPM12 para segmentar o modelo cerebral padrão do Montreal Neurological Institute (MNI) (mni_icbm152_t1_tal_nlin_asym_09c.nii, localizado na pasta Templates do DPABI) para obter a máscara de couro cabeludo padrão. As etapas específicas são as seguintes:
- Abra o SPM12, clique em fMRI e selecione Segmento no menu pop-up. Na interface de parâmetros , clique no botão Volumes , selecione o arquivo de modelo de cérebro padrão (ou seja, o modelo de cérebro MNI) na opção Volumes e, em seguida, clique em Campos de deformação para selecionar Inverso + Avançar.
- Contorne as bordas internas e externas do couro cabeludo padrão: No MATLAB, execute as bordas do código. Na janela pop-up, selecione a imagem c5.nii , clique em Concluído e gere o arquivo "c5_edges.nii".
- Contorne a imagem da borda mais externa do couro cabeludo padrão: No MATLAB, execute o código outer_edge . Na interface pop-up, selecione o arquivo c5_edges.nii e clique em Concluído para gerar o arquivo "c5_outer_edge.nii", que representa o limite do couro cabeludo no espaço padrão.
- Use o SPM12 para transformar a borda padrão do couro cabeludo de volta em um espaço individual. Na interface do menu , clique em Normalizar (Gravar) e, na interface de parâmetros , clique em Dados. Em Campos de deformação, selecione o arquivo iy_sub*.nii na pasta T1Img. Escolha c5_outer_edge.nii para Imagens a serem gravadas e insira a caixa delimitadora individual e os tamanhos de voxel.
- Converter coordenadas corticais em coordenadas do couro cabeludo: Abra o código TransCortex2Scalp no MATLAB e execute a primeira linha. Na interface pop-up, insira as coordenadas do ponto de ativação da tarefa individual e selecione o arquivo wc5_outer_edge.nii . Registre as coordenadas do couro cabeludo.
- Abra DPABI_Viewer, clique em Subjacência e selecione a imagem estrutural T1 individual. Localize e registre as coordenadas dos quatro pontos de referência: os picos auriculares esquerdo e direito, o násio e o íon.
- Defina a origem do couro cabeludo: Abra o código de interseção no MATLAB. No editor, insira as coordenadas dos quatro pontos de referência em suas posições especificadas. Execute o código para calcular as coordenadas de interseção da linha que conecta as pontas das orelhas esquerda e direita com a linha que conecta o násio e o íon e, em seguida, registre as coordenadas.
- Mova o ponto de interseção ao longo do eixo Z para o couro cabeludo: Abra o código de origem no MATLAB. Insira as coordenadas do ponto de interseção na posição Definir ponto H no editor. Execute o código e selecione o arquivo wc5_outer_edge.nii na janela pop-up para obter as coordenadas de origem do couro cabeludo O.
- Desenhe uma linha conectando as duas pontas auriculares para definir o eixo X e uma linha conectando o násio e a protuberância occipital externa para definir o eixo Y. O eixo perpendicular a ambos define o eixo Z. O plano bidimensional formado pelo eixo XY é o plano XY.
- Calcule a distância real da origem do couro cabeludo O a cada ponto: Execute o código de distância , selecione o arquivo wc5_outer_edge na interface pop-up e, na Janela de comando , siga os prompts para inserir a origem do couro cabeludo, o destino do couro cabeludo e os quatro pontos de referência.
NOTA: "Cada ponto" refere-se aos quatro pontos de referência do couro cabeludo na etapa 4.3.4 e ao alvo do couro cabeludo. Este código só pode calcular a distância do arco entre um ponto e outro de cada vez. Para calcular a distância entre um par diferente de pontos, você precisa executar o código novamente. - Calcule o ângulo entre a linha que conecta o alvo do couro cabeludo e a origem do couro cabeludo e o eixo X no plano XY: Abra o calculate_angle_X_axis de código e execute a primeira linha. Na janela de comando , insira as coordenadas da origem do couro cabeludo e o alvo de estimulação conforme solicitado.
- Use a régua de direcionamento (como mostrado na Figura 3) para fixar a posição da régua suave correspondente com base na distância e no ângulo calculados nas etapas anteriores. Marque o couro cabeludo com uma caneta lavável. Complete a localização do alvo de estimulação do couro cabeludo (Figura 4).
- Use o SPM12 para segmentar o modelo cerebral padrão do Montreal Neurological Institute (MNI) (mni_icbm152_t1_tal_nlin_asym_09c.nii, localizado na pasta Templates do DPABI) para obter a máscara de couro cabeludo padrão. As etapas específicas são as seguintes:
- EMTr
- Selecione o modo repetitivo para definir os parâmetros de estimulação, incluindo intensidade de estimulação, frequência (10 Hz), duração (3 s), número de pulsos em cada trem (30 pulsos), tempo de espera (12 s), número de trens (60 trens) e número total de pulsos entregues por dia (1.800 pulsos).
- Salve a sessão e pressione o botão Executar para iniciar a estimulação.
NOTA: A intensidade da estimulação é definida de acordo com o TMR do participante, que neste estudo é definido em 100% TMR. - Dentro de meia hora após o término da estimulação, faça com que o participante seja submetido a outra ressonância magnética, usando a mesma sequência de varredura usada antes da estimulação.
5. Detecção de efeito modulatório rTMS (processamento e análise de dados de ressonância magnética)
NOTA: Use o software de pré-processamento para realizar o pré-processamento de dados RS-fMRI, que inclui as seguintes etapas específicas:
- Remova os primeiros 10 pontos de tempo para obter o equilíbrio do sinal e permitir que os participantes se adaptem ao ruído do scanner.
- Corrija o atraso de tempo de aquisição entre as fatias.
- Execute a correção do movimento da cabeça.
NOTA: Diferentes limites de movimento da cabeça podem ser definidos com base nos requisitos específicos do estudo. - Normalize as imagens funcionais para o espaço MNI usando o modelo EPI.
- Regressão
- Remova tendências lineares.
- Aplique filtragem passa-banda (0,01-0,1 Hz).
- Realize a suavização espacial usando um kernel gaussiano com um FWHM de 6 mm.
- Calcule as métricas de atividade cerebral após o pré-processamento, incluindo amplitude de flutuação de baixa frequência (ALFF) e conectividade funcional (FC). Calcule as diferenças nas métricas de atividade cerebral local (ALFF e FC) entre pré-rTMS e pós-rTMS em condições navegadas e não navegadas e conduza testes t pareados nos mapas de diferença (correção GRF, voxel p < 0,001, cluster p < 0,05).
Resultados
Os resultados do teste t pareado e da ANOVA de duas vias indicaram que não houve diferenças significativas nas mudanças no ALFF ou FC antes e depois da EMTr em condições navegadas e não navegadas (correção de GRF, voxel p < 0,001, cluster p < 0,05). Não foram observadas diferenças significativas entre as condições de navegação e não navegação. Este resultado está alinhado com nossas expectativas, indicando que nosso método de não navegação não tem uma desvantagem significativa em comparação com o método de navegação. Para evitar fazer alegações sem suporte de que não há diferenças significativas, apresentamos os mapas de teste t de uma amostra para ambas as condições de rTMS aqui (não corrigida, voxel p < 0,05) (Figura 5). Esses resultados não sobrevivem a nenhum tipo de ajuste de comparação múltipla, como correção de FDR ou GRF. Para avaliar a equivalência das alterações da função cerebral induzidas pelos métodos não navegados e navegados, foi realizada uma análise de poder usando o d de Cohen. Os resultados indicaram que o valor de d de Cohen para ALFF foi de 0,22, enquanto o valor de d de Cohen para FC foi de 0,56.
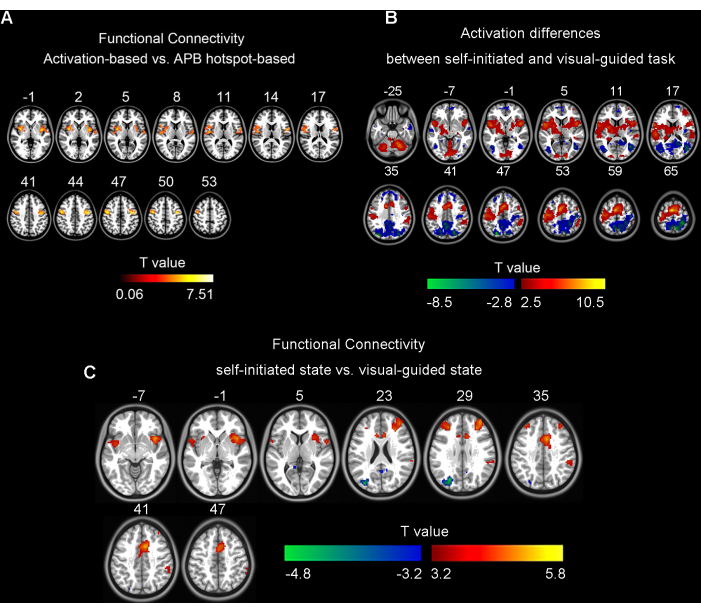
Figura 1: Resultados dos testes t pareados. (A) As diferenças entre a conectividade funcional baseada em ativação e a conectividade funcional baseada em hotspot APB (correção GRF, voxel único p < 0,001, nível de cluster p < 0,05). (B) As diferenças na ativação cerebral entre tarefas de toque de dedo autoiniciadas e guiadas por visual em 25 participantes (correção FDR, q < 0,05). (C) As diferenças entre a conectividade funcional baseada em ativação de estado autoiniciada e guiada por visual em 35 participantes (correção GRF, voxel único p < 0,001, cluster p < 0,05). A Figura 1A foi adaptada de Wang et al. (2020)5; As Figuras 1B,C foram preparadas extraindo um subconjunto diferente de dados de Wang et al. (2023)6. Abreviaturas: APB = Abdutor curto do polegar; GRF = Campo Aleatório Gaussiano; FDR = Taxa de Descoberta Falsa. Clique aqui para ver uma versão maior desta figura.
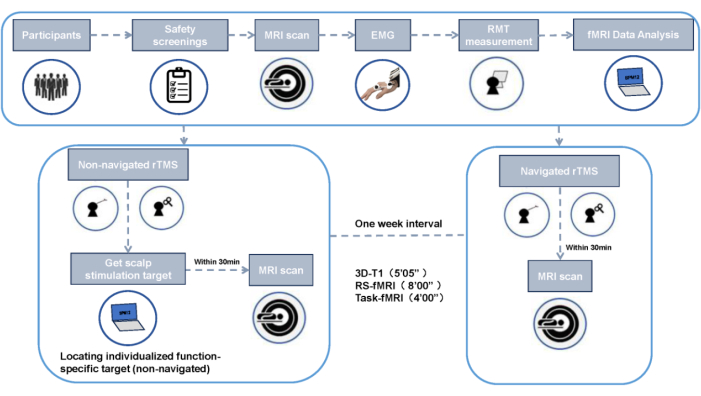
Figura 2: Fluxograma de projeto experimental. Clique aqui para ver uma versão maior desta figura.
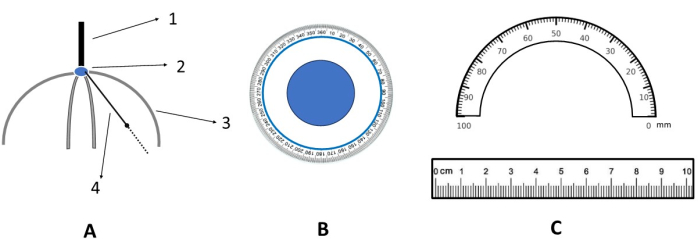
Figura 3: Diagrama esquemático da régua de mira. (A) Vista frontal da régua de mira. 1. Punho; 2. Ponto de ancoragem do couro cabeludo (ou seja, a origem do couro cabeludo no plano XY); 3. Régua de medição rígida (material acrílico); 4. Régua de medição rotativa e flexível (material de silicone). (B) Visão ampliada do ponto de ancoragem do couro cabeludo (ou seja, uma visão ampliada de 2 em A). (C) Vista ampliada da régua de medição flexível (ou seja, vistas ampliadas de 3 e 4 em A). Clique aqui para ver uma versão maior desta figura.

Figura 4: Conversão do alvo cortical específico da função para o alvo do couro cabeludo específico da função. O ponto vermelho representa o alvo cortical específico da função, o ponto verde representa o alvo específico do couro cabeludo e o ponto azul indica a origem do sistema de coordenadas 2D no couro cabeludo. Clique aqui para ver uma versão maior desta figura.
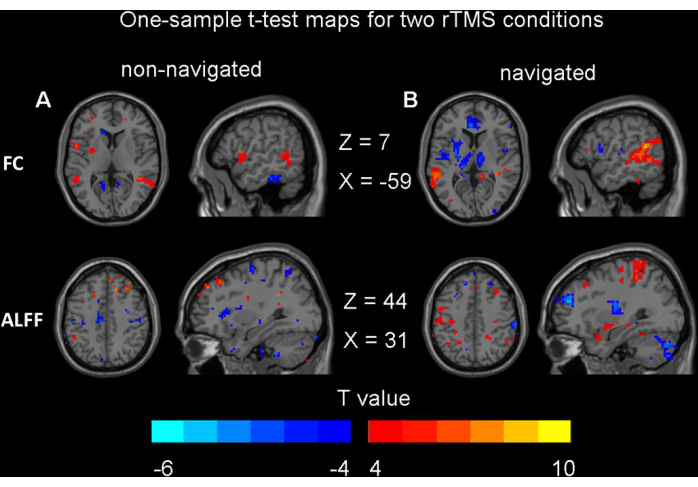
Figura 5: Resultados para testes t de uma amostra. (A) Efeitos modulatórios da EMTr não navegados na função cerebral (p < 0,05, não corrigido). (B) Efeitos modulatórios da EMTr navegados na função cerebral (p < 0,05, não corrigido). Abreviaturas: FC = conectividade funcional; ALFF = amplitude da flutuação de baixa frequência; EMTr = estimulação magnética transcraniana repetitiva. Clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar 1: Parâmetros usados no DPARSF Advanced Edition, conforme mencionado na seção 4.1.1 do protocolo. Clique aqui para baixar este arquivo.
Arquivo Suplementar 2: A pasta zip contendo o código MATLAB usado neste estudo. Clique aqui para baixar este arquivo.
Figura S1 suplementar: Tarefa de toque com o dedo iniciada por você mesmo. A tarefa consistiu em oito blocos, cada um com duração de 30 s, resultando em uma duração total de 4 min. Clique aqui para baixar este arquivo.
Discussão
Neste estudo, propomos o conceito de alvos específicos de função, que são regiões cerebrais associadas a funções específicas identificadas por meio de técnicas de neuroimagem. Inspirados em estudos anteriores 8,9,10, desenvolvemos um novo kit de ferramentas 7,11,12 para localizar alvos do couro cabeludo correspondentes a áreas corticais específicas da função, permitindo a EMTr direcionada à função específica sem a necessidade de equipamento de navegação. Em comparação com a estimulação usando equipamento de navegação, não foram observadas diferenças significativas nos efeitos da função cerebral. Isso sugere que, em certos casos, nosso método pode alcançar rTMS direcionado específico para função individualizada sem a necessidade de equipamentos de navegação caros.
Etapas essenciais no protocolo experimental
Para garantir a precisão da localização rTMS não navegada, o operador deve alinhar a escala na régua de mira com os pontos de referência da orelha esquerda e direita, o násio e o íon. A balança deve ser pressionada firmemente contra a superfície do couro cabeludo para minimizar os erros de medição causados pela espessura do cabelo. Esse processo é crucial para melhorar a precisão da localização e garantir o direcionamento preciso do local de estimulação.
Melhorias no método experimental e possíveis problemas técnicos
Como esse método é uma versão avançada de uma técnica desenvolvida anteriormente11, nenhuma área de melhoria foi identificada até o momento. Em relação a possíveis problemas técnicos, as diferenças individuais na forma do crânio podem resultar em protuberâncias occipitais menos proeminentes em alguns participantes, o que pode levar a erros de localização. Nesses casos, a protuberância occipital pode ser omitida e outros pontos de referência (como os marcadores auriculares esquerdo e direito e o násio) podem ser usados para localização sem comprometer a precisão, pois a redundância já foi levada em consideração na fase de desenvolvimento.
Limitações do método rTMS não navegado
A principal diferença em comparação com a EMTr navegada é a incapacidade de monitorar a distância e a direção relativas da bobina até o alvo de estimulação em tempo real. No entanto, mesmo com o rTMS navegado, o monitoramento em tempo real ainda requer operadores experientes para fazer ajustes manuais.
Importância do método experimental em relação aos métodos existentes
Comparado ao equipamento de navegação, nosso método não requer posicionamento prolongado ou calibração do equipamento. Em vez disso, os usuários simplesmente inserem dados de ressonância magnética no script de código e, em seguida, calculam as distâncias correspondentes por meio de código, após o que o posicionamento é rapidamente concluído usando uma ferramenta de medição. Com base em nossa experiência, esse método economiza pelo menos 15 minutos em comparação com os procedimentos complexos envolvidos na navegação. O equipamento de navegação normalmente requer hardware caro e treinamento especializado, enquanto nosso método requer apenas imagens de ressonância magnética e cálculos padrão para obter uma localização rápida, conveniente e precisa, reduzindo significativamente os custos iniciais e a complexidade operacional.
Em termos de custo, nossa ferramenta de medição recebeu uma patente de invenção (ZL202411874788.9)12., que ajuda a proteger a propriedade intelectual, mas não aumenta significativamente os custos de produção. A modelagem 3D está em andamento e em breve poderemos imprimir a ferramenta em 3D para nossos colaboradores clínicos. As considerações de custo foram integradas à fase de projeto desde o início. Para não colaboradores que desejam adquirir a ferramenta, o preço é de apenas 500 CNY (aproximadamente 70 USD), que permanece acessível apesar da proteção da patente.
Importância e potenciais aplicações do método em campos de pesquisa específicos
A intervenção e o tratamento da EMTr ganharam popularidade crescente nos campos clínico e de pesquisa nos últimos anos. Como todas as técnicas terapêuticas, o desenvolvimento está se movendo em direção a tratamentos precisos e individualizados direcionados a funções específicas. No entanto, os sistemas e equipamentos de navegação são caros e a maioria dos hospitais na China atualmente não tem acesso a esses dispositivos. Este método aborda a questão da rTMS direcionada individualizada e específica da função sem a necessidade de navegação. Ele projeta coordenadas de alvo corticais no couro cabeludo e usa uma ferramenta para marcar as coordenadas na superfície do couro cabeludo. O método de direcionamento cortical baseado em fMRI usado nesta abordagem é idêntico às coordenadas alvo de fMRI empregadas por sistemas e equipamentos de navegação internacionalmente. Embora não possa monitorar a distância e a direção relativas em tempo real entre a bobina e o alvo de estimulação, ele ainda oferece vantagens sobre os métodos clínicos atuais de "direcionamento cego" (como o uso de pontos de referência anatômicos na superfície da pele ou a seleção do ponto de acesso do motor da mão). Este método serve como uma abordagem de transição entre a navegação precisa em tempo real e a "segmentação cega". Para instituições clínicas sem sistemas e equipamentos de navegação, pode resolver problemas clínicos práticos. Este método promoverá significativamente o tratamento de precisão com EMT guiado por fMRI, levando à descoberta de alvos de estimulação mais eficazes e melhorando a eficácia dos tratamentos para vários distúrbios neurológicos e psiquiátricos.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Este estudo foi apoiado pelo Programa de Apoio à Ciência e Tecnologia da Província de Sichuan (nº 2024ZYD0189). Os autores gostariam de agradecer ao PREcision medicine Consortium for Imaging-guided transcranial magnetic Stimulation thErapy (PRECISE) por sua orientação profissional.
Materiais
| Name | Company | Catalog Number | Comments |
| Brainsight Neuronavigation system | Rogue Research Inc. | KITBSF0104 | |
| DPABI_V7.0 toolkit | DeepBrain | for RS-fMRI and task-based fMRI data analysis | |
| Magstim Rapid2 | The MAGSTIM Company Limited | 3012-00 | |
| SPM12 (7771) | Wellcome Centre for Human Neuroimaging | for RS-fMRI and task-based fMRI data analysis | |
| The Brainsight 2 channel electromyography acquisition device | Rogue Research Inc. | NTBX001001 |
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados