Method Article
Localizzazione di bersagli funzionali specifici per la stimolazione magnetica transcranica in assenza di apparecchiature di navigazione
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo articolo descrive come localizzare bersagli specifici per funzioni per interventi o trattamenti ripetitivi di stimolazione magnetica transcranica quando le apparecchiature di navigazione non sono disponibili.
Abstract
La stimolazione magnetica transcranica ripetitiva (rTMS) è una tecnica non invasiva che modula l'attività neurale nel cervello. Gli studi hanno dimostrato che la rTMS può regolare la plasticità neurale, promuovere la riorganizzazione della rete neurale ed è stata ampiamente applicata a disturbi neuropsichiatrici come l'ictus. Sebbene alcuni studi suggeriscano che la rTMS possa aiutare nella riabilitazione dell'ictus, la sua efficacia rimane incerta, probabilmente a causa delle limitazioni nella localizzazione tradizionale dell'hotspot motorio della mano.
L'hotspot motorio della mano è determinato dai potenziali evocati motori (MEP), che riflettono la conduttività del tratto corticospinale o piramidale, rappresentando il movimento non volontario. Al contrario, i punti di attivazione della risonanza magnetica funzionale (fMRI) da un compito motorio definiscono bersagli specifici della funzione, che coinvolgono sia la percezione che l'esecuzione motoria, che rappresentano il movimento volontario. Sulla base di ciò, proponiamo il concetto di bersagli specifici per la funzione, bersagli identificati attraverso tecniche di imaging cerebrale mirate a funzioni specifiche. I bersagli specifici della funzione mostrano una connettività funzionale più forte ed estesa con le regioni cerebrali correlate alla cognizione motoria, offrendo potenzialmente effetti regolatori più efficaci rispetto agli hotspot.
Abbiamo esplorato e convalidato gli effetti modulatori di bersagli specifici per funzione in studi precedenti. Tuttavia, le istituzioni che non dispongono di apparecchiature di navigazione non sono in grado di utilizzare questi obiettivi specifici per le funzioni. Pertanto, abbiamo sviluppato un metodo di localizzazione non navigato per target funzionali specifici, specificamente progettato per definire e localizzare target rTMS nell'emisfero omolaterale post-ictus, affrontando le sfide affrontate dalle istituzioni che non dispongono di apparecchiature di navigazione quando applicano rTMS mirate specifiche per funzione.
Introduzione
La stimolazione magnetica transcranica ripetitiva (rTMS) è una tecnica di neuromodulazione non invasiva in grado di regolare l'attività cerebrale ed è stata ampiamente utilizzata nel trattamento dei disturbi neuropsichiatrici, come nella riabilitazione della disfunzione motoria della mano nei pazienti con ictus. Alcuni studi hanno dimostrato che la rTMS ha effetti terapeutici sulle sequele post-ictus 1,2,3, ma la sua efficacia rimane incerta. Una delle ragioni principali di questa incertezza è la difficoltà di identificare obiettivi di stimolazione precisi. Gli studi TMS che mirano alla funzione motoria spesso si basano sul sistema internazionale di elettroencefalogramma 10-20 per la localizzazione, utilizzando C3/C4 come bersagli di stimolazione, oppure impiegano bersagli individualizzati, come l'hotspot motorio della mano. Tuttavia, questi metodi non sono in grado di determinare con precisione le aree corticali interessate dalla TMS. La risonanza magnetica funzionale (fMRI) guidata da rTMS mirata è stata ampiamente utilizzata nel trattamento della depressione.
La nostra ricerca precedente ha anche esplorato la sua applicazione nel trattamento della sindrome di Tourette stimolando l'area motoria supplementare4, ma non è ancora stata applicata all'area motoria primaria (M1). Per la rTMS, M1 si distingue dalle altre regioni del cervello perché contiene l'hotspot motorio della mano. Le contrazioni muscolari indotte dalla TMS rappresentano movimenti involontari, che riflettono la conduzione dall'alto verso il basso attraverso i tratti corticospinali o piramidali. Al contrario, i voxel di picco di attivazione definiti dalla risonanza magnetica funzionale durante le attività di tocco delle dita sono più funzionalmente collegati alle regioni cerebrali coinvolte nella cognizione motoria, che rappresentano i movimenti volontari5. Pertanto, nel trattamento dei disturbi del movimento, l'utilizzo dell'"attivazione" correlata al compito definita dalla risonanza magnetica funzionale come bersagli specifici della funzione può portare a migliori risultati terapeutici 5,6. Nel nostro lavoro precedente, abbiamo confrontato i modelli di attivazione cerebrale tra il compito guidato dalla vista e il compito auto-avviato utilizzando la risonanza magnetica funzionale e abbiamo determinato che il compito auto-avviato si allinea più strettamente con i requisiti dell'allenamento riabilitativo attivo6. Abbiamo confermato questo risultato rianalizzando un sottoinsieme di dati dello studio originale (Figura 1).
Individuare con precisione specifiche aree funzionali cerebrali richiede strumenti di navigazione precisi. Tuttavia, i sistemi attuali non solo sono ingombranti da utilizzare e limitati nelle funzionalità, ma i calibratori montati sulla testa spesso non riescono a rimanere stabili durante le procedure, sono inclini a spostarsi e sono costosi, a volte costano fino a un milione di yuan cinesi (CNY), circa 140.000 dollari statunitensi (USD). Secondo un'indagine sui modelli di utilizzo tra le istituzioni membri del Precision Medicine Consortium for Imaging-Guided Transcranial Magnetic Stimulation Therapy (PRECISE), questi inconvenienti hanno portato all'utilizzo delle tecnologie di navigazione in meno del 5% della ricerca TMS e della pratica clinica in Cina, nonostante i loro potenziali benefici. Ancora più importante, tuttavia, è che questi sistemi si concentrano solo sulla "localizzazione" dei siti di stimolazione senza affrontare la questione critica di "definire" il target, cioè selezionare l'area più appropriata per la stimolazione. Dati i costi elevati, la complessità operativa e le esigenze di tempo, questo è il motivo per cui questi dispositivi devono ancora raggiungere un'adozione clinica diffusa.
Per affrontare la sfida dell'utilizzo di bersagli specifici per funzione senza dispositivi di navigazione, abbiamo esplorato il metodo della rTMS mirata e non navigata. Utilizzando la fMRI, abbiamo identificato bersagli specifici della funzione nella corteccia motoria e li abbiamo proiettati sulla superficie del cuoio capelluto, consentendo la definizione e la localizzazione del bersaglio senza la necessità di apparecchiature di navigazione7. Sebbene l'rTMS non navigato non fornisca un monitoraggio in tempo reale durante l'intero processo, affronta i problemi di precisione nella localizzazione del bersaglio in condizioni cliniche in cui i dispositivi di navigazione non sono disponibili. Questo articolo elabora il razionale generale dello studio e delinea l'intero processo sperimentale, con particolare attenzione al confronto degli effetti di bersagli specifici per funzione sulla funzione cerebrale sia in condizioni navigate che non navigate. Per verificare la fattibilità della rTMS mirata alla funzione specifica, l'attuale studio ha incluso solo individui sani.
Protocollo
Questo lavoro è stato approvato dal Comitato Etico della Chengdu Sport University e tutti i partecipanti hanno fornito il consenso informato scritto (Figura 2). Questo protocollo descrive l'rTMS mirato non navigato rispetto a quello specifico della funzione navigata.
1. Reclutamento dei partecipanti
- Reclutare 10 partecipanti adulti destrimani sani (di età compresa tra 22 e 29 anni, con 5 femmine e 5 maschi; età media 24 ± 2 anni). Escludere un partecipante a causa di un movimento della testa superiore a 2,5 mm in traslazione o 2,5° in rotazione. Infine, includere 9 partecipanti nell'analisi statistica.
- Criteri di inclusione
- Reclutare partecipanti di età compresa tra 18 e 30 anni, che siano destrimani, superino sia gli screening di sicurezza MRI che TMS e non abbiano una storia di epilessia o altri disturbi neurologici o psichiatrici.
- Assicurarsi che i partecipanti soddisfino criteri aggiuntivi come l'assenza di controindicazioni per la risonanza magnetica, l'assenza di precedenti di lesioni cerebrali o gravi malattie cardiache e che non stiano attualmente assumendo farmaci antiepilettici o anticoagulanti.
- Reclutare partecipanti che non abbiano disturbi della coscienza, oggetti metallici nel loro corpo (come pacemaker, impianti dentali metallici o dispositivi intrauterini), claustrofobia grave o gravidanza e la cui vista sia normale o corretta alla normalità.
- Criteri di inclusione
- Criteri di esclusione dei dati post-esperimento
- Escludere i dati dei partecipanti che non sono in grado di completare l'esperimento o il cui movimento della testa durante la scansione fMRI supera i 2,5 mm di traslazione o i 2,5° di rotazione.
- Linee guida per i partecipanti alla fase pre-esperimento
- Assicurarsi che tutti i partecipanti abbiano firmato il modulo di consenso informato, che spiega lo scopo della ricerca, le procedure sperimentali e i potenziali effetti collaterali e rischi connessi.
- Condurre screening di sicurezza per i partecipanti.
- Spiegare le procedure sperimentali e le precauzioni per garantire una corretta esecuzione dell'esperimento.
- Consigliare ai partecipanti di evitare alcol, caffè o esercizio fisico vigoroso prima dell'esperimento.
- Ricorda ai partecipanti di dormire a sufficienza ed evitare di rimanere alzati fino a tardi.
2. Acquisizione dati fMRI
NOTA: Tutti i partecipanti vengono sottoposti a risonanza magnetica presso il Magnetic Resonance Brain Imaging Center nel campus di Qingshuihe dell'Università di Scienze e Tecnologie Elettroniche della Cina, utilizzando uno scanner 3T GE MR750. Ogni sessione di scansione include un'immagine strutturale pesata in T1, una fMRI in stato di riposo di 8 minuti (RS-fMRI) e una fMRI in stato di riposo di 4 minuti. I partecipanti ricevono due interventi rTMS: uno con navigazione e uno senza, con un intervallo di 1 settimana tra le sessioni per eliminare gli effetti residui. Condurre scansioni MRI prima e dopo ogni intervento, per un totale di quattro scansioni.
NOTA: Controbilanciare la sequenza delle condizioni navigate e non navigate tra i partecipanti.
- Procedure di scansione
- Prima di entrare nella sala di risonanza magnetica, dotare i partecipanti di tappi per le orecchie per ridurre il rumore e assicurarsi che tutti gli oggetti metallici siano stati rimossi.
- Spiega le attività che i partecipanti devono eseguire durante la scansione.
- Assicurati che i partecipanti siano sdraiati supini sul lettino di scansione, con la testa fissata saldamente utilizzando cuscinetti di schiuma per ridurre al minimo il movimento della testa.
- Durante la scansione RS-fMRI, istruisci i partecipanti a chiudere gli occhi, evitare di pensare deliberatamente e rimanere svegli per evitare di addormentarsi.
- Esportare manualmente le immagini nell'unità di rete designata o nel dispositivo di archiviazione esterno.
- Parametri di scansione
- Utilizzare i seguenti parametri di scansione RS-fMRI: tempo di ripetizione (TR) = 2.000 ms, tempo di eco (TE) = 30 ms, angolo di capovolgimento (FA) = 90°, campo visivo (FOV) = 220 mm × 220 mm, matrice = 64 x 64, spessore/spazio della fetta = 3,4 mm/0 mm, con 41 fette in totale, che coprono l'intero cervello, e 240 punti temporali raccolti.
- Utilizzare i seguenti parametri di scansione delle immagini strutturali pesate in T1: sequenza SPRG (Spoiled Gradient Recalled Echo), scansione sagittale TR/TE = 8,2 ms/2,98 ms, FA = 8°, FOV = 256 mm x 256 mm, matrice = 256 x 256, spessore/spazio della fetta = 1 mm/0 mm, con 166 fette che coprono l'intero cervello.
- Utilizzare parametri di scansione task-fMRI identici a quelli della RS-fMRI, tranne per il fatto che vengono raccolti solo 120 punti temporali.
- Dettagli sull'esecuzione delle attività
- Posiziona i partecipanti con i palmi delle mani rivolti verso l'alto e tenendo in mano una pulsantiera.
- Posiziona gli asciugamani tra le teste dei partecipanti e la bobina per stabilizzare le loro teste e ridurre al minimo i movimenti.
- Progettazione del blocco, attività auto-avviata (4 min): Quando sullo schermo appare l'immagine di un "+", chiedi ai partecipanti di riposare. Quando sullo schermo appare l'immagine di un orologio, chiedi al partecipante di premere il pulsante con il pollice destro ogni 2 secondi, cronometrandolo da solo (Figura supplementare S1).
3. Misurazione della soglia del motore a riposo (RMT)
NOTA: Utilizzare l'elettromiografia di superficie (EMG) per registrare l'ampiezza del potenziale evocato motorio (MEP) dal muscolo abduttore breve del pollice destro (APB), utilizzando una bobina a forma di otto da 70 mm collegata allo stimolatore Magstim Super Rapid2 per misurare la RMT con la stimolazione a impulso singolo.
- Rimuovere tutti gli oggetti metallici prima del test per evitare interferenze e garantire la sicurezza.
- Chiedi ai partecipanti di sedersi su una sedia e di rilassarti completamente.
- Applicare uno scrub esfoliante e alcol al 75% sulle mani dei partecipanti.
- Posizionare elettrodi di superficie argento/cloruro d'argento (Ag/AgCl) sulla pancia muscolare.
- Posizionare l'elettrodo di riferimento sull'articolazione metacarpo-falangea, assicurandosi che la distanza tra gli elettrodi sia compresa tra 20 mm e 30 mm.
NOTA: Parametri rilevanti: Utilizzare elettrodi con un diametro di 9 mm per le misurazioni. Il segnale EMG dal muscolo APB viene amplificato 1.000 volte, filtrato in banda passante tra 20 Hz e 2,5 kHz, quindi digitalizzato tramite un'interfaccia microdigitale a una frequenza di campionamento di 5 kHz. I dati vengono quindi memorizzati su un computer e visualizzati su uno schermo. - Caricare l'immagine strutturale T1 dell'individuo. Posizionare la bobina sull'area motoria primaria controlaterale, in particolare sul "ginocchio medio" del solco centrale, noto anche come "manopola della mano", che rappresenta l'area della mano nella corteccia motoria primaria.
NOTA: Confermare il rilassamento muscolare sia visivamente che tramite il monitoraggio EMG. - Spostare la bobina attorno alla "manopola manuale" con incrementi di 0,5 cm.
- Posizionare l'impugnatura con un angolo di 45° rispetto al piano sagittale medio per misurare il MEP.
- Iniziare con un'intensità di stimolazione inferiore alla soglia, aumentandola ogni volta del 5% della massima emissione di stimolo. Quando l'ampiezza picco-picco del MEP supera i 50 μV, diminuire gradualmente l'intensità della stimolazione dell'1% dell'uscita massima.
- Registrare l'intensità minima di stimolazione che evoca almeno cinque MEP maggiori o uguali a 50 μV in 10 stimolazioni consecutive a impulso singolo come RMT, con questa posizione identificata come hotspot. Se non è possibile determinare un hotspot dopo sei stimolazioni, spostare la bobina nella posizione successiva.
4. RTMS mirata personalizzata e specifica per funzione
- Definisci l'obiettivo specifico della funzione individualizzato.
- Dopo aver aperto il software di pre-elaborazione, fare clic su DPARSF 5.4, quindi selezionare DPARSF Advanced Edition per pre-elaborare i dati dello stato dell'attività utilizzando i parametri specifici mostrati nel file supplementare 1. Esegui le correzioni dei tempi di taglio e del movimento della testa. Coregistrare le immagini funzionali con le immagini strutturali e applicare il livellamento spaziale con una larghezza completa a metà massima (FWHM) di 6 mm.
NOTA: Regolare i parametri specifici in base al modello della macchina o all'attività di scansione. - Apri SPM12 e fai clic su Coregister Estimate. Per l'immagine di riferimento, selezionare il file denominato "sub*crop_1.nii" dalla cartella T1Img. Per l'immagine di origine, scegli il file "mean*.nii" dalla cartella RealignParameter. Per l'Altra immagine, selezionare il file "ra*.nii" dalla cartella FunImgAR.
NOTA: Utilizzare il file immagine funzionale generato dopo la correzione del movimento e la correzione della temporizzazione della sezione come "Altra immagine". A seconda dell'obiettivo della ricerca, possono essere selezionati file alternativi. - Fare clic su Segmento | Volumi e selezionare il file denominato "sub*crop_1.nii" dalla cartella T1Img. Per Campi di deformazione, selezionare Inverso + Avanti, quindi fare clic su Esegui. Ripetere questa procedura per segmentare il file "sub*.nii" dalla cartella T1Img.
NOTA: Segmentare "sub*crop_1.nii" per calcolare il punto di attivazione della singola attività. Segmenta "sub*.nii" per trasformare la maschera spaziale standard in spazio individuale. - Fare clic su Leviga, selezionare i file "ra*.nii" dalla cartella FunImgAR per l'opzione Immagine da levigare e immettere 6 6 6 nel campo FWHM .
- Eseguire l'analisi di primo livello per ottenere mappe di attivazione individuali e identificare il voxel di picco di attivazione come bersaglio della stimolazione. Includi i tre passaggi seguenti:
- Crea una nuova cartella denominata "indiv_act" e fai clic su Specifica 1° livello. Nel campo Directory, selezionare la cartella "indiv_act", fare clic su Unità per la progettazione, scegliere Scansioni e immettere 2 per l'intervallo Interscan. Nella sezione Dati e progettazione, selezionare i file "sra*.nii" in Scansioni; nella sezione Condizione, imposta il Nome da toccare (nome personalizzato), inserisci 0 30 60 90 per l'Inizio e imposta le Durate su 15. Fare clic su Regressors multipli e selezionare il file "rp_a*.txt" da RealignParameters.
NOTA: Inserire le informazioni sull'insorgenza e la durata in base al disegno sperimentale effettivo. - Stima: in "Seleziona SPM.mat", scegli il file "SPM.mat" dalla cartella "indiv_act" e genera la mappa di attivazione del task individuale, "spmT_0001".
- Fare clic su Risultati, selezionare il file "SPM.mat" dalla cartella "indiv_act", selezionare t-contrast e fare clic su Definisci nuovo contrasto. Inserisci un nome personalizzato nel campo del nome, inserisci 1 0 nel campo del contrasto , fai clic su Invia | Va bene | Fatto. In Applica mascheratura, selezionare Nessuno; in p Regolazione valore da controllare, scegliere Nessuno, con un valore di 0,001; Impostare il valore di soglia & Extend su 0.
- Crea una nuova cartella denominata "indiv_act" e fai clic su Specifica 1° livello. Nel campo Directory, selezionare la cartella "indiv_act", fare clic su Unità per la progettazione, scegliere Scansioni e immettere 2 per l'intervallo Interscan. Nella sezione Dati e progettazione, selezionare i file "sra*.nii" in Scansioni; nella sezione Condizione, imposta il Nome da toccare (nome personalizzato), inserisci 0 30 60 90 per l'Inizio e imposta le Durate su 15. Fare clic su Regressors multipli e selezionare il file "rp_a*.txt" da RealignParameters.
- Fare clic su Normalizza (Scrivi) | Dati. In Campi di deformazione, selezionare il file "iy_Crop_1" dalla cartella T1Img. Per Immagine da scrivere, scegli la maschera della regione cerebrale M1. Inserisci le singole dimensioni del riquadro di delimitazione e dei voxel.
NOTA: Immettere le dimensioni del riquadro di delimitazione e dei voxel in base alle caratteristiche specifiche dei dati. - Fare clic su Coregister (Reslice), quindi selezionare spmT_0001 dalla cartella "indiv_act" per Image Defining Space. Per Image to Reslice, scegliere il file "w*.nii" generato nel passaggio 4.1.6.
- Calcola il picco di attivazione della singola attività: in MATLAB, esegui il codice positivo di ordinamento . Per InputName1 selezionare il percorso del file "rw*.nii" generato nel passaggio 4.1.7; per InputName2, selezionare il percorso del file "spmT_0001" dalla cartella "indiv_act"; per InputName3 selezionare il percorso della cartella di output. La prima coordinata X con un valore negativo (l'emisfero sinistro) nei risultati ordinati è il picco di attivazione del singolo task; Registrare le coordinate di questo punto.
- Dopo aver aperto il software di pre-elaborazione, fare clic su DPARSF 5.4, quindi selezionare DPARSF Advanced Edition per pre-elaborare i dati dello stato dell'attività utilizzando i parametri specifici mostrati nel file supplementare 1. Esegui le correzioni dei tempi di taglio e del movimento della testa. Coregistrare le immagini funzionali con le immagini strutturali e applicare il livellamento spaziale con una larghezza completa a metà massima (FWHM) di 6 mm.
- Individuare la destinazione specifica della funzione personalizzata (navigata).
- Determinare l'intensità di uscita dello stimolatore in base all'RMT del partecipante.
- Utilizzare un sistema di neuronavigazione a tracciamento ottico stereotassico senza cornice, con il partecipante comodamente seduto e che indossa un calibratore montato sulla testa.
- Fare clic sull'opzione anatomica : Importare le immagini strutturali pesate in T1 del partecipante nel sistema di navigazione per la modellazione della testa.
- Fare clic sull'opzione Ricostruzione : Ricostruisci la pelle sull'immagine.
- Fare clic sull'opzione Punti di riferimento : utilizzare lo strumento localizzatore per contrassegnare quattro punti di riferimento (la nasion, la punta del naso e i punti preauricolari su entrambi i lati) sulla testa.
- Fare clic sull'opzione Target : Identifica e stabilisci la traiettoria target nella regione del cervello. Individuare l'obiettivo di stimolazione sulle immagini individuali del partecipante. Dopo il posizionamento, spostare il bersaglio in modo che si allinei con il mirino. Localizzazione TMS completa.
NOTA: Rendere la bobina tangente al cuoio capelluto e allineare il fuoco di stimolazione con il bersaglio.
- Individuare la destinazione specifica della funzione personalizzata (non navigata).
NOTA: Tutto il codice per la localizzazione del target del cuoio capelluto è fornito in File supplementare 2.- Utilizzare SPM12 per segmentare il modello cerebrale standard del Montreal Neurological Institute (MNI) (mni_icbm152_t1_tal_nlin_asym_09c.nii, che si trova nella cartella Modelli di DPABI) per ottenere la maschera standard del cuoio capelluto. I passaggi specifici sono i seguenti:
- Aprire SPM12, fare clic su fMRI, quindi selezionare Segmento dal menu a comparsa. Nell'interfaccia dei parametri , fare clic sul pulsante Volumi , selezionare il file modello di cervello standard (ad esempio, il modello di cervello MNI) dall'opzione Volumi , quindi fare clic su Campi di deformazione per selezionare Inverso + Avanti.
- Delineare i bordi interni ed esterni del cuoio capelluto standard: in MATLAB, eseguire i bordi del codice. Nella finestra pop-up, seleziona l'immagine c5.nii , fai clic su Fine e genera il file "c5_edges.nii".
- Delineare l'immagine del bordo più esterno del cuoio capelluto standard: in MATLAB, eseguire il codice outer_edge . Nell'interfaccia pop-up, seleziona il file c5_edges.nii e fai clic su Fine per generare il file "c5_outer_edge.nii", che rappresenta il limite del cuoio capelluto nello spazio standard.
- Usa SPM12 per trasformare il bordo standard del cuoio capelluto in uno spazio individuale. Nell'interfaccia del menu , fare clic su Normalizza (Scrittura), quindi, nell'interfaccia dei parametri , fare clic su Dati. In Campi di deformazione, selezionare il file iy_sub*.nii dalla cartella T1Img. Scegli c5_outer_edge.nii per Immagini da scrivere e inserisci le dimensioni del riquadro di delimitazione e dei voxel individuali.
- Converti le coordinate corticali in coordinate del cuoio capelluto: apri il codice TransCortex2Scalp in MATLAB ed esegui la prima riga. Nell'interfaccia pop-up, inserisci le coordinate del singolo punto di attivazione dell'attività e seleziona il file wc5_outer_edge.nii . Registra le coordinate del cuoio capelluto.
- Aprire DPABI_Viewer, fare clic su Sottofondo e selezionare l'immagine strutturale T1 individuale. Individua e registra le coordinate dei quattro punti di riferimento: i picchi auricolari sinistro e destro, la nasion e l'inion.
- Definisci l'origine del cuoio capelluto: apri il codice di intersezione in MATLAB. Nell'editor, inserisci le coordinate dei quattro punti di riferimento nelle posizioni specificate. Esegui il codice per calcolare le coordinate di intersezione della linea che collega gli auricolari sinistro e destro con la linea che collega il nasion e l'inion, quindi registra le coordinate.
- Sposta il punto di intersezione lungo l'asse Z fino al cuoio capelluto: apri il codice di origine in MATLAB. Immettere le coordinate del punto di intersezione nella posizione Definisci punto H nell'editor. Esegui il codice, quindi seleziona il file wc5_outer_edge.nii nella finestra pop-up per ottenere le coordinate di origine del cuoio capelluto O.
- Disegna una linea che collega i due auricolari per definire l'asse X e una linea che collega il naso e la protuberanza occipitale esterna per definire l'asse Y. L'asse perpendicolare a entrambi definisce l'asse Z. Il piano bidimensionale formato dall'asse XY è il piano XY.
- Calcola la distanza effettiva dall'origine del cuoio capelluto O a ciascun punto: esegui il codice della distanza , seleziona il file wc5_outer_edge nell'interfaccia popup e, nella finestra di comando , segui le istruzioni per inserire l'origine del cuoio capelluto, l'obiettivo del cuoio capelluto e i quattro punti di riferimento.
NOTA: "Ogni punto" si riferisce ai quattro punti di riferimento del cuoio capelluto nel passaggio 4.3.4 e all'obiettivo del cuoio capelluto. Questo codice può calcolare solo la distanza dell'arco tra un punto e l'altro alla volta. Per calcolare la distanza tra una coppia di punti diversa, è necessario eseguire nuovamente il codice. - Calcola l'angolo tra la linea che collega l'obiettivo del cuoio capelluto e l'origine del cuoio capelluto e l'asse X nel piano XY: apri il codice calculate_angle_X_axis ed esegui la prima riga. Nella finestra di comando , inserisci le coordinate dell'origine del cuoio capelluto e l'obiettivo della stimolazione come richiesto.
- Utilizzare il righello di puntamento (come mostrato nella Figura 3) per fissare la posizione del righello morbido corrispondente in base alla distanza e all'angolo calcolati nei passaggi precedenti. Segna il cuoio capelluto con una penna lavabile. Completare la localizzazione dell'obiettivo di stimolazione del cuoio capelluto (Figura 4).
- Utilizzare SPM12 per segmentare il modello cerebrale standard del Montreal Neurological Institute (MNI) (mni_icbm152_t1_tal_nlin_asym_09c.nii, che si trova nella cartella Modelli di DPABI) per ottenere la maschera standard del cuoio capelluto. I passaggi specifici sono i seguenti:
- rTMS
- Selezionare la modalità ripetitiva per impostare i parametri di stimolazione, tra cui intensità di stimolazione, frequenza (10 Hz), durata (3 s), numero di impulsi in ciascun treno (30 impulsi), tempo di attesa (12 s), numero di treni (60 treni) e numero totale di impulsi erogati al giorno (1.800 impulsi).
- Salva la sessione e premi il pulsante Esegui per avviare la stimolazione.
NOTA: L'intensità della stimolazione è impostata in base all'RMT del partecipante, che in questo studio è fissato al 100% RMT. - Entro mezz'ora dalla fine della stimolazione, sottoporre il partecipante a un'altra risonanza magnetica, utilizzando la stessa sequenza di scansione utilizzata prima della stimolazione.
5. Rilevamento dell'effetto modulatorio rTMS (elaborazione e analisi dei dati MRI)
NOTA: Utilizzare il software di pre-elaborazione per eseguire la pre-elaborazione dei dati RS-fMRI, che include i seguenti passaggi specifici:
- Rimuovi i primi 10 punti temporali per raggiungere l'equilibrio del segnale e consentire ai partecipanti di adattarsi al rumore dello scanner.
- Correggere il ritardo di acquisizione tra le sezioni.
- Eseguire la correzione del movimento della testa.
NOTA: È possibile impostare limiti di movimento della testa diversi in base ai requisiti specifici dello studio. - Normalizzare le immagini funzionali nello spazio MNI utilizzando il modello EPI.
- Elimina i segnali di disturbo, compresi quelli della sostanza bianca, del liquido cerebrospinale e di sei parametri di movimento della testa.
- Rimuovi le tendenze lineari.
- Applicare il filtro passa-banda (0,01-0,1 Hz).
- Eseguire il livellamento spaziale utilizzando un kernel gaussiano con un FWHM di 6 mm.
- Calcola le metriche dell'attività cerebrale dopo la pre-elaborazione, tra cui l'ampiezza della fluttuazione a bassa frequenza (ALFF) e la connettività funzionale (FC). Calcolare le differenze nelle metriche di attività cerebrale locale (ALFF e FC) tra pre-rTMS e post-rTMS sia in condizioni navigate che non navigate e condurre t-test accoppiati sulle mappe delle differenze (correzione GRF, voxel p < 0,001, cluster p < 0,05).
Risultati
I risultati accoppiati del t-test e dell'ANOVA a due vie hanno indicato che non c'erano differenze significative nelle variazioni di ALFF o FC prima e dopo rTMS sia in condizioni navigate che non navigate (correzione GRF, voxel p < 0,001, cluster p < 0,05). Non sono state osservate differenze significative tra le condizioni di navigazione e quelle di non navigazione. Questo risultato è in linea con le nostre aspettative, indicando che il nostro metodo di non navigazione non presenta uno svantaggio significativo rispetto al metodo di navigazione. Per evitare di fare affermazioni non supportate di differenze significative, presentiamo qui le mappe del test t a campione per entrambe le condizioni rTMS (non corrette, voxel p < 0,05) (Figura 5). Questi risultati non sopravvivono a nessun tipo di aggiustamento del confronto multiplo, come la correzione FDR o GRF. Per valutare l'equivalenza dei cambiamenti della funzione cerebrale indotti dai metodi non-navigated e navigated, è stata condotta un'analisi di potenza utilizzando la d di Cohen. I risultati hanno indicato che il valore d di Cohen per ALFF era 0,22, mentre il valore d di Cohen per FC era 0,56.
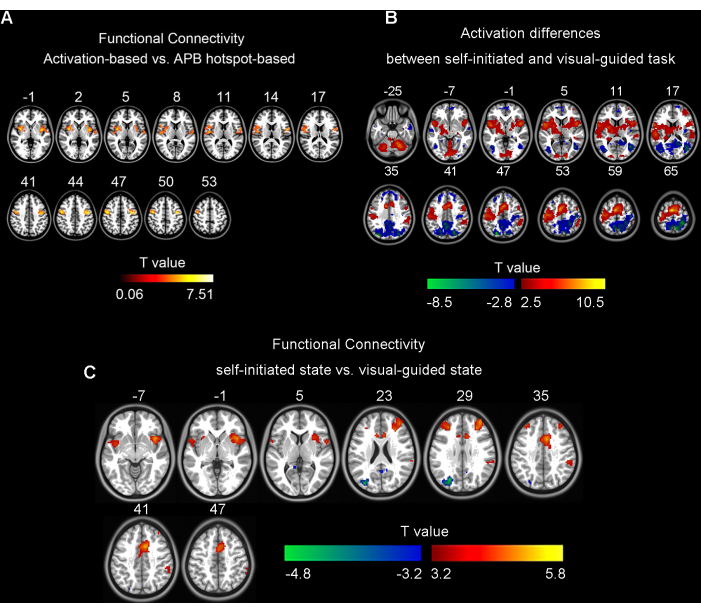
Figura 1: Risultati per i test t accoppiati. (A) Le differenze tra la connettività funzionale basata sull'attivazione e quella basata su hotspot APB (correzione GRF, singolo voxel p < 0,001, livello cluster p < 0,05). (B) Le differenze nell'attivazione cerebrale tra compiti di tocco delle dita auto-iniziati e guidati visivamente in 25 partecipanti (correzione FDR, q < 0,05). (C) Le differenze tra la connettività funzionale basata sull'attivazione dello stato auto-avviata e quella guidata visivamente in 35 partecipanti (correzione GRF, singolo voxel p < 0,001, cluster p < 0,05). La Figura 1A è stata adattata da Wang et al. (2020)5; Le figure 1B, C sono state preparate estraendo un diverso sottoinsieme di dati da Wang et al. (2023)6. Abbreviazioni: APB = Abduttore Breve del Pollice; GRF = Campo casuale gaussiano; FDR = Tasso di false scoperte. Clicca qui per visualizzare una versione più grande di questa figura.
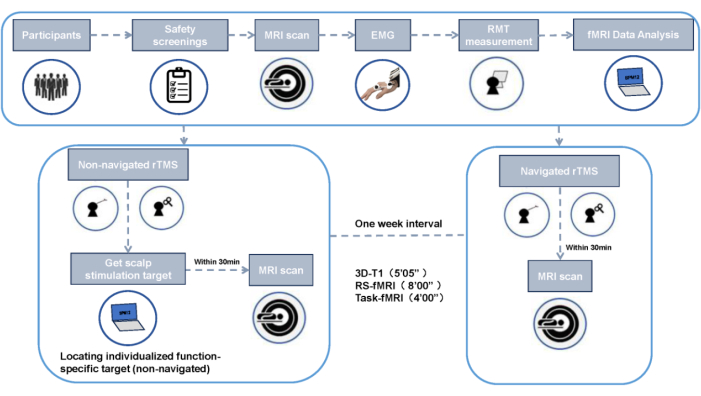
Figura 2: Diagramma di flusso del disegno sperimentale. Fare clic qui per visualizzare una versione più grande di questa figura.
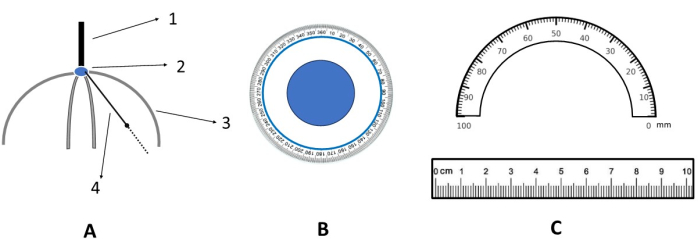
Figura 3: Diagramma schematico del righello di puntamento. (A) Vista frontale del righello di puntamento. 1. Maniglia; 2. Punto di ancoraggio del cuoio capelluto (cioè l'origine del cuoio capelluto nel piano XY); 3. Righello di misura rigido (materiale acrilico); 4. Righello di misura girevole e flessibile (materiale siliconico). (B) Vista ingrandita del punto di ancoraggio del cuoio capelluto (cioè una vista ingrandita di 2 in A). (C) Vista ingrandita del righello di misura flessibile (cioè, viste ingrandite di 3 e 4 in A). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Conversione del target corticale specifico della funzione nel target del cuoio capelluto specifico della funzione. Il punto rosso rappresenta l'obiettivo corticale specifico della funzione, il punto verde rappresenta l'obiettivo del cuoio capelluto specifico della funzione e il punto blu indica l'origine del sistema di coordinate 2D sul cuoio capelluto. Clicca qui per visualizzare una versione più grande di questa figura.
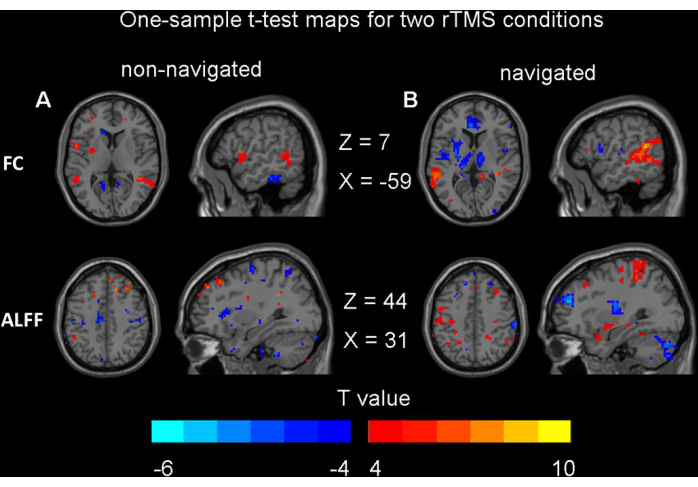
Figura 5: Risultati per i test t su un campione. (A) Effetti modulatori della rTMS non navigati sulla funzione cerebrale (p < 0,05, non corretti). (B) Effetti modulatori della rTMS navigata sulla funzione cerebrale (p < 0,05, non corretto). Abbreviazioni: FC = connettività funzionale; ALFF = ampiezza della fluttuazione a bassa frequenza; rTMS = stimolazione magnetica transcranica ripetitiva. Clicca qui per visualizzare una versione più grande di questa figura.
File supplementare 1: Parametri utilizzati nell'edizione avanzata DPARSF, come indicato nella sezione 4.1.1 del protocollo. Clicca qui per scaricare questo file.
File supplementare 2: la cartella zip contenente il codice MATLAB utilizzato in questo studio. Clicca qui per scaricare questo file.
Figura supplementare S1: Attività di tocco delle dita auto-avviata. L'attività consisteva in otto blocchi, ciascuno della durata di 30 s, per una durata totale di 4 minuti. Clicca qui per scaricare questo file.
Discussione
In questo studio, proponiamo il concetto di bersagli specifici per la funzione, che sono regioni cerebrali associate a funzioni specifiche identificate attraverso tecniche di neuroimaging. Ispirati da studi precedenti 8,9,10, abbiamo sviluppato un nuovo toolkit 7,11,12 per localizzare i bersagli del cuoio capelluto corrispondenti alle aree corticali specifiche della funzione, consentendo una rTMS mirata specifica per la funzione senza la necessità di apparecchiature di navigazione. Rispetto alla stimolazione con apparecchiature di navigazione, non sono state osservate differenze significative negli effetti della funzione cerebrale. Ciò suggerisce che, in alcuni casi, il nostro metodo può ottenere una rTMS mirata personalizzata e specifica per la funzione senza la necessità di costose apparecchiature di navigazione.
Passaggi essenziali del protocollo sperimentale
Per garantire l'accuratezza della localizzazione rTMS non navigata, l'operatore deve allineare la scala sul righello di puntamento con i punti di riferimento dell'orecchio sinistro e destro, la nasione e l'inion. La scala deve essere premuta saldamente contro la superficie del cuoio capelluto per ridurre al minimo gli errori di misurazione causati dallo spessore dei capelli. Questo processo è fondamentale per migliorare l'accuratezza della localizzazione e garantire un targeting preciso del sito di stimolazione.
Miglioramenti al metodo sperimentale e potenziali problemi tecnici
Poiché questo metodo è una versione avanzata di una tecnica precedentemente sviluppata11, finora non sono state identificate aree di miglioramento. Per quanto riguarda i potenziali problemi tecnici, le differenze individuali nella forma del cranio possono comportare protuberanze occipitali meno prominenti in alcuni partecipanti, il che potrebbe portare a errori di localizzazione. In questi casi, la protuberanza occipitale può essere omessa e altri punti di riferimento (come i marcatori dell'orecchio sinistro e destro e la nasion) possono essere utilizzati per la localizzazione senza compromettere l'accuratezza, poiché la ridondanza è già stata presa in considerazione nella fase di sviluppo.
Limitazioni del metodo rTMS non navigato
La differenza principale rispetto alla rTMS navigata è l'incapacità di monitorare in tempo reale la distanza relativa e la direzione della bobina rispetto al bersaglio di stimolazione. Tuttavia, anche con rTMS navigato, il monitoraggio in tempo reale richiede comunque che operatori esperti effettuino regolazioni manuali.
Importanza del metodo sperimentale in relazione ai metodi esistenti
Rispetto alle apparecchiature di navigazione, il nostro metodo non richiede un lungo posizionamento o calibrazione dell'attrezzatura. Invece, gli utenti devono semplicemente inserire i dati MRI nello script del codice e quindi calcolare le distanze corrispondenti tramite codice, dopodiché il posizionamento viene completato rapidamente utilizzando uno strumento di misurazione. In base alla nostra esperienza, questo metodo consente di risparmiare almeno 15 minuti rispetto alle complesse procedure coinvolte nella navigazione. Le apparecchiature di navigazione richiedono in genere hardware costoso e formazione specializzata, mentre il nostro metodo richiede solo immagini MRI e calcoli standard per ottenere una localizzazione rapida, conveniente e precisa, riducendo significativamente sia i costi iniziali che la complessità operativa.
In termini di costi, il nostro strumento di misura ha ottenuto un brevetto di invenzione (ZL202411874788.9)12., che aiuta a proteggere la proprietà intellettuale ma non aumenta significativamente i costi di produzione. La modellazione 3D è attualmente in corso e presto saremo in grado di stampare in 3D lo strumento per i nostri collaboratori clinici. Le considerazioni sui costi sono state integrate fin dall'inizio nella fase di progettazione. Per i non collaboratori che desiderano acquistare lo strumento, il prezzo è di soli 500 CNY (circa 70 USD), che rimane accessibile nonostante la protezione del brevetto.
Importanza e potenziali applicazioni del metodo in specifici ambiti di ricerca
Negli ultimi anni l'intervento e il trattamento della rTMS hanno guadagnato una crescente popolarità sia nella ricerca che nei campi clinici. Come tutte le tecniche terapeutiche, lo sviluppo si sta muovendo verso trattamenti precisi e individualizzati mirati a funzioni specifiche. Tuttavia, i sistemi e le apparecchiature di navigazione sono costosi e la maggior parte degli ospedali in Cina attualmente non ha accesso a tali dispositivi. Questo metodo risolve il problema della rTMS mirata individualizzata e specifica per funzione senza la necessità di navigazione. Proietta le coordinate del bersaglio corticale sul cuoio capelluto e utilizza uno strumento per contrassegnare le coordinate sulla superficie del cuoio capelluto. Il metodo di targeting corticale basato sulla fMRI utilizzato in questo approccio è identico alle coordinate target fMRI impiegate dai sistemi e dalle apparecchiature di navigazione a livello internazionale. Sebbene non sia in grado di monitorare in tempo reale la distanza relativa e la direzione tra la bobina e il bersaglio della stimolazione, offre comunque vantaggi rispetto agli attuali metodi clinici di "puntamento alla cieca" (come l'utilizzo di punti di riferimento anatomici sulla superficie della pelle o la selezione del punto caldo motorio della mano). Questo metodo funge da approccio di transizione tra la navigazione precisa in tempo reale e il "blind targeting". Per le istituzioni cliniche prive di sistemi e apparecchiature di navigazione, può risolvere problemi clinici pratici. Questo metodo promuoverà in modo significativo il trattamento di precisione TMS guidato dalla risonanza magnetica funzionale, portando alla scoperta di obiettivi di stimolazione più efficaci e migliorando l'efficacia dei trattamenti per vari disturbi neurologici e psichiatrici.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questo studio è stato supportato dal Programma di supporto scientifico e tecnologico della provincia del Sichuan (n. 2024ZYD0189). Gli autori desiderano ringraziare il PREcision medicine Consortium for Imaging-guided transcranial magnetic stimulation thErapy (PRECISE) per la loro guida professionale.
Materiali
| Name | Company | Catalog Number | Comments |
| Brainsight Neuronavigation system | Rogue Research Inc. | KITBSF0104 | |
| DPABI_V7.0 toolkit | DeepBrain | for RS-fMRI and task-based fMRI data analysis | |
| Magstim Rapid2 | The MAGSTIM Company Limited | 3012-00 | |
| SPM12 (7771) | Wellcome Centre for Human Neuroimaging | for RS-fMRI and task-based fMRI data analysis | |
| The Brainsight 2 channel electromyography acquisition device | Rogue Research Inc. | NTBX001001 |
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon