Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Проспективное, рандомизированное и контролируемое исследование инъекции мезенхимальных стволовых клеток пуповины человека для лечения язв диабетической стопы
* Эти авторы внесли равный вклад
В этой статье
Резюме
В настоящем протоколе описывается проспективное рандомизированное контролируемое клиническое исследование, в котором оценивают инъекцию мезенхимальных стволовых клеток пуповины человека для лечения хронических язв диабетической стопы.
Аннотация
С развитием общества и экономики заболеваемость язвами диабетической стопы продолжает увеличиваться. В настоящее время традиционная санация со сменой повязок, гипербарическим кислородом и вакуумным герметизирующим дренажем являются основными консервативными методами лечения в клинической практике, а большие раны часто требуют кожных трансплантатов или кожных лоскутов. Тем не менее, эффекты лечения не идеальны, и существует множество осложнений. Из-за сложного патогенеза, длительного времени лечения, значительных сопутствующих трудностей и высокого уровня инвалидности язвы диабетической стопы ложатся тяжелым бременем на пациентов, общество и медицинскую помощь. Согласно нашему предыдущему исследованию, фармакологические эффекты стволовых клеток пуповинной крови человека включают неспецифическую иммунную регуляцию; повышенная секреция факторов роста, вазоактивных факторов и противовоспалительных факторов; повышенная противоинфекционная способность организма человека; устранение воспалений; и содействие ангиогенезу и заживлению язв. Эти эффекты предполагают, что стволовые клетки могут быть полезны в качестве аутологичного или аллогенного лечения рефрактерных ран. Поэтому мы проводим клиническое исследование по лечению рефрактерных диабетических ран стволовыми клетками пуповины человека в нашей клинике для пациентов с язвой диабетической стопы, которые соответствуют критериям включения.
Введение
Сахарный диабет - это заболевание, которое поражает людей во всем мире, и Всемирная организация здравоохранения (ВОЗ) прогнозирует, что число людей с сахарным диабетом увеличится с 285 миллионов в 2010 году до 439 миллионов в 2030 году1. Диабетические язвы стопы (ДФУ) являются одним из наиболее серьезных осложнений диабета и являются основными причинами нетравматических ампутаций нижних конечностей во всем мире 2,3,4,5.
В последнее время стволовые клетки процветают в качестве терапии из-за их плюрипотентности, самообновления и способности стимулировать секрецию регенеративных цитокинов 6,7. Предыдущий клинический эксперимент показал, что гели стволовых клеток, полученные из жиров, оказали положительное влияние на лечение язв стопы при хроническом диабете8. Авторы подтвердили эффективность использования стволовых клеток для лечения диабетических ран у 59 пациентов. На 12-й неделе частота полного закрытия раны в группе лечения и контрольной группе составила 82% и 53% соответственно, что указывает на эффективность стволовых клеток для лечения рефрактерных диабетических ран. В целом, способность стволовых клеток к регенерации, замене, восстановлению и дифференцировке дала бесконечную надежду сообществу медико-биологических наук9.
В 2008 году Dulchavsky et al.10 использовали трансплантаты, содержащие аутологичные стромальные клетки костного мозга (BMSC), для лечения 20 случаев незаживающих ран различной причины. Гистологические исследования показали, что кожные раны 18 пациентов были полностью реэпителизированы. Аналогичным образом, использование аллогенных недиабетических мезенхимальных стволовых клеток (МСК) в желатиновых каркасах для лечения несращенных диабетических ран может способствовать ангиогенезу, увеличивать реэпителизацию и уменьшать площадь язвы11. Тем не менее, в отечественных и зарубежных клинических исследованиях мало случаев лечения ран диабетической стопы стволовыми клетками; Большинство из них представляют собой только отчеты о случаях или предварительные клинические исследования, в которых отсутствует строгий экспериментальный дизайн, и есть несколько крупных образцов с хорошим дизайном или рандомизированными контролируемыми клиническими испытаниями. Поскольку стволовые клетки не являются распространенными лекарственными средствами или биологическими продуктами, методы приготовления и контроля качества различаются в разных исследованиях. Данные одного исследования могут не полностью отражать безопасность всех стволовых клеток одного вида. Поэтому мы дополнительно обобщили соответствующие фундаментальные исследования и доклинические эксперименты с мезенхимальными стволовыми клетками пуповины человека (HUCMSC) и систематически оценивали безопасность и эффективность их клинического применения. На этой основе в качестве лечения была разработана инъекция мезенхимальных стволовых клеток из пуповины человека для заживления ран диабетической стопы. Это исследование направлено на проверку эффективности и безопасности восстановления стволовыми клетками ран диабетической стопы при клиническом использовании.
Таким образом, терапия стволовыми клетками имеет широкий спектр применения и большой потенциал и представляет собой многообещающий новый метод лечения. При постоянной поддержке Национального фонда естественных наук Китая (No 81571901, No 81501671 и No 82172224) мы провели серию исследований по лечению диабетических ран с помощью HUCMSC. Мы опубликовали более 20 связанных статей в Journal of Investigative Dermatology, Stem Cell Research and Therapy и Cell Death and Disease и подали заявки на три национальных патента на изобретения, тем самым накопив большой фундамент исследований12,13. Здесь мы предлагаем стандартный подход к оценке инъекций HUCMSC для заживления ран диабетической стопы. Эта стандартная процедура была одобрена китайскими клиническими испытаниями лекарств (регистрационный номер исследования: клинические испытания китайских лекарств: MR-32-21-015759, [Первоначальный выпуск: 20.10.2021]).
протокол
Это проспективное одноцентровое рандомизированное контролируемое клиническое исследование было одобрено Комитетом по этике дочерней больницы Медицинского университета Сюйчжоу (XYFY2021-KL124-02). Исследование началось в июле 2021 года и продлится до июля 2023 года; В этом эксперименте было набрано 60 пациентов. Все пациенты подписали информированное согласие, которое позволило исследователям использовать их клинические материалы и биологические данные.
1. Набор пациентов
- Критерии включения:
- Убедитесь, что возраст пациентов составляет от 18 до 80 лет (включительно), независимо от пола.
- Убедиться в том, что пациенты с сахарным диабетом 2 типа и язвами диабетической стопы соответствуют диагностическим критериямВОЗ 14 1999 г. и имеют уровень гликированного гемоглобина (HbA1c) ≤10%, выявленный в период скрининга или в течение 3 месяцев до рандомизации.
- Подтвердите, что лодыжечно-плечевой индекс15 целевой конечности составляет не менее 0,8 без перемежающейся хромоты.
- Убедитесь, что язва каждого пациента имеет следующие характеристики:
1 или 2 степень по системе оценок Вагнера16 для язв.
Расположение в стопе, лодыжке или передней голени.
Площадь поперечного сечения после санации 2-5см2.
Отсутствие гноя или некротического вещества, видимого невооруженным глазом, по крайней мере, за 4 недели до рандомизации. - Не включайте в исследование пациентов, проходящих обычное лечение других ран.
- Если присутствует несколько ран, выберите рану, которая соответствует критериям включения и имеет наибольшую площадь вмешательства и оценки.
- Если две или более раны одинаково большие, выберите рану с наиболее тяжелой степенью.
- Если есть две или более раны с одинаковой площадью и степенью, выберите рану с наибольшей продолжительностью раны.
- Участие в данном клиническом исследовании является добровольным. Убедитесь, что пациенты сотрудничают с врачами, проводящими исследование, и подписывают форму информированного согласия.
- Критерии исключения:
- Исключить пациентов с четкими хирургическими показаниями: окклюзия сосудов, обнажение костей, абсцесс, остеомиелит.
- Исключить пациентов с реваскуляризацией или ангиопластикой в течение 3 месяцев до включения.
- Исключить пациентов с печеночной недостаточностью; в частности, исключить пациентов с уровнями АЛТ (аспартатаминотрансферазы) и АСТ (аланинаминотрансферазы), в три раза превышающими верхнюю границу нормы.
- Исключить пациентов с уровнем креатинина в крови более чем в два раза выше верхней границы нормы; сывороточный альбумин <2,0 г/дл; иммуносупрессивное медикаментозное лечение; различные злокачественные опухоли; а также беременность, грудное вскармливание или недавний план родов.
- Исключить пациентов с противопоказаниями, аллергией или известной аллергией на любой компонент препаратов стволовых клеток.
- Исключите пациентов в других ситуациях, которые заставляют исследователя полагать, что пациент не должен участвовать в этом исследовании:
- Исключите пациентов, если после поступления обнаружится, что они не соответствуют наиболее важным критериям приема.
- Исключите пациентов с серьезными побочными реакциями, пациентов, которые просят выйти из исследования, и пациентов, чей законный опекун просит их выйти из исследования.
- Исключите пациентов с недостатком лекарств или эффективных данных наблюдений после включения.
- Рандомизация и ослепление
- Рандомизировать пациентов, набранных из амбулаторного отделения дочерней больницы Медицинского университета Сюйчжоу, в соотношении 1:1 в группу терапии стволовыми клетками и группу обычного лечения ран.
- Проведите двойное слепое исследование для лечения. Убедитесь, что третья сторона измеряет площадь раны каждого пациента.
2. Предоперационное лечение
- Проведение плановых предварительных обследований для пациентов после регистрации, включая рутинный анализ крови, анализ мочи, рутинную оценку стула, оценку биохимической функции, оценку функции свертывания крови, вирусологию и т. Д. Убедитесь, что пациенты наблюдаются в одной и той же больнице, чтобы обеспечить точность тестов.
- Включите пациентов, которые соответствуют критериям включения и подписали письменное информированное согласие. Назначьте каждого субъекта случайным образом либо в группу терапии стволовыми клетками, либо в группу обычного лечения ран в соотношении 1:1, используя метод пропорциональной выборки.
3. Лечебные процедуры
ПРИМЕЧАНИЕ: Пациенты в обеих группах получают систематическую рутинную смену повязки каждые 3 дня. В группе лечения стволовыми клетками пациенты получают местные инъекции стволовых клеток четыре раза (на 1-й, 8-й, 15-й и 22-й день после включения). В группе традиционной обработки ран пациентов обрабатывают повязкой с ионами серебра четыре раза (на 1-й, 8-й, 15-й и 22-й день после включения). Конкретные шаги заключаются в следующем.

Рисунок 1: Процесс лечения. В каждой группе 30 пациентов будут проходить лечение строго по протоколу, описанному в этом исследовании. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Группа терапии стволовыми клетками
- После местной дезинфекции раны повидон-йодом и удаления некротических тканей с раневой поверхности хирургическими ножницами с помощью шприца аспирируйте 50 мл физиологического раствора для очистки раневой поверхности внутри и снаружи.
- Измерьте область раны, используя стерильный крючок для края фольги методом17. Наложите на раневую поверхность прозрачную пленочную повязку с координатной сеткой, а по ее краю маркером очертите форму раневой поверхности. Рассчитайте площадь раны в соответствии с площадью каждой координатной сетки пленки.
- Вводят мезенхимальные стволовые клетки пуповины человека (2 x 105 клеток/см2; 0,4 мл/см2) на периферию и в основание раны (расстояние между инъекциями: 0,75 см; объем инъекции: 0,1 мл/участок).
ПРИМЕЧАНИЕ: Количество инъекций для каждого пациента зависит от области раны. - Обрежьте стерильную повязку до соответствующего размера, накройте ею раневую поверхность, а затем перевязьте.
- Традиционная группа лечения ран
- После местной дезинфекции раны йодофором и удаления некротической ткани с раневой поверхности хирургическими ножницами с помощью шприца аспирируйте 50 мл физиологического раствора для очистки раневой поверхности внутри и снаружи.
- Измерьте область раны, используя стерильный крючок для края фольги методом17. Наложите на раневую поверхность прозрачную пленочную повязку с координатной сеткой, а по ее краю маркером очертите форму раневой поверхности. Рассчитайте площадь раны в соответствии с площадью каждой координатной сетки пленки.
- Обрежьте повязку с ионами серебра до соответствующего размера, накройте ею раневую поверхность, а затем перевязьте.
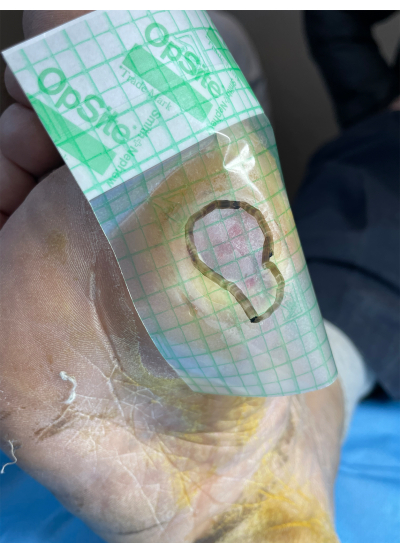
Рисунок 2: Принципиальная схема измерения площади язвы стопы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
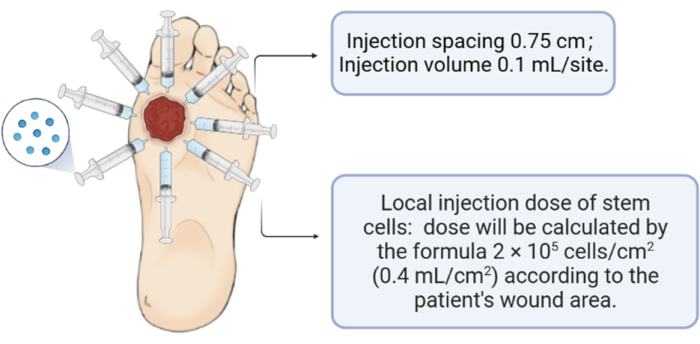
Рисунок 3: Схема инъекции мезенхимальных стволовых клеток пуповины человека. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Индикаторы наблюдения
- Получите демографические данные испытуемых.
- Запишите сопутствующее лечение; В частности, запишите состояние раны (местоположение, площадь, глубина, инфекция и ишемия), скорость заживления раны, время заживления и осложнения.
- Проведите лабораторные исследования. Берут раневой секрет на мазки и бактериологический посев. Проведите обычные анализы крови и анализы на функцию печени и почек.
5. Последующие действия
- Обследуйте пациентов в первый день терапии и во время контрольных визитов через 15 дней и 30 дней после последней терапии.
- Проводите последующее наблюдение, используя как амбулаторные, так и телефонные приемы, чтобы записать эффекты лечения, изменения состояния, ситуацию выздоровления и текущий статус жизни.
6. Оценка эффективности результатов
- Проведите клиническую оценку в соответствии со следующими критериями.
- Рассчитайте первичный индекс результата:
Скорость заживления раны за 30 дней = (исходная область раны − незажившая область раны через 30 дней)/исходная область раны × 100%. - Рассчитайте индекс вторичного результата
- Время заживления раны: Определите время закрытия раны как время, когда рана полностью реэпителизируется.
- Рассчитайте полную скорость заживления:
Коэффициент полного исцеления = количество полных исцеленных случаев / общее количество случаев × 100%
- Рассчитайте скорость хирургического вмешательства:
Частота хирургических вмешательств = количество хирургических вмешательств / общее количество случаев × 100%.
ПРИМЕЧАНИЕ: Субъекты, перенесшие одну из следующих процедур, регистрируются как пациенты с хирургическими вмешательствами: санация и дренирование, пересадка кожи, прилегающий кожный лоскут, дистальный кожный лоскут, неанастомозный кожный лоскут и ампутация. - Проведите бактериальный посев18 в соответствии со стандартными процедурами клинического осмотра и запишите результаты бактериального посева патогена ≥1 как положительные. Рассчитайте процент положительных результатов патогена:
Процент положительных патогенов = количество выявленных случаев заражения патогеном / общее количество случаев × 100%.
- Рассчитайте первичный индекс результата:
7. Процедуры безопасности
- В случае нежелательного явления (любое заболевание, новые симптомы, признаки или отклонения от нормы лабораторного обследования или ухудшение исходных симптомов и признаков, возникающих во время клинического исследования стволовых клеток, независимо от того, связано ли это событие с клиническим исследованием препарата или нет), примите необходимые меры для лечения и спасения.
- Отслеживайте и исследуйте все нежелательные явления и процесс лечения, а также подробно записывайте результаты до тех пор, пока они не будут должным образом разрешены или пока состояние не станет стабильным. Если тест является ненормальным и имеет клиническое значение, следите за ним, пока он не вернется к норме.
Результаты
В настоящее время наше исследование все еще находится на стадии набора пациентов, и в настоящее время мы завершили трех пациентов в группе лечения HUCMSCs и трех пациентов в контрольной группе повязками с ионами серебра, в результате чего в общей сложности шесть пациентов с хроническими р?...
Обсуждение
ДФУ являются одной из основных глобальных проблем общественного здравоохранения и одной из основных причин ампутаций нижних конечностей и ухудшения качества жизни, связанного со здоровьем19,20. В настоящее время в клиническом лечении по-прежнему преобла...
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Авторы благодарят дочернюю больницу Медицинского университета Сюйчжоу за сотрудничество, включая набор и наблюдение за пациентами с ранами диабетической стопы. Авторы также благодарят пациентов, которые участвовали в опросе потребностей пациентов во время разработки этого исследования.
Автор(ы) объявляют о получении следующей финансовой поддержки для исследования, авторства и/или публикации этой статьи: Национальный фонд естественных наук Китая 82172224, Программа последипломных исследований и практических инноваций провинции Цзянсу (SJCX22-1271) и Комиссия по инновациям и технологиям (Health@InnoHK).
Материалы
| Name | Company | Catalog Number | Comments |
| Silver Iin Wound Dressing | Shandong Cheerain Medical Co.,Ltd. | 20152640521 | Sterile silver ion dressing for medical use (Type F) 10 cm x 10 cm |
| Human Umbilical Cord Mesenchymal Stem Cells Injection | Shandong Qilu Cell Therapy Engineering Technology Co., Ltd. | 32183185-X | Main components: human umbilical cord mesenchymal stem cells. Pharmacological effect: non-specific immunomodulator can enhance the secretion of growth factor, vasoactive factor and anti-inflammatory factor, improve the anti infection ability of human body, eliminate inflammation, promote angiogenesis and ulcer healing. |
| Sterile mesh film transparent dressing | Smith & Nephew | 20162644490 | Sterile mesh film transparent dressing (used for wound area measurement) 6 cm x 7 cm |
Ссылки
- Sun, H., et al. IDF diabetes atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Research and Clinical Practice. 183, 109119 (2022).
- Volmer-Thole, M., Lobmann, R. Neuropathy and diabetic foot syndrome. International Journal of Molecular Sciences. 17 (6), 917 (2016).
- Boulton, A. J. The pathway to foot ulceration in diabetes. The Medical Clinics of North America. 97 (5), 7755-7790 (2013).
- Kumar, S., et al. The prevalence of foot ulceration and its correlates in type 2 diabetic patients: a population-based study. Diabetic Medicine. 11 (5), 480-484 (1994).
- Margolis, D. J., Jeffcoate, W. Epidemiology of foot ulceration and amputation: Can global variation be explained. The Medical Clinics of North America. 97 (5), 791-805 (2013).
- Burgess, J. L., Wyant, W. A., Abdo Abujamra, B., Kirsner, R. S., Jozic, I. Diabetic wound-healing science. Medicina. 57 (10), 1072 (2021).
- Behr, B., Ko, S. H., Wong, V. W., Gurtner, G. C., Longaker, M. T. Stem cells. Plastic and Reconstructive Surgery. 126 (4), 1163-1171 (2010).
- Moon, K. C., et al. Potential of allogeneic adipose-derived stem cell-hydrogel complex for treating diabetic foot ulcers. Diabetes. 68 (4), 837-846 (2019).
- Bacakova, L., et al. Stem cells: Their source, potency and use in regenerative therapies with focus on adipose-derived stem cells - A review. Biotechnology Advances. 36 (4), 1111-1126 (2018).
- Dulchavsky, D., et al. marrow-derived stromal cells (BMSCs) interact with fibroblasts in accelerating wound healing. Journal of Investigative Surgery. 21 (5), 270-279 (2008).
- Hu, Y., et al. Exosomes derived from pioglitazone-pretreated MSCs accelerate diabetic wound healing through enhancing angiogenesis. Journal of Nanobiotechnology. 19 (1), 150 (2021).
- Meng, F., et al. CircARHGAP12 triggers mesenchymal stromal cell autophagy to facilitate its effect on repairing diabetic wounds by sponging miR-301b-3p/ATG16L1 and miR-301b-3p/ULK2. The Journal of Investigative Dermatology. 142 (7), 1976.e4-1989.e4 (2022).
- Shen, C., et al. Exosomal microRNA rectangle93 rectangle3p secreted by bone marrow mesenchymal stem cells downregulates apoptotic peptidase activating factor 1 to promote wound healing. Bioengineered. 13 (1), 27-37 (2022).
- Alberti, K. G., Zimmet, P. Z. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: Diagnosis and classification of diabetes mellitus provisional report of a WHO consultation. Diabetic Medicine. 15 (7), 539-553 (1998).
- Lijmer, J. G., Hunink, M. G., vanden Dungen, J. J., Loonstra, J., Smit, A. J. ROC analysis of noninvasive tests for peripheral arterial disease. Ultrasound in Medicine & Biology. 22 (4), 391-398 (1996).
- Wagner Jr, F. W. The dysvascular foot: A system for diagnosis and treatment. Foot & Ankle. 2 (2), 64-122 (1981).
- Griffin, J. W., Tolley, E. A., Tooms, R. E., Reyes, R. A., Clifft, J. K. A comparison of photographic and transparency-based methods for measuring wound surface area. Physical Therapy. 73 (2), 117-122 (1993).
- Lipsky, B. A., et al. Diagnosis and treatment of diabetic foot infections. Plastic and Reconstructive Surgery. 117 (7 Suppl), 212S-238S (2006).
- Huang, Y. Y., et al. Effect of a novel macrophage-regulating drug on wound healing in patients with diabetic foot ulcers: A randomized clinical trial. JAMA Network Open. 4 (9), e2122607 (2021).
- Yarahmadi, A., et al. The effect of platelet-rich plasma-fibrin glue dressing in combination with oral vitamin E and C for treatment of non-healing diabetic foot ulcers: A randomized, double-blind, parallel-group, clinical trial. Expert Opinion on Biological Therapy. 21 (5), 687-696 (2021).
- Virador, G. M., de Marcos, L., Virador, V. M. Skin wound healing: Refractory wounds and novel solutions. Methods in Molecular Biology. 1879, 221-241 (2019).
- Um, S., Ha, J., Choi, S. J., Oh, W., Jin, H. J. Prospects for the therapeutic development of umbilical cord blood-derived mesenchymal stem cells. World Journal of Stem Cells. 12 (12), 1511-1528 (2020).
- Xiao, M., et al. Dynamic biological characteristics of human bone marrow hematopoietic stem cell senescence. Scientific Reports. 12, 17071 (2022).
- Zhang, Z., et al. Safety and immunological responses to human mesenchymal stem cell therapy in difficult-to-treat HIV-1-infected patients. AIDS. 27 (8), 1283-1293 (2013).
- Wu, M., et al. Human umbilical cord mesenchymal stem cell promotes angiogenesis via integrin beta1/ERK1/2/HIF-1alpha/VEGF-A signaling pathway for off-the-shelf breast tissue engineering. Stem Cell Research & Therapy. 13 (1), 99 (2022).
- Li, K., et al. Anti-inflammatory and immunomodulatory effects of the extracellular vesicles derived from human umbilical cord mesenchymal stem cells on osteoarthritis via M2 macrophages. Journal of Nanobiotechnology. 20 (1), 38 (2022).
- Qin, H. L., Zhu, X. H., Zhang, B., Zhou, L., Wang, W. Y. Clinical evaluation of human umbilical cord mesenchymal stem cell transplantation after angioplasty for diabetic foot. Experimental and Clinical Endocrinology & Diabetes. 124 (8), 497-503 (2016).
- Cai, J., et al. Umbilical cord mesenchymal stromal cell with autologous bone marrow cell transplantation in established Type 1 diabetes: A pilot randomized controlled open-label clinical study to assess safety and impact on insulin secretion. Diabetes Care. 39 (1), 149-157 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены