Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Электрохимически и Bioelectrochemically Индуцированные аммония Recovery
В этой статье
Резюме
We demonstrate the extraction of ammonium from an ammonium-rich stream using an electrochemical and a bioelectrochemical system. The reactor setup, operation and data analysis are discussed.
Аннотация
Streams such as urine and manure can contain high levels of ammonium, which could be recovered for reuse in agriculture or chemistry. The extraction of ammonium from an ammonium-rich stream is demonstrated using an electrochemical and a bioelectrochemical system. Both systems are controlled by a potentiostat to either fix the current (for the electrochemical cell) or fix the potential of the working electrode (for the bioelectrochemical cell). In the bioelectrochemical cell, electroactive bacteria catalyze the anodic reaction, whereas in the electrochemical cell the potentiostat applies a higher voltage to produce a current. The current and consequent restoration of the charge balance across the cell allow the transport of cations, such as ammonium, across a cation exchange membrane from the anolyte to the catholyte. The high pH of the catholyte leads to formation of ammonia, which can be stripped from the medium and captured in an acid solution, thus enabling the recovery of a valuable nutrient. The flux of ammonium across the membrane is characterized at different anolyte ammonium concentrations and currents for both the abiotic and biotic reactor systems. Both systems are compared based on current and removal efficiencies for ammonium, as well as the energy input required to drive ammonium transfer across the cation exchange membrane. Finally, a comparative analysis considering key aspects such as reliability, electrode cost, and rate is made.
This video article and protocol provide the necessary information to conduct electrochemical and bioelectrochemical ammonia recovery experiments. The reactor setup for the two cases is explained, as well as the reactor operation. We elaborate on data analysis for both reactor types and on the advantages and disadvantages of bioelectrochemical and electrochemical systems.
Введение
Восстановление ценных продуктов из сточных вод приобретает особое значение как ценные ресурсы истощаются и лечение без восстановления представляет собой лишь стоимость. Сточные воды содержит энергию и питательные вещества, которые могут быть восстановлены, и восстановление питательных веществ может помочь, чтобы закрыть производство петлю 1. Восстановление энергии через анаэробного сбраживания является хорошо установленный процесс, в то время как восстановление питательных веществ реже. Восстановление питательных веществ из потоков жидких отходов, таких как моча и навоз было широко изучено, например, за счет производства струвита и прямой зачистки аммиака 2,3. Тем не менее, потребность в химическом того является недостатком этих процессов 4. Здесь мы представляем технику для восстановления катионных питательных веществ из отходов, в том числе как калий и аммоний. Катионной форме этих питательных веществ позволяет восстановить с помощью ионоселективных мембран в электрохимической системе. В этом случае, electrochemicаль система состоит из анодной камеры (где происходит окисление), катодную камеру (где происходит восстановление) и ионов мембрана для разделения отсеков. Напряжение, приложенное к ячейке для получения тока от анода к катоду. Это напряжение может быть сгенерирован с помощью внешнего источника питания, чтобы ездить окисление воды и реакции восстановления. Альтернативно анодное окисление, например, из органических, может быть, катализируемой электроактивных бактерий, требующих меньше энергии. Чтобы закрыть контур и поддерживать баланс заряда, и заряженные частицы должны мигрировать между электродами для каждого электрона, генерируемого. Аммоний транспорт из анодной камеры в катодную камеру через катионообменную мембрану (CEM), таким образом, компенсировать поток электронов 4,5.
Техника, представленная здесь, не только удаляет аммоний из отходов, но и позволяет его восстановления. Общий азот аммиака (TAN) существует в равновесии как Аммонаий (NH + 4) и аммиак (NH 3), и зависит от рН и температуры 6. NH + 4 имеется в изобилии из-за высокой концентрации TAN и близким к нейтральному рН в анодной камере и положительно заряженных этого вида, следовательно, можно управлять током через СЕМ в катодную камеру. В настоящее время управляет уменьшение воды на катоде, что приводит к получению гидроксид-ионов и газообразного водорода. TAN равновесие смещается почти до 100% NH 3 в связи с высоким рН в катодной камере (> 10,0). NH 3 представляет собой газ, который может быть легко переведен с помощью циркуляции воздуха из десорбера в абсорбционную колонну, где он удерживается и концентрировали в растворе кислоты.
Эта технология имеет потенциал, чтобы уменьшить токсичность аммония во время анаэробного сбраживания N богатых потоков, как навоз, тем самым увеличивая извлечение энергии из этих отходов, в то же времявыздоравливающие питательные вещества 4. Электрохимическое и биоэлектрохимических извлечение аммония также могут быть применены в качестве питательных веществ для восстановления техники на отходов с высоким содержанием TAN, таких как моча, таким образом, избежать затрат на удаление питательных веществ в КОС 7.
Протокол, представленные здесь, могут служить в качестве основы для различных электрохимических и биоэлектрохимических экспериментов, как мы используем модульного реактора. Различные типы электродов, мембран и толщины рамы могут быть объединены, как описано в приведенной ниже протоколом. Основной целью протокола является создание средства для сравнения электрохимического восстановления аммония и био-электрохимическое восстановление аммония с использованием электролизера. Системы оцениваться с точки зрения эффективности добычи, потребляемой мощности и воспроизводимости.
протокол
1. Сборка реактора и подключение на вскрышные работы и поглощения единиц
- Соберите все необходимые материалы, чтобы построить реактор: электроды, рамы и каучуки (список материалов). Аккуратно вырежьте все детали, те же размеры, чтобы избежать утечек при сборке реактора.
- Просверлите отверстия в реакторных отсеков, чтобы соответствовать между мужчинами разъема. Дрель один дополнительный отверстие в середине стороны одной из реакторных отсеков в соответствии электрод.
- Подготовьте запас 1 MH 2 SO 4 для абсорбционной колонны. Увеличьте эту концентрацию, необходимую для размещения более высокие нагрузки аммиака.
- Убедитесь, что мембрана предварительно обрабатывают в соответствии с инструкциями изготовителя. Предварительной обработки углеродный войлок электрод, погрузив его в 2 мМ ЦТАБ (моющего средства) в течение 3 мин. Промойте углеродный войлок деминерализованной водой 8. Стабильный анод для электрохимических экспериментов не требуют PRetreatment.
- Стек различных частей реактора для того, в зависимости от типа реактора. Для биореактора: плексиглас концевой пластинки, Резина, нержавеющая сталь ток коллектора, предварительно обработанные графитового войлока, Perspex реакторного отсека, резину, катионообменной мембраны, резины, материал прокладки, электрод сетка из нержавеющей стали, резины, Perspex реакторного отсека, резину, Perspex торцевую крышку
- Стек части реактора для электрохимической ячейке следующим образом: Perspex торцевую крышку, резины, IROX анод через торцевую пластину, Perspex реакторного отсека, резины, прокладка, каучук, катионообменной мембраны, резины, материал прокладки, электрод сетка из нержавеющей стали, резины, плексигласа реактора купе, резина, плексиглас лобовая плита.
- Использование тефлон для уплотнения соединения портов реактора. Поместите электрод сравнения в том же отделении, в качестве рабочего электрода: анод в случае биоэлектрохимических клетки, катода или анода в случае электрохимической ячейки.
- Используйте гайки иБолты, чтобы закрыть реактор. Затянуть болты на противоположных сторонах, чтобы уравнять давление. Не пользуйтесь инструментами, чтобы закрыть реактор, как от руки достаточно, чтобы обеспечить реактор полностью решена.
- Заполните реактор с водой, чтобы проверить, если реактор утечек. Если появляются утечки, проверьте болты затянуты достаточно или если одна из частей реактора было перемещено во время сборки реактора. Если утечки не обнаружены, слейте воду из реактора.
- Добавить кольца Рашига и в колонке полосы и поглощения, чтобы заполнить столбцы наполовину.
- Калибровка расход всех насосов. Подключите подачи и рециркуляции насосов в реактор и воздушного насоса к зачистки и поглощения единиц (рис 1). Сведение к минимуму длину трубопровода как можно больше.
- Заполните абсорбционной колонны с 250 мл 1 М H 2 SO 4, она должна охватывать кольца Рашига. Убедитесь, что воздушный поток смешивается кислоты хорошо, когда насос включается. Увеличение или уменьшить объем кислоты на основе зачистки колонке дизайн и воздушного насоса мощностью.

Рисунок 1. Установка Реактор для биоэлектрохимических системы, позволяющей извлечение аммония. Система, представленная здесь работает в непрерывном режиме. Сплошные линии представляют поток жидкости, пунктирные линии представляют поток газа. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
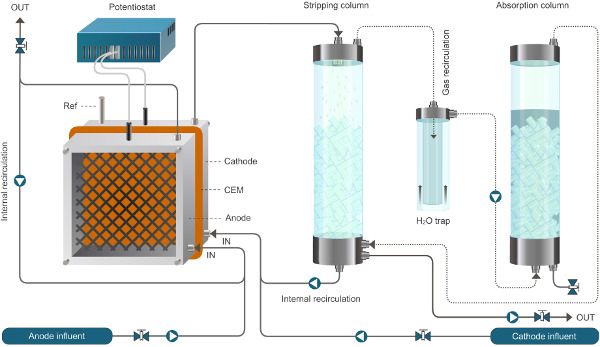
Рисунок 2. Установка Реактор для биоэлектрохимических системы, позволяющей извлечение аммония. Система, представленная здесь работает в непрерывном режиме. Сплошные линии представляют поток жидкости, пунктирные линии представляют поток газа.ww.jove.com/files/ftp_upload/52405/52405fig2large.jpg "TARGET =" _ пустое "> Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
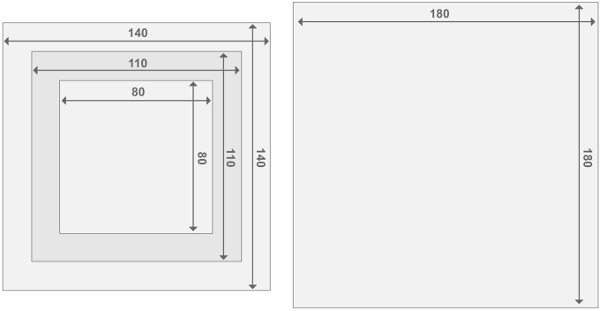
Рисунок 3. конструкции реактора кадров Perspex. Каждый реактор состоит из двух шайбами реакторов и 2 реакторных отсеков. Все части имеют толщину 2 см. Подробная информация о численности других материалов можно найти в списке материалов. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
2. Bioanode Driven Добыча
- Подготовка СМИ.
- Подготовка анолита для биореакторе, как описано в таблице 1 9. Увеличение концентрации аммония в среде для имитации обогащенный азотом поток отходов.
- Чтобы сохранить МЕДИмкм до использования, автоклав среды, чтобы обеспечить источник углерода не исчерпаны в результате загрязнения. Подготовка витамины и микроэлементы в соответствии с таблицей 1 и добавить после автоклавирования и охлаждения среды.
- Флеш среды путем продувки газообразным азотом в течение по крайней мере 30 мин для удаления кислорода. Чтобы сделать это, вставьте трубку или иглы в среде и превратить в потоке газообразного азота.
- Подготовка проводящий решение, как католита. В этом случае, используют 0,1 М NaCl, чтобы каустической.
| Компонент | Количество | ||
| Na 2 HPO 4 | 6 г / л | ||
| KH 2 PO 4 | 3 г / л | ||
| NaCl | 0,5 г / л | ||
| NH 4 Cl | 0,5 г / л | ||
| MgSO 4 · 7H 2 O | 0,1 г / л | ||
| CaCl 2 · 2H 2 O раствор (14,6 г / л) | 1 мл | ||
| Ацетат натрия | 2 г / л (для запуска) | ||
| Рассеянные элементы | 1 мл | ||
| Витамин решение | 1 мл | ||
| Микроэлементы (1,000x) | г / л | Витамины (1,000x) | г / л |
| CoCl 2 | 0,1 | биотин | 0,004 |
| Na 2 MoO 4 · 2H 2 O | 0,01 | фолиевая кислота | 0.004 |
| H 3 BO 3 | 0,01 | пиридоксина гидрохлорид | 0,02 |
| Mg 2 Cl 2 · 6H 2 O | 3 | рибофлавин | 0,01 |
| ZnCl 2 | 0,1 | тиамин гидрохлорид | 0,01 |
| CaCl 2 · 2H 2 O | 0,1 | никотиновая кислота | 0,01 |
| NaCl | 1 | Пантотенат DL-кальция | 0,01 |
| нитрилотриуксусная кислоты | 1,5 | Vit B12 | 0,0002 |
| AlCl 3 · 6H 2 O | 0,01 | р аминобензойной кислоты | 0,01 |
| CuCl 2 | 0,01 | липоевая (тиоктовой) кислоты | 0,01 |
| FeCl 2 | 0,1 | мио -inositol | 0,01 |
| MnCl 2 · 2H 2 O | 0,5 | холина хлорид | 0,01 |
| Отрегулируйте до рН 6,5 с помощью КОН | ниацинамид | 0,01 | |
| пиридоксаль гидрохлорид | 0,01 | ||
| аскорбат натрия | 0,01 |
Таблица 1. Анолит композиция для био-анод приводом добычи селитры.
- Прививка биореактора
Примечание: Работа в стерильных условиях не является необходимым для этого биореактора, так как смешанные культуры посевной используется и условия в реакторе будет выбирать для конкретных электроактивных организмов.- Подготовка посевного. Для этого биореакторе, готовят 30 мл смеси сточных вод от активных анаэробных биореакторах, включая ферментере, Bioanode, метантенковый и / или необработанных сточных вод. Собирают смеси в шприц.
- Подключение мешок, наполненный газа N 2 к бутылке анолита, чтобы сохранить давление стабильны, а не позволяет ввести кислород. Смешайте источник посевной с объемом анолита (здесь, 100 мл анолита в течение 30 мл источника инокулята) опорожнения шприца с инокулята в средней бутылки. Будьте уверены, чтобы получить объем, необходимый для заполнения анодного отсека.
- С помощью шприца, заполнить анодом и катодом отсек одновременно с их соответствующими растворами. Подключение мешок, наполненный газа N 2 к бутылке анолита, так что анолит раствор может быть удален через порт для отбора проб без введения кислорода. Закройте порт пробы с краном между переводов.
ПРИМЕЧАНИЕ: Выполните этот шаг вместе с коллегой, чтобы обеспечить, что оба реакторных отсеков заполнены одновременно. - Когда оба реакторных отсеков заполнены, включитециркуляционный насос со скоростью рециркуляции приблизительно 6 л / час.
- Подключите потенциостата кабель с тремя электродами, с помощью анода в рабочем электроде. Поместите электрод в анодном отделении.
- Включите потенциостата в режиме хроноамперометрии с помощью программного обеспечения Потенциостат. Выбор фиксированной анода потенциал -200 мВ относительно Ag / AgCl.
- Запуск реактор непрерывного действия для извлечения аммония
ПРИМЕЧАНИЕ: По мере развития биопленки, ток будет производиться с потреблением ацетата. Как следствие ацетата истощения, ток падает (см Результаты сечение, рисунок 3).- Чтобы перейти к непрерывной подачи, переключение на подающего насоса для анода и катода. Скорость насоса будет определять гидравлическим время пребывания (HRT). Здесь эксплуатировать реактор при HRT 6 ч.
- Включение воздушного насоса полосы и поглощения блока. Рециркуляцию воздуха в замкнутом контуре, или циркулируют вразомкнутого контура с помощью окружающего воздуха. Конфигурация воздушного потока может повлиять на эффективность поглощения.
- Обновите среднего три раза в неделю. Подготовка свежий анолита и католита, как описано в шагах 2.1.1-2.1.4.
- После выполнения этих шагов, приложите мешок наполненный газом с N 2 к бутылке закрытой подачи, остановить насос подачи, положить зажим на влиятельных линии, переключать старые и новые бутылки и, наконец, снять зажимы и снова запустить насос.
- Каждый раз, когда подача свежей, принимают 5 мл жидких проб из вытекающего потока и втекающий анолита и католита для измерения проводимости, рН, содержание ацетата аммония и концентрации.
- При изменении подачи, а также принимать 3 мл образца абсорбционной колонны, чтобы контролировать рН и для анализа TAN. Когда рН приближается 4, заменить абсорбент со свежим раствором 1 М серной кислоты, чтобы гарантировать высокую эффективность поглощения.
- Как тока сначала будет увеличиваться, а затем достичь плато, измерьте тузТейт содержание в анолита заборах и сточных вод, чтобы обеспечить это не обусловлено ограниченностью углерода: ацетат концентрации в анолита сточных вод ниже 100 мг / л указывают ограничение углерода. Увеличение концентрации ацетата в сырье в этом случае (Таблица 2).
- Если ток стабилизации не вызвано ацетата ограничений, постепенно увеличивать концентрацию аммония в сырье, и ждать стабилизации тока с целью оценки эффективности экстракции (таблица 3).
ПРИМЕЧАНИЕ: В концентрация ионов аммония увеличивается токсичность аммиака и высокая проводимость будет оспаривать биопленки и ток будет в конечном итоге падение, как следствие.
| Время | Количество ацетата натрия добавляют в корм анода (г / л) |
| День 0 - день 35 | 2 |
| День 35 - День 37 | 3 |
| День 37 - День 51 | 4 |
| День 51 - День 61 | 5 |
Таблица 2. Концентрации ацетата натрия в анолита для bioanode приводом экстракции аммония.
| Время | Количество NH 4 HCO 3 добавляется в корма анода (г / л) | Фаза |
| День 0 - день 16 | 2.26 | Я |
| День 16 - День 26 | 4,5 | II |
| День 26 - День 33 | 9 | III |
| День 33 - День 40 | 14,1 | IV |
| День 40 - День 47 | 20 | V |
| День 47 - День 54 | 25,4 | VI |
| День 54 - День 63 | 31 | VII |
Таблица 3. Концентрация аммония в анолита для bioanode приводом экстракции аммония. Фазы указано на графике плотности тока (фиг.2).
3. Электрохимический Добыча
- Подготовка СМИ
- Подготовьте синтетический поток сточных вод, как анолита в соответствии с таблицей 4 4. Добавить сульфат аммония до конечной концентрации 1, 3 или 5 г N / л.
- Подготовьте 0,1 М раствора NaCl для католита.
| Компонент | Количество |
| Na 2 HPO 4 · 2H 2 O | 1,03 г / л |
| KH 2 PO 4 | 0,58 г / л |
| MgSO 4 · 7H 2 O | 0,1 г / л |
| CaCl 2 · 2H 2 O | 0,02 г / л |
| (NH 4) 2 SO 4 | В зависимости от эксперимента, чтобы получить 1/3/5 г N / L конечной концентрации |
Таблица 4. Анолит композиция для извлечения электрохимический аммония 4.
- Запуск реактор непрерывного действия для извлечения аммония
- Включите питающий насос для заполнения реакторных отсеков. Чтобы ускорить процесс временно увеличить скорость насоса.
- Уменьшение скорости насоса, чтобы получить HRT из 6 ч после того, как реактор заполнен. Включение рециркуляционного насоса со скоростью 6 л / ч. Возьмем образец втекающего (5 мл).
ПРИМЕЧАНИЕ: периодически измерять скорость потока на протяжении всего экспериментачтобы убедиться, что он не меняется. - Начните полосы и поглощения блок. Использование данного устройства является такой же, как в биореактор.
- Включите потенциостата в режиме хронопотенциометрии с помощью программного обеспечения Потенциостат. Первый применить низкой плотности тока около 0,5 А / м для поляризации мембраны и определить поток азота за счет диффузии в покое.
- Когда система была поляризованный в течение 24 ч, применяют плотность тока, необходимого для эксперимента. Проверьте различной плотности тока, как правило, от 10 A / м² до 50 А / м. Возьмите образцы анодом и катодом сточных вод, а также абсорбционной колонны до увеличения плотности тока.
ПРИМЕЧАНИЕ: После 3 циклов ЗГТ, реактор должен подойти устойчивого состояния. - После того, как реактор достигнет устойчивого состояния, принимают по меньшей мере, три пробы по времени конечно. Отбор проб из анода и катода сточных вод, а также абсорбционной колонны (5 мл каждая). Запишите объем выборки, дату и время.
- В зависимости от устойчивости анодного втекающий, принять новый образец анода втекающего в случае необходимости. Это необходимо, когда используется в реальном сточных вод.
- Изменить условия испытаний, таких как прикладная плотности тока и концентрации TAN. После каждого изменения, пусть реактор стабилизироваться в течение, по крайней мере 3 HRTS До взятия пробы.
- Когда рН абсорбционной колонны приближается 4, заменить абсорбент со свежим раствором 1 М серной кислоты.
4. Анализ проб
- Измерьте рН и проводимость образцов в тот же день, как выборка, чтобы уменьшить неточности из-за потери летучих аммиака. Измерьте рН и проводимость, используя адекватно калиброванные рН и удельной проводимости.
- Если образец не измеряется непосредственно, хранить образцы для анализа (TAN обоих реакторах) и анализа жирных кислот (биореактор) при 4 ° С. Образцы фильтров из биореактора анода сточных вод и заборах через 0,45 мкм фильтры повторнодвигаться биомассы и помочь сохранить жирные кислоты. Заполните все пробирки с образцами к краю, чтобы минимизировать NH 3 потери.
- Измерение азот в качестве TAN стандартным методом паровой дистилляции или любой другой надежный метод для измерения ОКЧ 10.
- Измерьте жирные кислоты как ацетат от любого надежного метода, такие как ионной хроматографии или газовой хроматографии 11.
5. Анализ данных и расчеты
- Экспорт файла данных Потенциостат из программного обеспечения и импортировать их в программу электронных таблиц. Рассчитать средние за час электрохимические переменные, чтобы уменьшить количество точек данных и сгладить кривые при построении их.
- Соберите все измеренные данные (рН, аммиак, ЛЖК) в одном файле данных для вычислений. Расчеты описано в разделе результатов.
- Рассчитайте текущую добычу на биореакторе. Это лучше всего представить в виде плотности тока, которая рассчитывается следующим образом (уравнение 1,12):
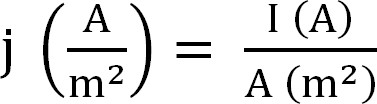 Уравнение 1
Уравнение 1
с J, как плотность тока, I абсолютной тока, а проектируемого участка поверхности электрода. В некоторых программ можно иметь это автоматически путем ввода площади поверхности анода до начала эксперимента. - Рассчитать параметры, связанные с добычей селитры
- Рассчитать поток азота. Нормализация поток азота (г N / м² / г) области поверхности мембраны, то выражается в плотности тока (I N). Использование этого значения для вычисления CE (уравнение 2, 3 и 4):
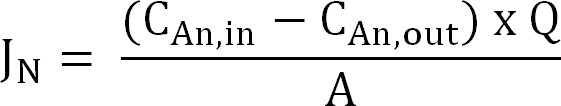 Уравнение 2
Уравнение 2
где С, в (г N / L) и C, из (г N / л) измеренные концентрации аммония входит и выходит анодного отделения,соответственно. Q (L / D) является расход анода и (м 2) площадь поверхности мембраны (равно прогнозируемого анодом и площади поверхности катода). - Представьте поток азота в качестве плотности тока (I N, / м²):
 Уравнение 3
Уравнение 3
где г NH4 + (-) есть заряд NH 4 +, F постоянная Фарадея (96485 С / моль) и М молекулярная масса азота (14 г / моль). - Рассчитайте текущую эффективность (CE,%) в виде:
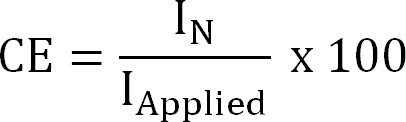 Уравнение 4
Уравнение 4
где я применил (/ m²) является применены (электрохимический добычи) или измерить (биоэлектрохимических добыча) плотность тока. - Рассчитать поток теоретических азота. Рассчитайте максимальную теоретическую азотапоток (J N, Макс, г N / м² / d) для данного прикладной области текущего и поверхности мембраны (уравнение 5):
 Уравнение 5
Уравнение 5 - Рассчитать эффективность удаления азота (RE,%). См процент аммиака, который удаляется из анолита в качестве эффективности удаления. Рассчитать от анодного заборах и сточных вод концентрации TAN (уравнение 6).
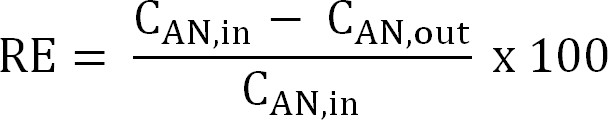 Уравнение 6
Уравнение 6 - Рассчитайте максимальную теоретическую эффективность удаления азота (RE макс,%) для данного влиятельных TAN нагрузки и применяется текущий (уравнение 7):
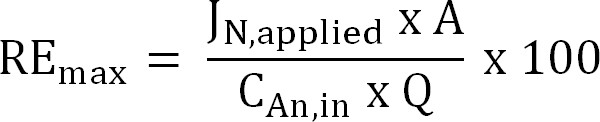 Уравнение 7
Уравнение 7
где J N, применяются (г Н · м -2 г - 1) применяется плотность тока выражается в виде потока азота.
- Рассчитать поток азота. Нормализация поток азота (г N / м² / г) области поверхности мембраны, то выражается в плотности тока (I N). Использование этого значения для вычисления CE (уравнение 2, 3 и 4):
- Рассчитать соотношение газ / жидкость, как (Уравнение 8):
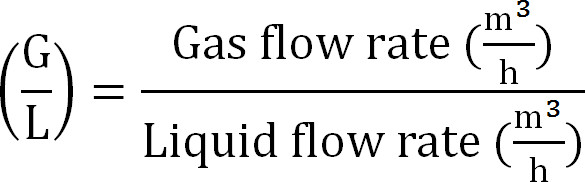 Уравнение 8
Уравнение 8 - Рассчитайте максимальную мощность абсорбционной колонны. Рассчитайте максимальную теоретическую N нагрузку на абсорбционной колонны от максимального потока теоретической азота J Nmax, концентрации TAN в сточной (моль / л), время работы т, площадь поверхности мембраны A, и объема абсорбента V ( Уравнение 9):
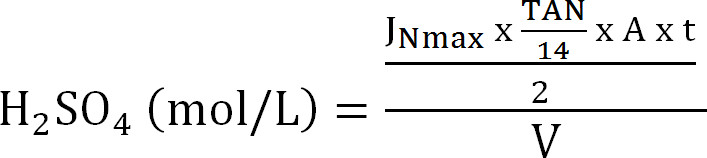 Уравнение 9
Уравнение 9 - Рассчитать эффективность отгонки SE (%) (уравнение 10):
 60; Уравнение 10
60; Уравнение 10 - Вычислить энергию вход для извлечения аммония через катионообменную мембрану (Е Н, выраженное в кВтч / кг) N (уравнение 11):
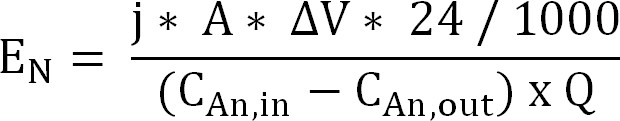 Уравнение 11
Уравнение 11
С Dgr; v измеренной разности потенциалов между анодом и катодом. В случае биореактора, у Av был рассчитан как среднее за период выборки, для электрохимического реактора в среднем за весь пробег принимается.
Результаты
Хроноамперометрии приводит из биореактора
Результаты хроноамперометрии, рассчитывают по уравнению 1, показывают типичный график для непрерывного реактора (фиг.4). В начале эксперимента, анод и катод были работать в режиме рециркуляции. Это позволяет б...
Обсуждение
Эта рукопись предоставляет необходимые инструменты для настройки биоэлектрохимических и электрохимическую ячейку для восстановления аммония. Расчеты, представленные в разделе результатов обеспечивают параметры для оценки производительности системы. Биологические и электрохимич?...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was supported by the BOF grant for SG from Ghent University. AL is supported by the Rutgers University NSF Fuels-IGERT. SA is supported by the European Union Framework Programme 7 project “ProEthanol 2G.” SA and KR are supported by Ghent University Multidisciplinary Research Partnership (MRP)—Biotechnology for a sustainable economy (01 MRA 510W). JD is supported by an IOF Advanced grant (F2012/IOF-Advanced/094). KR is supported by by the ERC Starter Grant “Electrotalk”. The authors thank Tim Lacoere for designing the TOC art figure, Robin Declerck for building the strip and absorption columns and Kun Guo for providing the inoculum source.
Материалы
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Carbon Felt 3.18 mm Thick | Alfa Aesar | ALFA43199 | Used as bioanode, 110 mm x 110 mm |
| Ti electrode coated with Ir MMO | Magneto Special Anodes (The Netherlands) | Used as stable anode for electrochemical tests | |
| Stainless steel mesh | Solana (Belgium) | RVS 554/64: material AISI 316L, mesh width: 564 micron, wire thickness: 140 micron, mesh number: 36,6 | Used as cathode, 110 mm x 110 mm |
| Stainless steel plate | Solana (Belgium) | inox 304 sheet, thickness: 0,5mm | Used as current collector for the bioanode |
| Ag/AgCl Reference Electrode | Bio-Logic (France) | A-012167 RE-1B | |
| Potentiostat (VSP Multipotentiostat) | Bio-Logic (France) | ||
| EC Lab | Bio-Logic (France) | software for performing electrochemistry measurements | |
| Cation Exchange Membrane | Membranes International (USA) | Ultrex CMI-7000 | Pretreated according to the manufacturers' instructions |
| Turbulence Promotor mesh | ElectroCell Europe A/S (Tarm, Denmark) | EPC20432-PP-2 | spacer material, 110 mm x 110 mm |
| Connectors | Serto | 1,281,161,120 | Other sizes possible, dependant on tubing type and size of holes in frames |
| Strip and absorption column | In house design | ||
| Tubing | Masterflex | HV-06404-16 | |
| Gas bag | Keika Ventures | Kynar gas bag with Roberts valve | |
| Rashig Rings | Glasatelier Saillart (Belgium) | Raschig rings 4 x 4 mm | Put inside the strip and absorption column to improve the air/liquid contact. Available with many suppliers |
| Rubber sheet | Cut to fit on the perspex frames | ||
| Perspex reactor frames | Vlaeminck, Beernem | In-house design, see tab "reactor frames" in this file |
Ссылки
- Verstraete, W., Van de Caveye, P., Diamantis, V. Maximum use of resources present in domestic "used water". Bioresource Technology. 100 (23), 5537-5545 (2009).
- Lei, X., Sugiura, N., Feng, C., Maekawa, T. Pretreatment of anaerobic digestion effluent with ammonia stripping and biogas purification. Journal of Hazardous Materials. 145 (3), 391-397 (2007).
- Siegrist, H. Nitrogen removal from digester supernatant-comparison of chemical and biological methods. Water Science and Technology. 34 (1), 399-406 (1996).
- Desloover, J., Abate Woldeyohannis, A., Verstraete, W., Boon, N., Rabaey, K. Electrochemical Resource Recovery from Digestate to Prevent Ammonia Toxicity during Anaerobic Digestion. Environmental Science & Technology. 46 (21), 12209-12216 (2012).
- Kim, J. R., Zuo, Y., Regan, J. M., Logan, B. E. Analysis of ammonia loss mechanisms in microbial fuel cells treating animal wastewater. Biotechnology and Bioengineering. 99 (5), 1120-1127 (2008).
- Emerson, K., Russo, R. C., Lund, R. E., Thurston, R. V. Aqueous ammonia equilibrium calculations: effect of pH and temperature. Journal of the Fisheries Board of Canada. 32 (12), 2379-2383 (1975).
- Kuntke, P., Sleutels, T. H. J. A., Saakes, M., Buisman, C. J. N. Hydrogen production and ammonium recovery from urine by a Microbial Electrolysis Cell. International Journal of Hydrogen Energy. 39 (10), 4771-4778 (2014).
- Guo, K., et al. Surfactant treatment of carbon felt enhances anodic microbial electrocatalysis in bioelectrochemical systems. Electrochemistry Communications. 39, 1-4 (2014).
- Guo, K., Chen, X., Freguia, S., Donose, B. C. Spontaneous modification of carbon surface with neutral red from its diazonium salts for bioelectrochemical systems. Biosensors and Bioelectronics. 47, 184-189 (2013).
- Rice, E. W., Greenberg, A. E., Clesceri, L. S., Eaton, A. D. . Standard Methods For The Examination Of Water And Wastewater. , (1992).
- Andersen, S. J., et al. Electrolytic Membrane Extraction Enables Production of Fine Chemicals from Biorefinery Sidestreams. Environmental Science & Technology. 48 (12), 7135-7142 (2014).
- Harnisch, F., Rabaey, K. The Diversity of Techniques to Study Electrochemically Active Biofilms Highlights the Need for Standardization. Chemsuschem. 5 (6), 1027-1038 (2012).
- Clauwaert, P., et al. Minimizing losses in bio-electrochemical systems: the road to applications. Applied Microbiology and Biotechnology. 79 (6), 901-913 (2008).
- Atkins, P., De Paula, J. . Elements of Physical Chemistry. , (2012).
- Aelterman, P., Freguia, S., Keller, J., Verstraete, W., Rabaey, K. The anode potential regulates bacterial activity in microbial fuel cells. Applied Microbiology and Biotechnology. 78 (3), 409-418 (2008).
- Kuntke, P., et al. Ammonium recovery and energy production from urine by a microbial fuel cell. Water Research. 46 (8), 2627-2636 (2012).
- Liu, H., Cheng, S., Logan, B. E. Power Generation in Fed-Batch Microbial Fuel Cells as a Function of Ionic Strength. Temperature, and Reactor Configuration. Environmental Science & Technology. 39 (14), 5488-5493 (2005).
- Gimkiewicz, C., Harnisch, F. Waste Water Derived Electroactive Microbial Biofilms: Growth, Maintenance, and Basic Characterization. JoVE. (82), e50800 (2013).
- Ping, Q., Cohen, B., Dosoretz, C., He, Z. Long-term investigation of fouling of cation and anion exchange membranes in microbial desalination cells. Desalination. 325, 48-55 (2013).
- Guerin, T., Mondido, M., McClenn, B., Peasley, B. Application of resazurin for estimating abundance of contaminant-degrading micro-organisms. Letters in Applied Microbiology. 32 (5), 340-345 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены