È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Contrasto dinamico migliorato risonanza magnetica di un modello ortotopico cancro del pancreas mouse
In questo articolo
Riepilogo
The goal of this protocol is to apply dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) for orthotopic pancreatic tumor xenografts in mice. DCE-MRI is a non-invasive method to analyze microvasculature in a target tissue, and useful to assess vascular response in a tumor following a novel therapy.
Abstract
Dynamic contrast enhanced magnetic resonance imaging (DCE-MRI) has been limitedly used for orthotopic pancreatic tumor xenografts due to severe respiratory motion artifact in the abdominal area. Orthotopic tumor models offer advantages over subcutaneous ones, because those can reflect the primary tumor microenvironment affecting blood supply, neovascularization, and tumor cell invasion. We have recently established a protocol of DCE-MRI of orthotopic pancreatic tumor xenografts in mouse models by securing tumors with an orthogonally bent plastic board to prevent motion transfer from the chest region during imaging. The pressure by this board was localized on the abdominal area, and has not resulted in respiratory difficulty of the animals. This article demonstrates the detailed procedure of orthotopic pancreatic tumor modeling using small animals and DCE-MRI of the tumor xenografts. Quantification method of pharmacokinetic parameters in DCE-MRI is also introduced. The procedure described in this article will assist investigators to apply DCE-MRI for orthotopic gastrointestinal cancer mouse models.
Introduzione
L'obiettivo generale di questo metodo è quello di applicare dinamico di contrasto maggiore risonanza magnetica (DCE-MRI) per ortotopici xenotrapianti tumorali pancreatiche nei topi. DCE-MRI è un metodo non invasivo per valutare microcircolo in un tessuto bersaglio monitorando la variazione di MR contrasto per un certo periodo di tempo dopo l'iniezione. DCE-MRI è stata utilizzata per diagnosticare tumori maligni e per valutare la risposta del tumore alle varie terapie 1-4. Quantitative DCE-MRI ha presentato alta riproducibilità 5. Per quantificare i parametri farmacocinetici di un agente di contrasto MR in un tessuto bersaglio, tutte le immagini DCE-MR acquisite in diversi momenti e T1 mappa ottenute prima iniezione di contrasto devono essere coregistrata 6. Tuttavia, a causa di movimenti respiratori e peristaltiche nella zona addominale, quantitativa DCE-MRI ha applicazione limitata per i tumori gastrointestinali.
Ortotopico modelli tumorali pancreatiche sono stati utilizzati per valutareRisposta pancreatico-tumorale a seguito di terapie biologiche e chemioterapie 7,8. Modelli tumorali ortotopico sono considerate superiori ai modelli sottocutanei convenzionali, poiché il microambiente nel sito del tumore originale viene riflessa e risposta tumorale umano così alla terapia può essere previsto con maggiore precisione. Tuttavia, il pancreas del mouse si trova nel quadrante in alto a sinistra dell'addome, in modo quantitativo DCE-MRI di ortotopici xenotrapianti tumorali pancreatiche nei topi non è stata immediatamente attuata.
Abbiamo stabilito un protocollo di DCE-MRI dei tumori addominali nei topi fissando i tumori utilizzando una scheda di plastica ortogonalmente piegato per impedire il trasferimento di movimento della regione toracica 9. La pressione applicata da questa tavola è stato localizzato sulla zona addominale, e non ha portato a difficoltà respiratoria. Una tecnica automatizzata immagine coregistrazione è stato convalidato per DCE-MRI di organi addominali in una modalità senza respiro, ma esegue effectively solo quando le regioni obiettivo si muovono lentamente e regolarmente 10. La frequenza respiratoria di animali è variabile durante l'imaging, ritenuta in modo fisico nella zona addominale sarà necessario recuperare i parametri farmacocinetici affidabili ortotopici modelli pancreatiche di topo tumore. Abbiamo quantificato con successo i parametri farmacocinetici di un agente di contrasto MR in ortotopici xenotrapianti tumorali pancreatiche usando la scheda di plastica ortogonalmente piegato in DCE-MRI 11-13. Ecco a voi la procedura dettagliata di ortotopica modellazione tumore pancreatico, DCE-MRI dei xenotrapianti tumorali nei topi, e la quantificazione dei parametri farmacocinetici.
Protocollo
Tutte le procedure sono state approvate dalla cura e l'uso degli animali Comitato Istituzionale presso la University of Alabama a Birmingham.
Modellazione 1. ortotopico pancreatica Tumor mouse
- Cultura linee standard di cellule del pancreas-tumorali umane in mezzo modificato Eagle Dulbecco (DMEM) addizionato con siero fetale bovino 10%. Mantenere tutte le culture a 37 ° C in atmosfera umidificata con 5% di CO 2.
- Utilizzare 8-10 femminili gravi topi immunodeficienti combinate settimana-vecchio. Posizionare gabbie per gli animali a 12 ore di luce e 12 ore ciclo buio a temperatura ambiente (21 ± 2 ° C), e il 60% di umidità.
- Anestetizzare tutti gli animali con ventilazione con il 2% di isoflurano mescolato con l'ossigeno (2 L / min) durante l'intervento chirurgico. Confermare la profondità dell'anestesia dal pizzico punta reflex. Posizionare animali su una piastra elettrica (37 ° C), per mantenere la temperatura corporea. Applicare veterinaria pomata oftalmica sugli occhi per prevenire la secchezza mentre sotto anestesia. &# 160;
- Rimuovere il capello nel quadrante superiore sinistro dell'addome di ogni topo, e dare un farmaco analgesico (carpofen, 5 mg / kg di peso corporeo per via sottocutanea) nella zona. Applicare una soluzione betadine alla pelle esposta. Preparare strumenti chirurgici in autoclave.
- Fare un 1 centimetro incisione nella pelle e del peritoneo con iris forbici diritte. Rimuovere delicatamente il pancreas dall'addome con una pinzetta chirurgica.
- Inserire 28 G ago di una siringa da 0,5 ml insulina nella coda del pancreas e poi lentamente infusione una soluzione di 2,5 milioni di cellule di cancro pancreatico umano in 30 ml di DMEM. Verificare che una piccola bozza viene creato nella testa del pancreas dalla soluzione.
- Posizionare delicatamente il pancreas nuovamente dentro l'addome con una pinzetta chirurgica. Chiudere il peritoneo e la pelle in 1 strato con 2 interrotto 5-0 suture Prolene, e quindi terminare la anestesia. Non restituire un animale che ha subito un intervento chirurgico per la compagnia di altri animali fino alla completa guarigione.60; Rimuovere suture a 7 ~ 10 giorni dopo l'intervento chirurgico.
- Dare un'altra dose del farmaco analgesico (carpofen, 5 mg / kg di peso corporeo per via sottocutanea) a 24 ore dopo l'intervento chirurgico.
- Controllare la dimensione del tumore palpando l'area chirurgia utilizzando due dita. I tumori in genere si sentono più denso e più irregolare rispetto ai tessuti circostanti e organi. Di solito ci vogliono ~ 1 - 2 settimane per iniziare a sentirsi un tumore.
- Monitorare gli animali al giorno per i segni della malattia. Quando gli animali appaiono (normali comportamenti di governare e di evitamento mancanza) malati, abbiamo risolto utilizzando dislocazione cervicale mentre sotto anestesia.
2. Magnetic Resonance Imaging
- Applicare MRI quando le dimensioni del tumore è di circa 5-7 mm di diametro al solito 2 ~ 4 settimane dopo l'impianto di cellule. Utilizzare uno scanner MR dedicato alle piccole immagini animale o uno scanner MR clinico dotato di una bobina specializzata per piccoli animali di imaging.
NOTA: Abbiamo utilizzato un piccolo animale scanner RM 9.4T con una combinazione di un volume risuonatore 1 H/ Trasmettitore e un ricevitore bobina di superficie (30 mm di diametro) (Bruker BioSpin Corp., Billerica, MA). Una bobina di superficie fornisce migliore rapporto segnale-rumore (SNR) 14. - Preparare una risonanza magnetica agente di contrasto a base di gadolinio per iniettare ~ 0,1 - 0,2 mmol / kg per ogni animale in ~ 0,1 - 0,2 ml di PBS (tampone fosfato salino).
NOTA: Abbiamo usato gadoteridolo e iniettato 0,2 mmol / kg in 0,15 ml di PBS in un periodo di 15 sec (0,1 ml / sec). - Preparare un tubo micro-polietilene (lunghezza: 7,62 mm, diametro interno: 0,28 millimetri, diametro esterno: 0,64 millimetri). Inserire un ago 30 G (lunghezza 12,7 mm) in una estremità del tubo, e una punta smussata dell'ago 30 G (9,5 mm di lunghezza) nell'altra estremità. Collegare una siringa da 1 ml contenente mezzo di contrasto MR all'ago punta smussata, e spingere lentamente la siringa per riempire l'intero tubo con l'agente di contrasto MR.
- Anestetizzare gli animali utilizzano ventilazione con ~ 1 - 2% di isoflurano mescolato con l'ossigeno (2 L / min) per tutta la preparazione e l'imaging. Confermare la profondità di Anesthesia by pizzico punta reflex. Applicare veterinaria pomata oftalmica sugli occhi per prevenire la secchezza mentre sotto anestesia. Dilatare la vena della coda con una lampada di calore prima dell'inserimento dell'ago. Afferra la metà dell'ago 30 G con pinze Kelly, e inserirlo nella vena della coda. Tape sia la coda e il tubo su un foglio di plastica o di carta cartone (10 mm di larghezza x 100 mm di lunghezza) per mantenere la retta coda.
- Posto l'animale in posizione supina nel letto animale dotato di circolazione acqua calda (o aria calda) per regolare la temperatura corporea durante l'imaging. Impostare la temperatura sul letto a 37 ° C. Inserire una sonda di temperatura rettale per controllare la temperatura corporea durante l'imaging.
- Applicare una scheda di plastica ortogonale piegata nella zona addominale. Assicurarsi che il tumore si trova dietro l'estremità superiore della scheda, e poi tirare giù il bordo leggermente (~ 2 mm) per garantire il tumore e 'colto dal consiglio. Nastro il consiglio a letto animale saldamente.
- Tape à transduce pad respirazioner (SA Instrument, Inc., Stony Brook, NY) sul petto per monitorare la respirazione degli animali durante l'imaging. Inserire una bobina di superficie sulla sommità della regione tumorale, e nastro a letto animale saldamente. Premere il letto animale nello scanner MR per posizionare la regione tumorale al centro della bobina di volume (diametro interno 72 mm).
- Eseguire adattamento e di accordo sia per il ricevitore e trasmettitore, seguito da spessori.
- Inizia con una sequenza RM anatomica per individuare il tumore. Utilizzare una sequenza spin-echo (T2W) turbo T2-pesate per ottenere immagini assiali con i seguenti parametri di acquisizione. Tempo di ripetizione (TR) / tempo di echo (TE) = 3.000 / 34 msec, 128 x 128 a matrice, 30 x 30 mm campo visivo, il numero delle medie = 1, lunghezza del treno eco = 4, e 20 contigui 1 millimetro fette spesse in una modalità interlacciata per coprire l'intera regione tumorale (tempo totale della scansione: 1,6 min).
NOTA: Dal momento che i tumori pancreatici ortotopici sono più difficili da trovarsi di quelli sottocutanei, locali convenzionaliimmagini zer hanno risoluzione inferiore non possono essere utili. - Acquisire (T1W) immagini pesate in T1 con diversi angoli di vibrazione per recuperare T1 mappa. A questo scopo, utilizzare un gradiente echo approccio angolo multiflip con i seguenti parametri: tempo di ripetizione (TR) / tempo di eco (TE) = 115/3 msec, 128 x 128 matrice, un campo 30 x 30 mm di vista, il numero delle medie = 4, ~ 5-7 contigue 1 millimetro di spessore fette in una modalità interlacciata per coprire la regione tumorale, e sette angoli di vibrazione di 10, 20, 30, 40, 50, 60, e 70 (tempo totale della scansione per ogni angolo di vibrazione: 1 min).
NOTA: Tuttavia, l'angolo multiflip approccio è efficace solo quando il campo B1 omogeneità è alta. Se no, mappe T1 può essere ottenuto con l'approccio TR multipla invece 15. - Acquisire le immagini T1W prima e dopo gadolinio basato iniezione di contrasto MR. Utilizzare gli stessi parametri di acquisizione e la geometria per la mappatura T1 ma con l'angolo di vibrazione fisso di 30. Usa codifica lineare per garantire lo stato stazionario, quando si ottiene il centro di k-spazio, especially quando si utilizzano una breve TR e un angolo di vibrazione basso grado. Acquisire 5 immagini al basale prima iniezione di contrasto. Poi acquisire 40 immagini dopo l'iniezione di contrasto (tempo totale della scansione: 45 min). Utilizzare una pompa a siringa per iniettare agente di contrasto ad un tasso costante (0,01 ml / sec).
- Monitorare respirazione animale continuamente, e regolare la concentrazione isoflurano per mantenere la frequenza respiratoria di 50 - 100 respiri al minuto. Monitorare la temperatura corporea degli animali in tutta l'imaging.
- Dopo aver completato DCE-MRI, togliere l'ago e altre sonde, e mettere l'animale in una gabbia vuota letti con tovaglioli di carta. Massaggiare delicatamente la zona addominale inferiore. La gabbia deve essere posto metà sotto una lampada di calore per consentire all'animale di muoversi dentro e fuori del gradiente termico come recupera. Non lasciare un animale incustodito fino a quando non ha ripreso conoscenza sufficiente per mantenere decubito sternale.
3. Image Processing and Analysis
- Regi tumorali Segmento sulle immagini in T2w. In T2w immagini, l'intensità del segnale in regione tumorale è luminoso di quello dei tessuti circostanti, così il confine tumore può essere delineata manualmente.
NOTA: tecniche di segmentazione semi-automatiche come soglia globale o contornatura attivo possono essere utilizzati 16,17, ma l'intensità sfondo uniforme devono essere corrette in particolare quando si utilizza una bobina di superficie. - Creare T1 e densità protonica mappe. Nelle immagini T1W acquisite con una sequenza gradient echo, supponendo che il tempo di eco (TE) è molto inferiore a T2 * valore, il valore del pixel è determinata dalla
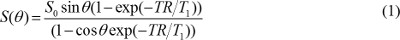
dove S 0 è la densità protonica, T 1 è costante T 1 tempo di rilassamento, TR è tempo di ripetizione, e θ è un angolo di vibrazione. L'equazione (1) può essere riscritta per
641eq2.jpg "/>
quando S (θ) / sinθ viene sostituito con Y, e S (θ) / tanθ viene sostituito con X. L'equazione (2) è un'equazione lineare, e il suo coefficiente angolare e può essere utilizzato per recuperare T1 e S 0 valori, rispettivamente. - Calcolare la concentrazione contrasto MR nelle immagini DCE-MR. Quando sulla base di contrasto MR gadolinio viene iniettato, T costante di tempo 1 relax è cambiata nel corso del tempo. Quindi, l'equazione (1) può essere riscritto per
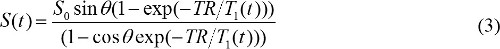
T 1 (t) è correlata con la concentrazione contrasto MR, C (t), come segue,
dove R 1 è relassività longitudinale del mezzo di contrasto MR. Quindi, combinando le equazioni (3) e (4), la concentrazione di contrasto MR è determinata - Quantificare i parametri di farmacocinetica di MR contrasto agente. C p (t) presenta concentrazioni contrasto MR nel plasma sanguigno al tempo t dopo l'inizio iniezione di contrasto. C p (t) è detta funzione di ingresso arteriosa (AIF). Se AIF è disponibile, i parametri farmacocinetici di mezzo di contrasto MR possono essere calcolati
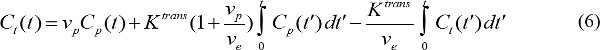
dove C t (t) è la concentrazione contrasto MR in un tessuto bersaglio, v p è il volume del plasma sanguigno frazionale, v e è frazionata del volume extracellulare extravascolare, e K trans è costante trasferimento di volume. Costante di Flux, k ep, è pari a K trans diviso per v e. Se AIF non è disponibile, allora la regione modello di riferimento può essere utilizzato invece 18,19. La regione modello di riferimento si basa sul flusso limitato Kety modello 20 e usa la concentrazione contrasto in una regione di riferimento per eliminare la necessità di AIF come segue,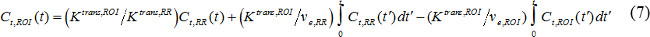
dove C t, ROI (t), K trans, ROI, ev e, ROI sono concentrazione contrasto, trasferimento volume costante, e il volume extravascolare-extracellulare frazionata, rispettivamente, nella regione di interesse (ROI), mentre C t, RR (t), K trans, RR, ev e, RR sono quelli della regione di riferimento. Muscoli paravertebrali è spesso selezionato come regione di riferimento, e v e, RR in pa murinomuscolo ravertebral si presume essere costante a 0,08 21. Abbiamo usato la regione modello di riferimento.
Risultati
Cellule tumorali pancreatiche umane crescere con successo nel topo pancreas creazione di un tumore solido. La figura 1 mostra le fotografie di (A) un normale pancreas dove soluzione delle cellule tumorali viene iniettato, e (B) un mouse rappresentante recante un ortotopico xenotrapianto tumore pancreatico (MIA PaCa-2 ). Tumor si trova nel quadrante superiore sinistro dell'addome, accanto alla milza. Di solito ci vogliono 2-4 settimane per i tumori a crescere fino a 5-7 mm di diametro dopo l'impi...
Discussione
Abbiamo introdotto metodi dettagliati di modellazione ortotopico tumore pancreatico utilizzando topi immunodeficienti, DCE-MRI dei tumori addominali nei topi, e la quantificazione dei suoi parametri cinetici. In ortotopico modellazione tumore pancreatico, bisogna fare attenzione quando si inserisce un ago nella coda del pancreas. In caso di successo, le cellule saranno trasferiti alla testa del pancreas creare una piccola bozza. Quando si applica una scheda di plastica ortogonalmente piegato, è fondamentale per conferm...
Divulgazioni
Authors do not have any conflicts of interest to declare.
Riconoscimenti
Authors thank Jeffrey Sellers to assist orthotopic pancreatic cancer mouse modeling. This work was supported by Research Initiative Pilot Awards from the Department of Radiology at UAB and NIH grants 2P30CA013148 and P50CA101955.
Materiali
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| DMEM | Invitrogen | 11965-118 | |
| Fetal bovine serum | Harlan Laboratories | BT-9501 | |
| Betadine | Purdue products | 67618-153-01 | |
| 5-0 Prolene sutures | Ethicon | 8720H | |
| 9.4T MR scanner | Bruker Biospin Corporation | BioSpec 94/20 USR | |
| Gadoteridol | Bracco Diagnostics Inc | NDC 0270-1111-03 | |
| Micro-polyethelene tube | Strategic Applications, Inc | #PE-10-25 | |
| 30G blunt tip needle | Strategic Applications, Inc | 89134-194 | |
| Monitoring and gating system | SA instruments, Inc | Model 1030 | This is an MR compatiable system to measure resiratory rating and body temperature of small animals at the same time. |
| Syringe pump | New Era Pump Systems, Inc. | NE-1600 |
Riferimenti
- Ergul, N., et al. Assessment of multifocality and axillary nodal involvement in early-stage breast cancer patients using 18F-FDG PET/CT compared to contrast-enhanced and diffusion-weighted magnetic resonance imaging and sentinel node biopsy. Acta Radiol. , (2014).
- Park, J. J., et al. Assessment of early response to concurrent chemoradiotherapy in cervical cancer: value of diffusion-weighted and dynamic contrast-enhanced MR imaging. Magn Reson Imaging. , (2014).
- Nguyen, H. T., et al. Prediction of chemotherapeutic response in bladder cancer using K-means clustering of dynamic contrast-enhanced (DCE)-MRI pharmacokinetic parameters. J Magn Reson Imaging. 10, (2014).
- Teo, Q. Q., Thng, C. H., Koh, T. S., Ng, Q. S. Dynamic Contrast-enhanced Magnetic Resonance Imaging: Applications in Oncology. Clin Oncol (R Coll Radiol). , (2014).
- Zhang, X., Pagel, M. D., Baker, A. F., Gillies, R. J. Reproducibility of magnetic resonance perfusion imaging. PLoS One. 9 (2), e89797 (2014).
- Kim, H., et al. Pancreatic adenocarcinoma: a pilot study of quantitative perfusion and diffusion-weighted breath-hold magnetic resonance imaging. Abdominal imaging. , (2014).
- Derosier, L. C., et al. Combination Treatment with TRA-8 Anti Death Receptor 5 Antibody and CPT-11 Induces Tumor Regression in an Orthotopic Model of Pancreatic Cancer. Clin Cancer Res. 13 (18), 5535s-5543s (2007).
- Derosier, L. C., et al. TRA-8 anti-DR5 monoclonal antibody and gemcitabine induce apoptosis and inhibit radiologically validated orthotopic pancreatic tumor growth. Mol Cancer Ther. 6 (12), 3198-3207 (2007).
- Kim, H., et al. Early therapy evaluation of combined anti-death receptor 5 antibody and gemcitabine in orthotopic pancreatic tumor xenografts by diffusion-weighted magnetic resonance imaging. Cancer Res. 68 (20), 8369-8376 (2008).
- Klein, S., Staring, M., Murphy, K., Viergever, M. A., Pluim, J. P. elastix: a toolbox for intensity-based medical image registration. IEEE Trans Med Imaging. 29 (1), 196-205 (2010).
- Kim, H., et al. Early therapy evaluation of combined cetuximab and irinotecan in orthotopic pancreatic tumor xenografts by dynamic contrast-enhanced magnetic resonance imaging. Mol Imaging. 10 (3), 153-167 (2011).
- Kim, H., et al. Antagonistic effects of anti-EMMPRIN antibody when combined with chemotherapy against hypovascular pancreatic cancers. M Mol Imaging Biol. 16 (1), 85-94 (2014).
- Kim, H., et al. Dual combination therapy targeting DR5 and EMMPRIN in pancreatic adenocarcinoma. Mol Cancer Ther. 11 (2), 405-415 (2012).
- Moyher, S. E., Vigneron, D. B., Nelson, S. J. Surface coil MR imaging of the human brain with an analytic reception profile correction. J Magn Reson Imaging. 5 (2), 139-144 (1995).
- Voigt, T., Nehrke, K., Doessel, O., Katscher, U. T1 corrected B1 mapping using multi-TR gradient echo sequences. Magn Reson Med. 64 (3), 725-733 (2010).
- Liu, H., Liu, Y., Zhao, Z., Zhang, L., Qiu, T. A new background distribution-based active contour model for three-dimensional lesion segmentation in breast DCE-MRI. Medical physics. 41 (8), 082303 (2014).
- Sarkar, S., Das, S. Multilevel image thresholding based on 2D histogram and maximum Tsallis entropy--a differential evolution approach. IEEE Trans Image Process. 22 (12), 4788-4797 (2013).
- Yankeelov, T. E., et al. Quantitative pharmacokinetic analysis of DCE-MRI data without an arterial input function: a reference region model. Magn Reson Imaging. 23 (4), 519-529 (2005).
- Cardenas-Rodriguez, J., Howison, C. M., Pagel, M. D. A linear algorithm of the reference region model for DCE-MRI is robust and relaxes requirements for temporal resolution. Magn Reson Imaging. 31 (4), 497-507 (2013).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer: standardized quantities and symbols. J Magn Reson Imaging. 10 (3), 223-232 (1999).
- Yankeelov, T. E., et al. Comparison of a reference region model with direct measurement of an AIF in the analysis of DCE-MRI data. Magn Reson Med. 57 (2), 353-361 (2007).
- Cao, R. Y., Amand, T., Ford, M. D., Piomelli, U., Funk, C. D. The Murine Angiotensin II-Induced Abdominal Aortic Aneurysm Model: Rupture Risk and Inflammatory Progression Patterns. Front Pharmacol. 1 (9), (2010).
- Parker, G. J., et al. Experimentally-derived functional form for a population-averaged high-temporal-resolution arterial input function for dynamic contrast-enhanced MRI. Magn Reson Med. 56 (5), 993-1000 (2006).
- Tseng, W., Leong, X., Engleman, E. Orthotopic mouse model of colorectal cancer. J Vis Exp. (10), 484 (2007).
- Bhullar, J. S., et al. A true orthotopic gastric cancer murine model using electrocoagulation. J Am Coll Surg. 217 (1), 64-70 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon