È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Anionico polimerizzazione di un copolimero Amphiphilic per la preparazione di copolimero a blocchi micelle stabilizzata da π-¸ Interazioni Stacking
In questo articolo
Riepilogo
Sono descritte le fasi cruciali di polimerizzazione anionica vivente di etere fenil glicidil (PheGE) di glicole metossi-polietilene (MPEG-b -PPheGE). Le micelle copolimero a blocchi risultanti (BCMS) sono stati caricati con doxorubicina 14% (% in peso) e rilascio prolungato di farmaci oltre 4 giorni sotto fisiologicamente è stato ottenuto relative condizioni.
Abstract
In questo studio, un copolimero anfifilica che comprende un blocco di formazione nucleo con gruppi fenilici è stato sintetizzato da polimerizzazione anionica vivente di fenil glicidil etere (PheGE) on metossipolietilenglicole (MPEG-b -PPheGE). Caratterizzazione del copolimero rivelato una stretta distribuzione molecolare (PDI <1.03) e confermato il grado di polimerizzazione di mPEG 122 - b - (PheGE) 15. La concentrazione critica micellare del copolimero è stata valutata utilizzando un metodo a fluorescenza stabilita con il comportamento di aggregazione valutate dalla dispersione della luce dinamica e trasmissione microscopia elettronica. Il potenziale del copolimero per l'uso in applicazioni di consegna della droga è stata valutata in modo preliminare compreso in vitro biocompatibilità, caricamento e rilascio del idrofobico antitumorale doxorubicina farmaco (DOX). Una formulazione micelle stabile di DOX è stato preparato con i livelli di farmaco di carico fino al 14% (% in peso), carico di droga efficiper proiezione> 60% (w / w) e sostenuta rilascio di farmaco per 4 giorni in condizioni fisiologicamente rilevanti (pH acido e neutro, presenza di albumina). Il livello elevato carico di droga e rilascio prolungato è attribuita alla stabilizzazione interazioni ¸-π tra DOX e il blocco di centro di formazione delle micelle.
Introduzione
In mezzi acquosi, copolimeri a blocchi anfifilici assemblare per formare micelle copolimero a blocchi di dimensioni nanometriche (BCMs) che consistono di un nucleo idrofobico circondato da un guscio idrofilo o corona. Il nucleo micelle può fungere da serbatoio per l'incorporazione di farmaci idrofobi; mentre, la corona idrofila fornisce un'interfaccia tra il nucleo e il mezzo esterno. Poli (etilene glicole) (PEG) e suoi derivati sono una delle più importanti classi di polimeri e uno dei più ampiamente utilizzato nella formulazione di droga. 1-3 BCMs hanno dimostrato di essere una piattaforma drug delivery degna con diverse formulazioni basandosi su questo tecnologia attualmente in sviluppo clinico fase avanzata. 4 più comunemente, il blocco idrofobo del copolimero comprende policaprolattone, poli (D, L-lattide), poli (ossido di propilene) o poli (β-benzil-L-aspartato). 5 -9
Il gruppo di Kataoka indagato micelle sferiche formate da sone B -PBLA E poli (ossido di etilene) - B -. (Polyaspartic doxorubicina acido-coniugato) per la consegna di doxorubicina (DOX) 10,11 Nelle loro relazioni, hanno messo in avanti che le interazioni π-¸ tra il farmaco di polimero coniugato o PBLA e gratuito DOX agire per stabilizzare il nucleo micelle con conseguente aumento di carico di droga e la ritenzione. È accertato che la compatibilità o le interazioni tra un farmaco e il blocco di formazione nucleo sono fattori determinanti di parametri chiave relativi alle prestazioni. 12 Oltre a DOX, una serie di terapie contro il cancro includono anelli aromatici all'interno della loro struttura di base (ad esempio, metotrexate, Olaparib, SN -38).
Come risultato vi è interesse significativo nella sintesi di copolimeri che comprendono anelli benzilici nei loro blocchi di formazione nucleo. Anionico anello apertura polimerizzazione di PEG e dei suoi derivati abilitare il controllo sul peso molecolare e il risultato in materiali di bassa polidispersità in buona resa. 13,14 di etileossido ne con etere fenil glicidil (PheGE) o ossido di stirene (SO) può essere (co) polimerizzare per formare copolimeri a blocchi che formano micelle per solubilizzazione dei farmaci idrofobi. 15-18 La presente relazione descrive i passi necessari per vivere polimerizzazione anionica di fenil glicidil etere monomero in mPEG-OH come macroinitiator (Figura 1). Il copolimero a blocchi risultante e gli aggregati sono quindi caratterizzati in termini di proprietà di rilevanza usare nella somministrazione di farmaci.
Protocollo
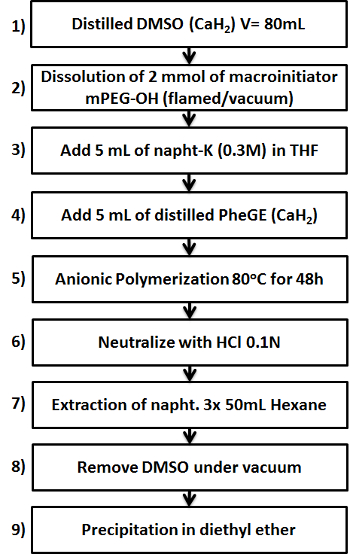
Figura 1. Schema che mostra i nove passi chiave nella preparazione del MPEG-b -PPheGE copolimero. Clicca qui per vedere una versione più grande di questa figura.
1. Preparazione dei reagenti in condizioni asciutte
- Preparazione dei reagenti.
- Pesare 15 g di mPEG-5K (M n = 5400 g / mol, PDI 1.03) e posto a 50 ° C in stufa sotto vuoto per 48 ore prima dell'uso.
- Dry 200 ml di dimetilsolfossido (DMSO) su idruro di calcio (CaH 2) (~ 1 g), posto sotto vuoto per 30 minuti, sotto argon spurgo e agitare per 48 ore prima dell'uso.
- Mettere 50 ml del monomero PheGE in un pallone asciutto e pulito (100 ml), aggiungere 1 g di CaH 2, tenuta sotto vuoto per 15 min in ghiaccio, spurgo sotto argone lasciare mescolare per 24 hr sotto argon prima dell'uso.
2. Preparazione del potassio Naftalene
- Accuratamente, tagliare piccoli pezzi di sodio (~ 1,5 g) essiccato con esano per rimuovere l'olio minerale in eccesso e aggiungere al pallone contenente il tetraidrofurano (THF) (v = 500 ml).
NOTA: I pezzi di sodio non devono essere esposte all'aria per lungo tempo a causa del rischio di incendio. - Aggiungere benzofenone (~ 5 g), spurgo con argon e sigillare il pallone (2 colli) con tappi di vetro.
- Dopo agitazione sotto argon per 24 ore, collegare il pallone a fondo tondo a un apparecchio di distillazione (Figura 2), distillare la soluzione scuro sotto argon mentre riflusso (cioè riflusso per un periodo di circa 2 ore dopo la soluzione diventa blu). Inizia a raccogliere il volume desiderato ~ 150 ml di THF chiudendo la valvola sinistra (trovato nel mezzo dell'apparecchio di distillazione).
NOTA: Se questa soluzione non diventa blu, fermare la distillazionemento, raffreddare a temperatura ambiente (RT) e aggiungere più benzofenone o di sodio e riavviare il distillazione. Questa è un'indicazione che il THF contiene ancora acqua. - In un Erlenmeyer asciutto aggiungere THF distillato (v = 100 ml) e sciogliere 3,9 g di naftalene.
NOTA: Stop distillazione, raffreddare a temperatura ambiente e aprire la valvola diritto di trasferire il volume di THF. - Come descritto al punto 2.1, tagliare piccoli pezzi di potassio (1,1 g) e aggiungere alla soluzione contenente il naftalene (concentrazione finale ~ 0,3 mol / L). Sigillare la beuta con un adattatore di lavaggio (T) (on / off) con un setto in alto e spurgo con argon.
- Dopo agitazione sotto argon per 24 ore, osservare la soluzione risultante della base naftalene potassio come colore verde scuro omogeneo.
- In condizioni inerti, rimuovere un'aliquota 5 ml della soluzione di base dalla muffola con una siringa e aggiungere 10 ml di acqua distillata. Successivamente aggiungere 1-2 gocce di fenolftaleina a questa soluzione,che trasforma la soluzione di un colore fucsia.
- Utilizzare una buretta per titolare la soluzione naftalene di potassio con una soluzione standard di acido cloridrico (0,1 N) finché la soluzione diventa incolore.
3. Materiali e le precauzioni necessarie per un'efficace Living anionici polimerizzazione
- Sistema di argon / collettore del vuoto.
NOTA: Come descritto in figura 2, un collettore doppio vetro con rubinetti cave di vetro viene utilizzato per commutare tra consegna argon e vuoto condizioni in vetro.- Collegare il serbatoio di argon (con manometro) per una colonna essiccante secco e alla linea collettore utilizzando tubi di gomma inerte. All'altra estremità della linea di argon, collegare un gorgogliatore (contenente olio minerale).
- Per i rubinetti di vetro, collegare i tubi flessibili inerti e gli aghi. Per l'altra linea del collettore, collegare una trappola vetro immersa in un Dewar fredda (riempito con ghiaccio / acqua o azoto liquido) ad una pompa ad alto vuoto.
- Apparecchio per distillazione del monomero e DMSO.
NOTA: Un conveniente (cioè, tutto in uno) Apparecchiatura per alta distillazione sotto vuoto viene impiegato (Figura 2). La vetreria a secco è realizzato con valvole alto vuoto, e condensatori built-in con una testa refrigerato interiore.- Collegare flusso dell'acqua attraverso l'ingresso (A) e di uscita (B) del gruppo di raffreddamento (lettera). Collegare l'altro ingresso / uscita (C) al collettore complanare per argon / vuoto. Aggiungere e sigillare un setto (fili metallici) alla bocca di mandata / aspirazione e collegare una cannula di acciaio inossidabile per il trasferimento di liquidi sensibili all'aria (D) (in alto / loop).
- Prima della polimerizzazione, distillare PheGE e DMSO cappe riscaldamento semisferiche a 100 ° C e 70 ° C, rispettivamente, per 2 ore sotto vuoto con agitazione. il punto di ebollizione del monomero PheGE è 254 ° C, mentre la temperatura di ebollizione per DMSO è 189 ° C a (1 atm).
- Vetreria per polymerizat anionicoionico.
- In aggiunta al sistema di distillazione, usare solo di alta cristalleria resistente al vuoto compreso rotonda palloni a fondo (certificati dal costruttore), cilindri graduata (per il trasferimento di volumi di solvente, base e monomeri), cannule, setti e fili metallici per sigillare i setti.
NOTA: per polimerizzazione, calore vivente accuratamente (sotto vuoto) e raffreddare la vetreria sotto flusso di argon prima dell'uso. Mantenere la pistola termica ad una distanza ~ 10 cm dal vetro.
- In aggiunta al sistema di distillazione, usare solo di alta cristalleria resistente al vuoto compreso rotonda palloni a fondo (certificati dal costruttore), cilindri graduata (per il trasferimento di volumi di solvente, base e monomeri), cannule, setti e fili metallici per sigillare i setti.
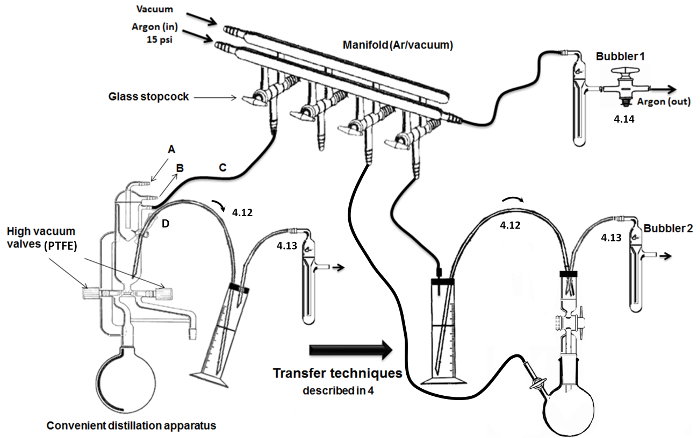
Figura 2. Montaggio e fasi di distillazione / trasferimento chiave. Cliccate qui per vedere una versione più grande di questa figura.
4. Descrizione dei passaggi chiave di Living anionico di polimerizzazione: la distillazione e di trasferimento
- Pesare mPEG-5K (2 mmol, 10 g) in un f seccalask / Schlenk (forno) contenente una barra agitatrice e sigillare l'adattatore di lavaggio (T) (on / off) con un setto in alto.
- Collegare il pallone al collettore e spurgare il pallone per 2-3 minuti con vampate di argon. Ruotare la valvola in posizione di vuoto per spurgare il pallone.
- Ruotare il pallone manualmente e asciugare il recipiente di reazione in modo omogeneo con un asciugacapelli (pistola ad aria calda) fino a Mpeg-5K si scioglie.
NOTA: Tenere la pistola di calore ad una distanza ~ 10 cm dal pallone. - Dopo 1 minuto, eliminare il vuoto ruotando la valvola sul collettore verso la posizione argon con diversi scatta veloci.
NOTA: Un flusso continuo di argon deve essere osservato nel gorgogliatore. Quando il flusso è continuo, la valvola rimane in posizione argon. fasi di riscaldamento e raffreddamento ripetere due volte per rimuovere ogni traccia di umidità. - Mantenere il macroinitiator polimerico sotto vuoto per ~ 2 ore e sotto argon prima dell'inizio della reazione.
- Montare due distillazione apparati alto vuoto sotto il cofano (figure 2); uno per la distillazione di DMSO e uno per la distillazione del monomero (PheGE).
- Collegare le beute separate contenenti il DMSO e monomero ai due apparati e installare ciascuno su un mantello riscaldante emisferica (o in un bagno d'olio). Collegare acqua fredda all'inizio dell'apparecchiatura (in / out) e al collettore (argon / vuoto).
- Assicurarsi che ogni apparato è sicuro e ben sigillato. Inserire il vuoto mediante la valvola.
NOTA:. Come descritto al punto 3.3, ripetere il riscaldamento e il raffreddamento passi due volte per rimuovere ogni traccia di umidità. - Impostare il riscaldamento attraverso un regolatore di temperatura e iniziare agitazione delle soluzioni. Dopo 2 h di circolazione / distillazione di DMSO, chiudere la valvola del vuoto elevato (trovato nel mezzo dell'apparecchio di distillazione) per raccogliere circa 20 ml di soluzione (per lavare l'interno dell'apparecchio). Quindi, rilasciare la frazione nel pallone e ripetere l'operazione di nuovo per garantire la purezza della frazione desiderata che è collected tardi.
- Riscaldare il pallone contenente la MPEG-5K (sotto vuoto) con la pistola di calore fino a quando il polimero (MPEG-5K) si scioglie. Spurgare di nuovo con argon.
NOTA: La procedura contribuirà alla dissoluzione dopo il trasferimento del DMSO. - Dopo 2 ore, chiudere la valvola di alto vuoto e raccogliere il volume di solvente (V DMSO = ~ 100 ml). Arrestare riscaldamento ed eliminare il vuoto dal collettore. Rilasciare argon (da automatici) nella camera come descritto sopra.
- Sotto una pressione positiva di argon, collegare un lato della cannula (attesa presso il rubinetto dell'apparato) ad un cilindro graduato o direttamente al pallone contenente MPEG-5K (se distillazione ha laurea) e, immergere l'altra estremità attenzione nella frazione distillata di fresco.
- Utilizzando pressione argon, guidare il DMSO attraverso la cannula nel pallone di reazione. Collegare un gorgogliatore in più per il pallone (o cilindro, se necessario, per la misurazione) e, chiudere il rubinetto di vetro collegato al the gorgogliatore sul lato opposto del collettore.
NOTA: Quando un lato di una cannula viene rimossa per il trasferimento, assicurarsi che sia applicata una pressione positiva argon. - Per evitare incidenti causati dalla pressione argon, aprire il rubinetto di vetro per 1-2 secondi e richiudere per continuare il flusso di DMSO (ripetuto una volta per 0,5 min) fino al completo trasferimento è completato. Riaprire il rubinetto di arresto al termine.
NOTA: La stessa procedura deve ora essere seguita per la distillazione e la raccolta del monomero. Il solvente e monomero non possano essere rilevati contemporaneamente. - Transfer 5 ml di 0,3 M naftalene potassio tramite cateterismo in un cilindro graduato sigillata da un setto con cannula (loop).
NOTA: La stessa precauzione, come descritto nella nota 4.13. pressione argon positivo deve essere mantenuta prima dal pallone naftalene potassio al cilindro e quindi dal cilindro al pallone di reazione per evitare / contaminazione dell'acqua dell'aria. - Inserire un altro ago dalla manifold nel cilindro (argon). Rimuovere la cannula collegata al sistema di distillazione con attenzione e inserire rapidamente nel pallone di reazione.
NOTA: Utilizzare questa tecnica per il trasferimento di base e monomero. - Aggiungere il calo di base a goccia fino a quando la soluzione diventa scuro. Dopo la lenta scomparsa di colore, aggiungere un'altra parte fino a quando il colore scuro appare di nuovo, e ripetere fino a quando il pieno trasferimento.
- Trasferire il volume desiderato di monomero (V PheGE = 5 ml) per raggiungere un grado di polimerizzazione di PPheGE ~ n = 18-20.
- Lasciare la reazione per 48 ore a 80 ° C sotto atmosfera di argon con agitazione costante per garantire la completa polimerizzazione.
- Quench la reazione mediante aggiunta di gocce di HCl 1 N in metanolo (misurati utilizzando carta tornasole (pH neutro)) e osservati da una scomparsa colore.
- Estrarre il naftalene dalla soluzione DMSO con esano (3 x 50 ml). Rimuovere il DMSO per distillazione sotto vuoto ~ 70 ml (stesso apparato). tubarel giù la soluzione liquami e aggiungere 50 ml di THF.
- Rimuovere il sale dalla soluzione slurry per centrifugazione a 5.000 xg per 10 min. Trasferire il surnatante e aggiungere goccia a goccia per 500 ml di etere etilico freddo.
- Raccogliere il precipitato mediante filtrazione o centrifugazione (ripetere due volte) ed essiccare sotto vuoto a 30 ° C per 24-48 ore (resa 85%).
NOTA: Il copolimero è ora pronto per la caratterizzazione.
5. Caratterizzazione dei copolimeri
- Pesare 5-10 mg di copolimero (record di massa reale) in una padella di campione di alluminio e sigillare ermeticamente con il coperchio in alluminio. Carico campione pan e pan di riferimento (vuoto) nel calorimetro a scansione differenziale.
- Programma un metodo ( "caldo / freddo / calore") Ciclo: 1) il calore da 40 ° C a 100 ° C a 10 ° C / min, 2) fresco a -70 ° C a 10 ° C / min, 3) il calore a 100 ° C a 10 ° C / min. Ripetere 2) e 3) due volte. Determinare il punto di fusione (T m), in criallization (T c) e temperature di transizione vetrosa (Tg), e calore di fusione (d H f) dalle tracce termiche del terzo ciclo (se applicabile).
- Sciogliere i polimeri in THF (2 mg / ml) e filtrare attraverso un filtro di PTFE da 0,2 micron. Iniettare il campione in un sistema di cromatografia a permeazione (50 microlitri) e utilizzare il tempo di ritenzione del campione e una curva di calibrazione prodotta utilizzando una serie di standard di polistirene per determinare il peso molecolare del polimero. 19
- Sciogliere i (co) polimeri (15 mg / ml) in DMSO d 6 per 1 H NMR spettroscopia. 19
- Determinare la concentrazione micellare critica (CMC) del copolimero con 1,6-difenil-1,3,5-esatriene (DPH) come sonda a fluorescenza. 9
- Preparare una soluzione DPH magazzino in THF (2.32 mg / L) al buio e aggiungere 100 ml di questa soluzione, a ciascuna di una serie di fiale.
- Prepare una soluzione di copolimero magazzino in THF e aggiungere aliquote di uguale volume di (2 ml) alla serie di flaconi (ciascuno contenente una aliquota della soluzione madre DPH) con concentrazioni copolimero finali che variano da 0,01 a 1,000 mg di copolimero / ml.
- Successivamente, vortice copolimero-DPH soluzioni e aggiungere goccia a goccia a 10 ml di acqua bidistillata agitando bar. Le soluzioni devono poi essere mescolato vigorosamente al buio per 48 ore sotto un flusso di azoto per consentire lenta evaporazione del THF. La concentrazione finale di DPH in ciascuna soluzione è 0.232 mg / L.
- Misurare l'emissione di fluorescenza dei campioni a 430 nm (λ ex = 350 Nm) con una micropiastra spettrofluorimetro doppia scansione e la trama di fluorescenza contro log [polimero]. L'intervallo fra le due piste lineari fornisce il valore CMC per il copolimero.
6. Procedura per il caricamento di doxorubicina in BCMs
- Sciogliere 12 mg di DOX in 1 ml di acetonitrile, aggiungere 10 ml di trietilammina e lasciare che la soluzione mescolare al buio per 2 ore.
- Sciogliere il copolimero (45 mg) in 1 ml di THF e mescolare per lo stesso periodo di tempo. Aggiungere la soluzione di copolimero alla soluzione DOX e risciacquare flaconcino contenente copolimero residua con un volume aggiuntivo di THF (0,5 ml).
- Aggiungere la miscela copolimero-farmaco (2,5 ml) goccia a goccia ad una fiala (20 ml) contenente 15 ml di soluzione salina allo 0,9% (NaCl) con agitazione.
- Trasferire la soluzione in un sacchetto di dialisi (3,5 kDa tagliato) e dializzare contro fisiologica 0,9% (500 ml).
NOTA: Modificare la salina esterna dopo 6 ore e lasciare che la dialisi continua per 24 ore con agitazione al buio a temperatura ambiente. - Trasferire il dializzato in un tubo da 50 ml e centrifugare a 5000 xg per 15 min.
- Trasferire il supernatante in un sistema di ultrafiltrazione (con capacità di 10 ml) contenente una membrana di dialisi (cut off 10 kDa). Mettere l'adattatore mescolando nel sistema di ultrafiltrazione, chiudere il coperchio e aperto cometream dell'azoto.
- Concentrare la soluzione BCM ad un volume di 4 ml e aggiungere 6 ml di soluzione salina fresca e ripetere la procedura due volte.
- Concentrare la soluzione BCM a 4 ml, lavare la camera con 0,5 ml di soluzione salina ed aggiungere alla soluzione. Conservare in fiale marrone a temperatura ambiente in un ulteriore scuro uso prima.
7. Valutazione di doxorubicina Caricamento in DOX-BCMs
- Sciogliere DOX-BCM in dimetilformammide (100 ml a 400 ml) per distruggere le micelle e diluire in soluzione acquosa di HCl (0,1 N) prima della valutazione (100 ml in 900 ml di HCl 0,1 N).
- Misurare carico di droga a 490 nm utilizzando un sistema da banco micropiastra spettrofotometrica. Utilizzare le seguenti equazioni per determinare la capacità di carico di droga (DLC) e l'efficienza della droga di carico (DLE):
DLC (wt%) = (peso di farmaco caricata / peso totale di BCMs) x 100%
DLE (%) = (peso di farmaco carico / peso di farmaco nei mangimi) x 100%
8. Valutazionein vitro di rilascio di DOX da DOX-BCMs
- Indagare il rilascio di DOX da BCMs a 37 ° C in 0,1 M tampone fosfato salino (PBS, pH 7,4) contro PBS pH 7,4 contenente 0,1% (w / v) Tween 80, BCMs + BSA (50 mg / ml) contro PBS pH 7,4 e 0,1 M di acetato-tampone a pH = 5,5. 20,21
- Diluire la formulazione BCM-DOX (700 microlitri) nella soluzione tampone (2,3 ml) per determinare una quantità totale di ≈ 0,6-0,7 mg di DOX nel sacchetto di dialisi.
- Posizionare la soluzione nel sacchetto di dialisi, sigillare con clip e immergere il sacchetto in 200 ml dei rispettivi supporti esterni.
- Rimuovere 2 ml della soluzione esterna del sacchetto di dialisi in momenti predeterminati e sostituirlo con lo stesso volume di tampone fresco.
- Conservare le aliquote rimosse a -20 ° C prima dell'analisi mediante spettrofotometria UV-Vis (Abs 490 nm). La percentuale cumulativa di farmaco rilasciato (E R) può essere calcolata utilizzando la seguente equazione:

NOTA: Dove m DOX rappresenta la quantità di DOX nei BCMs, V 0 è il volume totale dei mezzi di distribuzione (200 ml), V t è il volume del supporto sostituiti (V t = 2 ml), Ci è la concentrazione prima della correzione, e C n rappresenta la concentrazione di DOX nel campione.
Risultati
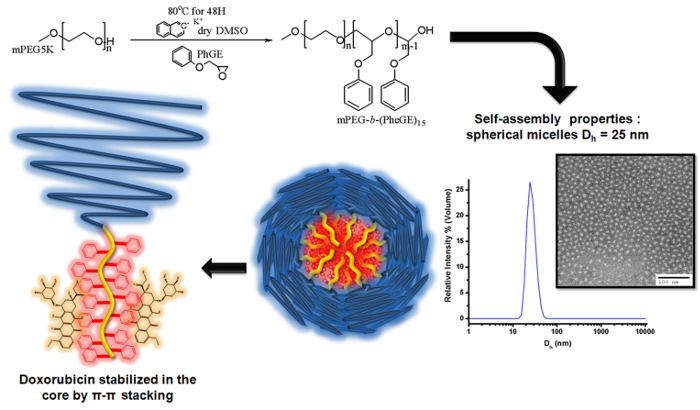
Figura 3. Illustrazione della polimerizzazione anionica fenil glicidil etere sull'MPEG macroinitiator produrre MPEG-b - (PheGE) 15 per la preparazione di micelle copolimero a blocchi per il caricamento di doxorubicina La rappresentazione la deprotonazione del gruppo ossidrile di mPEG utilizzando naftalene potassio.
Discussione
Grazie al buon controllo che la polimerizzazione anionica fornisce più di peso molecolare è uno dei processi più applicati nell'industria per la preparazione di polimeri a base di monomeri di ossirano (PEG e PPG). Le condizioni ottimali e stringenti devono essere utilizzati per la polimerizzazione di successo da raggiungere. la purificazione rigorosa di tutti i reagenti e apparecchi adeguata sono essenziali per il personaggio vivente della sintesi. Limitazioni della configurazione attuale sono per lo più associa...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
CA acknowledges a Discovery grant from the Natural Sciences and Engineering Research Council of Canada. CA acknowledges a Chair in Pharmaceutics and Drug Delivery from GSK. The authors declare no competing financial interest.
Materiali
| Name | Company | Catalog Number | Comments | |||||
| DMEM/HAMF12 | Gibco, Life Technologies | 12500 | Supplemented with 10%FBS. Warm in 37 °C water bath | |||||
| Trypsin-EDTA(0.25%) | Sigma-Aldrich | T4049 | Warm in 37 °C water bath | |||||
| Fetal bovine serum (FBS) | Sigma-Aldrich | F1051 | Canada origin | |||||
| MDA-MB-468 cell line | ATCC | HTB-132 | ||||||
| MTS tetrazolium reagent | PROMEGA | G111B | ||||||
| Phenazine ethosulfate (PES) | Sigma-Aldrich | P4544 | >95% | |||||
| mPEG5K (Mn 5400 g/mol) | Sigma-Aldrich | 81323 | PDI=1.02 | |||||
| Dimethylsolfoxide (DMSO) | Sigma-Aldrich | D4540 | >99.5% | |||||
| Naphthalene | Sigma-Aldrich | 147141 | >99% | |||||
| Phenyl glycidyl ether | Sigma-Aldrich | A32608 | >85% | |||||
| Benzophenone | Sigma-Aldrich | 427551 | >99% | |||||
| Potassium | Sigma-Aldrich | 451096 | >98% | |||||
| Tetrahydrofuran | Caledon Laboratory Chemicals | 8900 1 | ACS | |||||
| Hexane | Caledon Laboratory Chemicals | 5500 1 | ACS | |||||
| Calcium hydride (CaH2) | ACP | C-0460 | >99.5% | |||||
| Diethyl Ether | Caledon Laboratory Chemicals | 1/10/4800 | ACS | |||||
| Microplate reader | BioTek Instruments | |||||||
| Differential scanning calorimetry (DSC) | TA Instruments Inc | DSC Q100 | ||||||
| Gel permeation chromatography (GPC) | Waters | 2695 separation moldule / 2414 detector | 2 Columns: Agilent Plgel 5µm Mixed-D | |||||
| NMR spectroscopy | Varian Mercury 400MHz | |||||||
| Chloroform-d | Sigma-Aldrich | 151858 | 99.96% | |||||
| DMSO-d | Sigma-Aldrich | 156914 | 99.96% | |||||
| Vaccum pump | Gardner Denver Welch Vacuum Tech, Inc. | Ultimate pressure 1.10-4 torr | ||||||
| Drierit with indicator, 8 mesh | Sigma-Aldrich | 238988 | Regenerated at 230°C for 2 hrs | |||||
Riferimenti
- Dickerson, T. J., Reed, N. N., Janda, K. D. Soluble Polymers as Scaffolds for Recoverable Catalysts and Reagents. Chemical Reviews. 102, 3325-3344 (2002).
- van Heerbeek, R., Kamer, P. C. J., van Leeuwen, P. W. N. M., Reek, J. N. H. Dendrimers as Support for Recoverable Catalysts and Reagents. Chemical Reviews. 102 (10), 3717-3756 (2002).
- Knop, K., Hoogenboom, R., Fischer, D., Schubert, U. S. Poly(ethylene glycol) in Drug Delivery: Pros and Cons as Well as Potential Alternatives. Angewandte Chemie International Edition. 49 (36), 6288-6308 (2010).
- Eetezadi, S., Ekdawi, S. N., Allen, C. The challenges facing block copolymer micelles for cancer therapy: In vivo barriers and clinical translation. Advanced Drug Delivery Reviews. 91, 7-22 (2015).
- Attwood, D., Booth, C., Yeates, S. G., Chaibundit, C., Ricardo, N. Block copolymers for drug solubilisation: Relative hydrophobicities of polyether and polyester micelle-core-forming blocks. International Journal of Pharmaceutics. 345 (1-2), 35-41 (2007).
- Matsumura, Y., Kataoka, K. Preclinical and clinical studies of anticancer agent-incorporating polymer micelles. Cancer Science. 100 (4), 572-579 (2009).
- Chan, A. S., Chen, C. H., Huang, C. M., Hsieh, M. F. Regulation of particle morphology of pH-dependent poly(epsilon-caprolactone)-poly(gamma-glutamic acid) micellar nanoparticles to combat breast cancer cells. Journal of Nanoscience and Nanotechnology. 10 (10), 6283-6297 (2010).
- Diao, Y. Y., et al. Doxorubicin-loaded PEG-PCL copolymer micelles enhance cytotoxicity and intracellular accumulation of doxorubicin in adriamycin-resistant tumor cells. International Journal of Nanomedicine. 6, 1955-1962 (2011).
- Mikhail, A. S., Allen, C. Poly(ethylene glycol)-b-poly(ε-caprolactone) Micelles Containing Chemically Conjugated and Physically Entrapped Docetaxel: Synthesis, Characterization, and the Influence of the Drug on Micelle Morphology. Biomacromolecules. 11 (5), 1273-1280 (2010).
- Kataoka, K., Harada, A., Nagasaki, Y. Block copolymer micelles for drug delivery: design, characterization and biological significance. Advanced Drug Delivery Reviews. 47 (1), 113-131 (2001).
- Nakanishi, T., et al. Development of the polymer micelle carrier system for doxorubicin. Journal of Controlled Release. 74 (1-3), 295-302 (2001).
- Liu, J., Xiao, Y., Allen, C. Polymer-drug compatibility: A guide to the development of delivery systems for the anticancer agent, ellipticine. Journal of Pharmaceutical Sciences. 93 (1), 132-143 (2004).
- Flory, P. J. Molecular Size Distribution in Ethylene Oxide Polymers. Journal of the American Chemical Society. 62 (6), 1561-1565 (1940).
- Kazanskii, K. S., Solovyanov, A. A., Entelis, S. G. Polymerization of ethylene oxide by alkali metal-naphthalene complexes in tetrahydrofuran. European Polymer Journal. 7 (10), 1421-1433 (1971).
- Crothers, M., et al. Micellization and Gelation of Diblock Copolymers of Ethylene Oxide and Styrene Oxide in Aqueous Solution. Langmuir. 18 (22), 8685-8691 (2002).
- Taboada, P., et al. Block Copolymers of Ethylene Oxide and Phenyl Glycidyl Ether: Micellization, Gelation, and Drug Solubilization. Langmuir. 21 (12), 5263-5271 (2005).
- Taboada, P., et al. Micellization and Drug Solubilization in Aqueous Solutions of a Diblock Copolymer of Ethylene Oxide and Phenyl Glycidyl Ether. Langmuir. 22 (18), 7465-7470 (2006).
- Attwood, D., Booth, C. . Colloid Stability. , 61-78 (2010).
- Le Devedec, F., et al. Postalkylation of a Common mPEG-b-PAGE Precursor to Produce Tunable Morphologies of Spheres, Filomicelles, Disks, and Polymersomes. ACS Macro Letters. 5 (1), 128-133 (2016).
- Chtryt, V., Ulbrich, K. Conjugate of Doxorubicin with a Thermosensitive Polymer Drug Carrier. Journal of Bioactive and Compatible Polymers. 16 (6), 427-440 (2001).
- Kataoka, K., et al. Doxorubicin-loaded poly(ethylene glycol)-poly(β-benzyl-l-aspartate) copolymer micelles: their pharmaceutical characteristics and biological significance. Journal of Controlled Release. 64 (1-3), 143-153 (2000).
- Cammas, S., Matsumoto, T., Okano, T., Sakurai, Y., Kataoka, K. Design of functional polymeric micelles as site-specific drug vehicles based on poly (α-hydroxy ethylene oxide-co-β-benzyl l-aspartate) block copolymers. Materials Science and Engineering: C. 4 (4), 241-247 (1997).
- Lv, S., et al. Doxorubicin-loaded amphiphilic polypeptide-based nanoparticles as an efficient drug delivery system for cancer therapy. Acta Biomaterialia. 9 (12), 9330-9342 (2013).
- Kim, J. O., Oberoi, H. S., Desale, S., Kabanov, A. V., Bronich, T. K. Polypeptide nanogels with hydrophobic moieties in the cross-linked ionic cores: synthesis, characterization and implications for anticancer drug delivery. Journal of Drug Targeting. 21 (10), 981-993 (2013).
- Zhao, C. L., Winnik, M. A., Riess, G., Croucher, M. D. Fluorescence probe techniques used to study micelle formation in water-soluble block copolymers. Langmuir. 6 (2), 514-516 (1990).
- Wilhelm, M., et al. Poly(styrene-ethylene oxide) block copolymer micelle formation in water: a fluorescence probe study. Macromolecules. 24 (5), 1033-1040 (1991).
- Cammas, S., Kataoka, K. Functional poly[(ethylene oxide)-co-(β-benzyl-L-aspartate)] polymeric micelles: block copolymer synthesis and micelles formation. Macromolecular Chemistry and Physics. 196 (6), 1899-1905 (1995).
- Kwon, G., et al. Micelles based on AB block copolymers of poly(ethylene oxide) and poly(.beta.-benzyl L-aspartate). Langmuir. 9 (4), 945-949 (1993).
- Ahmed, F., Discher, D. E. Self-porating polymersomes of PEG-PLA and PEG-PCL: hydrolysis-triggered controlled release vesicles. Journal of Controlled Release. 96 (1), 37-53 (2004).
- Uhrig, D., Mays, J. W. Experimental techniques in high-vacuum anionic polymerization. Journal of Polymer Science Part A: Polymer Chemistry. 43 (24), 6179-6222 (2005).
- Parker, A. J. The effects of solvation on the properties of anions in dipolar aprotic solvents. Quarterly Reviews, Chemical Society. 16 (2), 163-187 (1962).
- Cram, D. J. . Fundamentals o] Carbanion Chemistry. , (1965).
- Szwarc, M. . ACS Symposium Series. 166, 1-15 (1981).
- Cho, Y. W., Lee, J., Lee, S. C., Huh, K. M., Park, K. Hydrotropic agents for study of in vitro paclitaxel release from polymeric micelles. Journal of Controlled Release. 97, 249-257 (2004).
- Dewhurst, P. F., Lovell, M. R., Jones, J. L., Richards, R. W., Webster, J. R. P. Organization of Dispersions of a Linear Diblock Copolymer of Polystyrene and Poly(ethylene oxide) at the Air−Water Interface. Macromolecules. 31 (22), 7851-7864 (1998).
- Opanasopit, P., et al. Block Copolymer Design for Camptothecin Incorporation into Polymeric Micelles for Passive Tumor Targeting. Pharmaceutical Research. 21 (11), 2001-2008 (2004).
- Allen, G., Booth, C., Price, C. VI-The physical properties of poly(epoxides). Polymer. 8, 414-418 (1967).
- Jada, A., Hurtrez, G., Siffert, B., Riess, G. Structure of polystyrene-block-poly(ethylene oxide) diblock copolymer micelles in water. Macromolecular Chemistry and Physics. 197 (11), 3697-3710 (1996).
- Attwood, D., Florence, A. T. . Surfactant systems : their chemistry, pharmacy, and biology. , (1983).
- Rekatas, C. J., et al. The effect of hydrophobe chemical structure and chain length on the solubilization of griseofulvin in aqueous micellar solutions of block copoly(oxyalkylene)s. Physical Chemistry Chemical Physics. 3 (21), 4769-4773 (2001).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon