È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Metodologie per lo studio
In questo articolo
Riepilogo
This study presents the development of reproducible methodologies to study biofilm inhibitors and their effects on Bacillus subtilis multicellularity.
Abstract
This work assesses different methodologies to study the impact of small molecule biofilm inhibitors, such as D-amino acids, on the development and resilience of Bacillus subtilis biofilms. First, methods are presented that select for small molecule inhibitors with biofilm-specific targets in order to separate the effect of the small molecule inhibitors on planktonic growth from their effect on biofilm formation. Next, we focus on how inoculation conditions affect the sensitivity of multicellular, floating B. subtilis cultures to small molecule inhibitors. The results suggest that discrepancies in the reported effects of such inhibitors such as D-amino acids are due to inconsistent pre-culture conditions. Furthermore, a recently developed protocol is described for evaluating the contribution of small molecule treatments towards biofilm resistance to antibacterial substances. Lastly, scanning electron microscopy (SEM) techniques are presented to analyze the three-dimensional spatial arrangement of cells and their surrounding extracellular matrix in a B. subtilis biofilm. SEM facilitates insight into the three-dimensional biofilm architecture and the matrix texture. A combination of the methods described here can greatly assist the study of biofilm development in the presence and absence of biofilm inhibitors, and shed light on the mechanism of action of these inhibitors.
Introduzione
comunità batteriche multi-cellulari giocano un ruolo significativo in ambienti naturali e antropici, e può essere utile o altamente deleterio. Queste colonie multicellulari sono noti come biofilm, in cui le singole celle sono incorporate in una matrice sostanze polimeriche extracellulari autoprodotti (EPS). L'EPS aderiscono fortemente le cellule alla superficie colonizzano. Essi servono come scudo contro le forze meccaniche e chimiche e creano stretto contatto tra cellule vicine, facilitando comunicazione cellulare 1. Un biofilm può essere visto come una comunità differenziate, in cui le cellule uso altamente regolati, orchestrato processi per coordinare le loro attività all'interno della comunità, così come tra le specie 2-5. Il passaggio da un planctoniche, modalità di vita libera di crescita a uno stato biofilm è spesso associata a processi di sviluppo. Un buon esempio è il Bacillus subtilis batterio del suolo Gram-positivi, e quindi un undómëceppo sticated serve come un modello robusto organismo per studiare le fasi di sviluppo che portano alla formazione di biofilm. In questo batterio, cellule mobili si organizzano in strutture multicellulari cospicui che svolgono mansioni specializzate 4. Un gruppo di cellule, la matrice-produttori secernono esopolisaccaridi 6, la proteina amiloide ATAS 7,8, e la proteina di superficie hydrophobicity BSLA 9,10; ognuno dei quali partecipare all'Assemblea degli EPS 11-13.
Data l'abbondanza di biofilm in nicchie naturali e antropici e il danno fatale putativo possono causare, vi è un urgente bisogno di trovare modi per prevenire la loro formazione. Gli inibitori di piccole molecole in grado di aiutare nella scoperta di nuovi percorsi normativi, enzimi e proteine strutturali coinvolte nella formazione di biofilm, e, quindi, di promuovere approfondimenti nei complessi processi di assemblaggio comunità multicellulare. Come B. subtilis è un modello ben studiato per la biofilmazione 14,15, può essere utilizzato per valutare gli effetti di vari inibitori biofilm. Questo studio affronta quattro metodi fondamentali che sono fondamentali per la valutazione della risposta dei biofilm a piccole molecole inibitrici. Innanzitutto, per garantire che questi inibitori hanno un obiettivo specifico biofilm, la separazione degli effetti sulla crescita planctonici dall'effetto sulla formazione del biofilm è critica. La maggior parte degli agenti antibatterici colpire le cellule nella loro fase di crescita planctonici, ma le molecole che hanno come target lo stile di vita biofilm sono rari. Inoltre, come le molecole che non influenzano la crescita planctonici non sono tossici, possono ridurre la pressione selettiva che favorisce i mutanti resistenti agli antibiotici 16. Per esempio, quando biofilm sono trattati con D-amminoacidi o alcune altre molecole parete cellulare interferente, o sono disturbati o smontati, ma questi inibitori riguardano solo lievemente planktonic 12,17 crescita. Al contrario, molti antibiotici alterano drammaticamente la crescita planctonici, con little o nessun effetto sulla formazione di biofilm 17.
In secondo luogo, che stabilisce un quadro sperimentale consistente e robusto per studiare l'effetto delle piccole molecole è fondamentale. Abbiamo osservato che l'intervallo di concentrazione attiva delle piccole molecole inibitrici era sensibile alle condizioni pre-coltura e alla configurazione sperimentale utilizzato per studiare l'effetto di queste piccole molecole inibitrici. Diversi rapporti, in particolare quelli che studiano B. subtilis, rivelato variazioni nell'intervallo di concentrazione in cui D-amminoacidi inibiscono la formazione di pellicole - i galleggianti biofilm batterici 12,17-19. I risultati qui presentati indicano che i seguenti fattori rappresentano differenze nella gamma di concentrazione attiva: le condizioni di pre-coltura (logaritmica 12,17 contro fase tardo-stazionaria 20 di crescita), il terreno di coltura utilizzato nella condizione di pre-cultura (ricco, indefinita [Luria Broth, LB] contro definito [glutammato monosodico-glycerol, MSgg]), il rapporto di inoculazione e soprattutto la rimozione del mezzo di precoltura prima dell'inoculo. La temperatura di crescita pellicola statica mostrato un ruolo meno importante nella gamma attività della piccola molecola inibitore D-leucina, acido rappresentante D-amino utilizzato in questo studio.
Infine, una volta che i biofilm sono trattati con inibitori biofilm specifici, metodi robusti e informativi sono necessari per caratterizzare gli effetti di questi inibitori sui biofilm fitness. Qui, due metodi per caratterizzare in modo indipendente l'effetto di piccole molecole inibitrici sono descritte in dettaglio: (1) L'effetto sulla singole celle all'interno di una colonia di biofilm e la loro resistenza agli agenti antimicrobici. Le cellule in biofilm sono in genere più resistenti agli antibiotici rispetto ai batteri a vita libera 21-23. Mentre questo fenomeno è multifattoriale, la capacità dell'EPS per ridurre la penetrazione antibiotico è spesso considerata come una spiegazione attraente 24 . Questo metodo valuta la sopravvivenza delle cellule biofilm prestabiliti dopo l'esposizione a sostanze antibatteriche. (2) L'effetto sull'architettura biofilm colonia, dalla grande alla piccola scala. colonie Biofilm sono caratterizzati dalla loro struttura tridimensionale e la presenza di EPS. Utilizzando la microscopia elettronica a scansione, cambiamenti nella morfologia cellulare, struttura colonia biofilm e l'architettura e l'abbondanza dei EPS possono essere visualizzati dal grande (mm) alla piccola scala (micron).
Protocollo
1. valutare l'effetto di piccole molecole inibitori sulla Pellicle e la formazione di biofilm Colony
- Preparare una soluzione di 2x definito medio MSgg biofilm che inducono 25 senza il cloruro di calcio e ferro (III) cloruro esaidrato. Dopo la sterilizzazione del filtro, aggiungere il cloruro di calcio. Il mezzo è pronto all'uso direttamente oppure può essere conservato a 4 ° C al buio.
- Preparare la diluizione 1x MSgg il giorno dell'esperimento.
- Diluire il mezzo 2x MSgg a 1x con acqua distillata sterile (pellicole) o agar sterile 3% calda (80 ° C) (biofilm) e aggiungere ferro (III) cloruro esaidrato ad una concentrazione finale di 50 pM (pellicole) o 250 pM ( biofilm). Aggiungere antibiotici o piccole molecole inibitrici alla concentrazione desiderata e mescolare bene. Ad esempio, per ottenere una concentrazione finale di 0,5 mM D-leucina in 30 ml di stabilire pellicole o biofilm, aggiungere 196,6 ml di un 76,3 mM (10 mg / ml) di soluzione D-leucina.
NOTE:. La composizione finale 1x MSgg sono descritte nella Tabella 1 Rispetto alla ricetta originale 25, il mezzo conteneva 50 ug / ml treonina e la concentrazione di ferro per crescere colonie biofilm su terreno solido MSgg stato aumentato 2.5x per ottimizzare la morfologia delle colonie rugosa .
- Diluire il mezzo 2x MSgg a 1x con acqua distillata sterile (pellicole) o agar sterile 3% calda (80 ° C) (biofilm) e aggiungere ferro (III) cloruro esaidrato ad una concentrazione finale di 50 pM (pellicole) o 250 pM ( biofilm). Aggiungere antibiotici o piccole molecole inibitrici alla concentrazione desiderata e mescolare bene. Ad esempio, per ottenere una concentrazione finale di 0,5 mM D-leucina in 30 ml di stabilire pellicole o biofilm, aggiungere 196,6 ml di un 76,3 mM (10 mg / ml) di soluzione D-leucina.
- Dopo la solidificazione del agar, asciugare le piastre MSgg solidi in una cappa biologica per 30-45 minuti prima della inoculazione.
- Per selezionare inibitori specifici che interferiscono con i meccanismi di formazione pellicola (figura 1), esclude che le concentrazioni utilizzate influenzano planctonici e crescita statica.
- Determinare crescita planktonic (aumento della densità ottica nel tempo in coltura liquida) in una curva di crescita semplice misurando la densità ottica a 600 nm ogni ora fino alla fase di crescita stazionaria.
- Per confermare che la torbidità cultura misurata rappresenta conta di cellule vive, determinare il numero di unità formanti colonia (CFU)di cellule in fase di crescita planctonici da una coltura agitando dopo diversi punti temporali.
- Per valutare l'effetto di piccole molecole inibitrici sulla crescita pellicola statica, cellule raccolto alla fine di una incubazione di 3 giorni a 23 ° C da 24 pozzetti coltura cellulare e, inoculato nelle stesse condizioni come descritto nelle sezioni 1,7-1,9 e determinare la CFU. Per questo controllo, utilizzare un ceppo pellicola con deficit che manca i operoni che codificano per i componenti della matrice extracellulare (vale a dire, B. subtilis Δ epsH, Δ TASA).
NOTA: Questo ceppo è in grado di crescere in condizioni statiche, ma a differenza di un ceppo selvatico pellicle-formatura, è carente nella capacità di galleggiare all'interfaccia liquido-aria, la cui crescita è favorita a causa di un aumento dei livelli di ossigeno 26. Così, questo da matrice extracellulare e la tensione pellicola-carente è un ceppo di riferimento consigliato per valutare la crescita in condizioni statiche.
NOTA: Per la specifica exampio del non canonica D-amino acido D-leucina descritte di seguito, un effetto sulla planctonici e la crescita statica a concentrazioni che interferivano con la formazione di pellicola è stato escluso 12,17. I metodi per determinare planctonici e crescita statica sono descritte in dettaglio 17.
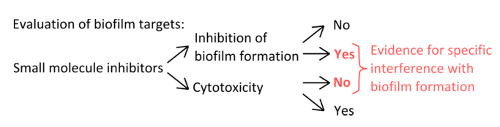
Figura 1. panoramica concettuale per l'identificazione di un robusto apparato sperimentale per valutare l'inibizione specifica della formazione di biofilm. I criteri di selezione per le piccole molecole inibitrici che indicano l'interferenza specifico con la formazione di biofilm, senza effetto pronunciato sulla crescita planctonici. Clicca qui per vedere una versione più grande di questa figura.
- Streak fuori B. subtilis da un C magazzino -80 ° (LB culture di 10 9 cellule / ml congelati in glicerolo al 20%) per isolare singole colonie su una piastra di agar-% 1,5 LB con una punta sterile o un bastoncino applicatore.
- Crescere notte a 30 ° C.
- PUNTO CRITICO: Per una robusta inibizione pellicola dagli acidi non canonica D-amino come D-leucina, crescere una singola colonia prelevata dal% piastra di agar-1.5 LB in 3 ml brodo LB a 37 ° C per 4 ore in un agitazione incubatore (velocità di agitazione 200 rpm). Sostituire il brodo LB con il mezzo MSgg biofilm che inducono prima inoculazione mediante centrifugazione cultura 1,5 ml di avviamento per 4 min a 6.000 xg, rimuovere con attenzione il surnatante e ri-sospensione il pellet in 1,5 ml di mezzo MSgg. Il resto della coltura può essere scartato.
Importante: Per garantire la robustezza del sistema, la densità ottica a 600 nm (OD 600) della coltura starter lavato dovrebbe essere compreso tra 0,6 e 1. - Durante la crescita della coltura starter, preparare un 12-pozzetti di coltura cellulare plate multidish contenentg 3 ml di terreno MSgg senza o con un intervallo di concentrazione della piccola molecola inibitore (ad esempio, 0,3, 0,5, 1 mM D-leucina 17). Per escludere effetti di bordo, distribuire la collocazione delle diverse concentrazioni di tutta la piastra multidish. In alternativa, utilizzare 24 pozzetti coltura cellulare piastre multidish contenente 1,5 ml di terreno MSgg.
- Inoculare pozzetti della coltura cellulare piastra multidish 12 pozzetti con 3 ml di coltura starter lavato (1: 1.000 diluizione).
NOTA: Un rapporto di diluizione inferiore, cioè, 1: 500 può essere utilizzato. Questo riduce il tempo di sviluppo delle pellicole. - Grow le pellicole a 23 ° C in condizioni statiche per tre giorni. Non spostare le pellicole durante questo tempo, in quanto può influenzare la morfologia superficiale finale della pellicola.
- Acquisire le immagini con un'esposizione binoculare e omogeneo di fulmini. In alternativa, fare una foto delle pellicole con una fotocamera ad alta risoluzione. Per evitare artefatti causati da inconsisangoli di luce tenda e ombre, scattare foto top-down con la telecamera fissa su un treppiede e utilizzare una fonte di luce morbida e grande a 45 ° da entrambi i lati.
NOTA: Un metodo alternativo per studiare B. subtilis pluricellularità è il saggio colonia di biofilm su, terreno solido biofilm che inducono MSgg. Come pellicole, questo test permette lo studio dei processi spazio-temporali. Una volta che la gamma attiva delle piccole molecole inibitrici è determinata, il loro effetto sulla formazione di biofilm colonia può essere studiato. - Per crescere colonie biofilm, simmetricamente individuare 1,5 ml di non lavato precoltura (Passo 1.7) sul MSgg 1,5% agar essiccato con l'aiuto di un modello - 4 gocce per Petri di 8,5 cm di diametro. Lasciate che le gocce adsorbono alla piastra prima di muoversi.
NOTA: Il modello consente di ottenere una distribuzione uniforme delle colonie biofilm all'interno della zona dove si coltivano le cellule. Per preparare il modello, disegnare l'area totale della crescita su scale originali, dividerlo alla parità di settaors e marcare il centro. Per un giro Petri di 8,5 cm di diametro, questo assegna 14 centimetri 2 di una colonia biofilm. - Incubare le piastre a 30 ° C per tre giorni. Durante questo tempo, colonie biofilm sviluppano e formano un tridimensionale, struttura rugosa.
- Scattare foto come al punto 1.11.
2. Etanolo Resistenza Assay
- Crescere biofilm come descritto ai punti 1,1-1,7 e 1.12-1.14.
- Dopo 68 h di crescita a 30 ° C, tagliare le colonie biofilm in due parti uguali con l'aiuto di una lama di rasoio e il modello.

Figura 2. Esempio disegno sperimentale per valutare la resistenza delle cellule biofilm colonie di agenti sterilizzanti. (A) Template utilizzato per la distribuzione uniforme delle colonie biofilm attraverso una piastra di Petri e per il taglio. (B)immagini top-down non trattati wild-type biofilm coltivate per 68 h su terreno solido, definito biofilm che inducono MSgg a 30 ° C. L'ingrandimento mostra come una colonia biofilm può essere tagliato in due metà uguali. (C) Le due metà uguali biofilm sono trattati allo stesso modo (il controllo, PBS) o sia con PBS o agente sterilizzante e trattati come descritto. Bar Scala:. 1 cm Clicca qui per vedere una versione più grande di questa figura.
- Sollevare attentamente ciascuna metà della colonia biofilm dalla piastra di agar con una piccola spatola e spostarlo in una provetta da 1,5 ml microcentrifuga contenente 500 ml di tampone fosfato salino (PBS). Se necessario, raschiare le cellule rimanenti dalla piastra e trasferirli provetta pure.
NOTA: La seconda metà della colonia biofilm viene trattato differentemente, a seconda che esso è il controllo o per testare la resistenza alla steriAgenti Lizing. - Per il controllo, incubare la seconda metà della colonia biofilm in 500 microlitri di PBS come al punto 2.3. Per valutare la resistenza agli agenti sterilizzanti, trasferire la seconda metà della colonia biofilm a 500 microlitri 50% (v / v) etanolo.
NOTA: sterilizzazione alternativo agenti come ipoclorito di sodio possono essere usati. Per tutti gli agenti sterilizzanti utilizzati, determinare il tempo di concentrazione e incubazione attiva in un esperimento preliminare. - Incubare le colonie biofilm per 10 min sul banco a temperatura ambiente.
- Centrifugare le colonie biofilm per 5 min a 18.000 xg e rimuovere con attenzione il surnatante con una pipetta. Aggiungere 300 ml di PBS.
- Sonicare cellule leggermente (ampiezza 10%, impulso 5 sec) con lo micropunte di un sonicatore.
NOTA: L'energia sonicazione deve essere sufficiente ad aggregati biofilm separati. Tuttavia, troppo dura sonicazione può lisi delle cellule. Confermare in anticipo al microscopio ottico che l'energia sonicazioneutilizzati non lisare le cellule e che tutti gli aggregati sono dissolti. - Aggiungere 700 microlitri di PBS fino ad un volume finale di 1 ml. Eseguire una diluizione seriale (a 10 -7) in PBS e diffondere 100 ml di 3 diluizioni su una piastra di agar-% 1,5 LB utilizzando microsfere di vetro sterili.
NOTA: Le diluizioni ottimali per essere placcato dovrebbe essere determinata in un esperimento preliminare, in quanto dipende dalla quantità di cellule nella colonia biofilm di interesse e il tasso di sopravvivenza delle cellule in risposta all'agente sterilizzante. - Incubare le piastre notte a 30 ° C, contare il CFU e determinare CFU / ml. Dalla finale CFU / ml di ciascuna delle colonie mezzo biofilm, calcolare la percentuale di sopravvissuti.
NOTA: Quando eseguito e analizzato come descritto, le due metà della colonia di controllo biofilm e trattata contro etanolo trattata la metà della colonia biofilm greggia dovrebbe produrre differenze inferiori al 10% della conta delle cellule vitali, verificando la simmetria o la resistenza della colonia , faucibusctively. In alternativa, i risultati possono essere rappresentati in totale CFU. I conteggi di cellule di controllo e non trattato colonia biofilm dovrebbero rimanere nello stesso ordine di grandezza. Al contrario, i conteggi cellulari del mezzo etanolo trattata di una piccola molecola biofilm colonia trattati dovrebbero scendere da un minimo di due ordini di grandezza la rivendicazione per una maggiore sensibilità all'agente sterilizzante.
3. biofilm Colony Preparazione del campione per la microscopia elettronica a scansione
- Crescere colonie biofilm come descritto nei passaggi 1,1-1,7 e 1.12-1.14.
- Preparare una serie fresca di 2% (v / v) glutaraldeide, 3% (v / v) di paraformaldeide in 100 mM cacodilato di sodio, 5 mM di tampone di cloruro di calcio, pH 7.3. Preparare 5 ml di fissativo per ogni capsula di Petri di 8,5 cm di diametro.
ATTENZIONE: glutaraldeide e paraformaldeide sono pericolosi. li maneggiare con dispositivi di sicurezza all'interno di una cappa chimica. Eliminare le soluzioni ed i materiali contaminati al hazrifiuti ardous. - Aggiungere con cautela il fissativo alle colonie biofilm, senza l'erogazione direttamente sulla parte superiore dei biofilm.
NOTA: A causa del carattere idrofobico della colonia biofilm, le colonie staccano lentamente dalla agar ed iniziano a galleggiare. - sigillare accuratamente le piastre con una striscia di Parafilm. Incubare su un agitatore rotante per 2 ore a temperatura ambiente e successivamente trasferire le piastre a 4 ° C per una notte.
- Il giorno successivo, rimuovere con cautela il liquido con una pipetta Pasteur di vetro collegato ad una pompa a vuoto.
- Aggiungere con cautela 10 ml 100 mM cacodilato di sodio, 5 mM di tampone cloruro di calcio per lavare il biofilm e incubare per 5 min. Rimuovere delicatamente il liquido con la pipetta Pasteur di vetro da un angolo del piatto per evitare di danneggiare il biofilm e aggiungere la soluzione di lavaggio fresca delicatamente pipettando. Ripetere questa operazione una sola volta.
- Per la disidratazione delle colonie biofilm, procedere con le seguenti operazioni: 2 x 5 min in DDH 2 O; 2x 20 min a 30% di etanolo; 2x 20 min in etanolo al 50%; 2x 20 min in etanolo al 70%; 2x 20 min in etanolo al 96%; 2x 30 min a 100% di etanolo.
- Aggiungere 15 ml di liquido per ogni piatto Petri di 8,5 cm di diametro in ogni passo e rimuovere il liquido accuratamente dopo ogni incubazione.
- Utilizzare uno dei due metodi differenti per asciugare i campioni da etanolo.
- Per l'aria di essiccazione da etanolo:
- Tagliare un filtro di carta di cellulosa (diametro di 9 cm) in quarti. Brevemente immergere un quarto in 100% di etanolo, e poi trasferire con cura uno galleggiante biofilm colonia su di esso. Mettere la carta da filtro bagnata in una capsula di Petri foderato con carta da filtro. Coprire la piastra di Petri e lasciare che le colonie biofilm asciugare per una notte in una cappa chimica.
- Per punto critico (CP) -Essiccazione utilizzando anidride carbonica (CO 2) come fluido di transizione:
- Riempire il 75% della camera di critica macchina a punti di asciugatura con etanolo al 100%. Trasferire i campioni in un supporto, ogni campione nel proprio cHamber. Se necessario, tagliare il biofilm con le forbici in piccoli pezzi. Lasciare i campioni immersi in etanolo durante tutte le manipolazioni. Quindi, trasferire il supporto nella camera e chiudere la camera ermeticamente.
- Raffreddare la camera al 7 ° C e iniziare a mescolare. Riempire la camera completamente con CO 2 liquida. Nel corso di un periodo di incubazione 7 min, lasciare che la miscela di etanolo con la CO 2. Poi, scarico 25% della soluzione.
NOTA: Non svuotare la camera di sotto del livello del campione. - Ripetere il punto 3.8.2.2 quattro volte.
- Ripetere il punto 3.8.2.2 cinque volte con un tempo di incubazione di soli 5 min. Infine, l'etanolo dovrebbe essere completamente sostituita da CO 2.
- Durante l'ultimo giro, vuoto solo il 5% della camera. Spegnere l'agitazione e il raffreddamento. Avviare riscaldamento della camera a 42 ° C. Ad una temperatura di 31,1 ° C e una pressione di 73,9 bar, il liquido CO 2 raggiunge il suo punto critico, lo stato in cui il ph gassosaase ha la stessa densità della fase liquida del solvente 27. Quando la temperatura raggiunge 42 ° C, incubare per 10 min. A 42 ° C, la CO 2 nella camera esiste come gas supercritico.
NOTA: controllare costantemente la pressione della camera. La pressione non deve superare i 120 bar a 42 ° C. - Iniziare a rilasciare lentamente il gas con riscaldamento continuo. Ciò mantiene i campioni nella fase CO 2 -Gas e impedisce la deformazione della morfologia campione attraverso la tensione superficiale del liquido. Impostare il misuratore di portata a 5 l / h per la messa a punto la valvola di dosaggio che controlla il misuratore di portata. Attendere fino al rilascio del tutto la pressione nella camera. Ora aprire la camera e rimuovere i campioni con cautela dal supporto.
- Per l'aria di essiccazione da etanolo:
- Coat un microscopio elettronico a stub con nastro di carbonio. Con l'aiuto di pinzette, trasferire accuratamente le colonie biofilm sul stub. Collegare ogni colonia allo stub con l'aggiunta di un sottile ponte da autonastro bon, che è cruciale per l'eliminazione carica sotto il fascio di elettroni. In questa fase, gestire le colonie biofilm con cura in quanto sono molto fragili. Conservare i campioni in un essiccatore per almeno 24 ore o fino esame.
- Il giorno dell'esame con il microscopio elettronico a scansione, le colonie biofilm per 2 minuti per polverizzazione catodica-coat in un angolo di 60 ° in un oro-palladio polverizzazione-dispositivo a induzione. Ripetere questa operazione due volte e ruotare i campioni di 120 ° in mezzo. Alla fine, i campioni sputter-coat volta per 3 min dall'alto. Il sottile strato di 20 nm di oro-palladio migliora la conducibilità e migliora il contrasto del campione per l'imaging SEM.
- Conservare i campioni in un essiccatore per evitare la reidratazione del campione 28 fino l'imaging con un microscopio elettronico a scansione 29,30.
Risultati
Il saggio pellicle è un metodo per studiare i processi altamente regolamentati e dinamici di B. subtilis pluricellularità. Oltre a questo, il saggio pellicle è adatto per testare una serie di condizioni sia di pre-avviamento o concentrazioni molecola di piccole dimensioni in un piatto multidish singola cella-cultura in un esperimento. Tuttavia, B. subtilis formazione pellicle è sensibile alle condizioni pre-coltura (ad esempio, crescita media del pre-coltura e la sua fase di crescita), il ...
Discussione
Bacillus subtilis forme robuste e altamente strutturati biofilm sia a liquido (pellicole) e su terreno solido (colonie). Quindi, serve come organismo modello ideale per caratterizzare la modalità d'azione degli inibitori specifici biofilm. Il supporto solido, cellule formano strutture multicellulari con caratteristiche distintive che non sono evidenti in pellicole, come rughe irradiano dal centro verso il bordo. Così, pellicole e le colonie sono sistemi complementari per lo studio B. subtilis plu...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Electron microscope imaging was conducted at the Electron Microscopy Unit of the Weizmann Institute of Science, supported in part by the Irving and Cherna Moskowitz Center for Nano and Bio-Nano Imaging. This research was also supported by the ISF I-CORE grant 152/1, Mr. and Mrs. Dan Kane, Ms. Lois Rosen, by a Yeda-Sela research grant, by the Larson Charitable Foundation, by Ruth and Herman Albert Scholars Program for New Scientists, by the Ilse Katz Institute for Materials Sciences and Magnetic Resonance Research grant, by the Ministry of Health grant for alternative research methods, and by the France-Israel Cooperation - Maimonide-Israel Research Program. IKG is a recipient of the Rowland and Sylvia Career Development Chair.
Materiali
| Name | Company | Catalog Number | Comments |
| Luria Broth, Lennox | Difco | 240230 | |
| Bacto Agar | Difco | 214010 | |
| potassium phosphate monobasic | Sigma, 136.09 g/mol | P0662-500G | |
| potassium phosphate dibasic | Fisher Scientific, 174.18 g/mol | BP363-1 | |
| 3-(N-morpholino)propanesulfonic acid | Fisher Scientific, 209.27 g/mol | BP308-500 | |
| magnesium chloride hexahydrate | Merck, 203.30 g/mol | 1.05833.0250 | |
| calcium chloride anhydrous | J.T. Baker, 110.98 g/mol | 1311-01 | |
| manganese(II) chloride tetrahydrate | Sigma, 197.91 g/mol | 31422-250G-R | |
| iron(III) chloride hexahydrate | Sigma, 270.30 g/mo) | F2877-500G | |
| zinc chloride anhydrous | Acros Organics, 136.29 g/mol | 424592500 | |
| thiamine hydrochloride | Sigma, 337.27 g/mol | T1270-100G | |
| L-tryptophan | Fisher Scientific, 204.1 g/mol | BP395-100 | |
| L-phenylalanine | Sigma, 165.19 g/mol | P5482-100G | |
| L-threonine | Sigma, 119.12 g/mol | T8625-100G | |
| glycerol anhydrous | Bio-Lab Itd | 712022300 | |
| L-glutamic acid monosodium salts hydrate | Sigma, 169.11 g/mol | G1626-1KG | |
| D-leucine | Sigma, 169.11 g/mol | 855448-10G | |
| ethanol anhydrous | Gadot | 830000054 | |
| razor blade | Eddison | NA | |
| circular cellulose filter papers | Whatman, 90 mm | 1001-090 | |
| glutaraldehyde | EMS (Electron Micoscopy Science), 25% in water | 16220 | |
| paraformaldehyde | EMS, 16% in water | 15710 | |
| sodium cacodylate | Merck, 214.05 g/mol | 8.2067 | |
| calcium chloride 2-hydrate | Merck, 147.02 g/mol | 1172113 | |
| stub-aluminium mount | EMS, sloted head | 75230 | |
| carbon adhesive tape | EMS | 77825-12 | |
| Shaker 37°C | New Brunswick Scientific Innowa42 | NA | |
| Centrifuge | Eppendorf table top centrifuge 5424 | NA | |
| Digital Sonifier, Model 250, used with Double Step Microtip | Branson | NA | |
| Incubator 30 °C | Binder | NA | |
| Incubator 23 °C | Binder | NA | |
| Filter System, 500 ml, polystyrene | Cornig Incorporated | NA | |
| Rotary Shaker - Orbitron Rotatory II | Boekel | NA | |
| S150 Sputter Coater | Edwards | NA | |
| CPD 030 Critical Point Dryer | BAL-TEC | NA | |
| Environmental Scanning Electron Microscope | XL30 ESEM FEG Philips (FEI) | NA |
Riferimenti
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Stoodley, P., Sauer, K., Davies, D. G., Costerton, J. W. Biofilms as complex differentiated communities. Annu Rev Microbiol. 56, 187-209 (2002).
- Miller, M. B., Bassler, B. L. Quorum sensing in bacteria. Annu Rev Microbiol. 55, 165-199 (2001).
- Aguilar, C., Vlamakis, H., Losick, R., Kolter, R. Thinking about Bacillus subtilis as a multicellular organism. Curr Opin Microbiol. 10, 638-643 (2007).
- Kolter, R., Greenberg, E. P. Microbial sciences: the superficial life of microbes. Nature. 441, 300-302 (2006).
- Kearns, D. B., Chu, F., Branda, S. S., Kolter, R., Losick, R. A master regulator for biofilm formation by Bacillus subtilis. Mol Microbiol. 55, 739-749 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol Microbiol. 59, 1229-1238 (2006).
- Romero, D., Aguilar, C., Losick, R., Kolter, R. Amyloid fibers provide structural integrity to Bacillus subtilis biofilms. Proc Natl Acad Sci USA. 107, 2230-2234 (2010).
- Kobayashi, K., Iwano, M. BslA(YuaB) forms a hydrophobic layer on the surface of Bacillus subtilis biofilms. Mol Microbiol. 85, 51-66 (2012).
- Hobley, L., et al. BslA is a self-assembling bacterial hydrophobin that coats the Bacillus subtilis biofilm. Proc Natl Acad Sci USA. 110, 13600-13605 (2013).
- Romero, D., Vlamakis, H., Losick, R., Kolter, R. An accessory protein required for anchoring and assembly of amyloid fibres in B. subtilis biofilms. Mol Microbiol. 80, 1155-1168 (2011).
- Kolodkin-Gal, I., et al. D-amino acids trigger biofilm disassembly. Science. 328, 627-629 (2010).
- Chan, Y. G., Kim, H. K., Schneewind, O., Missiakas, D. The capsular polysaccharide of Staphylococcus aureus is attached to peptidoglycan by the LytR-CpsA-Psr (LCP) family of enzymes. J Biol Chem. 289, 15680-15690 (2014).
- Mielich-Suss, B., Lopez, D. Molecular mechanisms involved in Bacillus subtilis biofilm formation. Environ Microbiol. 17, 555-565 (2014).
- Cairns, L. S., Hobley, L., Stanley-Wall, N. R. Biofilm formation by Bacillus subtilis: new insights into regulatory strategies and assembly mechanisms. Mol Microbiol. 93, 587-598 (2014).
- Chen, M., Yu, Q., Sun, H. Novel strategies for the prevention and treatment of biofilm related infections. Int J Mol Sci. 14, 18488-18501 (2013).
- Bucher, T., Oppenheimer-Shaanan, Y., Savidor, A., Bloom-Ackermann, Z., Kolodkin-Gal, I. Disturbance of the bacterial cell wall specifically interferes with biofilm formation. Environ Microbiol Rep. 7, 990-1004 (2015).
- Sarkar, S., Pires, M. M. D-Amino acids do not inhibit biofilm formation in Staphylococcus aureus. PLoS One. 10, e0117613 (2015).
- Wei, W., Bing, W., Ren, J., Qu, X. Near infrared-caged D-amino acids multifunctional assembly for simultaneously eradicating biofilms and bacteria. Chem Commun (Camb). 51, 12677-12679 (2015).
- Leiman, S. A., et al. D-amino acids indirectly inhibit biofilm formation in Bacillus subtilis by interfering with protein synthesis. J Bacteriol. 195, 5391-5395 (2013).
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Davies, D. Understanding biofilm resistance to antibacterial agents. Nat Rev Drug Discov. 2, 114-122 (2003).
- Olsen, I. Biofilm-specific antibiotic tolerance and resistance. Eur J Clin Microbiol Infect Dis. 34, 877-886 (2015).
- Tseng, B. S., et al. The extracellular matrix protects Pseudomonas aeruginosa biofilms by limiting the penetration of tobramycin. Environ Microbiol. 15, 2865-2878 (2013).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc Natl Acad Sci USA. 98, 11621-11626 (2001).
- Holscher, T., et al. Motility, Chemotaxis and Aerotaxis Contribute to Competitiveness during Bacterial Pellicle Biofilm Development. J Mol Biol. 427, 3695-3708 (2015).
- Bray, D. . Methods in Biotechnology. 13, 235-243 (2000).
- Ensikat, H. J., Ditsche-Kuru, P., Barthlott, W. . Scanning electron microscopy of plant surfaces: simple but sophisticated methods for preparation and examination. 1, 248-255 (2010).
- Hayat, M. A. . Principles and techniques of scanning electron microscopy: Biological applications. 2, (1976).
- Schatten, H. . Scanning Electron Microscopy for the Life Sciences. , (2013).
- Bridier, A., Meylheuc, T., Briandet, R. Realistic representation of Bacillus subtilis biofilms architecture using combined microscopy (CLSM, ESEM and FESEM). Micron. 48, 65-69 (2013).
- Boyde, A., MacOnnachie, E. Volume changes during preparation of mouse embryonic tissue for scanning electron microscopy. SCANNING. 2, 149-163 (1979).
- Yao, Z., Kahne, D., Kishony, R. Distinct single-cell morphological dynamics under beta-lactam antibiotics. Mol Cell. 48, 705-712 (2012).
- Epstein, A. K., Pokroy, B., Seminara, A., Aizenberg, J. Bacterial biofilm shows persistent resistance to liquid wetting and gas penetration. Proc Natl Acad Sci USA. 108, 995-1000 (2011).
- Vlamakis, H., Chai, Y., Beauregard, P., Losick, R., Kolter, R. Sticking together: building a biofilm the Bacillus subtilis way. Nat Rev Microbiol. 11, 157-168 (2013).
- Shemesh, M., Chai, Y. A combination of glycerol and manganese promotes biofilm formation in Bacillus subtilis via histidine kinase KinD signaling. J Bacteriol. 195, 2747-2754 (2013).
- Kolodkin-Gal, I., et al. Respiration control of multicellularity in Bacillus subtilis by a complex of the cytochrome chain with a membrane-embedded histidine kinase. Genes Dev. 27, 887-899 (2013).
- Oppenheimer-Shaanan, Y., et al. Spatio-temporal assembly of functional mineral scaffolds within microbial biofilms. npj Biofilms and Microbiomes. 2, 15031 (2016).
- Garcia-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J Vis Exp. , e3796 (2012).
- Bogino, P. C., Oliva Mde, L., Sorroche, F. G., Giordano, W. The role of bacterial biofilms and surface components in plant-bacterial associations. Int J Mol Sci. 14, 15838-15859 (2013).
- Fratamico, P. M., Annous, B. A., Guenther, N. W. . Biofilms in the Food and Beverage Industires. 1, (2009).
- Gao, G., et al. Effect of biocontrol agent Pseudomonas fluorescens 2P24 on soil fungal community in cucumber rhizosphere using T-RFLP and DGGE. PLoS One. 7, e31806 (2012).
- Chen, Y., et al. Biocontrol of tomato wilt disease by Bacillus subtilis isolates from natural environments depends on conserved genes mediating biofilm formation. Environ Microbiol. 15, 848-864 (2013).
- Bryers, J. D. Medical biofilms. Biotechnol Bioeng. 100, 1-18 (2008).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7, 375-381 (2009).
- Nevin, K. P., Woodard, T. L., Franks, A. E., Summers, Z. M., Lovley, D. R. Microbial electrosynthesis: feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds. MBio. 1, (2010).
- Torres, C. I., et al. A kinetic perspective on extracellular electron transfer by anode-respiring bacteria. FEMS Microbiol Rev. 34, 3-17 (2010).
- Li, J., Wang, N. Foliar application of biofilm formation-inhibiting compounds enhances control of citrus canker caused by Xanthomonas citri subsp. citri. Phytopathology. 104, 134-142 (2014).
- Okegbe, C., Price-Whelan, A., Dietrich, L. E. Redox-driven regulation of microbial community morphogenesis. Curr Opin Microbiol. 18, 39-45 (2014).
- Mann, E. E., Wozniak, D. J. Pseudomonas biofilm matrix composition and niche biology. FEMS Microbiol Rev. 36, 893-916 (2012).
- Bouffartigues, E., et al. Sucrose favors Pseudomonas aeruginosa pellicle production through the extracytoplasmic function sigma factor SigX. FEMS Microbiol Lett. 356, 193-200 (2014).
- Wu, C., Lim, J. Y., Fuller, G. G., Cegelski, L. Quantitative analysis of amyloid-integrated biofilms formed by uropathogenic Escherichia coli at the air-liquid interface. Biophys J. 103, 464-471 (2012).
- Serra, D. O., Richter, A. M., Hengge, R. Cellulose as an Architectural Element in Spatially Structured Escherichia coli Biofilms. J Bacteriol. 195, 5540-5554 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon